Амфотерные соединения это кратко
Обновлено: 08.07.2024
Понятие амфотерность как характеристика двойственного поведения вещества было введено в 1814 г. Ж. Гей-Люссаком и Л. Тенаром.
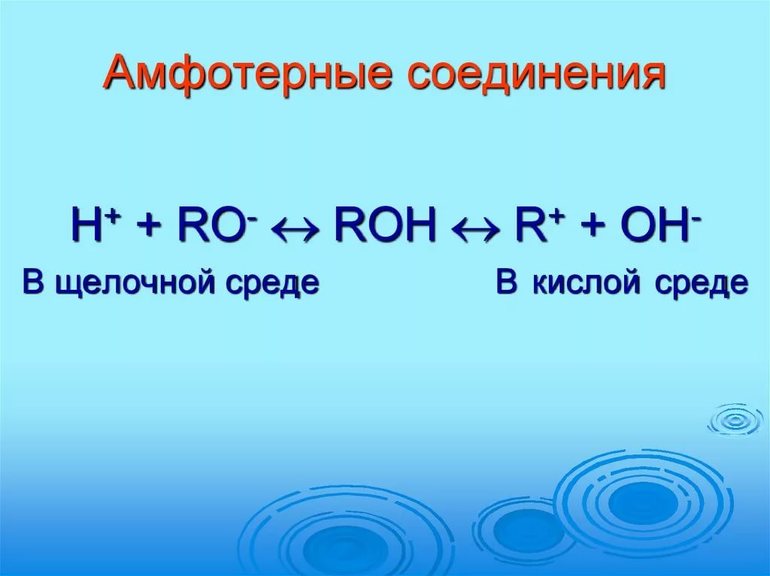
Амфотерными называются оксиды и гидроксиды, которые проявляют и основные и кислотные свойства в зависимости от условий.
кислотами и щелочами .
ОСНОВНЫЕ СВОЙСТВА
При взаимодействии с кислотами все просто. Амфотерные соединения ведут себя как основания :
Таким образом, при описании основных свойств записывают хорошо знакомые уравнения реакций обмена .
КИСЛОТНЫЕ СВОЙСТВА
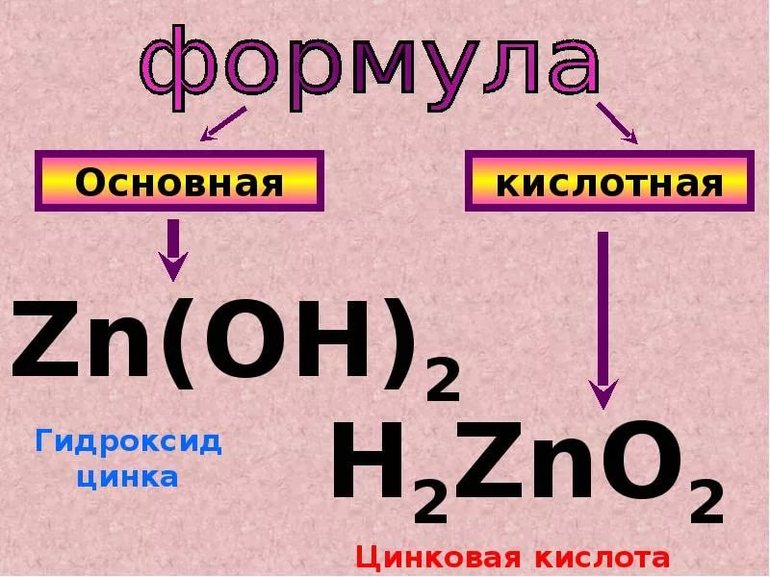
Гидроксид цинка записывать в виде H 2 ZnO 2 не принято. Пишем как обычно Zn ( OH )2, но подразумеваем (для собственного удобства), что это кислота H 2 ZnO 2 :
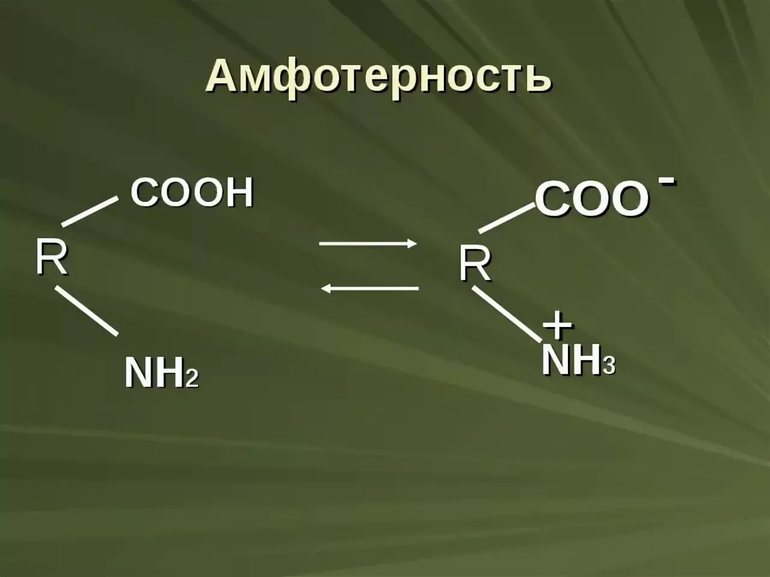
Амфотерные соединения – соединения, которые в зависимости от условий проведения реакции могут проявлять как свойства кислот, так и оснований, т.е. могут и отдавать, и принимать протон (Н + ).
К амфотерным неорганическим соединениям относят оксиды и гидроксиды следующих металлов – Al, Zn, Be, Cr (в степени окисления +3) и Ti (в степени окисления +4). Амфотерными органическими соединениями являются аминокислоты – NH2–CH(R)-COOH.
Получение амфотерных соединений
Амфотерные оксиды получают путем реакции горения соответствующего металла в кислороде, например:
Если щелочь присутствует в избытке, то есть вероятность получения комплексного соединения:
Органические амфотерные соединения – аминокислоты получают путем замещения галогена на аминогруппу в галогензамещенных карбоновых кислотах. В общем виде уравнение реакции будет выглядеть так:
Химические амфотерных соединений
Главным химическим свойством амфотерных соединений является их способность реагировать с кислотами и щелочами:
Специфические свойства амфотерных органических соединений
При растворении аминокислот в воде аминогруппа и карбоксильная группа взаимодействуют друг с другом с образованием соединений, называемых внутренними солями:
Молекулу внутренней соли называют биполярным ионом.
Две молекулы аминокислоты могут взаимодействовать друг с другом. При этом происходит отщепление молекулы воды и образуется продукт, в котором фрагменты молекулы связаны между собой пептидной связью (-CO-NH-). Например:

Также для аминокислот характерны все химические свойства карбоновых кислот (по карбоксильной группе) и аминов (по аминогруппе).
Способность химического вещества проявлять свои основные свойства и показывать кислотные характеристики называется амфотерностью.

Это определение было введено при изучении общей теоретической химии в области ведущих и кислотных взаимодействий при наступлении определенных условий.
Отмечается влияние смены растворяющего вещества на дуальные характеристики.
Амфотерные свойства
В концепции электролитической диссоциации, когда происходит распадение проводящего вещества на отдельные ионы при сплавлении или растворении, субстанция реагирует по кислотному механизму или основным свойствам. В первом случае отщепляются частицы гидроксония, Н + , во втором варианте отделяются гидроксид-анионы, ОН - . Электролиты получают ионы одновременно из нейтральных молекул и атомов, процесс проходит под совместным действием кислотных и генеральных качеств вещества. В этом случае проводящие смеси имеют название амфолитов.
Гидроксиды элементов и их сцеплений из таблицы Менделеева, которые относятся к амфотерным соединениям:
- элементы головных подгрупп (алюминий, бериллий, сурьма, галлий, селен, мышьяк);
- участники дополнительных подвидов (вольфрам, цинк, молибден).
Чаще всего вещества проявляют одно из взаимодействий, которое изменяет характер при перемене условий. Например, происходят процессы ионизации азотной кислоты, при этом получаются нитрозильные анионы и нитрит-катионы, в качестве амфолита выступает вода.
Амфотерность рассматривается в виде способности проводящего вещества быть донором и акцептировать протоны в рамках протеолитической концепции Бренстеда и Лоури. В этом случае вода проявляет свойства самоионизации в форме обратимой передачи молекул между жидкостями, в результате появляется одинаковое число анионов и катионов.
Амфолитами являются субстанции с содержанием структурных включений органических молекул, которые передают свойственные характеристики разного характера.
Такие вещества представлены пептидами, белками и аминокислотами. Эти группы частично ионизируются при помещении в раствор.
Молекулы и частицы аминокислот имеют равновесные состояния:
- заряженная (цвиттер-ион);
- незаряженная форма.
В этих случаях вещество представлено кислотой (воспроизводят катионы) и протоны или работает по основному свойству и акцептирует катионы и протоны.
Характеристики гидроксидов
Способность амфотерного элемента проявляется и в форме взаимодействия с кислотами и основаниями.

Так ведут себя оксиды, комплексные соединения, гидроксиды и отдельные р-элементы на средней стадии окисления. Для неорганических связей с присутствием гидроксильной группы ОН такое взаимодействие является общей характеристикой.
Традиционная теория об амфотерности гидроксидов в процессе разложения на ионы по основному и кислотному виду не подтверждается. Амфотерное поведение гидроксидов заключается в реакции обмена частицами среды с молекулами, имеющими связь с акцепторным центром. Гидроксиды обладают особенностью выделять соль и по-разному взаимодействовать в кислотной среде и растворе щелочи.
В первом случае они действуют по типу оснований, а вторая среда заставляет проявлять реакцию кислот.
Амфотерность гидроксидов и оксидов проявляется в продуцировании 2 рядов солей. Двойственность свойств используется при проведении качественного анализа и отделения веществ с подобными характеристиками от других элементов. Интервал появления осадка проявляется узким промежутком, поэтому внимание уделяется тщательности регулировки растворной среды.
Номенклатура и химические особенности
На особом положении в ряду амфотерных элементов находится алюминий, он стоит на границе между кислотами и основаниями. Это ведет к его диссоциации по двум типам поведения.
Амфотерные металлы и неметаллы обладают свойствами:
- гидроксиды слабо растворяются в водной среде, поэтому не способствуют приобретению водой основных или кислотных характеристик;
- оксид-гидроксиды имеют особенности, типичные для электроположительных веществ;
- гидроксиды активных металлических групп чаще проявляют характеристики акцепторов элементарных частиц;
- по мере перехода к неметаллам свойства переходят от типичных оснований к амфотерным связкам, т. е. вещества выступают донорами протонов;
- в категории основных гидроксидов с положительными катионами существует ионная спайка, а кислород присоединяется к водороду с помощью ковалентной связи;
- в группе кислотных оксидов кислород имеет ковалентную связь с положительными электрочастицами, а с водородом соединяется полярной сцепкой ионов.
Гидроксиды с двойственными свойствами имеют физические промежуточные характеристики, доказать амфотерность можно на примере взаимодействия комплексных соединений из списка веществ 3 периода таблицы Менделеева.

В химии свойства однотипных сульфидов и оксидов, а также гидросульфитов и гидроксидов имеют разную реакцию в пределах отличающихся периодов. Свойство оснований проявляют сульфиды типичных металлов, а кислотные характеристики присутствуют в бинарных соединениях неметаллических субстанций. Различие химического происхождения наблюдается при обменной реакции между действующим веществом и растворителем, а также во взаимодействии сульфидов друг с другом.
Амфотерность гидроксидов металлических элементов объясняется тем, что в воде вещество распадается на отдельные ионы водорода по кислотному виду, а образование гидроксильных ионов проходит по типу основы.
Степени окисления
У некоторых веществ наблюдается несколько ступеней окисления, поэтому амфотерные свойства гидроксидов и оксидов подлежат разной классификации. Вещества с низкими окислительными характеристиками тяготеют к группе оснований, а сам элемент обладает свойствами металла, поскольку содержится в категории катионов. Субстанции с высокой степенью окисления являются участниками кислотных групп и проявляют неметаллические показатели, так как представляют собой анионы.
Например, у гидроксида и оксида марганца (2) главными являются основные свойства, а сам элемент входит в категорию катионов. У разновидности марганца (Vil) преобладают показатели кислоты, а само вещество относится к анионовой группы (тип МПО4).
Свойства оксидов и гидроксидов проявляются в зависимости от характеристики металла. Для элементов подвида бора (исключается таллий) типичной является 3-я степень перехода заряженных частиц от донора-восстановителя к окислительному акцептору. В результате свойства основания для элемента ослабляются.
При переходе к 3 группе встречаются вещества, которые образуют кислоты и неорганические кислоты. Последние обладают сочетанием химических и физических показателей, характерных для кислот и являются типовыми для многих элементов, за исключением щелочноземельных и щелочных металлов.

Рост свойств основного вещества происходит при увеличении радиуса движения ионов. Некоторые субстанции имеют почти одинаковую степень диссоциации с получением ионов, а у других аморфные показатели выражаются слабо.
В соединениях развитие основных свойств происходит медленно. Это объясняется тем, что атомы веществ 3 группы представляют собой аналоги с характерным строением внешней оболочки по типу благородных газов. Другие субстанции отличаются наружным слоем атома в форме электронной оболочки с 10 электронами. В таблице после алюминия наблюдается увеличение радиусов ионов, отмечается диагональное сходство, что ведет к постепенному усилению основных характеристик.
Процессы при диссоциации
В некоторых случаях амфотерные характеристики металлических гидроксидов проявляются не только в водной среде, но под действием кислотного и щелочного раствора. Если в случае с кислотой при продуцировании нейтральных частиц выделяется вода и появляется ион металла (свойство основания), то в щелочной среде не происходит отщепление протона.
При тяготении азота к висмуту степень окисления стабилизируется и усиливаются показатели основного характера. Такие соединительные субстанции выполняют одновременно окислительные и восстановительные функции. Двойственный процесс объясняется ионизацией молекулы воды, которая располагается во внутренней сфере, а протон перемещается к иону ОН.
В этом случае затрудняется определение развитости кислотных и основных показателей вещества, так как оно не имеет в составе подвижного водородного атома.
В результате из бокситов получаются другие элементы, что служит показателем использования химических характеристик при разделении. Метод основывается на применении свойства амфотерности алюминия. К этому же разряду относится выделение магния из воды морей и океанов.
Реакции взаимного действия с расплавами щелочей и кислотами ведут к появлению молекул воды и соли, а в результате степень окисления остается неизменной.
Двойственные показатели
Ионный потенциал вещества увеличивается в результате проявления двойственного механизма при диссоциации амфотерных соединений. Например, Мл (0Н) является неуравновешенным основанием, а Мп (0Н)4 представляет собой амфотерный элемент, который в равной степени проявляет кислотные особенности. НМПО4 переходит в категорию усиленных кислот, при этом снижаются свойства основания.

Щелочная среда используется для восстановления элементов с образованием гидросолей, например, гексагидроксоалюминат натрия. Если судить о тетрагидроксиде титана, то название подчеркивает возможность взаимной реакции с кислотами. Эта же субстанция гидроокиси называется ортокислотой при характеристике ее реагирования в условиях щелочной среды.
Активные металлические соединения образовывают сильнополярные ионные связи, поэтому относятся к группе оснований. Уменьшение динамичности характера вещества изменяется в сторону кислотного реагирования: НМпО, КОН, 5с (ОН)3, Са (ОН)2, НУО3 и другие.
Амфотерные оксиды М2О3 и соответствующие им гидроксиды М (ОН)3 (при этом исключается В2О3) плохо растворяются в водном растворе.
Гидроксиды характеризуются неравномерным изменением двойственных характеристик:
- А1 (0Н)3 имеет небольшое показание в области диссоциации, как основание, и представляет собой амфотерный проводящий электролит.
- Оа (0Н)3 является дуалистическим гидроксидом с неизменной константой распада, которая характеризует вещество в качестве основания и одновременно кислоты.
- Переход от Оа (0Н)3 к Т1 (0Н)3 происходит постепенно, также равномерно изменяется реакция в сторону кислотного взаимодействия в результате увеличения металлизации.
Другие вещества
Соединение гидроксида циркония является малорастворимым в воде и проявляет устойчивость к этой среде. Вещество относится к классу полимеров с положительно заряженными частицами, который содержит периодические цепи, расположенные в клеточном порядке. Материал не реагирует на основания, восстановительных и окислительных агентов.
В кислых растворах гидроксид циркония переводит анионы С1, НО3, СГО4, 8Ог на ионы ОН. Увеличение температурных показателей почти не сказывается на скорости обмена. В случае с цирконием не происходит образование определенных гидратов, термогравиметрические измерения показывают осадок полимерных частиц с образованием структурного слоя.
Германий находится ближе к группе металлов и образовывает связи, в которых его степень окисления расценивается по 2 категории. Соединения являются менее прочными, по сравнению с контактами германиевого аналога свинцовой группы, и отличаются восстановительными характеристиками. Амфотерный гидроксид с явно выраженными кислотными свойствами соответствует черному оксиду германия, молекулы которого не растворяются в жидкости. Последний носит название германистой кислоты, а его осадочные соли — германитов.
Если элемент в зависимости от условий образовывает несколько различающихся по составу оснований, то наиболее сильным признается то, которое отличается низкой окислительной степенью.
Качества основания в таких веществах выражаются ярко. Сильной является кислота, анионы которой содержат множество кислородных атомов в случае появления у элемента нескольких кислотосодержащих соединений.
Гидроксиды – это неорганические соединения, образованные тем или иным элементом, кислородом и водородом. В гидроксидах обязательно имеется водород, связанный с кислородом (связь О–Н). В некоторых гидроксидах водород может непосредственно соединяться с атомами элемента. Например, в H3РO3 два атома водорода связаны с атомами кислорода, а один – с атомом фосфора.
В ряде случаев гидроксиды являются продуктами гидратации (соединения с водой) соответствующих оксидов, хотя многие оксиды непосредственно с водой не взаимодействуют. В результате дегидратации гидроксидов образуются соответствующие оксиды.
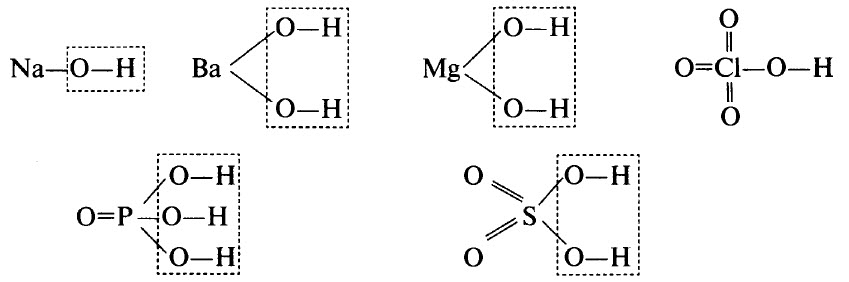
Гидроксиды могут быть основными (основания), кислотными (кислородсодержащие кислоты) и амфотерными. Примерами основных гидроксидов являются NaOH, Ва(ОН)2, Mg(OH)2. Примерами кислотных гидроксидов являются НСlO4 (хлорная кислота, высший гидроксид хлора), H3РO4 (ортофосфорная кислота, высший гидроксид фосфора), H2SO4 (серная кислота, высший гидроксид серы).
Графические формулы перечисленных гидроксидов приведены ниже. Во всех гидроксидах имеется связь О–Н:
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Амфотерность (от греч. amphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие.
Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например: ВeО – Вe(ОН)2, Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Их основные и кислотные свойства выражены слабо, они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых степень окисления металла +3, +4, иногда +2.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3, SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и некоторые другие.
Оксиды и гидроксиды элементов побочных подгрупп, соответствующие высоким степеням окисления, как правило, являются кислотными, например: СrO3 (ему соответствует H2СrO4), Мn2O7 (ему соответствует НМnO4).
Для низших оксидов и гидроксидов характерно преобладание основных свойств, например: СrO и Сr(ОН)2, МnО и Мn(ОН)2.
Оксиды и гидроксиды, в которых степени окисления элементов +3 и +4, являются, как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3 и Fe(OH)3. Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Рассмотрим амфотерные свойства оксида и гидроксида цинка – ZnO и Zn(OH)2. Оба вещества реагируют с кислотами:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O

Оксид и гидроксид цинка реагируют также и со щелочами:
В результате реакций со щелочами в растворах образуются комплексные ионы – тетрагидроксоцинкаты (например, Na2[Zn(OH)4]), а при сплавлении – цинкаты (например, Na2ZnO2). Чтобы составить формулы цинкатов, запишите формулу гидроксида цинка Zn(OH)2 как формулу кислоты – H2ZnO2. Кислотным остатком такой кислоты является ион ZnO2 2– .
Докажем амфотерность оксида и гидроксида алюминия Al(ОН)3. Он растворяется в кислотах с образованием солей, где алюминий находится в катионной форме:
Al(ОН)3 + 3Н + = Al 3+ + 3H2O
Но гидроксид алюминия взаимодействует и со щелочами. При сплавлении со щелочами образуются алюминаты (метаалюминаты):
Al(ОН)3 + NaOH = NaAlO2 + 2H2O
Чтобы составить формулы алюминатов, запишите формулу гидроксида алюминия Al(ОН)3 как H3AlO3. Теперь представьте, что от 1 моль этого соединения отщепляется 1 моль воды. Образуется соединение НАlO2, в котором кислотным остатком будет ион AlO2 – .
В образовавшейся соли алюминий образует анион AlO2 – (алюминий в анионной форме). В растворах в результате реакции со щёлочью образуется комплексный тетрагидроксоалюминат-ион [Al(ОН)4] – :
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Некоторые амфотерные оксиды и гидроксиды не проявляют амфотерность в обычных условиях и в растворах ведут себя как основные. Амфотерность таких соединений проявляется в более жёстких условиях. Например, гидроксид железа (III) Fe(OH)3 легко реагирует с кислотами:
Fe(OH)3 + 3НCl = FeCl3 + 3H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Признаком этой реакции будет растворение бурого осадка. А вот при добавлении раствора щёлочи гидроксид железа (III) не растворяется. Тогда, может быть, считать его основанием, не растворимым в воде? Дело в том, что в данном случае соль образуется при плавлении со щёлочью.
Естественно, что в ходе плавления происходит разложение гидроксида на оксид и воду, и в действительности реакция идёт между оксидом и щёлочью:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Таким образом, гидроксид железа (III) можно отнести к амфотерным гидроксидам, хотя основные свойства у него преобладают.
Читайте также:

