Алкины способы получения кратко
Обновлено: 04.07.2024
Алкины – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна тройная связь между атомами углерода С≡С.
Остановимся на свойствах, способах получения и особенностях строения алкинов.
1. Дегидрирование алканов
При дегидрировании алканов, содержащих от двух до трех атомов углерода в молекуле, образуются двойные и тройные связи.
| Например, при дегидрировании этана может образоваться этилен или ацетилен: |

2. Пиролиз метана
Пиролиз метана – это промышленный способ получения ацетилена.

Реакцию проводят, очень быстро пропуская метан между электродами (электродуговой способ) — примерно 0,1-0,01 секунды при температуре 1500 о С.
Если процесс проводить дольше, то метан разлагается на углерод и водород:

3. Гидролиз карбида кальция
Лабораторный способ получения ацетилена – водный или кислотный гидролиз карбида кальция CaC2.
В кислой среде образуется ацетилен и соответствующая соль:
Карбид кальция можно получить, нагревая оксид кальция с углеродом:
СаО + 3С (изб) → СаС2 + СО
4. Дегидрогалогенирование дигалогеналканов
Дигалогеналканы, в молекулах которых два атома галогена расположены у одного, либо у соседних атомов углерода, реагируют с избытком спиртового раствора щелочей с образованием алкинов.
| Например, 1,2-дихлорпропан реагирует со спиртовым раствором гидроксида натрия |

1,1-дихлорпропан реагирует со спиртовым раствором щелочи с образованием пропина.
5. Алкилирование соединений алкинов с металлами
Ацетилениды, пропиниды и прочие соединения алкинов с металлами реагируют с галогеналканами с образованием гомологов алкинов. При этом происходит удлиннение исходной молекулы алкина.
| Например, пропинид натрия реагирует с бромэтаном с образованием пентина-2 |

Добавить комментарий
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.

Алканы, алкены, алкины - это органические химические вещества. Все они построены из таких химических элементов, как карбон и гидроген. Алканы, алкены, алкины - это химические соединения, которые принадлежат к группе углеводородов.
В этой статье мы рассмотрим алкины.
Что это такое?
Эти вещества еще называются ацетиленовыми углеводородами. Строение алкинов предусматривает наличие в их молекулах атомов карбона и гидрогена. Общая формула ацетиленовых углеводородов такая: CnH2n-2. Самым простый простой алкин - этин (ацетилен). Он обладает вот такой химической формулой - С2Н2. Также к алкинам относится пропин с формулой С3Н4. Кроме того, к ацетиленовым углеводородам можно отнести бутин (С4Н6), пентин (С5Н8), гексин (С6Н10), гептин (С7Н12), октин (С8Н14), нонин (С9Н16), децин (С10Н18) и т. д. Все виды алкинов обладают похожими характеристиками. Давайте рассмотрим их подробнее.

Физические свойства алкинов
По своим физическим характеристикам ацетиленовые углеводороды напоминают алкены.
В нормальных условиях алкины, в молекулах которых содержится от двух до четырех атомов карбона, обладают газообразным агрегатным состоянием. Те, в молекулах которых находится от пяти до 16 атомов карбона, при нормальных условиях жидкости. Те, в составе молекул которых от 17 и больше атомов этого химического элемента, - твердые вещества.
Плавятся и кипят алкины при более высокой температуре, чем алканы и алкены.
Растворимость в воде незначительная, но немного выше, чем у алкенов и алканов.
Наиболее широко используемый алкин - ацетилен - обладает такими физическими свойствами:
- не имеет цвета;
- не имеет запаха;
- при нормальных условиях находится в газообразном агрегатном состоянии;
- обладает меньшей плотностью, чем воздух;
- температура кипения - минус 83,6 градусов Цельсия;
Химические свойства алкинов
В этих веществах атомы связаны тройной связью, чем и объясняются основные их свойства. Алкины вступают в реакции такого типа:
- гидрирование;
- гидрогалогенирование;
- галогенирование;
- гидратация;
- горение.
Давайте рассмотрим их по порядку.
Гидрирование
Химические свойства алкинов позволяют им вступать в реакции такого типа. Это вид химического взаимодействия, при котором молекула вещества присоединяет к себе дополнительные атомы водорода. Вот пример такой химической реакции в случае с пропином:
Эта реакция происходит в две стадии. На первой молекула пропина присоединяет два атома гидрогена и на второй - столько же.
Галогенирование
Это еще одна реакция, которая входит в химические свойства алкинов. В ее результате молекула ацетиленового углеводорода присоединяет атомы галогенов. К последним относятся такие элементы, как хлор, бром, иод и др.
Вот пример такой реакции в случае с этином:
Такой же процесс возможен и с другими ацетиленовыми углеводородами.
Гидрогалогенирование
Это также одна из основных реакций, которая входит в химические свойства алкинов. Она заключается в том, что вещество взаимодействует с такими соединениями, как НСІ, НІ, HBr и др. Это химическое взаимодействие происходит в две стадии. Давайте рассмотрим реакцию такого типа на примере с этином:
Гидратация
Это химическая реакция, которая заключается во взаимодействии с водой. Она тоже происходит в два этапа. Давайте рассмотрим ее на примере с этином:
Вещество, которое образуется после первого этапа реакции, называется виниловым спиртом.
В связи с тем, что согласно правилу Эльтекова функциональная группа ОН не может располагаться рядом с двойной связью, происходит перегруппировка атомов, в результате которой из винилового спирта образуется ацетальдегид.
Процесс гидратации алкинов еще называется реакцией Кучерова.
Горение
Это процесс взаимодействия алкинов с кислородом при высокой температуре. Рассмотрим горение веществ этой группы на примере с ацетиленом:
При избытке кислорода ацетилен и другие алкины горят без образования карбона. При этом выделяются только оксид карбона и вода. Вот уравнение такой реакции на примере с пропином:
Горение других ацетиленовых углеводородов также происходит подобным образом. В результате выделяется вода и углекислый газ.
Другие реакции
Также ацетилены способны реагировать с солями таких металлов, как серебро, медь, кальций. При этом происходит замещение гидрогена атомами металла. Рассмотрим такой вид реакции на примере с ацетиленом и нитратом серебра:
Еще один интересный процесс с участием алкинов - реакция Зелинского. Это образование бензола из ацетилена при его нагревании до 600 градусов по Цельсию в присутствии активированного угля. Уравнение этой реакции можно выразить таким образом:
Также возможна полимеризация алкинов - процесс объединения нескольких молекул вещества в одну полимерную.
Получение
Алкины, реакции с которыми мы рассмотрели выше, получают в лаборатории несколькими методами.
Первый - это дегидрогалогенирование. Выглядит уравнение реакции таким образом:
Для проведения такого процесса необходимо нагреть реагенты, а также добавить этанол в качестве катализатора.
Также есть возможность получения алкинов из неорганических соединений. Вот пример:
Следующий метод получения алкинов - дегидрирование. Вот пример такой реакции:
С помощью реакции подобного типа можно получить не только этин, но и другие ацетиленовые углеводороды.
Применение алкинов
Наибольшее распространение в промышленности получил самый простой алкин - этин. Он широко используется в химической отрасли.
- Нужен ацетилен и другие алкины для получения из них других органических соединений, таких как кетоны, альдегиды, растворители и др.
- Также из алкинов можно получить вещества, которые используются при производстве каучуков, поливинилхлорида и др.
- Из пропина можно получить ацетон в результате ракции Кучерова.
- Кроме того, ацетилен используется при получении таких химических веществ, как уксусная кислота, ароматические углеводороды, этиловый спирт.
- Еще ацетилен применяется в качестве топлива с очень высокой теплотой горения.
- Также реакция горения этина используется для сваривания металлов.
- Кроме того, с использованием ацетилена можно получить технический карбон.
- Также это вещество применяется в автономных светильниках.
- Ацетилен и ряд других углеводородов этой группы используются в качестве ракетного топлива благодаря своей высокой теплоте горения.
На этом применение алкинов заканчивается.

Заключение
В качестве завершающей части приводим краткую таблицу о свойствах ацетиленовых углеводородов и их получении.
В современном мире ацетилен и его гомологи имеют большое значение. Они являются исходным веществом для многих простых и сложных органических соединений. Поэтому немаловажное значение имеет изучение возможных способов получения ацетилена и других алкинов, изучение экономической эффективности и целесообразности. Далее рассмотрим получение алкинов в лаборатории и промышленности, а также области их применения.
Данный способ получения ацетилена важен только с исторической точки зрения и не имеет практического значения
Способы получения алкинов

1) Из олефинов. Получение алкинов путем последовательного присоединения к олефинам молекулы галогена и отщепления двух молекул галогенводорода при воздействии спиртового раствора щелочи:

При воздействии цинка на полигалогеналканы также образуются алкины:
2) Из кетонов. Путем воздействия хлористого фосфора на кетон (150-170°С) замещают кислород на два хлора и отщепляя от образовавшегося соединения двух молекул галогенводорода получают алкин: 3) Из солей ацетиленовых углеводородов путем их алкилирования получают алкины с большим числом углеродных атомов:
Применение алкинов
Наибольшее значение и применение среди алкинов имеют ацетилен и винилацетилен.
Большая доля производимого ацетилена идет на сварку и резку металла. Ацетиленово — кислородное пламя имеет температуру — порядка 3500°С, что позволяет легко плавить сталь.
Некоторая часть ацетилена из-за его наркотического воздействия применяется в медицинской практике (нарцилен).
Как исходное вещество ацетилен используется в производстве соединений органического синтеза и целевой химической продукции — уксусной кислоты, ацетальдегида, этанола, хлоруксусные кислоты, изопрена, винилацетилена, который далее используется при получении хлоропренового каучука и т.п.

Ацетиленовые углеводороды (алкины)
Ключевые слова конспекта: Ацетиленовые углеводороды (алкины). Межклассовая изомерия. Карбидный и метановый способы получения ацетилена. Винилхлорид. Поливинилхлорид. Реакция Кучерова.
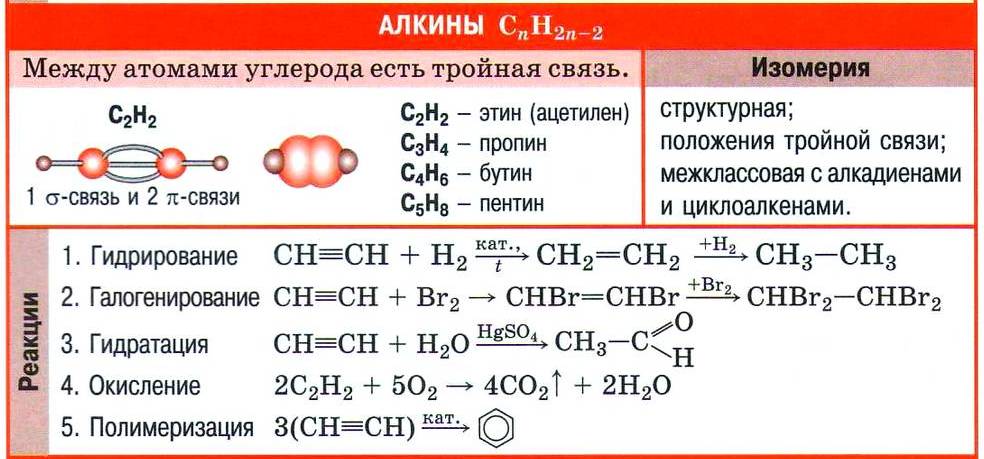
Гомологический ряд алкинов
Как правило, любое научное открытие не только имеет теоретическую ценность, но и находит практическое применение. В химической науке есть немало примеров того, как практическое использование свойств вновь открытых веществ приводило к созданию новых материалов или технологий.
температура пламени достигала 3100 °С, что в 2 раза выше температуры плавления железа! Это свойство кислородно-ацетиленового пламени используют и сейчас при газовой резке и сварке металлов.
В XX в. было установлено строение молекулы ацетилена. Как оказалось, в ней два атома углерода связаны тройной углерод-углеродной связью:
H—C≡C—H

Ацетилен — первый представитель гомологического ряда ацетиленовых углеводородов.
Номенклатура и изомерия алкинов
Принадлежность углеводорода к алкинам обозначают суффиксом -ин, который указывает на тройную углерод-углеродную связь в молекуле. За основу названия алкина берут корень названия соответствующего алкана. Так, ацетилен в соответствии с номенклатурой ИЮПАК называют этином.

Формулы некоторых алкинов и их названия приведены в таблице.
Для алкинов, как и для алкенов, характерна изомерия положения кратной (тройной) связи. Например, изомерны бутин-1 и бутин-2.
Кроме этого, следует учесть, что гомологический ряд алкинов имеет такую же общую формулу, как и ещё один гомологический ряд уже знакомых вам углеводородов (алкадиенов): CnH2n–2. Такой вид структурной изомерии называют межклассовой изомерией.
Способы получения ацетилена
Рассмотрим способы получения важнейшего представителя класса алкинов — ацетилена.

Карбидный способ основан на взаимодействии карбида кальция с водой:

В промышленности карбид кальция получают сплавлением оксида кальция (негашёной извести) с коксом (углеродом):

Оксид кальция получают обжигом известняка по реакции:

В промышленном масштабе ацетилен получают метановым методом — пропусканием газообразного метана в специальных реакторах через зону с высокой (1500 °С) температурой:
Химические свойства алкинов
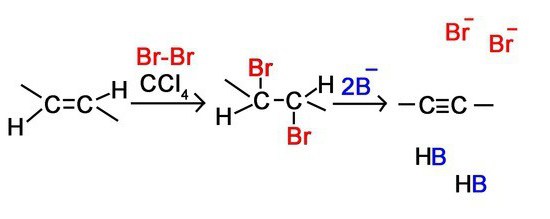
Тройную связь в молекулах алкинов обнаруживают с помощью двух качественных реакций — обесцвечивания бромной воды и раствора перманганата калия.

Непредельный характер алкинов обусловливает и наиболее характерные реакции веществ этого класса — реакции присоединения, которые протекают в две стадии. Например, реакция бромирования ацетилена:

Реакцию присоединения галогеноводородов к алкинам мы рассмотрим на примере важной в практическом отношении реакции хлороводорода с ацетиленом:
Хлорэтен называют также винилхлоридом, потому что одновалентный радикал этилена СН2=СН— носит название винил. Хлорэтен — исходное вещество для получения ценного полимера поливинилхлорида. Уравнение реакции полимеризации хлорэтена выглядит так:


Как и этилен, ацетилен вступает в реакцию гидратации, т. е. присоединяет воду. Однако отличие тройной углерод-углеродной связи от двойной отражается на строении продукта реакции гидратации. Схематично присоединение воды к ацетилену можно изобразить так:

или
Реакция гидратации ацетилена названа в честь русского учёного-химика Михаила Григорьевича Кучерова, предложившего для проведения этого процесса использовать в качестве катализатора соли ртути(II). Продукт реакции Кучерова — органическое вещество уксусный альдегид. До середины XX в. реакция Кучерова лежала в основе промышленного получения уксусного альдегида, но в настоящее время её не используют из-за токсичности солей ртути. Получение уксусного альдегида по реакции Кучерова было вытеснено так называемым Вакер-процессом — получением ацетальдегида прямым окислением этилена в присутствии катализатора — хлорида палладия(II).
Ацетилен применяют в органическом синтезе. Он является одним из исходных веществ в производстве синтетических каучуков, поливинилхлорида и других полимеров. Из ацетилена получают органические растворители. Ацетилен до сих пор используют для газовой сварки и резки металлов.
Читайте также:

