Алкены интересные факты кратко
Обновлено: 07.07.2024
В области органической химии алкены, также известные как олефины, представляют собой ненасыщенный углеводород. Они состоят из двух атомов углерода и водорода и имеют одну или несколько двойных связей в своей химической структуре, то есть являются непредельными. Гомологический ряд представлен формулой CnH2n. Примеры: С2Н4 — этилен, С3Н6 — пропилен.
Структура и свойства
Структурную (пространственную) изомерию имеют представители с четырьмя и более углеродными атомами. Это означает, что для каждой молекулярной формулы можно создать два и более изомера. Наглядно строение можно увидеть на примере бутена — С4Н8 (СН2 = СН-СН2-СН3):
- СН3-СН = СН-СН3 — бутен-2;
- (С Н3)2С = СН2 — 2-метилпропен.
Однако существует другой вид изомерии — геометрическая. Поскольку углеродная связь не позволяет вращаться вокруг неё, группы СН3 блокируются на одной стороне молекулы или напротив друг друга.
Соединения содержат двойную карбоновую связь. Именно она определяет и меняет физические свойства алкенов:

- Физическое состояние. Этилен, пропилен и бутен существуют в виде бесцветных газов. Элементы из пяти и более атомов углерода (гентен, гексен и гептен) являются жидкими. Представители, которые вмещают в себя пятнадцать и более углеродных атомов, — твёрдые вещества.
- Плотность. Алкены неполярные и менее плотные, чем вода, поэтому практически нерастворимы в ней.
- Растворимость. Хорошо растворяются в органических растворителях.
- Точки кипения. Температура кипения зависит от молекулярной массы соединения (длины цепи). Чем больше добавлено межмолекулярной массы, тем выше t кипения.
- Точки плавления. Это свойство зависит от упаковки молекулы. Однако цис-изомеры, которые упакованы в форме U-изгиба, будут иметь более низкие точки плавления, чем транс-изомеры. Пример в таблице:
Соединения Точка плавления, ° С Точка кипения, ° С Этилен - 169 - 104 Пропен - 185 - 47 1-пентен - 165 30 1-гептен - 119 115 - Полярность. Алкены неполярны. Химическая структура и функциональные группы могут влиять на полярность алкеновых соединений. Углерод sp2 (орбитальные гибридизации) — более электроноаккумулирующий, чем гибридизирующие орбитали sp3, поэтому создаёт слабый диполь вдоль углеродной связи заместителя.
Почти все представители семейства не проводят электричество. Некоторые соединения имеют запах. Например, этилен — сладковатый. А этан совсем не пахнет.
Реакционная способность
Алкеновые соединения относительно стабильные. Однако они более реакционноспособны, чем алканы. Это связано, вероятно, с особенностями связи углерод-углерод. Основные химические свойства алкенов — участие в реакциях.
Первая — реакция добавления. Она происходит путём раскрытия двойной связи. Основной механизм — электрофильное присоединение. Например, гидрогалогенирование, галогенирование, образование галогидрина, оксимеркурация, гидроборирование, добавление дихлоркарбена, реакция Симмонса-Смита, каталитическое гидрирование, эпоксидирование, радикальная полимеризация и гидроксилирование. Более подробно о самых распространённых:


- Гидрирование. Даёт соответствующий алкан. Реакцию проводят под давлением при температуре 200 ° C в присутствии металлического катализатора. В промышленности используют катализаторы, основанные на палладии, никеле или платине. В лабораторном синтезе часто применяют никель Ренея (сплав с алюминием). Пример каталитического гидрирования этилена с получением этана: СН2 = СН2 + Н2 → СН3 - СН3.
- Гидратация. Добавление воды через двойную связь алкенов. Приводит к спиртам. В качестве катализатора реакции выступают сильные кислоты, например, серная. В промышленности проводят для получения этанола: СН2 = СН2 + Н2О → СН3 - СН2ОН.
- Галогенирование. Добавление элементарного брома или хлора к алкенам даёт вицинальные дибром- и дихлоралканы (1, 2-дигалогениды или этилендигалогениды) соответственно. Кстати, аналитическим тестом на наличие алкеновых соединений в воде является добавление в неё раствора брома. Если он обесцветился, алкены есть.
- Гидрогалогенация. Представляет собой добавление таких галогеноводородов, как HCI и/или HI, к алкенам с получением соответствующих галогеналканов. Когда два атома углерода в двойной связи связаны с различным числом атомов водорода, то галоген будет находиться преимущественно в углеродном атоме с меньшим количеством водородных заместителей. Эта модель более известна как правило Марковникова. Использование радикальных инициаторов, а также других соединений может привести к противоположному результату. Бромистоводородная кислота, в частности, склонна к образованию радикалов в присутствии различных примесей или даже атмосферного кислорода.
- Образование галогидрина. Происходит в результате реакции присоединения, когда алкены реагируют с водой и галогенами.
- Окисление. Алкены реагируют с больши́м количеством окислителей. Присутствие кислорода вызывает горение алкенов с образованием углекислого газа и воды. Эпоксиды получаются в результате каталитического окисления алкеновых соединений с перкарбоновыми кислотами. Озонолиз приводит к разрыву двойной связи. В результате получаются два альдегида или кетоны.
- Фотооксигенация. В присутствии подходящего фотосенсибилизатора, таких как метиленовый синий и свет, алкены вступают в реакцию с активными формами кислорода, генерируемыми, например, гидроксильными радикалами или синглетным кислородом.
Вторая распространённая химическая реакция — полимеризация. Она даёт полимеры высокой промышленной ценности при большой экономичности процесса. Получаются, например, различные пластмассы, полиэтилен и полипропилен. Полимеры из алкеновых мономеров принято называть полиолефинами или в редких случаях полиалкенами.
Помимо перечисленных, алкены могут участвовать в других реакциях, например, в алкилировании, поэтому часто служат сырьём для нефтехимической промышленности.
Получение алкенов
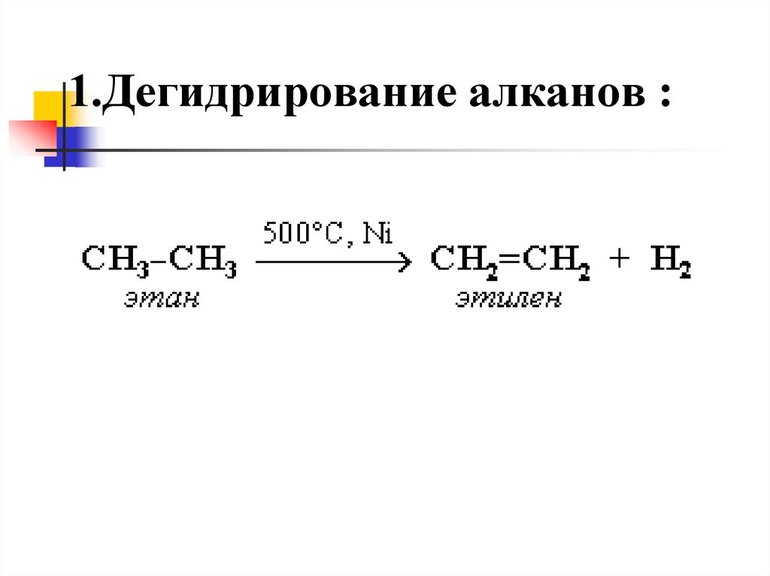
В промцелях алкены получают путём крекинга (сложные молекулы разбиваются на более простые) углеводородов. Основным сырьём являются компоненты природного газового конденсата — этан и пропан. Алканы распадаются при высоких температурах в присутствии цеолитного катализатора. Смесь затем разделяется путём фракционной перегонки. Такой метод используется в основном для получения небольших алкенов, содержащих до шести атомов углерода.
Одним из основных способов синтеза алкенов в лабораторных условиях является удаление в помещении алкилгалогенидов, спиртов и подобных соединений. Самой распространённой считается бета-элиминация по механизму Е2 или Е1. Ещё один метод получения алкеновых соединений включает построение новой углерод-углеродной связи путём сочетания карбонильного соединения (альдегид или кетон) с карбанионным эквивалентом. Такие реакции иногда называют олифенациями. Наиболее известным из этих методов является реакция Виттига.
Алкены могут быть получены путём обмена с другими алкеновыми соединениями в реакции, известной как метатезис олефина. Катализируемое переходным металлом гидровинилирование является ещё одним важным процессом синтеза. Как правило, это включает добавление водорода и винильной группы (или алкенильной) через двойную связь. В настоящее время такую реакцию проводят с помощью таких катализаторов, как железо, кобальт и палладий.
Монозамещённые алкены получают путём карбометаллирования алкинов, что приводит к разнообразию получаемых соединений. Помимо метасинтеза олефинов, используют большое количество перициклических реакций, например, перегруппировку Куопа.
Образование названий
Молекулярная формула углеводорода показывает информацию о возможных типах структур, которые он может представлять. Соединения могут иметь тройную связь, две двойные, одно или два кольца. Поэтому, как и в случае алканов, было необходимо принять последовательную систему номенклатуры, которая могла бы разделять природу этих ненасыщенных химических веществ.
Самыми простыми являются алкены, представляющие собой углеводороды, которые имеют функциональные группы углерод-углеродная двойная связь с формулой CnH2n. Общие правила Международного союза теоретической и прикладной химии (англ. аббр. ИЮПАК) по номенклатуре для класса алкенов гласят:
- На группу указывает суффикс (окончание) -ен.
- Самая длинная цепь, выбранная для имени корня, должна включать оба атома углерода двойной цепи.
- Корневая цепочка должна быть пронумерована от конца ближайшего к атому углерода двойной связи. Если связь находится в центре цепи, для определения конца, где начинается нумерация, используется правило ближайшего заместителя.
- Меньшее из двух чисел, обозначающих атомы углеродной связи, используется в качестве её локатора.
- Соединения называются диеновыми, триеновыми. Добавляется другой эквивалентный префикс, указывающих на количество связей, с присвоением номера локатора.
- Заместителями являются: винильная - Н2С = СН и аллильная группы - Н2С = СН-СН2.
Системные имена алкенов по первому правилу МСТПХ можно представить в виде таблицы. Она содержит первые двадцать представителей с прямой цепью.
| Название | Формула | Название | Формула |
|---|---|---|---|
| Этилен | С2Н4 | Ундецен | С11Н22 |
| Пропен | С3Н6 | Додецен | С12Н24 |
| Бутен | С4Н8 | Тридецен | С13Н26 |
| Пентен | С5Н10 | Тетрадецен | С14Н28 |
| Гексен | С6Н12 | Пентадецен | С15Н30 |
| Гептен | С7Н14 | Гексадецен | С16Н32 |
| Октен | С8Н16 | Гептадецен | С17Н34 |
| Нонен | С9Н18 | Октадецен | С18Н36 |
| Децен | С10Н20 | Нонадецен | С19Н38 |
Согласно второму правилу, если алкен содержит только одну двойную карбоновую связь, и она является концевой, то никаких чисел перед именем не ставят. Например:
- бутан С4Н10 (СН3СН2СН2СН3);
- бутен С4Н8 (СН2 = СНСН2СН3).
В ином случае атомы углерода должны быть пронумерованы таким образом, чтобы дать первому из двух двойных минимально возможное число. При этом оно должно предшествовать суффиксу -ен с тире, например:
- пент-2-ен (СН3СН = СНСН2СН3) - правильно, но допускается написание 2-пентен;
- пент-3-ен (СН3СН2СН = СНСН3) - неверно, поскольку переворот формулы приводит к меньшему числу.
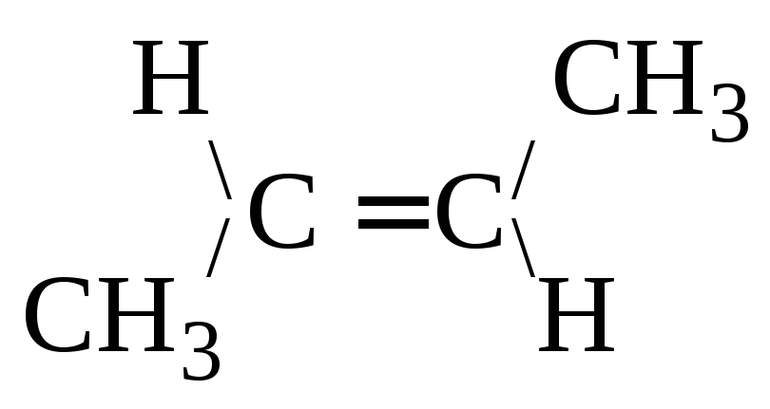
Часто вызывает затруднения шестое правило. Нужно помнить, что общее название этенила — винил, а 2-пропенила — аллил. Формулы заместителей следующие:
- винильный Н2С = СН-;
- аллильный Н2С = СН-СН2 -.
Понять и закрепить правило помогут уравнения. Необходимо взять молекулярную формулу алкена и назвать его, согласно правилам МСТПХ и, наоборот, по имени соединения написать формулу.
Способы применения

В природе алкеновые соединения чаще всего являются частью других веществ. Терпены — основные компоненты эфирных масел. Например, альфа-пинен входит в состав скипидарного масла, а 1-ментен даёт характерный аромат мяте. Конъюгированными полиенами являются, например, витамин А и бета-каротин. В этом контексте интересно отметить, что процесс зрения основан на индуцированной светом цис-транс-изомеризации, связанного с белком ретинола.
Натуральный каучук — полиен, полученный из молочного сока каучукового дерева. Формально этот ненасыщенный углеводород получают путём полимеризации изопрена. Этен — самый простой алкен, также встречается в природе. Как растительный гормон он влияет на созревание плодов. Фрукты, например, киви, которым предстоит долгое путешествие и длительное хранение, собирают рано и держат при низких температурах и высоких СО2 концентрациях. Впоследствии их созревание начинается с обработки плодов газообразным этиленом.
Благодаря качественным характеристикам применение алкенов в промышленной среде довольно разнообразно. Они используются для исходных материалов при синтезе спиртов, пластмасс, лаков, моющих средств и топлива:
- Этен. Применяется в качестве органического сырья в химической промышленности. Его получают из природного газа и сырой нефти путём крекинга. Из него производят такие продукты, как полиэтилен, винилхлорид, стирол.
- Пропен. Используется в основном для производства различных продуктов окисления, таких как бутанол, акриловая кислота, акролеин и прочих.
- Бутадиен. Из него готовят различные синтетические каучуки и другие ударопрочные полимеры.
К слову, алкены используют для производства ядовитого газа иприта, который является боевым оружием. В быту алкеновые соединения в чистом виде не применяются.

Почему важно следить за весом?
В жировой ткани человека и животных накапливаются хлорорганические соединения. Они крайне опасны для человека – поражают почки, печень, приводят к нарушениям эндокринной и сердечнососудистой систем.
Слайд 4

В чем опасность хлорированной воды?
При хлорировании воды образуется хлороформ, дихлорметан, обладающие канцерогенной активностью – способностью вызывать злокачественные опухоли.
Часовое принятие ванны, содержащей хлорированную воду, соответствует десяти литрам выпитой хлорированной воды
Слайд 5

Слайд 6

Слайд 7

Френы и озоновые дырки
Главными веществами, влияющими на разрушение озона (О3) являются простые вещества (водород, кислород, хлор, бром) и органические соединения (метан, фторхлор, фторбром, последние – фреоны)
Фреоны – галогеналканы, фтор и хлорсодержащие производные насыщенных углеводородов
Слайд 8
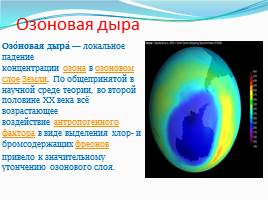
Озоновая дыра
Озо́новая дыра́ — локальное падение концентрации озона в озоновом слое Земли. По общепринятой в научной среде теории, во второй половине XX века всё возрастающее воздействие антропогенного фактора в виде выделения хлор- и бромсодержащих фреонов привело к значительному утончению озонового слоя.
Слайд 9
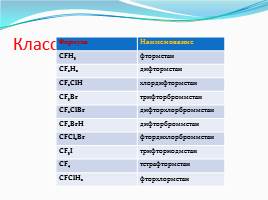
Классификация фреонов
Формула Наименование
CFH3 фторметан
CF2H2 дифторметан
CF2ClH хлордифторметан
CF3Br трифторбромметан
CF2ClBr дифторхлорбромметан
CF2BrH дифторбромметан
CFCl2Br фтордихлорбромметан
CF3I трифториодметан
CF4 тетрафторметан
CFClH2 фторхлорметан
Слайд 10

Это интересно:
Предположительно, что на поверхности Титана (спутник Сатурна) в условиях низких температур (−180 °C) существуют целые озёра и реки из жидкой метано-этановой смеси.
Слайд 11
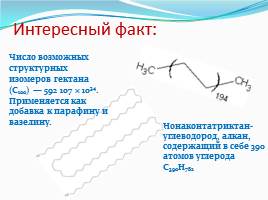
Интересный факт:
Нонаконтатриктан- углеводород, алкан, содержащий в себе 390 атомов углерода C390H782
Число возможных структурных изомеров гектана (С100) — 592 107 × 1034. Применяется как добавка к парафину и вазелину.
Слайд 12

Углеводороды в космосе
В небольших количествах алканы содержатся в атмосфере внешних газовых планет Солнечной системы: на Юпитере — 0,1 % метана, 0,0002 % этана, на Сатурне метана 0,2 %, а этана — 0,0005 %, метана и этана на Уране — соответственно 1,99 % и 0,00025 %, на Нептуне же — 1,5 % и 1,5·10−10, соответственно
Слайд 13
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
Алкены - непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда - этилену - CH2=CH2. Общая формула их гомологического ряда - CnH2n.
Номенклатура и изомерия алкенов
Названия алкенов формируются путем добавления суффикса "ен" к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.

Атомы углерода, прилежащие к двойной связи находятся в sp 2 гибридизации.
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.

- Длина связи между атомами углерода составляет 0,134 нм
- Тип гибридизации атомов углерода (прилежащих к двойной связи) - sp 2
- Валентный угол (между химическими связями) составляет 120°
Получение алкенов
В результате крекинга нефти образуется один алкан и один алкен.
При наличии катализатора и повышенной температуры от молекул алканов отщепляется водород. Наиболее легко водород отдает третичный атом, чуть труднее - вторичный и заметно труднее - первичный.
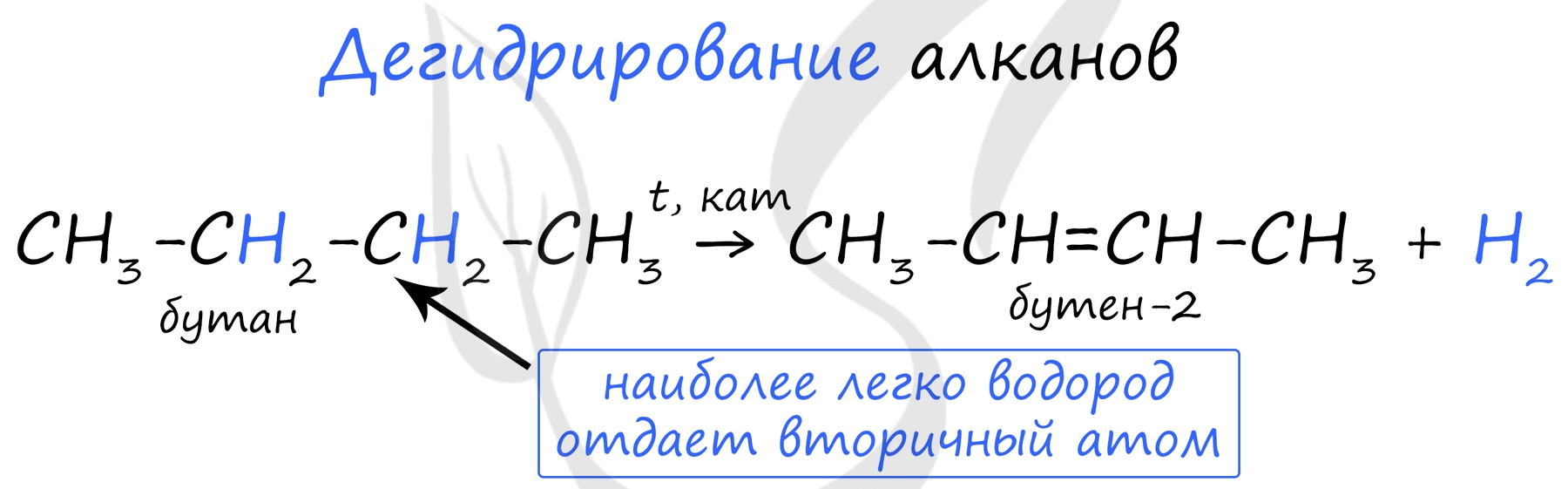
В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород отщепляется от соседнего наименее гидрированного атома углерода.

В подобных реакциях применяется цинк (цинковая пыль) - двухвалентный металл, который связывает расположенные рядом атомы галогенов. Между атомами углерода, которым принадлежали галогены, завязывается двойная связь.

При нагревании спиртов c серной кислотой - H2SO4, обладающей выраженными водоотнимающими свойствами, происходит отщепление воды от спирта по правилу Зайцева. В результате образуется алкен.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.

Химические свойства алкенов
Алкены - ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны.
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).

Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.

Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена - к наименее гидрированному атому углерода.

Присоединение воды, гидратация, происходит по правилу Марковникова. Водород присоединяется к наиболее гидрированному атому углерода, гидроксогруппа - к наименее гидрированному.

При горении алкены, как и все органические соединения, сгорают с образованием углекислого газа и воды - полное окисление. При неполном окислении образуются окиси.

Окисление алкенов перманганатом калия (марганцовкой) в нейтральной среде является качественной реакцией на алкены в частности, и непредельные углеводороды в целом. В результате реакции фиолетовый раствор марганцовки обесцвечивается и выпадает осадок бурого цвета - MnO2.
В более жестких условиях - при подкислении раствора серной кислотой, реакция идет с полным разрывом в самом слабом месте молекулы - двойной связи.

Полимеризация - цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров.
Индекс "n", степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.

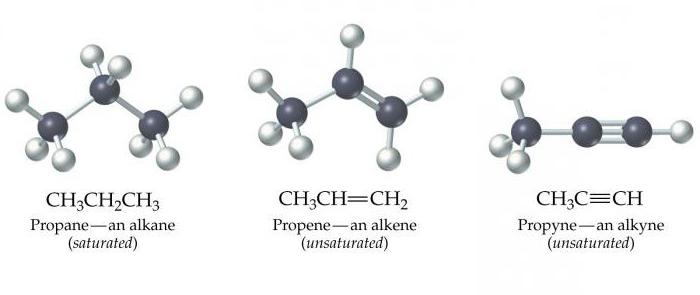
Алканы, алкены, алкины - это органические химические вещества. Все они построены из таких химических элементов, как карбон и гидроген. Алканы, алкены, алкины - это химические соединения, которые принадлежат к группе углеводородов.
В этой статье мы рассмотрим алкины.
Что это такое?
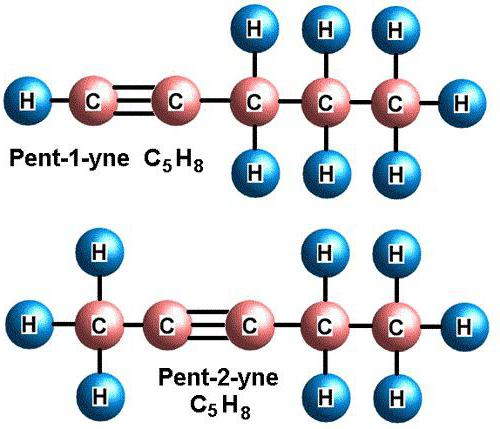
Эти вещества еще называются ацетиленовыми углеводородами. Строение алкинов предусматривает наличие в их молекулах атомов карбона и гидрогена. Общая формула ацетиленовых углеводородов такая: CnH2n-2. Самым простый простой алкин - этин (ацетилен). Он обладает вот такой химической формулой - С2Н2. Также к алкинам относится пропин с формулой С3Н4. Кроме того, к ацетиленовым углеводородам можно отнести бутин (С4Н6), пентин (С5Н8), гексин (С6Н10), гептин (С7Н12), октин (С8Н14), нонин (С9Н16), децин (С10Н18) и т. д. Все виды алкинов обладают похожими характеристиками. Давайте рассмотрим их подробнее.
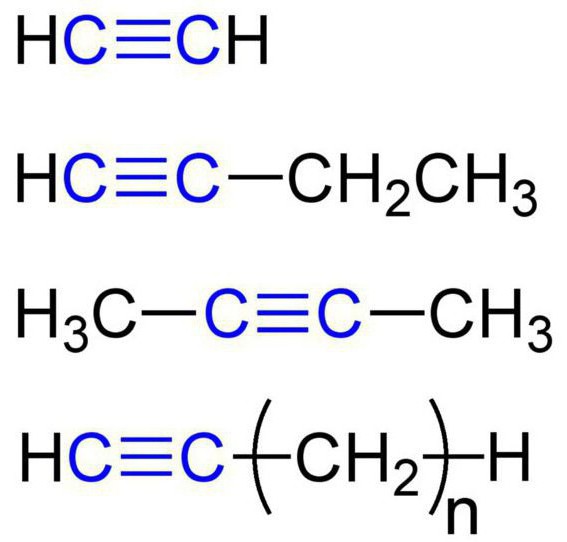
Физические свойства алкинов
По своим физическим характеристикам ацетиленовые углеводороды напоминают алкены.
В нормальных условиях алкины, в молекулах которых содержится от двух до четырех атомов карбона, обладают газообразным агрегатным состоянием. Те, в молекулах которых находится от пяти до 16 атомов карбона, при нормальных условиях жидкости. Те, в составе молекул которых от 17 и больше атомов этого химического элемента, - твердые вещества.
Плавятся и кипят алкины при более высокой температуре, чем алканы и алкены.
Растворимость в воде незначительная, но немного выше, чем у алкенов и алканов.
Наиболее широко используемый алкин - ацетилен - обладает такими физическими свойствами:
- не имеет цвета;
- не имеет запаха;
- при нормальных условиях находится в газообразном агрегатном состоянии;
- обладает меньшей плотностью, чем воздух;
- температура кипения - минус 83,6 градусов Цельсия;
Химические свойства алкинов
В этих веществах атомы связаны тройной связью, чем и объясняются основные их свойства. Алкины вступают в реакции такого типа:
- гидрирование;
- гидрогалогенирование;
- галогенирование;
- гидратация;
- горение.
Давайте рассмотрим их по порядку.
Гидрирование
Химические свойства алкинов позволяют им вступать в реакции такого типа. Это вид химического взаимодействия, при котором молекула вещества присоединяет к себе дополнительные атомы водорода. Вот пример такой химической реакции в случае с пропином:
Эта реакция происходит в две стадии. На первой молекула пропина присоединяет два атома гидрогена и на второй - столько же.
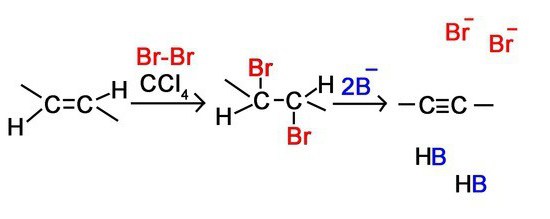
Галогенирование
Это еще одна реакция, которая входит в химические свойства алкинов. В ее результате молекула ацетиленового углеводорода присоединяет атомы галогенов. К последним относятся такие элементы, как хлор, бром, иод и др.
Вот пример такой реакции в случае с этином:
Такой же процесс возможен и с другими ацетиленовыми углеводородами.
Гидрогалогенирование
Это также одна из основных реакций, которая входит в химические свойства алкинов. Она заключается в том, что вещество взаимодействует с такими соединениями, как НСІ, НІ, HBr и др. Это химическое взаимодействие происходит в две стадии. Давайте рассмотрим реакцию такого типа на примере с этином:
Гидратация
Это химическая реакция, которая заключается во взаимодействии с водой. Она тоже происходит в два этапа. Давайте рассмотрим ее на примере с этином:
Вещество, которое образуется после первого этапа реакции, называется виниловым спиртом.
В связи с тем, что согласно правилу Эльтекова функциональная группа ОН не может располагаться рядом с двойной связью, происходит перегруппировка атомов, в результате которой из винилового спирта образуется ацетальдегид.
Процесс гидратации алкинов еще называется реакцией Кучерова.
Горение
Это процесс взаимодействия алкинов с кислородом при высокой температуре. Рассмотрим горение веществ этой группы на примере с ацетиленом:
При избытке кислорода ацетилен и другие алкины горят без образования карбона. При этом выделяются только оксид карбона и вода. Вот уравнение такой реакции на примере с пропином:
Горение других ацетиленовых углеводородов также происходит подобным образом. В результате выделяется вода и углекислый газ.
Другие реакции
Также ацетилены способны реагировать с солями таких металлов, как серебро, медь, кальций. При этом происходит замещение гидрогена атомами металла. Рассмотрим такой вид реакции на примере с ацетиленом и нитратом серебра:
Еще один интересный процесс с участием алкинов - реакция Зелинского. Это образование бензола из ацетилена при его нагревании до 600 градусов по Цельсию в присутствии активированного угля. Уравнение этой реакции можно выразить таким образом:
Также возможна полимеризация алкинов - процесс объединения нескольких молекул вещества в одну полимерную.
Получение
Алкины, реакции с которыми мы рассмотрели выше, получают в лаборатории несколькими методами.
Первый - это дегидрогалогенирование. Выглядит уравнение реакции таким образом:
Для проведения такого процесса необходимо нагреть реагенты, а также добавить этанол в качестве катализатора.
Также есть возможность получения алкинов из неорганических соединений. Вот пример:
Следующий метод получения алкинов - дегидрирование. Вот пример такой реакции:
С помощью реакции подобного типа можно получить не только этин, но и другие ацетиленовые углеводороды.
Применение алкинов
Наибольшее распространение в промышленности получил самый простой алкин - этин. Он широко используется в химической отрасли.
- Нужен ацетилен и другие алкины для получения из них других органических соединений, таких как кетоны, альдегиды, растворители и др.
- Также из алкинов можно получить вещества, которые используются при производстве каучуков, поливинилхлорида и др.
- Из пропина можно получить ацетон в результате ракции Кучерова.
- Кроме того, ацетилен используется при получении таких химических веществ, как уксусная кислота, ароматические углеводороды, этиловый спирт.
- Еще ацетилен применяется в качестве топлива с очень высокой теплотой горения.
- Также реакция горения этина используется для сваривания металлов.
- Кроме того, с использованием ацетилена можно получить технический карбон.
- Также это вещество применяется в автономных светильниках.
- Ацетилен и ряд других углеводородов этой группы используются в качестве ракетного топлива благодаря своей высокой теплоте горения.
На этом применение алкинов заканчивается.

Заключение
В качестве завершающей части приводим краткую таблицу о свойствах ацетиленовых углеводородов и их получении.
Читайте также:

