Агрегатные состояния вещества 7 класс физика кратко
Обновлено: 05.07.2024
1. В каких агрегатных состояниях может находиться вещество?
В природе вещества встречаются в трех состояниях: в твердом, жидком и газообразном.
В зависимости от условий одно и то же вещество может быть твердым, жидким или газообразным.
В различных состояниях вещества обладают разными свойствами.
Вода может быть льдом (твердое тело), водяным паром (газ) и жидкостью.
Ртуть в термометре в обычных условиях жидкость, в Антарктиде при очень низких температурах (ниже минус 39 градусов) замерзает.
Ртуть легко испаряется, переходя в газообразное состояние.
2. Каковы общие свойства твердых тел?
Большинство окружающих нас тел состоят из твердых веществ. Это дома, машины, инструменты и др. Форму твердого тела можно изменить, но для этого необходимо приложить усилие. Например, чтобы согнуть гвоздь, нужно приложить довольно большое усилие.
В обычных условиях трудно сжать или растянуть твердое тело.
Для придания твердым телам нужной формы и объема на заводах и фабриках их обрабатывают на специальных станках: токарных, строгальных, шлифовальных.
Твердое тело имеет собственную форму и объем.
3. Каковы общие свойства жидкостей?
Жидкости принимают форму сосуда, в котором находятся.
Жидкости легко меняют свою форму, но сохраняют объем.
Вода, налитая в бутылку, имеет форму бутылки, а та же вода в стакане принимает форму стакана.
Интересно, что жидкость в невесомости, и капли дождя при падении тоже, имеют форму шара.

4. Каковы общие свойства газов?
Газы не имеют собственной формы и постоянного объема.
Газы легко изменяют свой объем.
Газы принимают форму сосуда и полностью заполняют предоставленный им объем.
Если мы сжимаем резиновый мяч, то изменяем в нем объем воздуха.
Газ в закрытом сосуде занимает весь его объем. Нельзя заполнить газом половину бутылки.
Все окружающие нас тела отличаются друг от друга не только своим внешним видом, объёмом и цветом, но и составом.
Тела состоят из веществ. У веществ имеются различные свойства.
Любое вещество может принимать все три состояния, а повседневно в этих состояниях можно встретить воду.

На Земле чаще всего встречается вода в жидком состоянии.

Наливаете стакан сока и добавляете туда лед, моете стакан водой, а потом можно еще паром обдать, чтобы стакан был совсем чистым. В этом процессе трижды используется вода, но в разных агрегатных состояниях. Давайте разбираться, в каких.
О чем эта статья:
Агрегатные состояния вещества
Чтобы разобраться с тем, какими бывают агрегатные состояния, предлагаю по ходу чтения статьи заполнять таблицу.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Лед, вода и водяной пар — это все три агрегатных состояния одного вещества. Лед — твердое состояние, вода — жидкая, пар — газообразное. Для каждого вещества существует три состояния.
Твердое состояние
Его очень легко представить — это любой предмет, который мы встречаем в жизни. В этом состоянии тело сохраняет форму и объем. Расстояние между молекулами, приблизительно равно размеру самих молекул, которые, в свою очередь, расположены очень структурированно.
Такая структура называется кристаллической решеткой — из-за четкой структуры молекулам сложно двигаться, и они просто колеблются около своих положений равновесия.
Заполняем нашу табличку
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
Жидкое состояние
В этом состоянии сохраняется объем, но не сохраняется форма. Например, если перелить молоко из кувшина в стакан, то молоко, имевшее форму кувшина, примет форму стакана. Кстати, в корове у молока тоже была другая форма.

Расстояние между молекулами в жидком состоянии чуть больше, чем в твердом, но все равно невелико. При этом частицы не собраны в кристаллическую решетку, а расположены хаотично. Молекулы почти не двигаются, но при нагревании жидкости делают это более охотно.
Вспомните, что происходит, если залить чайный пакетик холодной водой — он почти не заваривается. А вот если налить кипяточку — чай точно будет готов.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
Газообразное состояние
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
занимают предоставленный объем
больше размеров молекул
хаотичное и непрерывное
На самом деле, есть еще четвертое — плазма. Звучит, как что-то из научной фантастики, но это просто ионизированный газ — газ, в котором помимо нейтральных частиц есть еще и заряженные. Ионизаторы воздуха как раз строятся на принципе перехода из газообразного вещества в плазму.
С агрегатными состояниями разобрались, ура! Но до сих пор неясно, каким образом у каждого вещества их целых три, и как одно переходит в другое. Для этого узнаем, что такое фазовые переходы.
Фазовые переходы: изменение агрегатных состояний вещества
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Фазовые переходы интересны тем, что все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы металлургии и микроэлектроники.
На схеме — названия всех фазовых переходов:

Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
График фазовых переходов
Если взять процесс превращения льда в воду, воды — в пар, и обратные действия, то мы получим очень информативный график.

Разбираемся по шагам.
Сначала взяли лед, конечно, при отрицательной температуре, потому что при нуле лед начинает плавиться. Нагрели лед до температуры плавления (до 0 градусов Цельсия).
После того, как лед нагрелся до температуры плавления, он начинает плавиться. В точке B это еще лед, а в точке C — уже вода. Плавление происходит при постоянной температуре и тем дольше длится, чем больше масса плавящегося вещества. Еще этот процесс зависит от свойств самого вещества, но об этом немного позже.
Расплавленное вещество уже в жидком состоянии снова начинает нагреваться, и температура увеличивается, пока не достигает температуры кипения. В данном случае нагревается вода — это значит, что ее температура кипения равна 100 градусам Цельсия.
- DE — кипение (парообразование) воды
При 100 градусах вода кипит, пока не выкипит целиком. В данном случае процесс, как и плавление, происходит при постоянной температуре. Но парообразование нельзя путать с испарением, потому что парообразование происходит при конкретной температуре, а испарение — при любой .
Далее полученный пар нагревается, но путем нагревания невозможно дойти до другого фазового перехода — можно пойти только обратно.
Первый шаг в обратную сторону — охлаждение до температуры кипения.
Дойдя до температуры кипения (в данном случае 100 градусов), пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
Сконденсировавшись, вода охлаждается, пока не начнет замерзать.
Кристаллизуется (замерзает) вода при той же температуре, что и плавится лед — 0 градусов. Кристаллизация также происходит при постоянной температуре.
После кристаллизации лед охлаждается.
С нагреванием и охлаждением все совсем просто — мы либо передаем теплоту телу (веществу), и оно идет на увеличение температуры, либо тело отдает тепло и охлаждается.
В остальных процессах температура не меняется. Это связано с тем, что количество теплоты не всегда зависит от температуры. Формулы для всех процессов выглядят так:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг · ˚C]
m — масса [кг]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Плавление
Кристаллизация
Q — количество теплоты [Дж]
λ — удельная теплота плавления вещества [Дж/кг]
m — масса [кг]
Парообразование
Конденсация
Q — количество теплоты [Дж]
L — удельная теплота парообразования вещества [Дж/кг]
m — масса [кг]
Онлайн-уроки физики в Skysmart не менее увлекательны, чем наши статьи!
Решение задач по фазовым переходам
С теорией разобрались — а теперь давайте практиковаться!
Задачка раз. Температура медного образца массой 100 г повысилась с 20 °С до 60 °С. Какое количество теплоты получил образец? Удельную теплоёмкость меди считать равной 380 Дж/(кг · °С)
Сначала нужно перевести массу в килограммы:
Q = 380 · 0,1 · (60 − 20) = 1520 Дж
Ответ: образец получил 1520 Дж
Задачка два. Какое количество теплоты необходимо для плавления 2,5 т стали, взятой при температуре плавления? Удельная теплота плавления стали λ = 80 кДж/кг. Теплопотерями пренебречь.
Сначала нужно перевести массу в килограммы и удельную теплоту в Дж/кг:
80 кДж/кг = 80 000 Дж/кг
Q = 80 000 · 2500 = 200 000 000 Дж = 200 МДж
Ответ: для плавления 2,5 т стали необходимо 200 МДж теплоты.
Сублимация и десублимация
Мы уже рассказали про такие процессы, как сублимация и десублимация.
- Переход из твердого состояния в газообразное, минуя жидкое — сублимация (возгонка);
- Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
Примерчики из жизни🤓
Про белье. Попробуйте повесить белье сушиться на улицу в мороз. Поскольку вода замерзает из-за низких температур, белье должно вернуться домой в виде большого айсберга, но этого не происходит — оно возвращается абсолютно сухим. В данном процессе произошла возгонка молекул воды (сублимация).
Про принтеры. Цветные принтеры (только не лазерные) печатают путем сублимации. Вот как это работает: частицы краски быстро переходят из твердого состояния в газообразное и оседают на бумаге — так получается цветная картинка.
Рисуночки на окнах. Если вы решите проехаться на автобусе в холодную погоду — увидете на стеклах чудесные узоры. Из-за огромной разницы температур между улицей и автобусом, мы можем наблюдать процесс десублимации в виде красивых рисунков на стеклах. Иней образуется похожим способом — резкое похолодание приводит к десублимации воздуха.
Влажность воздуха: испарение и конденсация
Такие процессы, как испарение и конденсация, становятся более логичными и простыми, если их рассмотреть на примере влажности воздуха.
Влажность воздуха говорит нам о том, сколько в воздухе содержится водяного пара. Любое количество пара в воздух не запихнешь, поэтому, во-первых, его там очень мало, а во-вторых, при избыточном количестве водяного пара происходит конденсация — это когда образуется роса.
Допустим, зимой при температуре −20 градусов в 1 литре воздуха содержится 1 миллиграмм пара. Относительная влажность в таком случае равна 100% — испарения не будет, больше пара в этот воздух уже не запихнешь. Но если мы тот же воздух поместим в помещение с температурой +20 градусов, то в него может испариться уже до 17 миллиграмм пара. Значит, что его влажность будет равна 1/17 = 6%. Человеку комфортнее всего находиться при значении влажности 40–50%.
Как влажность влияет на человека
Для человека влажность очень важна, потому что мы состоим из воды на 90%. Если окружающей среде нечего испарять, она будет испарять нас. Поэтому при низкой влажности мы чувствуем сухость во рту, а при высокой — волосы впитывают влагу, разбухают и начинают виться. На этом принципе построены некоторые гигрометры — приборы для измерения влажности. Они так и называются — волосяные гигрометры. Только внутри не человеческий волос, а конский, но принцип от этого не меняется.
При высокой влажности холод и тепло воспринимаются более чувствительно. Это связано с потливостью человека при высокой температуре. Такой механизм помогает нам бороться с жарой, но при высокой влажности пот не может испариться. При испарении пота мы теряем избыточное тепло, а в данном случае этого не происходит.
При низкой влажности происходит нечто похожее. Как ни странно, в мороз мы тоже потеем (намного меньше, но все-таки это происходит). Если влажность на улице низкая, то пот испарится из-под куртки и нам будет комфортно, а при высокой влажности — он там задержится и будет проводить тепло наружу, забирая у нас драгоценные Джоули тепла. Поэтому зимой в Петербурге холоднее, чем в Москве.
Влажностью можно управлять. Существуют мешочки с шариками адсорбентами, которые кладут в коробки с обувью, чтобы впитать лишнюю влагу. Чтобы окна не запотевали, можно насыпать в рамы соль, которая также впитает влагу. А если вам наоборот нужно больше влаги — берем увлажнитель воздуха (классная вещь!): он добавляет в воздух водяной пар.

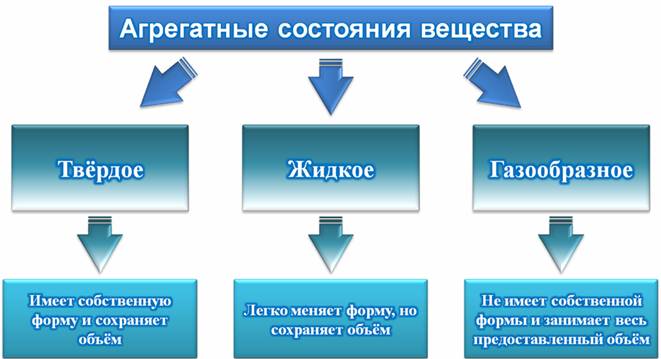
Все вещества могут находиться в трех разных состояниях: твердом, жидком и газообразном, которые называются агрегатными состояниями. На этом уроке мы узнаем, какие тела называются твердыми, какие – жидкими, а какие – газообразными.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Агрегатные состояния вещества"
Агрегатные состояния вещества
Радость видеть и понимать –
есть величайший дар природы
Альберт Эйнштейн
Данная тема посвящена изучению различных состояний вещества. Известно, что вода может находиться в трех состояниях: твердом, жидком и газообразном. То есть, при достаточно низких температурах вода становится льдом или снегом. И, наоборот, при достаточно высоких температурах, вода превращается в пар. Это, конечно, присуще не только воде, но и другим веществам. Итак, любое тело может быть твердым, жидким или газообразным. В зависимости от состояния, тела обладают различными свойствами. Известно, что твердые тела имеют собственную форму и сохраняет объём. Например, стол или стул – это твердые тела, поскольку они имеют определенную форму, которую сохраняют и занимают определенный объём. Для того чтобы изменить форму твердого тела, нужно приложить большое усилие. Например, практически невозможно согнуть или расплющить монету руками. Однако если по ней ударить молотком, то можно её расплющить. Другой пример: стеклянный стакан тоже сохраняет свой объем и форму. Конечно, стакан довольно легко разбить: чаще всего, достаточно просто уронить его на пол. Жидкости, напротив, легко меняют свою форму. Разумеется, это легко доказать, если переливать воду в емкости различной формы: вода будет принимать форму того сосуда, в который она помещена. Тем не менее, жидкости сохраняют свой объём. Это тоже легко проверить: если наполнить бутылку до краев водой и попробовать перелить эту воду в стакан, который явно поменьше. Можно убедиться, что вода туда не поместится: либо в бутылке останется немного воды, либо вода польётся через край стакана.
Газы не сохраняют ни форму, ни объём. Большинство газов прозрачны и бесцветны, а потому невидимы. Достаточно известен один пример газа – это воздух. Конечно, можно перемещаться по комнате, не испытывая никаких затруднений с дыханием. Значит, воздух заполняет всю комнату.
Если попробовать поднять стакан вверх дном и опустить его в воду, то вода его не заполнит. Почему? Потому что там воздух. Ранее был рассмотрен пример с воздушным шариком: можно без труда изменить объём и форму шарика, несмотря на то, что количество газа внутри шарика не меняется. Итак, газы не сохраняют ни свою форму, ни свой объём. Они принимают форму сосуда и заполняют весь предоставленный объём.
Одно и то же вещество может находиться в различных состояниях в зависимости от внешних условий (в основном, это температура).
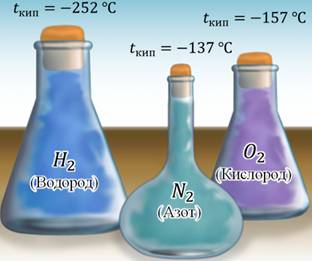
Например, водород закипает уже при температуре минус 252 градуса Цельсия (°С). Конечно, такую температуру на Земле можно получить только в лабораторных условиях и то, это довольно не просто. Газ азот (который является основной составляющей воздуха) становится жидким только при температуре минус 137°С, а кислород – при температуре минус 157°С. Поэтому, данные вещества практически всегда находятся в газообразном состоянии на нашей планете. Металлы – наоборот, почти всегда находятся в твердом состоянии. Дело в том, что для того, чтобы перевести их в жидкое состояние, нужны высокие температуры. Например, чтобы расплавить железо, нужно более полутора тысяч градусов Цельсия. Чтобы расплавить медь нужно нагреть её до температуры около тысячи ста градусов Цельсия. Такие температуры достигаются на различных заводах и фабриках, которые производят изделия из металлов.
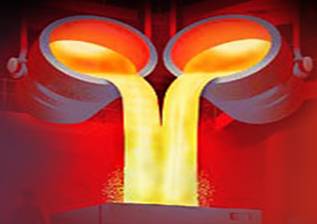
Люди используют свойство жидкости – легко менять свою форму. После того, как металлы переходят в жидкое состояние, их заливают в нужную форму, а потом остужают, чтобы они снова стали твердыми.
Изменение агрегатных состояний вещества постоянно происходит на нашей планете. Это отлично демонстрируется таким явлением, как круговорот воды в природе. Вода испаряется из водоемов, и водяные пары уносятся в атмосферу. Там они остывают, образуя облака и тучи. В конце концов, вода снова переходит в жидкое состояние и возвращается на Землю в виде осадков. Важно понимать, что изменение агрегатных состояний вещества не влечет за собой изменение молекул. Молекулы льда, воды и водяного пара абсолютно одинаковы: они состоят из двух атомов водорода и одного атома кислорода.
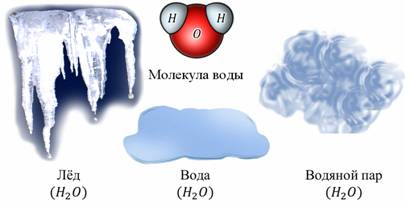
Поэтому, ни в коем случае нельзя путать изменение самого вещества с изменением его состояния. Различные агрегатные состояния вещества определяются расположением молекул, их движением и характером взаимодействия. Но об этом будет подробно рассказано в следующей теме.
Основные выводы:
– Все вещества могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном.
– Твердые тела имеют собственный объём и сохраняют форму.
– Жидкости легко меняют форму, но при этом сохраняют объём.
– Газы не имеют своей формы и занимают весь предоставленный объём (то есть, не сохраняют ни объём, ни форму).
– Вещество переходит в то или иное агрегатное состояние в зависимости от внешних условий.
Читайте также:

