Аденилатциклазный механизм действия гормонов кратко
Обновлено: 08.07.2024
Пути действия гормонов рассматриваются в виде двух альтернативных возможностей:
1) действия гормона с поверхности клеточной мембраны после связывания со специфическим мембранным рецептором и запуска тем самым цепочки биохимических превращений в мембране и цитоплазме (эффекты пептидных гормонов и катехоламинов);
2) действия гормона путем проникновения через мембрану и связывания с рецептором цитоплазмы, после чего гормон-рецепторный комплекс проникает в ядро и органоиды клетки, где и реализует свой регуляторный эффект (стероидные Гормоны, гормоны щитовидной железы).
Считается, что функция распознавания предназначенного определенным клеткам специфического гормонального сигнала у всех клеток для всех гормонов осуществляется мембранным рецептором, а после связывания гормона с соответствующим ему рецептором, дальнейшая роль гормон- рецепторного комплекса для пептидных и стероидных гормонов различна.
У пептидных, белковых гормонов и катехоламинов гормон-рецепторный комплекс приводит к активации мембранных ферментов и образованию различных вторичных посредников гормонального регуляторного эффекта, реализующих свое действие в цитоплазме, органоидах и ядре клетки.
Известны четыре системы вторичных посредников:
1) аденилатциклаза — циклический аденозинмонофосфат (цАМФ);
2) гуанилатциклаза — циклический гуанозинмонофосфат (цГМФ);
3) фосфолипаза С — инозитолтрифосфат (ИФз);
4) ионизированный кальций
У стероидных гормонов передача сигнала на внутриклеточные рецепторы.
Рецепторы гормонов могут находиться в цитозоле или в ядре. Цитозольные рецепторы связаны с белком-шапероном, который предотвращает преждевременную активацию рецептора. Ядерные и цитозольные рецепторы стероидных и тиреоидных гормонов содержат ДНК-связывающий домен, который обеспечивает в ядре взаимодействие комплекса гормон-рецептор с регуляторными сайтами ДНК.
Последовательность событий, приводящих к экспрессии специфических белков:
· гормон проходит через двойной липидный слой клеточной мембраны и взаимодействует с рецептором.
· комплекс гормон-рецептор проходит в ядро, взаимодействует с регуляторной нуклеотидной последовательностью в ДНК - энхансером или сайленсером.
· увеличивается (при взаимодействии с энхансером) или уменьшается (при взаимодействии с сайленсером) доступность промотора для РНК-полимеразы.
· соответственно увеличивается или уменьшается скорость транскрипции структурных генов.
· зрелые мРНК выходят из ядра
· увеличивается или уменьшается скорость трансляции.
· изменяется количество белков, которые могут влиять на метаболизм и функциональное состояние клетки.
Эффекты гормонов, которые передают сигнал через внутриклеточные рецепторы, нельзя наблюдать сразу, так как на протекание матричных процессов (транскрипцию и трансляцию) требуется время.
Интернализация гормон-рецепторных комплексов происходит за счет эндоцитоза, т.е. активного поглощения с помощью впячивания мембраны, с образованием в цитоплазме пузырька с гормон — рецепторными комплексами, который подвергается затем лизосомному разрушению. Тем не менее, в клетках удалось обнаружить и свободные неразрушенные комплексы, способные оказывать и внутриклеточные эффекты.
ЦиклоАМФ является наиболее популярным мессенджером
Циклический АМФ (циклоАМФ, цАМФ) образуется в клетке, когда действуют гормоны гипофиза (ТТГ, ЛГ, МСГ, ФСГ. АКТГ), кальцитонин, соматостатин, глюкагон, паратгормон, адреналин (через α2- и β-адренорецепторы), вазопрессин (через V2-рецепторы).
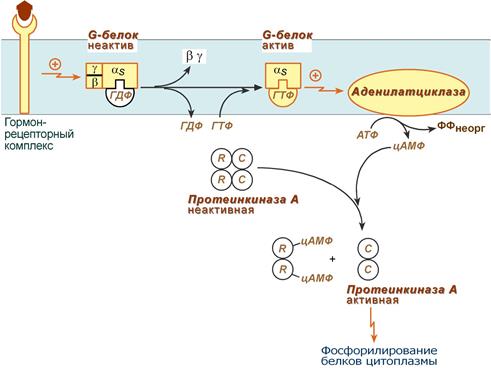
Механизм наработки цАМФ связан с активацией фермента аденилатциклазыи называется аденилатциклазный механизм:.

Схема аденилатциклазного механизма действия гормонов
Этапы передачи сигнала выглядят следующим образом:
1. Взаимодействие лиганда (гормона)с рецептором приводит к изменению конформации последнего. Это изменение передается на G-белок (GTP, ГТФ-зависимый), который состоит из трех субъединиц (α, β и γ), α-субъединица связана с ГДФ.
В составе G-белков α-субъединицы бывают двух типов по отношению к аденилатциклазе: активирующие αS и ингибирующие αI. С активирующей субъединицей αS взаимодействуют β-адренорецепторы, с ингибирующей – α2-адренорецепторы.
2. В результате взаимодействия с рецепторомβ- и γ-субъединицы отщепляются, одновременно на α-субъединице ГДФ заменяется на ГТФ.
3. Активированная таким образом αS-субъединица стимулирует аденилатциклазу, которая начинает синтез цАМФ. Если в действо была вовлечена αI-субъединица, то она ингибирует аденилатциклазу, все останавливается.
4.Циклический АМФ (цАМФ) – вторичный мессенджер – в свою очередь связывается с регуляторными субъединицами протеинкиназы А (R) и вызывает их диссоциацию от каталитических. В результате каталитические субъединицы (C) становятся активными..
Протеинкиназа А (ПК А) фосфорилирует ряд ферментов, среди которых киназа фосфорилазы гликогена, гликогенсинтаза,ТАГ-липаза,транскрипционный факторCREB.
5. Наработка цАМФ продолжается некоторое время, пока α-субъединица, которая является ГТФ-азой, отщепляет фосфат от ГТФ.
6. Как только ГТФ превратился в ГДФ, то α-субъединица инактивируется, теряет свое влияние на аденилатциклазу, обратно соединяется с β- и γ-субъединицами.
7. Все возвращается в исходное положение.
Гормон отрывается от рецептора еще раньше:
если концентрация гормона в крови велика, то следующая его молекула присоединится к рецептору через малый промежуток времени и повторный запуск АЦ-механизма произойдет быстро – в клетке активируются соответствующие процессы.
если гормонав крови мало – для клетки наступает некоторая пауза, изменения метаболизма нет.
46. Типы механизма действия гормонов. Каскадный механизм усиления сигнала в инозитолфосфатной системе. Роль .
Инозитолфосфатная система включает 3 мембранных белка:
R- рецептор активатора инозитолфосфатной системы – интегральный белок
Фосфолипаза С - поверхностный белок
Gplc – ГТФ-связывающий белок активирует фосфолипазу С – заякоренный белок
Работу системы обеспечивают белок кальмодулин, фермент протеинкиназа С, регулируемые Са2+ -каналы мембраны ЭПР, Са2+ -АТФаза клеточной и митохондриальной мембран

Последовательность событий, приводящих к активации фосфолипазы С:
связывание сигнальной молекулы, например гормона с рецептором (R), вызывает изменение конформации и увеличение сродства к Gр1с-белку.
образование комплекса гормон-рецептор Gрlс-ГДФ приводит к снижению сродства αрlс-протомера Gрlс-белка к ГДФ и увеличению сродства к ГТФ. В активном центре αрlс-субъединицы ГДФ заменяется на ГТФ.
это вызывает изменение конформации αрlс-субъединицы и она отделяется от βγ-
отделившаяся α- ГТФ субъединица латерально перемещается по мембране к центру связывания фермента фосфолипазы С.
взаимодействие α- ГТФ субъединицы с фосфолиггазой С изменят конформацию и активность фермента, увеличивается скорость гидролиза фосфолипида клеточной мембраны фосфатидилинозитол-4,5-бисфосфата (ФИФ2).
в ходе гидролиза образуется и выходит в цитозоль гидрофильное вещество инозитол-1,4,5-трифосфат (ИФ3). Другой продукт реакции диацилглицерол (ДАГ) остаётся в мембране и участвует в активации фермента протеинкиназы С (ПКС).
инозитол-1,4,5-трифосфат (ИФ3) связывается специфическими центрами Са2+-канала мембраны ЭПР, это приводит к изменению конформации белка и открытию Са2+-канала. Са2+ по градиенту концентрации поступает в цитозоль. В отсутствие в цитозоле ИФ3 канал закрыт.
Активация протеинкиназы С
Повышение концентрации Са2+ в цитозоле клетки увеличивает скорость взаимодействия Са2+ с неактивным цитозольным ферментом протеинкиназой С (ПКС) и белком кальмодулином.
Связывание протеинкиназы С с ионами кальция позволяет ферменту вступать в кальций-опосредованное взаимодействие с молекулами "кислого" фосфолипида мембраны, фосфатидилсерина (ФС). Диацилглицерол, занимая специфические центры в протеинкиназе С, ещё более увеличивает её сродство к ионам кальция.
На внутренней стороне мембраны образуется ферментативный комплекс – (ПКС ▪ Са2+ ▪ ДАГ ▪ ФС) - активная протеинкиназа С, фосфорилирующая специфические ферменты по серину и треонину.
Участие белка кальмодулина в инозитолфосфатной передаче сигнала
В клетках многих тканей присутствует белок кальмодулин, который функционирует как внутриклеточный рецептор Са2+, он имеет 4 центра для связывания Са2+. При повышении концентрации кальция он присоединяется к кальмодулину, образуя комплекс (4Са2+-кальмодулин) и этот комплекс взаимодействует с различными белками и ферментами приводит к их активации, повышая скорость фосфорилирования по серину и треонину.
Как и большинство систем трансмембранной передачи сигналов, инозитолфосфатная система имеет не только механизм усиления, но и механизм подавления сигнала. Присутствующие в цитозоле инозитол-1,4,5-трифосфат (ИФ3) и диацилглицерол (ДАТ) в мембране могут в результате серии реакций опять превращаться в фосфатидилинозитол-4,5-бисфосфат (ФИФ2). Ферменты, катализирующие восстановление фосфолипида, активируются фосфорилированием протеинкиназой С.
Концентрация Са2+ в клетке снижается до исходного уровня при действии Са2+-АТФ-аз цитоплазматической мембраны и ЭР, а также Na+/Ca2+-и Н+/Са2+-транслоказ (активный антипорт) клеточной и митохондриальной мембран.
Функционирование транслоказ Са2+ и Са2+-АТФ-аз может активироваться:
протеинкиназой А (фосфорилированием);
протеинкиназой С (фосфорилированием). Понижение концентрации Са2+ в клетке и диацилглицерола в мембране приводит к изменению конформации протеинкиназы С, снижению её сродства к фосфатидилсерину, фермент диссоциирует в цитозоль (неактивная форма). Фосфорилированные протеинкиназой С ферменты и белки под действием фосфопротеинфосфатазы переходят в дефосфорилированную форму.
По этому механизму, который получил название кальций-фосфолипидный механизм, действуют вазопрессин(через V1-рецепторы), адреналин(через α1-адренорецепторы), ангиотензин II.
Гидролиз ФИФ2 продолжается некоторое время, пока αP-субъединица, которая является ГТФ-азой, отщепляет фосфат от ГТФ.
Циклический АМФ (циклоАМФ, цАМФ) образуется в клетке, когда действуют гормоны гипофиза (ТТГ, ЛГ, МСГ, ФСГ. АКТГ), кальцитонин, соматостатин, глюкагон, паратгормон, адреналин (через α2- и β-адренорецепторы), вазопрессин (через V2-рецепторы).
Механизм наработки цАМФ связан с активацией фермента аденилатциклазы и называется аденилатциклазный механизм:.
Общая схема аденилатциклазного механизма действия гормонов
Этапы передачи сигнала
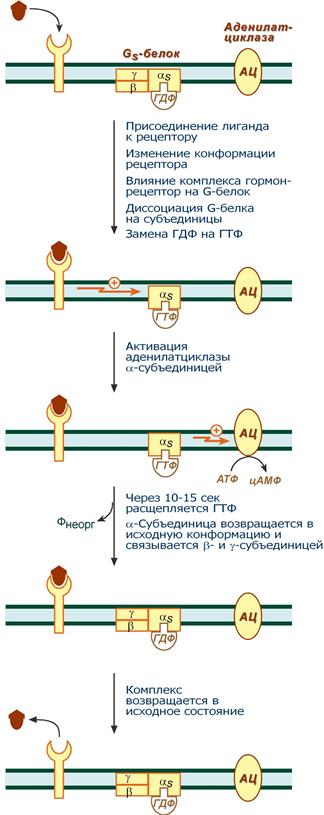
Этапы передачи сигнала выглядят следующим образом:
1. Взаимодействие лиганда с рецептором приводит к изменению конформации последнего. Это изменение передается на G-белок (GTP, ГТФ-зависимый), который состоит из трех субъединиц (α, β и γ), α-субъединица связана с ГДФ.
В составе G-белков α-субъединицы бывают двух типов по отношению к аденилатциклазе: активирующие αs и ингибирующие αi.
Например, в случае действия адреналина с активирующей субъединицей αs взаимодействуют β-адренорецепторы, с ингибирующей – α2-адренорецепторы.
2. В результате взаимодействия с рецептором β- и γ-субъединицы отщепляются, одновременно на α-субъединице ГДФ заменяется на ГТФ.
3. Активированная таким образом αs-субъединица стимулирует аденилатциклазу, которая начинает синтез цАМФ. Если в действо была вовлечена αi-субъединица, то она ингибирует аденилатциклазу, все останавливается.
4. Циклический АМФ (циклоАМФ, цАМФ) – вторичный мессенджер – в свою очередь связывается с регуляторными (R) субъединицами протеинкиназы А и вызывает их диссоциацию от каталитических. В результате каталитические (C) субъединицы становятся активными.
Протеинкиназа А (ПК А) фосфорилирует ряд ферментов, среди которых киназа фосфорилазы гликогена, гликогенсинтаза, гормончувствительная липаза, транскрипционный фактор CREB (cAMP-response element-binding protein).
5. Наработка цАМФ продолжается некоторое время, пока α-субъединица, которая является ГТФ-азой, отщепляет фосфат от ГТФ.
6. Как только ГТФ превратился в ГДФ, то α-субъединица инактивируется, теряет свое влияние на аденилатциклазу, обратно соединяется с β- и γ-субъединицами.
7. Все возвращается в исходное положение.
Гормон отрывается от рецептора еще раньше:
- если концентрация гормона в крови велика, то следующая его молекула присоединится к рецептору через малый промежуток времени и повторный запуск АЦ-механизма произойдет быстро – в клетке активируются соответствующие процессы.
- если гормона в крови мало – для клетки наступает некоторая пауза, изменения метаболизма нет.
Остановка АЦ-механизма
Очевидно, что находящийся в цитозоле цАМФ должен своеременно удаляться, чтобы гормональный сигнал не оказывал избыточное воздействие. Для ликвидации цАМФ (и циклоГМФ) в клетках присутствуют различные фосфодиэстеразы , "открывающие" созданный фосфатом цикл.
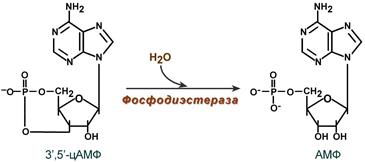
Снижение активности цАМФ-фосфодиэстеразы вызывается глюкокортикоидами, что усиливает действие адреналина при стрессе, и кофеином, что обусловливает его адреналиноподобные эффекты, а именно гипергликемию, ино- и хронотропный эффект на сердце, расширение сосудов скелетных мышц и головного мозга.
Активация фосфодиэстеразы вызывается инсулином, также быстро и обратимо обеспечивается ионами Cа 2+ либо непосредственно, либо через гуанилатциклазный механизм.
Клеточные фосфодиэстеразы отличаются друг от друга внутриклеточной и органной локализацией, структурой и молекулярной массой, сродством к цГМФ и цАМФ. В связи с этим выделяют 11 типов фосфодиэстераз, среди них, например, Са 2+ -зависимые, цГМФ-регулируемые, цАМФ- и цГМФ-специфичные.
Наиболее изученным является аденилатциклазный путь передачи гормонального сигнала. В нем задействовано мимимум пять хорошо изученных белков: 1) рецептор гормона; 2) фермент аденилатциклаза, выполняющая функцию синтеза циклического АМФ (цАМФ); 3) G-белок, осуществляющий связь между аденилатциклазой и рецептором; 4) цАМФ-зависимая протеинкиназа, катализирующая фосфорилирование внутриклеточных ферментов или белков-мишеней, соответственно изменяя их активность; 5) фосфодиэстераза, которая вызывает распад цАМФ и тем самым прекращает (обрывает) действие сигнала (рис. 8.5).
Получены в чистом виде α- и β-адренергические рецепторы из плазматических мембран клеток печени, мышц и жировой ткани. Показано, что связывание гормона с β-адренергическим рецептором приводит к структурным изменениям внутриклеточного домена рецептора, что в свою очередь обеспечивает взаимодействие рецептора со вторым белком сигнального пути – ГТФ-связывающим.
ГТФ-связывающий белок – G-белок – представляет собой смесь 2 типов белков: активного Gs(от англ. stimulatory G) и ингибиторного Gi с мол. массой 80000–90000. В составе каждого из них имеется три разные субъединицы (α-, β- и γ-), т.е. это гетеротримеры. Показано, что β-субъеди-ницы Gsи Giидентичны (мол. масса 35000); в то же время α-субъединицы, являющиеся продуктами разных генов (мол. масса 45000 и 41000), оказались ответственными за проявление G-белком активаторной и ингибиторной активности соответственно. Гормонрецепторный комплекс сообщает G-белку способность не только легко обменивать эндогенный связанный ГДФ на ГТФ, но и переводить Gs-белок в активированное состояние, при этом активный G-белок диссоциирует в присутствии ионов Mg 2+ на β-, γ-субъединицы и комплекс α-субъединицы Gsв ГТФ-форме; этот активный комплекс затем перемещается к молекуле аденилатциклазы и активирует ее. Сам комплекс затем подвергается самоинактивации за счет энергии распада ГТФ и реассоциации β- и γ-субъединиц с образованием первоначальной ГДФ-формы Gs.
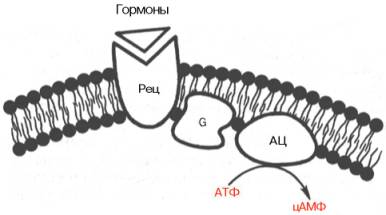
Рис. 8.5. Аденилатциклазный путь передачи гормонального сигнала.
Рец - рецептор; G - G-белок; АЦ-аденилатциклаза.
Аденилатциклаза представляет собой интегральный белок плазматических мембран, его активный центр ориентирован в сторону цитоплазмы и катализирует реакцию синтеза цАМФ из АТФ:
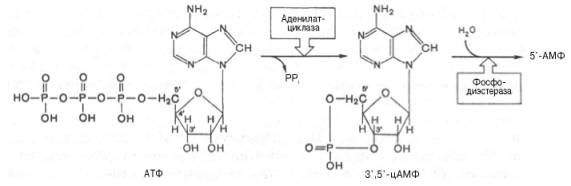
Каталитический компонент аденилатциклазы, выделенный из разных тканей животных, представлен одним полипептидом с мол. массой 120000– 150000; в отсутствие G-белков он практически неактивен; содержит две SH-группы, одна из которых вовлечена в сопряжение с Gs-белком, а вторая необходима для проявления каталитической активности. В молекуле фермента имеется несколько аллостерических центров, через которые осуществляется регуляция активности низкомолекулярными соединениями: ионами Mg 2+ , Mn 2+ и Са 2+ , аденозином и форсколином. Под действием фосфоди-эстеразы цАМФ гидролизуется с образованием неактивного 5'-АМФ.
Протеинкиназа – это внутриклеточный фермент, через который цАМФ реализует свой эффект. Протеинкиназа может существовать в 2 формах. В отсутствие цАМФ Протеинкиназа представлена в виде тетрамерного комплекса, состоящего из двух каталитических (С2) и двух регуляторных (R2) субъединиц с мол. массами 49000 и 38000 соответственно; в этой форме фермент неактивен. В присутствии цАМФ протеинкиназный комплекс обратимо диссоциирует на одну R2-субъединицу и две свободные каталитические субъединицы С; последние обладают ферментативной активностью, катализируя фосфорилирование белков и ферментов, соответственно изменяя клеточную активность.
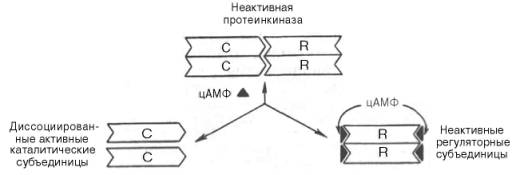
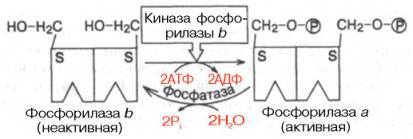
Рис. 8.6. Ковалентная регуляция гликогенфосфорилазы.
Следует отметить, что в клетках открыт большой класс цАМФ-зависи-мых протеинкиназ , названных протеинкиназами А; они катализируют перенос фосфатной группы на ОН-группы серина и треонина (так называемые серин-треонин-киназы). Другой класс протеинкиназ, в частности активируемый инсулиновым рецептором (см. ранее), действует только на ОН-группу тирозина. Однако во всех случаях добавление высокозарядной и объемной фосфатной группы вызывает не только конформационные изменения фосфорилированных белков, но изменяет их активность или кинетические свойства.
Активность многих ферментов регулируется цАМФ-зависимым фосфо-рилированием, соответственно большинство гормонов белково-пептидной природы активирует этот процесс. Однако ряд гормонов оказывает тормозящий эффект на аденилатциклазу, соответственно снижая уровень цАМФ и фосфорилирование белков. В частности, гормон соматостатин, соединяясь со своим специфическим рецептором – ингибиторным G-белком (Gi , являющимся структурным гомологом Gs-белка (см. ранее), ингиби-рует аденилатциклазу и синтез цАМФ, т.е. вызывает эффект, прямо противоположный вызываемому адреналином и глюкагоном. В ряде органов простагландины (в частности, РGЕ1) также оказывают ингибиторный эффект на аденилатциклазу, хотя в том же органе (в зависимости от типа клеток) и тот же PGE1может активировать синтез цАМФ.
Более подробно изучен механизм активирования и регуляции мышечной гликогенфосфорилазы, активирующей распад гликогена. Выделяют 2 формы: каталитически активную – фосфорилазаа и неактивную – фосфо-рилаза b. Обе фосфорилазы построены из двух идентичных субъединиц (мол. массой 94500), в каждой остаток серина в положении 14 подвергается процессу фосфорилирования–дефосфорилирования, соответственно активированию и инактивированию (рис. 8.6).
Под действием киназы фосфорилазы b, активность которой регулируется цАМФ-зависимой протеинкиназой, обе субъединицы молекулы неактивной формы фосфорилазы b подвергаются ковалентному фосфорилиро-ванию и превращаются в активную фосфорилазу а. Дефосфорилирование последней под действием специфической фосфатазы фосфорилазы а приводит к инактивации фермента и возврату в исходное состояние.
В мышечной ткани открыты 3 типа регуляции гликогенфосфорилазы. Первый тип – ковалентная регуляция, основанная на гормонзависимом фосфорилировании–дефосфорилировании субъединиц фосфорилазы (см. рис. 8.6).
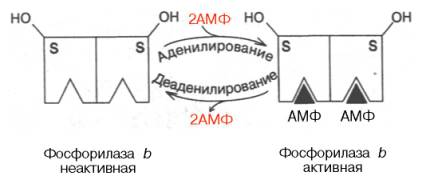
Второй тип – аллостерическая регуляция. Она основана на реакциях аденилирования–деаденилирования субъединиц гликогенфосфорилазы b (соответственно активирование–инактивирование). Направление реакций определяется отношением концентраций АМФ и АТФ, присоединяющихся не к активному центру, а к аллостерическому центру каждой субъединицы (рис. 8.7).
В работающей мышце накопление АМФ, обусловленное тратой АТФ, вызывает аденилирование и активирование фосфорилазы b. В покое, наоборот, высокие концентрации АТФ, вытесняя АМФ, приводят к аллостериче-скому ингибированию этого фермента путем деаденилирования.
цАМФ и протеинкиназа играют центральную роль в гормональной регуляции синтеза и распада гликогена в печени (рис. 8.8). Подробно о химических превращениях гликогена см. в главе 10.
Третий тип – кальциевая регуляция, основанная на аллостерическом активировании киназы фосфорилазы b ионами Са 2+ , концентрация которых повышается при мышечном сокращении, способствуя тем самым образованию активной фосфорилазы а.
Основные системы вторичных посредников. Система аденилатциклаза — цАМФ.
Мембранный фермент аденилатциклаза может находиться в двух формах — активированной и неактивированной. Активация аденилатциклазы происходит под влиянием гормон-рецепторного комплекса, образование которого приводит к связыванию гуанилового нуклеотида (ГТФ) с особым регуляторным стимулирующим белком (GS-белок), после чего GS-белок вызывает присоединение Mg к аденилатциклазе и ее активацию. Так действуют активирующие аде-нилатциклазу гормоны — глюкагон, тиротропин, паратирин, вазопрессин (через V-2-рецепторы), гонадотропин и др. Ряд гормонов, напротив, подавляет аденилатциклазу — соматостатин, ангиотензин-II и др.
Гормонрецепторные комплексы этих гормонов взаимодействуют в мембране клетки с другим регуляторным ингибирующим белком (GI-белок), который вызывает гидролиз гуанозинтрифосфата (ГТФ) до гуанозиндифосфата (ГДФ) и, соответственно, подавление активности аденилатциклазы. Адреналин через р-адренорецепторы активирует аденилатциклазу, а через альфа1-адренорецепторы ее подавляет, что во многом и определяет различия эффектов стимуляции разных типов рецепторов.
Под влиянием аденилатциклазы из АТФ синтезируется цАМФ, вызывающий активацию двух типов протеинкиназ в цитоплазме клетки, ведущих к фосфорилированию многочисленных внутриклеточных белков. Это повышает или снижает проницаемость мембран, активность и количество ферментов, т. е. вызывает типичные для гормона метаболические и, соответственно, функциональные сдвиги жизнедеятельности клетки. В табл. 6.2 приведены основные эффекты активации цАМФ-зависимых протеинкиназ.
Кроме активации протеинкиназ внутриклеточные эффекты цАМФ реализуются также через другие механизмы: систему кальций—кальмодулин, трансметилазную систему, аденозин-5-монофосфат — аденозин, тирозин-киназы. О роли системы кальций—кальмодулин сказано ниже.

Опосредование гормонального сигнала системой аденилатциклаза— цАМФ. Образование гормон-рецепторного комплекса приводит к связыванию гуанилового нуклеотида (ГТФ) с регуляторным стимулирующим белком (GS-белок), последний вызывает присоединение Mg к аденилатциклазе и ее активацию (слева вверху). Так действуют активирующие аденилатциклазу гормоны — глюкагон, тиротропин, паратирин и др. Гормон-рецепторные комплексы соматостатина, ангиотензина-И и других подавляющих аденилатциклазу гормонов взаимодействуют в мембране клетки с другим регуляторным ингибирующим белком (GI-бе-лок), который вызывает гидролиз ГТФ до ГДФ и, соответственно, подавление активности аденилатциклазы (вверху справа). Под влиянием аденилатциклазы из АТФ синтезируется цАМФ, вызывающий активацию протеинкиназ в цитоплазме клетки и фосфорилирование многочисленных внутриклеточных белков. Это меняет проницаемость мембран, активность и количество ферментов, т. е. вызывает типичные для гормона метаболические и, соответственно, функциональные сдвиги. Внутриклеточные эффекты цАМФ реализуются также через другие механизмы: систему кальций-кальмодулин, трансметилазную систему, аденозин-5-монофосфат — аденозин, тирозинкиназы.
Трансметилазная система обеспечивает метилирование ДНК, всех типов РНК, белков хроматина и мембран, ряда гормонов на уровне тканей, фосфолипидов мембран. Это способствует реализации многих гормональных влияний на процессы пролиферации, дифференцировки, состояние проницаемости мембран и свойства их ионных каналов и, что важно подчеркнуть особо, влияет на доступность мембранных рецепторных белков молекулам гормонов.
Прекращение гормонального эффекта, реализуемого через систему аденилатциклаза — цАМФ, осуществляется с помощью специального фермента фосфодиэстеразы цАМФ, вызывающей гидролиз этого вторичного посредника с образованием аденозин-5-монофосфата. Однако этот продукт гидролиза превращается в клетке в аденозин, также обладающий эффектами вторичного посредника, так как подавляет в клетке процессы метилирования.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

