Взаимодействие этилена с водородом водой галогенами реакция полимеризации конспект
Обновлено: 08.08.2024
В данной статье мы расскажем вам о многочисленных химических свойствах такого органического вещества, как этилен. Во всех подробностях разберем химические реакции с этим веществом. Помимо химических свойств обязательно рассмотрим и общее строение этилена, а также применение данного алкена, основанное на его качествах и способностях.
Характеристики этилена
- Атомы углерода в данном соединении находятся в состоянии sp 2 -гибридизации. Следовательно, каждый углеродный атом образует две ковалентные сигма-связи с атомами водорода и одну - с соседним атомом C. Благодаря одной негибридизованной орбитали между атомами C образуется пи-связь. Оси трех гибридных орбиталей, а также центры шести атомов в молекуле этена находятся в плоскости, перпендикулярной плоскости пи-связи.
- Валентный угол в молекуле C2H4 равен 120 градусам.
- Молекула этилена является плоской.
Важно! В молекуле этилена невозможно свободное вращение sp 2 -гибридизованных углеродных атомов друг относительно друга без разрыва пи-связи.
В обычных условиях данное органическое вещество является газом без цвета и запаха. А теперь можем перейти к главной теме - химическим свойствам этилена.
Главные химические свойства C2 H4
Изучение химических способностей этена будет разделено на отдельные блоки, в которых четко и детально будут расписаны подробности взаимодействий.
Реакции присоединения
- Гидрогалогенирование - присоединение галогеноводородов . Этилен взаимодействует с бромоводородом без особых условий, в результате чего получается бромэтан. Помните, что при присоединении реагента к несимметричному алкену действует правило Марковникова. Оно гласит о том, что атом водорода присоединяется к более гидрогенизированному углеродному атому, а галоген - к менее гидрогенизированному C.
- Гидратация - присоединение H2O . C2 H4 реагирует с водой в присутствии концентрированной серной кислоты и при температуре. Продуктом реакции является этанол - одноатомный первичный спирт. Катализатором в данном случае может быть и фосфорная кислота. Если бы мы проводили аналогичное взаимодействие с пропеном, то получили бы пропанол-2 - вторичный спирт.
- Галогенирование - присоединение галогенов . В ходе этой реакции этен реагирует с хлором. Хлор присоединяется к C2 H4 , разрывая двойную связь, и на выходе получим 1,2-дихлорэтан. Реакция галогенирования является качественной на кратную связь.
- Гидрирование или дегидрирование - присоединение или отщепление атомов водорода. При гидрировании этилен взаимодействует с водородом в присутствии никелевого катализатора и температуры, образуя алкан - этан.

Рис. 2. Химические свойства этилена В случае дегидрирования при аналогичных условиях будут получаться водород и алкин - этин или ацетилен.
Реакция полимеризации
Полимеризация - это процесс соединения одинаковых простых молекул - мономеров, в более сложные - полимеры. Берется неограниченное количество молекул этилена, и при повышенных давлении и температуре, в присутствии катализатора образуется полиэтилен.
Важно! Обратите внимание, что в полиэтилене уже нет кратной связи, она разрывается в процессе реакции.
Реакции окисления
- Реакция Вагнера (в нейтральной среде) - окисление перманганатом калия в водной среде . Три молекулы этена реагируют с двумя молекулами перманганата и четырьмя H2O. В результате этого взаимодействия мы получим три молекулы этиленгликоля - двухатомного спирта. Также выделится гидроксид калия и два оксида марганца (IV). Единственным условием данной реакции может являться холодная среда, то есть наличие температуры в 0 градусов, но это можно и не указывать.
- Реакция Вагнера (в кислотной среде) - окисление перманганатом калия в среде, где находится серная кислота . Этен аналогично реагирует с перманганатом, но вместо воды в этот раз присутствует серная кислота. Соответственно - продукты реакции будут другие. Мы получим две молекулы углекислого газа, сульфаты марганца и калия, а также воду. Взаимодействие идет при термическом воздействии.
- Горение- алкены горят так же, как и все органические соединения. Этилен не является исключением. При сгорании этена образуются углекислый газ и вода. Так как данная реакция является экзотермической, то происходит выделение энергии.
- Обесцвечивание окраски бромной воды- данная реакция является качественной на наличие кратной связи. Важно то, что нельзя отличить, тройная это связь или двойная. Этен реагирует с раствором брома без каких-либо условий. В ходе взаимодействия образуется 1,2-дибромэтан. Исходная темная окраска исчезает, а остается прозрачная жидкость.
Реакция изомеризации
Механизм реакции электрофильного замещения
Мы уже рассмотрели реакцию присоединения галогена к этилену. Но стоит отдельно рассказать о механизме данной реакции, который необходимо знать. В результате отталкивания от пи-связи этена в молекуле хлора происходит поляризация, благодаря которой один атом хлора становится частично положительно заряженным, а другой - частично отрицательно заряженным. Это приводит к смещению пи-связи и образованию пи-комплекса.

Рис. 3. Главные химические свойства этилена Из-за сильной поляризации в молекуле хлора происходит гетеролитический разрыв ковалентной связи. Положительно заряженный ион хлора присоединяется к углеродному атому. Второй атом углерода становится положительно заряженным. Происходит образование сигма-комплекса или карбокатиона. Отрицательно заряженный ион хлора присоединяется к положительному углероду. Образовался 1,2-дихлорэтан.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Тип урока : комбинированный.
изучить реакции присоединения у непредельных углеводородов на примере этилена
получить этилен лабораторным способом
Образовательные : приобретение новых знаний о химических свойствах этилена на основе состава и строения его молекул; выявление и оценка степени овладения системы знаний и комплексов навыков и умений, готовность обучающихся успешно применять полученные знания на практике.
Развивающие : развитие логического мышления, самостоятельности, обеспечение системности учения.
Воспитательные : воспитание положительной мотивации учения, правильной самооценки и чувства ответственности, умения работать в паре.
В алеологические : привитие учащимся навыков стремления заботиться о своем здоровье .
Оборудование : компьютер, медиапроектор, микролаборатории, реактивы: реакционная смесь (спирт этиловый + серная кислота), водный раствор йода, водный раствор перманганата калия, пробирки, стаканчик с водой.
Организационный момент : приветствие, подготовка к уроку.
Проверка домашнего задания :
Первый ученик у доски оформляет решение задачи, на вывод формулы непредельного углеводорода + изомеры полученного вещества;
Второй ученик у доски: сравнительная характеристика предельных и непредельных углеводородов по строению на примере бутана и бутена;
Работа с классом: написать структурные формулы следующих веществ по названию:
1). Будут ли эти вещества гомологами? ( нет )
2). Является ли эти вещества изомерами? ( нет )
3). Имеют ли они общую формулу, если да , то какую( С n H 2 n +2 )
4). Для первого вещества напишите один гомолог и один изомер, назовите их, проверьте друг у друга.
Заслушиваем ответы у доски и оцениваем их.
Объяснение нового материала .
Этиленовые углеводороды более реакционноспособны, чем предельные углеводороды (УВ). Наличие в их строении двойной связи между атомами углерода даёт возможность вступать в реакции присоединения по месту разрыва двойной связи (=).
Двойная связь образуется σ- и π-связью. (Слайд №2-3)
π-связь – более слабая, поэтому разрывается при взаимодействии с некоторыми веществами.
Схема зависимости между строением и свойствами веществ. (Слайд №4)
Сегодня на уроке рассмотрим реакции присоединения. Механизм реакции: разрыв π-связи и появление свободных валентных электронов у атомов углерода при двойной связи, к ним-то и присоединяются реагирующие вещества. (Слайд №5)
Обучающиеся в тетради записывают уравнения четырёх реакций присоединения: гидрирования, галогенирования, гидрогалогенирования и гидротации.
Полное окисление (горение). (Слайд №6)
Качественные реакции (слайд №7): обесцвечивание растворов перманганата калия и бромной воды (записать реакции в тетрадь)
Физкультминутка . (Слайд №8)
Снимем напряжение с глаз – зрение надо беречь!
Найдите точку А и по часовой стрелке следим глазом по красному контуру 2 раза, теперь в обратную сторону тоже 2 раза.
Найдите точку Б (синий контур) следим туда и обратно по 2 раза
Найдите точку В (зеленый контур) то же самое 2 раза туда и обратно
Коричневая горизонтальная линия (вправо – лево 2 раза)
Коричневая вертикальная линия (вверх – вниз 2 раза).
Закрыть глаза ладонями и досчитать до 5).
Открываем практические тетради
Цель: получить этилен и исследовать его свойства
работаем аккуратно над столом, всё лишнее убрать
правила нагревания, обращение со спиртовкой
Проверка техники безопасности – тест каждому (3 минуты на выполнение), а затем взаимопроверка.
Ответы на тест (Слайд №9).
Исправьте ошибки и поставьте оценки.
(таблица заготовлена дома).
Инструкция по выполнению работы на партах.
Что делал? Что видел?
Вывод: на практической работе получили этилен и изучили его свойства.
Если позволит время урока: рассмотрим реакцию окисления этилена перманганатом калия (реакция Вагнера).
Этилен (этен) – первый представитель ряда алкенов – непредельных углеводородов с одной двойной связью.
Формула – С2Н4 (СН2 = СН2). Молекулярная масса (масса одного моль) – 28 г/моль.
Углеводородный радикал, образованный от этилена называется винил (-CH = CH2). Атомы углерода в молекуле этилена находятся в sp 2 -гибридизации.
Химические свойства этилена
Для этилена характерны реакции, протекающщие по механизму электрофильного, присоединения, реакции радикального замещения, окисления, восстановления, полимеризации.
Галогенирование (электрофильное присоединение) — взаимодействие этилена с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды:
![]()
С), в этом случае разрыва двойной связи не происходит – реакция протекает по механизму радикального замещения:
Гидрогалогенирование — взаимодействие этилена с галогенводородами (HCl, HBr) с образование галогенпроизводных алканов:
Гидратация — взаимодействие этилена с водой в присутствии минеральных кислот (серной, фосфорной) с образованием предельного одноатомного спирта – этанола:
Среди реакций электрофильного присоединения выделяют присоединение хлорноватистой кислоты (1), реакции гидрокси- и алкоксимеркурирования (2, 3) (получение ртутьорганических соединений) и гидроборирование (4):
Реакции нуклеофильного присоединения характерны для производных этилена, содержащих электроноакцепторные заместители. Среди реакций нуклеофильного присоединения особое место занимают реакции присоединения циановодородной кислоты, аммиака, этанола. Например,
В ходе реакций окисления этилена возможно образование различных продуктов, причем состав определяется условиями проведения окисления. Так, при окислении этилена в мягких условиях (окислитель – перманганат калия) происходит разрыв π-связи и образование двухатомного спирта — этиленгликоля:
При жестком окислении этилена кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием муравьиной кислоты и углекислого газа:
![]()
С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
При восстановлении этилена происходит образование этана, представителя класса алканов. Реакция восстановления (реакция гидрирования) этилена протекает по радикальному механизму. Условием протекания реакции является наличие катализаторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
Этилен вступает в реакцию полимеризации. Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация этилена происходит под действием кислот (катионный механизм) или радикалов (радикальный механизм):
Физические свойства этилена
Этилен – бесцветный газ со слабым запахом, малорастворимый в воде, растворим в спирте, хорошо растворим в диэтиловом эфире. При смешении с воздухом образует взрывоопасную смесь
Получение этилена
Основные способы получения этилена:
— дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей
— дегалогенирование дигалогенпроизводных алканов под действием активных металлов
![]()
C) или пропускании его паров над катализатором
![]()
С) в присутствии катализатора (Ni, Pt, Pd)
Применение этилена
Этилен является одним из важнейших соединений, производимых в огромных промышленных масштабах. Его используют в качестве сырья для производства целого спектра различных органических соединений (этанол, этиленгликоль, уксусная кислота и т.д.). Этилен служит исходным сырьем для производства полимеров (полиэтилен и др.). Его применяют в качестве вещества, ускоряющего рост и созревание овощей и фруктов.
Примеры решения задач
| Задание | Осуществите ряд превращений этан → этен (этилен) → этанол → этен → хлорэтан → бутан. |
| Решение | Для получения этена (этилена) из этана необходимо использовать реакцию дегидрирования этана, которая протекает в присутствии катализатора (Ni, Pd, Pt) и при нагревании: |
Получение этанола из этена осуществляют по реакции гидратации, протекающей водой в присутствии минеральных кислот (серной, фосфорной):
Для получения этена из этанола используют реакцию дегидротации:
Получение хлорэтана из этена осуществляют по реакции гидрогалогенирования:
Для получения бутана из хлорэтана используют реакцию Вюрца:
| Задание | Вычислите сколько литров и граммов этилена можно получить из 160 мл этанола, плотность которого равна 0,8 г/мл. |
| Решение | Этилен из этанола можно получить по реакции дегидратации, условием протекания которой является присутствие минеральных кислот (серной, фосфорной). Запишем уравнение реакции получения этилена из этанола: |
Найдем массу этанола:
Молярная масса (молекулярная масса одного моль) этанола, вычисленная с помощью таблицы химических элементов Д.И. Менделеева – 46 г/моль. Найдем количество вещества этанола:
Могласно уравнению реакции v(C2H5OH) : v(C2H4) = 1:1, следовательно, v(C2H4) = v(C2H5OH) = 2,78 моль. Молярная масса (молекулярная масса одного моль) этилена, вычисленная с помощью таблицы химических элементов Д.И. Менделеева – 28 г/моль. Найдем массу и объем этилена:
Как вы уже знаете, при дегидрировании этана образуется этилен — родоначальник гомологического ряда алкенов.
Потеря двух атомов водорода приводит к образованию между атомами углерода не одинарной, а двойной связи:

Так как валентности атомов углерода в этилене и его гомологах не до предела насыщены атомами водорода, то такие соединения называют непредельными.
| Алкены — это непредельные углеводороды, содержащие в молекуле, кроме одинарных связей, одну двойную углерод-углеродную связь. Состав их отражает общая формула CnH2n. |
Если сравнить общие формулы алканов и алкенов, нетрудно заметить, что их состав отличается на два атома водорода:

Принадлежность углеводорода к классу алкенов отражают родовым суффиксом -ей в его названии. Этилен — родоначальник гомологического ряда алкенов (табл. 3).
Таблица 3 Гомологический ряд этилена

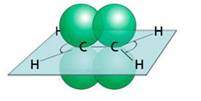
Строение молекулы этилена представлено на рисунке 14. Нетрудно заметить, что молекула этилена имеет плоскостное строение. Аналогично и у всех алкенов по месту расположения двойной связи фрагмент молекулы будет иметь плоскостное строение.

Рис. 14.
Модели молекулы этилена:
1 — масштабная; 2 — шаростержневая
Начиная с третьего члена гомологического ряда алкенов, содержащего в молекуле четыре атома углерода, появляется изомерия углеродного скелета и изомерия положения кратной связи:

Для алкенов характерна межклассовая изомерия с углеводородами другого класса, имеющего такую же общую формулу CnH2n, — циклоалканами. Особенностью химического строения циклоалканов является наличие замкнутой цепочки атомов углерода — цикла, например:

Особенности построения названий алкенов состоят в том, что главная цепь атомов углерода должна обязательно включать двойную С=С-связь, и ее нумерацию проводят с того конца главной цепи, к которому эта связь ближе. В названии углеводорода, оканчивающегося на -ен, цифрой указывают номер того атома углерода, от которого начинается двойная углерод-углеродная связь. Остальные правила формирования названий алкенов остаются такими же, как и для алканов. Например:

В промышленности этилен получают крекингом (расщеплением) продуктов переработки нефти, например керосина.
В лабораторных условиях этилен получают дегидратацией этилового спирта:

| Реакция дегидратации — это процесс отщепления молекулы воды от молекулы органического соединения. |
Этилен — это бесцветный газ без запаха, почти нерастворим в воде. Он обладает способностью ускорять созревание плодов и овощей, что используют в овощехранилищах, куда закладывают недозрелую плодоовощную продукцию.
Рассмотрим химические свойства алкенов на примере этилена.
Наличие в молекулах алкенов двойной С=С-связи обусловливает их химические свойства.
Для алкенов, как для непредельных углеводородов, характерны реакции присоединениях 1) водорода (гидрирование), 2) воды (гидратация), 3) галогенов (гало-генирование) и др. При этом одна из двух связей между атомами углерода разрывается, и оба атома присоединяют атомы или группу атомов реагента. В результате алкен превращается в алкан или его производное:

Последняя реакция применяется для обнаружения соединений с кратной (двойной или тройной) углерод-углеродной связью, т. е. является качественной на кратную связь. При этом происходит обесцвечивание бромной воды (раствора брома в воде) (рис. 15). Аналогичная реакция с хлором имеет практическое значение, поскольку приводит к образованию важного продукта — 1,2-дихлорэтана, используемого в качестве растворителя и для получения пластмасс.

Рис. 15.
Обесцвечивание бромной воды этиленом (качественная реакция на кратную связь)
Для гомологов этилена, например пропилена, реакция гидратации протекает в соответствии с правилом В. В. Марковникова.
При присоединении полярных молекул, например галогеноводородов или воды, к алкену водород преимущественно присоединяется к атому углерода при двойной связи, с которым соединено большее число атомов водорода:

Аналогично гидратации протекает и реакция присоединения галогеноводородов к алкенам, например:
Сущность любой химической реакции заключается в образовании новых молекул из тех же самых атомов, из которых образованы исходные вещества. В ходе любой реакции одни связи разрываются, другие — образуются. Разрыв ковалентной связи можно рассматривать как процесс, обратный ее образованию. Следовательно, при этом возможны два направления разрыва.
Гемолитический разрыв приводит к тому, что оба атома, ранее связанные ковалентной связью, получают по одному электрону, превращаясь в частицы с неспаренным электроном — свободные радикалы.
Подобный тип разрыва химической связи и, соответственно, радикальный механизм реакции наблюдается при уже рассмотренном процессе галогенирования метана.
Гетеролитический разрыв осуществляется таким образом, что один из атомов получает оба электрона, служившие ранее общей электронной парой. Такой тип разрыва связи приводит к образованию заряженных частиц — ионов:
Подобный тип разрыва химической связи и, соответственно, ионный механизм реакции наблюдается в процессе присоединения галогеноводорода к алкенам.
Как известно, химическая связь в молекуле хлорово-дорода является полярной. В условиях реакции молекула НС1 распадается на ионы Н + и С1 - :
Эти ионы и присоединяются к атомам углерода за счет гетеролитического разрыва двойной связи в молекуле алкена.
Особым случаем реакций присоединения является реакция полимеризации.
Полимеризацию этилена можно отразить с помощью следующей схемы:

или с помощью следующего уравнения:

Полимеризацию проводят в присутствии инициаторов, например перекисных соединений, которые являются источниками свободных радикалов. Перекис-ными соединениями называют вещества, молекулы которых включают группу —О—О—. Простейшим перекисным соединением является пероксид водорода Н-О-О-Н.
Вещество, вступающее в реакцию полимеризации, называют мономером, продукт такой реакции — полимером, формулу в скобках в уравнении такой реакции — структурным звеном, а индекс n — степенью полимеризации, которая показывает, сколько структурных звеньев образуют молекулу полимера.
В настоящее время нашу жизнь невозможно представить без полимеров. Изделия из них все в большей степени вытесняют из нашего быта изделия, изготовленные из природных материалов, поскольку полимеры обладают самыми разнообразными свойствами, сравнительно дешевы, легко обрабатываются.
Полиэтилен представляет собой важнейшую пластмассу, которая находит широкое применение в народном хозяйстве (рис. 16).

Рис. 16.
Применение полиэтилена:
1 — медицинское оборудование; 2 — предметы домашнего обихода; 3 — пленка для парников; 4 — трубы и шланги; 5 — клейкая лента; 6 — упаковочная пленка; 7 — пакеты; 8 — детали
В лабораторных условиях с помощью реакции деполимеризации технического полиэтилена (она является обратной процессу полимеризации), например, из полиэтиленовых гранул, можно получить этилен (рис. 17):


Рис. 17.
Получение этилена деполимеризацией полиэтилена
На кратную связь, кроме реакции обесцвечивания бромной воды, существует еще одна качественная реакция — реакция обесцвечивания раствора перманганата калия КМп04 (рис. 18), уравнение которой


Рис. 18. Обесцвечивание раствора перманганата калия этиленом (качественная реакция на кратную связь)
Этилен — важнейший продукт химической промышленности, так как используется для получения других ценных веществ и материалов (рис. 19).

Рис. 19.
Применение этилена:
1 — в овощехранилищах для ускорения созревания плодов; 2—6 — производство органических соединений (полиэтилена 2, растворителей 3, уксусной кислоты 4, спиртов 5, 6)

Данный видеоурок посвящён алкенам. Особенности строения и свойства рассматриваются на примере этилена. Подробно и наглядно демонстрируются способы получения этилена, качественные реакции на примере этилена: обесцвечивание бромной воды и раствора перманганата калия, кроме этого, здесь приведён пример реакции полимеризации этилена.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Алкены. Химические свойства этилена"
Алкены. Химические свойства этилена
Первым представителем алкенов является этилен, или этен. Его молекулярная формула С2Н4. Из этой формулы можно выразить общую формулу этого класса – CnH2n.
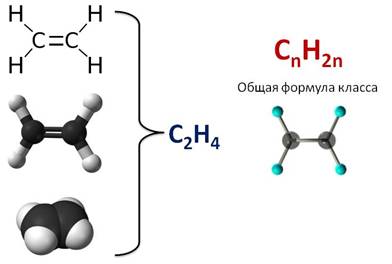
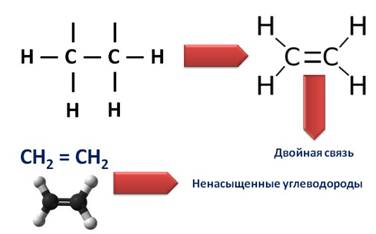
В образовании молекулы этилена участвуют два атома углерода, с каждым атомом углерода соединено два атома водорода и ещё у каждого атома углерода остаётся по одной свободной валентности, ведь атомы углерода должны быть четырёхвалентны. Поэтому между этими двумя углеродами возникает ещё одна связь. Такую связь называют двойной.
Из-за этой двойной связи этилен относят к ненасыщенным углеводородам, потому что атомы углерода не насыщены до предела атомами водорода, а образуется двойная C – C связь.
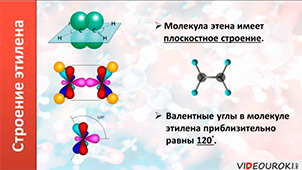
Молекула этилена плоская. Все шесть атомов молекулы лежат в одной плоскости. Экспериментально установлено, что валентные углы в молекуле этилена приблизительно равны 120 0 .
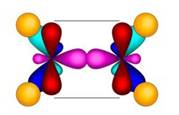
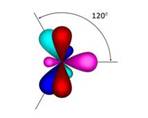
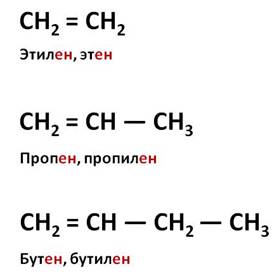
Вторым представителем гомологического ряда алкенов является пропен, или пропилен. Как вы могли заметить, в названии свех алкенов употребляется суффикс – ен. Следующим представителем алкенов является бутен, или бутилен.
По физическим свойствам этилен – газ со слабым запахом, незначительно растворяется в воде, лучше – в органических растворителях.
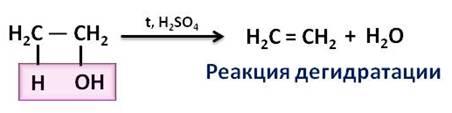
В лаборатории этилен можно получить из этилового спирта, путём отщепления от него молекулы воды. Эта реакция протекает в присутствии серной кислоты и при нагревании.
Эта реакция является реакцией дэгидратации. То есть, реакции дэгидратации – это реакции разложения, в результате которых от молекул веществ отщепляется вода.

Если поджечь выделяющийся газ, то можно заметить, что этилен горит светящимся пламенем.
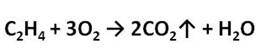
Этилен в промышленности получают нагреванием при высокой температуре углеводородов, содержащихся в попутных газах нефти. Эта реакция – крекинг (от английского крэк – расщеплять).
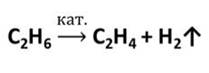
Этилен применяют для получения пластмасс и полиэтилена.
Полиэтилен – распространённый материал, из которого изготавливают трубы, посуду, его используют как покрытие для теплиц, как упаковку для сельхозпродуктов и продуктов питания, изготовления одноразовой посуды. Этилен используют для получения этилового спирта и других растворителей.

Полиэтилен получают из этилена при высокой температуре и давлении.
Эта реакция называется реакцией полимеризации. То есть, реакции полимеризации – это реакции, в которых происходит соединение молекул исходного вещества в огромную молекулу.
Исходное вещество, которое вступает в реакцию полимеризации, называется мономером. В данном случае, это – этилен, а продукт реакции – это полимер, у нас это – полиэтилен.
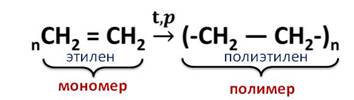
Полимеризацию можно рассматривать как частный случай реакции присоединения.
Для алкенов характерны и другие реакции присоединения. Эти реакции протекают с разрывом одной из двух связей.
Например, реакция присоединения воды, которая называется реакцией гидратации.
В результате реакции гидратации этилена образуется спирт – этанол. Эта реакция протекает в присутствии катализатора.
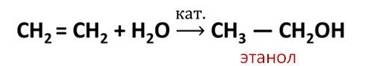
Этанол, или этиловый спирт широко используется как растворитель, для производства каучуков, пластмасс и химических волокон.
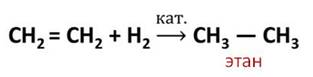
Водород присоединяется к этилену в присутствии катализатора с образованием этана. В этой реакции разорвалась одна химическая связь в молекуле этилена и связь в молекуле водорода и образовались две новые связи Н – С в молекуле этана.
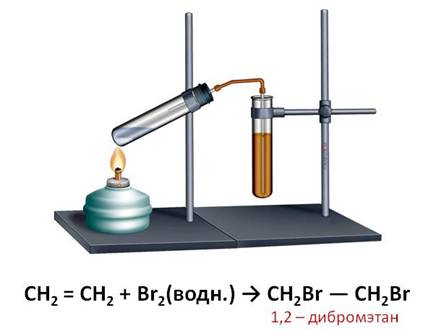
С помощью реакций присоединения можно распознать алкены. Качественными реакциями на двойную связь являются реакции обесцвечивания ими бромной воды и водного раствора перманганата калия.
Например, если пропустить через раствор бромной воды этилен, то происходит обесцвечивание бромной воды. В результате данной реакции образуется соединение – 1,2 – дибромэтан – вещество, у которого отсутствуют кратные связи.
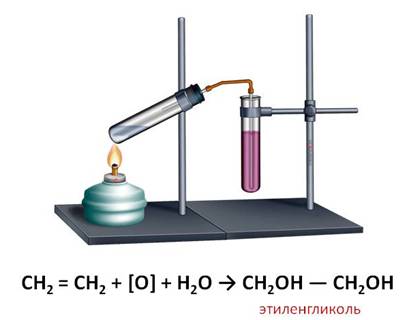
Если пропустить газ этилен через раствор марганцовки, то в данном случае, также происходит обесцвечивание этого раствора. В результате данной реакции образуется этиленгликоль.
Таким образом, молекула этилена имеет плоскостное строение, то есть все атомы находятся в одной плоскости. Валентный угол равен 120 0 . Характерными реакциями этилена являются реакции присоединения. Качественными реакциями на этилен являются реакции обесцвечивания бромной воды и водного раствора перманганата калия.
Читайте также:

