Важнейшие классы бинарных соединений оксиды и летучие водородные соединения кратко конспект
Обновлено: 07.07.2024
Оксиды — это сложные вещества, состоящие из двух химических элементов, один ил которых — кислород ее степенью окисления -2.
Оксиды широко распространенный в природе класс неорганических соединений. К оксидам относят такие хорошо
Boдa H2О. Это самое удивительное, самое распространенное н самое необходимое вещество на нашей планете. Почти три четверти поверхности земного шара занято водой морей н океанов. Льдом покрыто 20% суши (ледники гор. арктическая и антарктическая шапки планеты). Вода влияет на климат планеты, потому что она обладает очень большой теплоемкостью. Нагреваясь, вода поглощает тепло, а остывая, отдает его и тем самым выравнивает климат. Л от космического холода предохраняют Землю те молекулы воды, которые рассеяны в атмосфере — вобляках в виде пара.
Вода составляет до 80% массы клетки и выполняет в ней чрезвычайно важные функции: определяет объем и упругость клеток, транспортирует в клетку и из нее растворенные вещества, предохраняет клетку от резких колебаний температур. Тело человека на г/я состоит из воды. Почти все реакции в живой клетке протекают в водных растворах. Большинство реакций, используемых в технологических процессах на предприятиях химической, фармацевтической и пищевой промышленности, происходит также в водных растворах.
На вопрос: много ли воды на Земле? — однозначно ответить трудно: и очень много, и очень мало одновременно. Почему много — очевидно: океаны, ледники, реки, дожди. А вот почему мало? Во-первых, потому, что потребности человечества в воде сегодня уже сравнимы с возобновляемымп ресурсами пресной воды на нашей планете. Во-вторых, осуществляя производственные процессы, мы больше загрязняем воду, чем очищаем ее. В-третьих, большая часть земной воды — это не просто вода, а концентрированные солевые и иные растворы. В-четвертых, очень много пресной воды мы расходуем бездумно и напрасно. Поэтому необходимо беречь воду.
Углекислый газ СО2 — диоксид углерода. В воздухе всегда содержится около 0.03% (по объему) углекислого газа. Содержяние его в воздухе непостоянное. Воздух в городах, особенно вблизи заводов и фабрик, содержит несколько больше углекислого гязя, чем воздух в сельской местности.

Образуется углекислый газ при дыхании и сгорании топлива, а также при тлении и гниении различных органических веществ. В воде многих минеральных источников содержится значительное количество растворенного углекислого газа. Один из таких источников минеральной воды (нарзан) находится в Кисловодске. Ежесуточно этот источник выносит около двух с половиной миллионов литров минеральной воды, содержащей до 5 г свободного углекислого газа.
В водах морей и океанов содержится очень много растворенного углекислого газа, в десятки раз больше, чем в воздухе.
Углекислый газ бесцветный, без запаха. Он почти в 1.5 раза тяжелее воздуха. При обычных условиях в одном объеме воды растворяется один объем углекислого газа.
Другим важнейшим классом бинарных соединений являются водородные соединения элементов — гидриды и летучие водородные соединения.
Гидриды металлов — твердые, нелетучие и тугоплавкие вещества, в которых атомы водорода и метялля связаны между собой обычно ионной связью. Например, NаН, СаН2.
Более известны благодаря широкому применению в промышленности и в быту бинарные соединения неметаллов с водородом. Это летучие вещества, как правило, газы, хорошо растворимые в воде. К этому классу веществ относится и водя, хотя является жидкостью в обычных условиях. Рассмотрим летучие водородные соединения на примере хлоро-водородf HCl и аммиака HaN (чаще встречается NH3 — трядиционная запись).
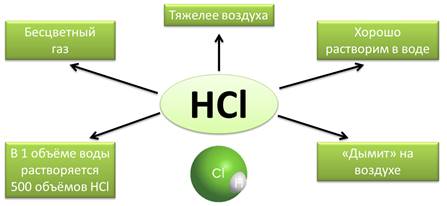
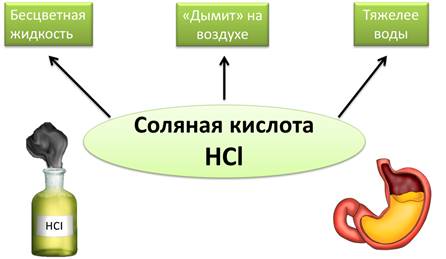
Хлороводород HCl — это бесцветный газ. тяжелее воздуха, хорошо растворим в воде. В одном объеме воды при обычных условиях может раствориться около 500 объемов хлороводорода. На открытом воздухе хлороводород притягивает находящиеся в воздухе пары воды, образуя туманное облако, состоящее из мельчяйших капелек, поэтому говорят, что хлороводород на воздухе (дымит). Раствор хлороводорода в воде называется соляной кислотой и представляет собой бесцветную, дымящуюся на воздухе жидкость несколько тяжелее воды. У людей и животных соляная кислота содержится в желудочном соке, она создает своеобразный барьер для микробов, попадающих в желудок вместе с пищей.

Аммиак NH3 — бесцветный газ со своеобразным резким запахом. Он почти в два раза легче воздуха. Растворимость аммиака в воде очень велика — в одном объеме воды растворяется при обычных условиях 700 объемов аммиака. Раствор аммиака в воде называется нашатырным спиртом, который широко используется в медицине. Амиак выделяется при гниении органических веществ, содержащих азот.
1. Оксиды. 2. Вода. 3. Углекислый газ. 4. Негашеная известь. 5. Гидриды. 6. Летучие водородные соединения. 7. Хлороводород и соляная кислота. 8. Аммиак и нашатырный спирт.
Оксиды — широко распространённый в природе класс неорганических соединений. К оксидам относят такие хорошо известные соединения, как песок (диоксид кремния SiО2 с небольшим количеством примесей), вода (оксид водорода Н2О), углекислый газ (диоксид углерода СО2), глина (оксид алюминия с небольшим количеством других соединений) и т. д. Большинство руд чёрных металлов содержат оксиды, например красный железняк — Fe2О3 и магнитный железняк — Fe3О4.
Среди оксидов есть твёрдые при обычных условиях вещества — SiО2, Fe2О3, жидкие — Н2О и газообразные — СО, СО2. Познакомимся с важнейшими из них.
Вода Н2О. Это самое удивительное, самое распространённое и самое необходимое вещество на нашей планете.
Почти три четверти поверхности земного шара занято водой морей и океанов. Льдом покрыто 20% суши: ледники гор, арктическая и антарктическая шапки планеты (рис. 53).

Рис. 53.
Вода на Земле
Вода составляет до 80% массы клетки и выполняет в ней чрезвычайно важные функции: определяет объём и упругость клеток, транспортирует в клетку и из неё растворённые вещества, предохраняет клетку от резких колебаний температур. Тело человека на 2/3 состоит из воды.
Почти все химические реакции в живой клетке протекают в водных растворах. Большинство реакций, используемых в технологических процессах на предприятиях химической, фармацевтической и пищевой промышленности, происходит также в водных растворах.
Без воды невозможно представить жизнь человека, который потребляет её для самых разных бытовых нужд (рис. 54).

Рис. 54.
Потребление воды человеком
Углекислый газ СО2 — диоксид углерода. В воздухе всегда содержится около 0,03% (по объёму) углекислого газа. Содержание его в воздухе непостоянное. Воздух в городах, особенно вблизи заводов и фабрик, содержит несколько больше углекислого газа, чем воздух в сельской местности.
Образуется углекислый газ при дыхании и сгорании топлива, а также при тлении и гниении различных органических веществ. В воде многих минеральных источников содержится значительное количество растворённого углекислого газа. Один из таких источников минеральной воды (нарзан) находится в Кисловодске. Ежесуточно этот источник выносит около двух с половиной миллионов литров минеральной воды, содержащей до 5 г свободного углекислого газа в каждом литре.
В водах морей и океанов содержится очень много растворённого углекислого газа, в десятки раз больше, чем в воздухе.
Углекислый газ бесцветный, без запаха. Он почти в 1,5 раза тяжелее воздуха. При обычных условиях в одном объёме воды растворяется один объём углекислого газа.

Рис. 55.
Сухой лёд используют для хранения мороженого
При увеличении давления до 60 атм он превращается в бесцветную жидкость. При испарении жидкого углекислого газа часть его может превратиться в твёрдую снегообразную массу. Её прессуют и получают так называемый сухой лёд, который при обычном давлении возгоняется, не плавясь, причём температура его понижается до -78,5 °С. Поэтому сухой лёд в основном применяют для хранения пищевых продуктов, и в первую очередь мороженого (рис. 55). Наиболее широко СО2 используют при изготовлении газированных напитков (рис. 56).

Рис. 56.
Для приготовления газированных напитков необходим углекислый газ
Углекислый газ не поддерживает горения и потому применяется для тушения пожаров (рис. 57).

Рис. 57.
Тушение пожара с помощью углекислотного огнетушителя

Рис. 58.
Разновидности оксида кремния (IV):
а — аметист; б — кварц; в — опал; г — агат; д — кремнезём
Основную массу земной коры — литосферы — образуют оксид кремния (IV) (SiО2) и оксид алюминия (А12О3), которые входят в состав многих минералов и горных пород, а также образуют минералы, почти полностью состоящие из этих оксидов. Так, оксид кремния (IV) образует кварц, кварцевый песок, кремнезём, горный хрусталь и др. (рис. 58), а оксид алюминия — рубин, сапфир, основную массу особых глин — бокситов и др. (рис. 59).

Рис. 59.
Разновидности оксида алюминия:
а — корунд; б — боксит; в — рубин; г — сапфир
Лабораторный опыт № 7
Ознакомление с коллекцией оксидов
-
Ознакомьтесь с коллекцией оксидов. Запишите формулы представленных в ней оксидов. Опишите их физические свойства.
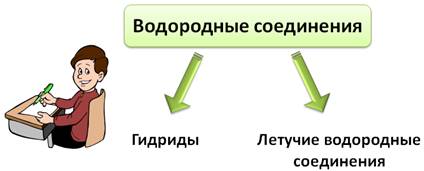
Другим важнейшим классом бинарных соединений являются водородные соединения элементов — гидриды и летучие водородные соединения.
Гидриды металлов IA и IIА групп Периодической системы — твёрдые, нелетучие и тугоплавкие вещества, в которых атомы водорода и металла связаны между собой ионной связью. Например, NaH, СаН2.
Более известны благодаря широкому применению в промышленности и в быту соединения неметаллов с водородом. Это летучие вещества, как правило газы, хорошо растворимые в воде. К этому классу веществ относится и вода, хотя является жидкостью в обычных условиях.
Рассмотрим летучие водородные соединения на примере хлороводорода НС1 и аммиака H3N (чаще встречается традиционная запись — NH3).
Раствор хлороводорода в воде называют соляной кислотой. Это бесцветная, дымящаяся на воздухе жидкость несколько тяжелее воды. У людей и животных соляная кислота содержится в желудочном соке, она создаёт своеобразный барьер для микробов, попадающих в желудок вместе с пищей.
Аммиак NH3 — бесцветный газ со своеобразным резким запахом. Он почти в два раза легче воздуха. Растворимость аммиака в воде очень велика — в одном объёме воды растворяется при обычных условиях 700 объёмов аммиака. Раствор аммиака в воде называют нашатырным спиртом, который широко используется в медицине. Аммиак выделяется при гниении органических веществ, содержащих азот.
Цель: создать условия для формирования у учащихся понятий бинарные соединения, оксиды, водородные соединения.
образовательная: сформировать первоначальные знания об оксидах и водородных соединениях, показать значение важнейших представителей в природе и жизни человека;
развивающая: развивать умение классифицировать оксиды, давать им химические названия, определять степени окисления по формуле, выводить формулы бинарных соединений по степеням окисления элементов;
воспитательная: умение осуществлять самостоятельную деятельность на уроке, умение адекватной самооценки и самоконтроля. Воспитывать культуру умственного труда, развивать коммуникативные качества.
Регулятивные : умение планировать и регулировать свою деятельность; умение оценивать степень успеха или неуспеха своей деятельности.
Коммуникативные: самостоятельно организовывать учебное взаимодействие в группе; готовность отстаивать собственное мнение в диалоге.
Познавательные: уметь составлять на основе текста таблицы; под руководством учителя проводить наблюдения; осуществлять классификацию, обобщение.
Личностные: осознавать единство и целостность окружающего мира, возможности его познаваемости; осознавать потребность и готовность к самообразованию; формировать мышление о необходимости бережного отношения к природным ресурсам.
Оборудование: образцы оксидов, природных руд и минералов, содержащих оксиды.
1. Организационный момент (5 минут).
- Приветствие учащихся, пожелание положительного эмоционального настроя, проверка готовности к уроку.
- Создание комфортной психологической атмосферы урока, настрой на учебную деятельность.

На этом уроке учащиеся на наглядных примерах разберут отличия водородных соединений и оксидов, научатся называть и составлять их формулы, изучат свойства наиболее распространенных оксидов и водородных соединений. Благодаря иллюстрациям и разнообразным примерам ученикам понравится изложение нового материала.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Водородные соединения. Оксиды"
Гидриды – это бинарные соединения металлов I и II A групп с водородом. Например: CaH2, NaH, BaH2, LiH. Все эти гидриды твердые, нелетучие, тугоплавкие вещества с ионным типом связи.
Летучие водородные соединения – это бинарные соединения неметаллов с водородом. Эти соединения могут быть как жидкостями (например, Н2О), так и газами (HCl, NH3).
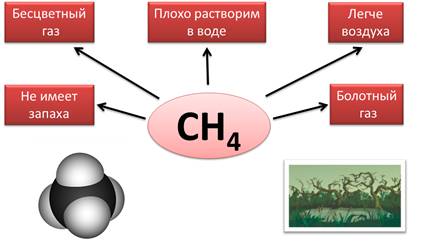
Еще одни важным летучим водородным соединением является метан – СН4. Метан – бесцветный газ, плохо растворим в воде, легче воздуха, не имеет запаха. Его еще называют болотным газом, т.к. он образуется на дне болот и водоемов при разложении растительных остатков без доступа кислорода. Кроме того, метан содержится в природном и попутном нефтяном газе.
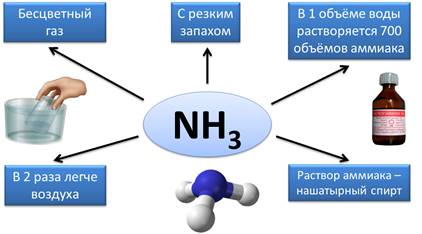
Известным и распространенным водородным соединением является аммиак – NH3. Аммиак является бесцветным газом, имеет резкий запах, в 1 объёме воды растворяется 700 объёмов аммиака, он почти в 2 раза легче воздуха. Раствор аммиака в воде называют нашатырным спиртом, который широко используют в медицине.
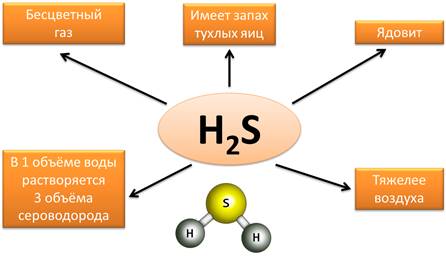
Сероводород – H2S – тоже известное летучее водородное соединение. Он является бесцветным газом, имеет запах тухлых яиц, ядовит, в 1 объеме воды растворяется 3 объёма сероводорода, он тяжелее воздуха.
Оксиды – это сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления -2.

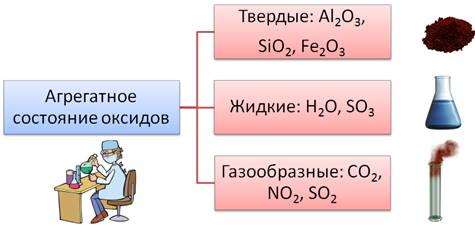
По агрегатному состоянию оксиды делят на твёрдые: к ним относятся такие оксиды, как Al2O3, SiO2, Fe2O3 и др., жидкие оксиды – это H2O, SO3, газообразными являются такие оксиды, как СО2, NO2, SO2 и др.
Познакомимся с вами с наиболее важными оксидами.
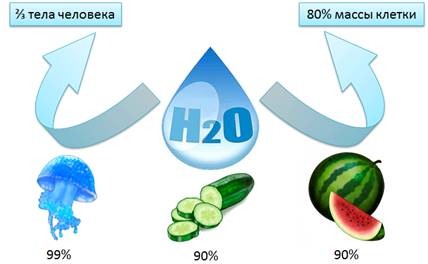
Вода – Н2О – самое распространенное и самое необходимое вещество на планете. Почти ¾ поверхности земного шара занято водой. Однако, это вода морей и океанов, которая является солёной. Она непригодна для питья, для сельского хозяйства, для промышленности. Кроме того, тело человека на 2/3 состоит из воды. Вода составляет до 80% массы клетки и выполняет важные функции: защитную, транспортную и др. У некоторых медуз вода занимает почти 99% от массы тела. Содержание воды в огурцах и арбузах превышает 90%. Большинство реакций и процессов в различных отраслях промышленности тоже протекают в растворах. Однако запасы пресной воды малы, всего 3% от общего объёма, поэтому нужно беречь и экономить воду. Без воды невозможно представить жизнь человека, который потребляет ее для бытовых нужд.
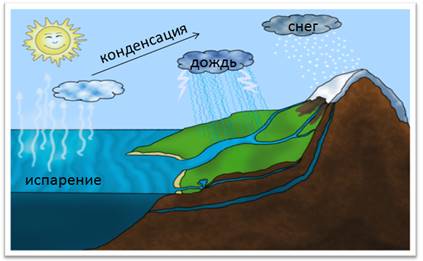
В природе постоянно происходит круговорот воды. Под влиянием солнечного тепла часть воды испаряется в атмосферу. При охлаждении воздуха образуются водяные капельки, из которых состоят облака. Эти мелкие капельки сливаются в более крупные и выпадают на землю в виде осадков: снега, дождя, града.
Круговорот воды в природе
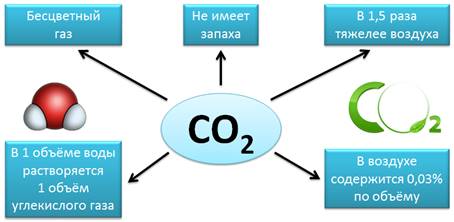
Еще одним известным оксидом является диоксид углерода, углекислый газ, или оксид углерода (IV) – CO2. Это бесцветный газ, не имеет запаха, в 1,5 раза тяжелее воздуха. В 1 объёме воды растворяется 1 объем углекислого газа. В воздухе содержится 0,03% (по объему) диоксида углерода.
Негашеная известь, или СаО, является белым, тугоплавким веществом, которое энергично реагирует с водой, при этом образуется гашеная известь. Негашеная известь применяется для получения вяжущих строительных материалов.
Основная часть литосферы – это оксид кремния (IV) – SiO2. Он входит в состав минералов и горных пород. Этот оксид образует кварц, кварцевый песок, кремнезем, горный хрусталь и др. соединения.
Еще одно соединение, которое является основой литосферы – это оксид алюминия – Al2O3. Он также входит в состав минералов и горных пород. Этот оксид образует корунд, рубин, сапфир, каолин и др. соединения.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Выберите документ из архива для просмотра:
Выбранный для просмотра документ конспект.docx
МБОУ «СОШ с.Сухой Карабулак Базарно-Карабулакского муниципального
Урок химии в 8 классе



Учитель химии, биологии
Тема: Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения.
Образовательные:
Сформировать понятие об оксидах ;
Познакомить учащихся с основными представителями классов оксидов и летучих водородных соединений, их значении в природе и жизни человека.
Развитие у учащихся общеучебных умений анализировать, выделять главное, делать выводы, развитие коммуникативных умений учащихся.
Развитие у учащихся памяти, внимания, логического мышления
Воспитательная:
Воспитание у учащихся культуры общения.
Воспитание бережного отношения к природе и своему здоровью.
Оборудование: презентация, проектор, оксид меди(II), оксид кальция, оксид железа(III), вода, оксид алюминия, стакан(с углекислым газом), таблицы.
1. Организационный момент.
2. Проверка домашнего задания .(слайд1)
А) Ответьте на вопросы
1. Что такое вещество?
2. Какие вы знаете вещества?(простые и сложные)
3. Что такое сложное вещество?
4. Что такое бинарное вещество?
5. Что такое степень окисления?
Б) Расставьте степени окисления и дайте названия следующих веществ :
Как вы думаете, что мы узнаем сегодня на уроке?(формулируют цель: Узнаем что такое оксиды и летучие водородные соединения, познакомимся с некоторыми представителями это класса). Давайте дадим определение понятия оксиды(ответы детей, учитель обобщает все ответы и записывают определение со слайда). (слайд3)
Оксиды –сложные вещества, состоящие из двух химических элементов, один из которых – кислород в степени окисления -2.
(слайд 4) Задание: Определите, какие из перечисленных веществ относятся к оксидам и выпишите их(по очереди выписывают на доску). H 2 O, H 2 O 2 , CO 2 , OF 2 , CaO, Al 2 O 3 , FeO, Na 2 O 2 , Fe 2 O 3 , SiO 2 . Проверим (слайд 5) (проверяют со слайда, вспоминают что такое оксиды)
(слайд 6) А знаете ли вы, что в 1870 году в Петербургской академии обсуждалась возможность называть вещества следующим образом:
На Земле очень много оксидов, некоторые представлены перед вами(на демонстрационном столе коллекция). Все они различаются по цвету, агрегатному состоянию и свойствам. Самый распространенный из них – вода. (слайд 7)
Углекислый газ CO 2 (слайд 11) – диоксид углерода(демонстрация слайдов про углерод). В воздухе всегда содержится около 0,03% углекислого газа. (слайд 12). Содержание его в воздухе непостоянное. Воздух в городах, особенно вблизи заводов и фабрик, содержит несколько больше углекислого газа, чем воздух в сельской местности. Образуется углекислый газ при дыхании и сгорании топлива, при гниении органических веществ. Содержится в минеральных источниках. Углекислый газ бесцветный, без запаха. В 1,5 раз тяжелее воздуха. (слайд 13). При обычных условиях в 1 объеме воды растворяется 1 объем углекислого газа. При увеличении давления он превращается в бесцветную жидкость. При испарении жидкого углекислого газа, часть его превращается в твердую снегообразную массу, так называемый сухой лед . Наиболее широко СО 2 используют при изготовлении газированных напитков. Т.к. углекислый газ не поддерживает горение, его применяют для тушения пожаров.
Негашеная известь СаО. (слайд 14) Это белое тугоплавкое вещество, которое энергично взаимодействует с водой, образуя при этом гашенную известь. Применяется в строительстве.
Оксид кремния SiO 2 и оксид алюминия Al 2 O 3 (слайд 15) составляют основную массу земной коры и входят в состав многих минералов и горных пород, а так же образуют минералы, почти полностью состоящие из этих оксидов. Так оксид кремния образует кварц, кварцевый песок, горный хрусталь и др., (слайд 16) а оксид алюминия – рубин, сапфир.
Лабораторная работа.(слайд 17) Обратимся к нашей коллекции и выполним лабораторную работу. (учащиеся заполняют таблицу, подходят к коллекции, выполняют взаимопроверку по эталону). Выполним проверку. (слайд 18)
В каких агрегатных состояниях могут находиться оксиды?(в тетрадь записать )(слайд 19)
Жидкие Твердые Газообразные
Водородные соединения. (слайд 20) Другие важнейшие бинарные соединения это соединения водорода. Широко используются человеком соединения неметаллов с водородом, они называются летучими водородными соединениями.
Аммиак NH 3 (слайд 21) – это бесцветный газ со своеобразным резким запахом. Всем вам известен раствор аммиака в воде – нашатырный спирт. Аммиак в два раза легче воздуха. В одном объеме воды растворяется 700 объемов аммиака.
Гидриды. Соединения водорода с металлами I,II группы носят название гидриды. Это твердые, нелетучие, тугоплавкие вещества. Составьте формулы гидрида калия, гидрида кальция, гидрида натрия.
Закрепление. (слайд 22)
1. (№1, стр.114 учебника). Выпишите из приведенного перечня формул в два столбика формулы оксидов металлов и оксидов неметаллов и дайте им названия: Na 2 O , N 2 O 5 , NaOH , HNO 3 , CuO , SO 2 , SCl 2 , Cl 2 O 7 , FeS , Fe 2 O 3 , Cu 2 O , CuF 2 , P 2 O 5 .
2. Какова масса 1,5 моль аммиака? Какой объём займёт это количество вещества? Сколько молекул будет содержать это количество? (слайд 23)
Читайте также:

