Углеводороды 10 класс химия конспект
Обновлено: 05.07.2024
Урок 10: Знакомство с классами органических веществ. Углеводороды: классификация, получение и химические свойства
Углеводороды – соединения, состоящие из атомов углерода и водорода, связанные ковалентной связью. По строению углеродного скелета углеводороды делятся на ациклические и циклические; по типу связей – на предельные, непредельные и ароматические.
Каждый вид углеводородов образует гомологический ряд, который имеет свою общую формулу.
Алканы (предельные углеводороды)
Алканы – углеводороды, в молекулах которых атомы углерода связаны между собой σ-связью, а остальные их валентности предельно насыщены атомами водорода. Отсюда другое название алканов – предельные углеводороды.
Рассмотрим некоторые способы получения алканов
Синтез Вюрца: получаем алкан с удвоенным числом атомов углерода
Восстановление непредельных углеводородов
В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Гидрированием ненасыщенных углеводородов
Химические свойства алканов.
Предельные углеводороды при обычных условиях химически мало активны, что объясняется прочностью σ-связей между атомами углерода. Для алканов характерны реакции замещения атомов водорода на галогены (с бромом), на нитрогруппу (с азотной кислотой). При реакции дегидрирования (отщепления водорода) образуются алкены. И характерны реакции изомеризации – получение изомеров. Свойства алканов представлены на схеме на примере н-бутана

Следующий класс углеводородов – алкены (этиленовые углеводороды) - ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода
Алкены получают несколькими способами:

Алкены - ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны. Характерны реакции присоединения водорода, галогенов, гидрогалогенов, воды, реакции полимеризации. В присутствии катализаторов или сильных окислителей алкены окисляются до альдегидов или двухатомных спиртов. Свойства алкенов представлены на схеме на примере пропена

Следующий класс - Алкадиены - непредельные (ненасыщенные) углеводороды, имеющие в молекуле две двойных связи С=С.
Алкадиены получают несколькими способами:


Химические свойства алкадиенов похожи на свойства алкенов, т.к. присутствует двойная связь. Но есть свои особенности. При присоединении одной молекулы реагента к алкадиену рвется только одна двойная связь. При присоединении двух молекул реагента к алкадиену разрываются обе двойные связи.
Свойства алкадиенов представлены на схеме на примере бутадиена-1,3

И знакомимся еще с одни классом Алкинами непредельными углеводородами, имеющие в молекуле одну тройную связь С≡С.
Зная химические свойства алкенов, понимая механизм протекания реакций, разобраться с химическими свойствами алкинов – нетрудно. Для алкинов, как и для алкенов, характерны реакции присоединения: водорода, галогенов, гидрогалогенов, воды. Так как тройная связь содержит две π-связи, реакции присоединения к алкинам могут происходить в две стадии. Вначале идет присоединение по месту двойной π-связи с образование производных олефинов, а затем по месту второй π-связи с образованием производных алканов.
В отличие от алкенов в алкинах могут идти реакции замещения. Характерны реакции окисления.
Свойства алкинов представлены на схеме на примере ацетилена

И рассмотрим еще один класс углеводородов – арены -ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи. Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Первый член гомологического ряда - бензол - C6H6. И рассматривать все свойства и получение мы будем для бензола. Начнем с получения бензола
1) Бензол получают из нефти и каменноугольной смолы, образующейся при коксовании каменного угля.
2) Советский академик Николай Дмитриевич Зелинский установил, что бензол образуется из циклогексана (дегидрирование циклоалканов):

Химические свойства. Ядро бензола обладает большой прочностью. Этим и объясняется склонность аренов к реакциям замещения. Они протекают легче, чем у предельных углеводородов. ● Реакция замещения идут только в присутствии катализаторов: галогенирования, нитрования, гидрирования. В отличие от алкенов бензол не присоединяет галогеноводороды и воду. Бензол очень устойчив к окислителям. В отличие от непредельных углеводородов он не обесцвечивает бромную воду и раствор KMnO4. Бензол на воздухе горит коптящим пламенем. Свойства бензола представлены на схеме
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Тема урока: Углеводороды ряда метана, их электронное и пространственное строение.
развивающие: развитие памяти, внимательности, умения работать учебником;
воспитывающие: воспитание коммуникабельности, самостоятельности.
Оборудование : интерактивная доска, модели атомов, на столах учащихся - ведомости учета знаний.
Тип урока: комбинированный.
Форма: самостоятельная работа.
Проверка домашнего задания.
1. Ответить на вопросы:
Что такое углеводороды?
Чему равны длина связи С-Н и валентный угол НСН?
Как определили качественный состав метана?
Каково основное и возбужденное состояние атома углерода?
Что такое гибридизация электронных облаков?
Сколько электронов скрывается в формуле sp 3 ?
Какую форму имеет молекула метана?
Какие вещества называются гомологами? Среди веществ назвать гомолог пропана:
Какие углеводороды называются предельными?
Определите число атомов водорода, если число атомов углерода равно 7,15?
Чему равняется число атомов углерода, если число атомов водорода 50?
Физические свойства предельных углеводородов.
Назвать агрегатное состояние бутана, пентана, пентадекана.
Ответы оцениваются и выставляются в ведомость учета знаний (образец ведомости дается ниже).
Записать формулы алканов по числу атомов углерода:
Записать формулы алканов по числу атомов водорода:
Оценки ставят в ведомость.
II . Изучение новой темы.
Нахождение в природе.
Электронное и пространственное строение предельных углеводородов.
Нахождение в природе.
Работа с учебником, самостоятельно, глава II , стр.16.
Отвечают на вопрос 10, стр.22.
Названия радикалов.
Работа по учебнику, стр. 15 и по таблице 1, стр.14, глава II .
Как образуются радикалы?
(Если мысленно вычесть из формул по одному атому водорода, то получаются группы атомов, которые называют радикалами.)
Как образуются названия радикалов?
(Названия радикалов образуются от названий соответствующих углеводородов путем изменения суффикса –ан на –ил.)
Назвать по таблице предельные углеводороды и их радикалы.
Электронное и пространственное строение предельных углеводородов.
Зная строение молекулы метана, какое можно сделать предположение о пространственном строении молекулы этана? пропана? Каково должно быть строение углеродной цепи?
На моделях показываются постепенное наращивание цепи атомов углерода, у которых связи имеют тетраэдрическую направленность. Вывод: в молекулах предельных углеводородов атомы углерода образуют зигзагообразную цепь.
На моделях показывается вращение атомов вокруг σ-связей.
Отмечается, что с увеличением числа атомов углерода в молекуле увеличивается число пространственных форм (их в науке называют поворотными изомерами или конформациями).
Рассмотреть состояние молекулы пентана, используя шаростержневую модель
Физкультпауза
III. Закрепление. Фронтальная работа.
Соберите шаростержневую модель н-бутана и покажите на ней различные пространственные формы.
Зарисуйте на бумаге две-три формы.
Соберите шаростержневую модель пропана и покажите на ней σ -связи и валентные углы.
В молекулах предельных углеводородов полностью исчерпаны валентные возможности атомов углерода. Связь С – Н ковалентная малополярная, связь С – С ковалентная неполярная.
Атомы углерода в молекулах имеют тетраэдрическое строение, они находятся в состоянии sp 3 -гибридизации, валентный угол – 109 о 5 / .
Молекулы предельных углеводородов постоянно образуют разные пространственные формы.
IV. Тестирование (на листочках). Взаимоконтроль.
К гомологическому ряду метана относится:
Какой вид связи в молекуле СН 4 ?
а) σ - c вязь; б) π -связь, в) ароматическая; г) водородная.
4. Какая запись соответствует атому углерода в возбужденном состоянии?
а) sp 3 – гибридизация электронных орбиталей внешнего электронного слоя.
б) 1 s 2 2 s 2 2 p 3 .
в) sp 2 - гибридизация электронных орбиталей внешнего электронного слоя.
г) 1s 2 2s 2 2p 2 .
Основным составляющим природного газа является :
а) пропан, б) бутан, в) этан, г) метан.
1. Какая запись соответствует атому углерода в стационарном состоянии?
а) sp 3 – гибридизация электронных орбиталей внешнего электронного слоя.
б) 1 s 2 2 s 1 2 p 3 .
в) sp 2 - гибридизация электронных орбиталей внешнего электронного слоя.
г) 1s 2 2s 2 2p 2 .
Какие виды связей в молекуле С 2 Н 6 ?
а) σ - c вязь; б) π -связь, в) ароматическая; г) водородная.
Укажите, какое из веществ является гомологом для вещества с формулой С 4 Н 10 .
4. Какому веществу соответствует электронная формула Н Н
а) пропану; б) этану; в) бутану, г) метану.
5. Исходя из строения молекул, ответьте, какой из следующих алканов должен иметь наиболее высокую температуру кипения.
а) н-пентан; б) н-гексан; в) изомер гексана.
а) химические связи, образованные в результате перекрывания валентных орбиталей, напрвление которых совпадает с линией, соединяющей центры связываемых атомов;
б) химические связи, осуществляемые путем перекрывания р-орбиталей, направленных перпендикулярно линии, проходящей через центры связываемых атомов;
в) название цис-, трансизомеров веществ;
г) пространственные геометрические формы молекул, переходящие друг в друга путем вращения одинарных связей.
Укажите неверную характеристику для данного класса органических молекул. Алканы:
а) углеводороды с малополярными молекулами;
б) легко смешиваются (жидкие и твердые) с водой и другими полярными растворителями;
в) жидкие алканы – хорошие растворители для жиров и жирных масел;
г) химически инертные вещества.
Выберите наиболее полное и точное определение алканов. Алканы – это:
а) насыщенные углеводороды, молекулы которых состоят из атомов углерода и водорода, связанных между собой только σ-cвязями;
б) насыщенные углеводороды с открытой цепью атомов, связанные только σ-cвязями;
в) углеводороды, в которых все атомы углерода находятся в состоянии sp 3 -гибридизации;
г) насыщенные углеводороды, в которых все атомы углерода, находящиеся в состоянии sp 3 -гибридизации, связаны между собой и атомами водорода ковалентными σ-cвязями.

Вещества, состоящие из углеродного скелета, полностью занятого атомами водорода, называются насыщенными или предельными углеводородами. К ним относятся два схожих класса веществ – линейные алканы и циклические циклоалканы. Общая химическая формула алканов – CnH2n+2, циклоалканов – CnH2n.
Строение
Алканы и циклоалканы находятся в состоянии sp 3 -гибридизации. Углерод связан с водородом одинарными σ-связями, образующими тетраэдр.
Молекулы алканов состоят из линейно присоединённых метиленовых групп -CH2, соединённых -С-С- связями. К любому атому углерода может присоединяться метильная группа -CH3, образуя разветвлённые цепочки.
Молекулы циклоалканов образованы по такому же принципу, но цепочки замкнуты в кольцо. Форма кольца или цикла зависит от количества атомов углерода: чем больше атомов, тем сложнее фигура.

Рис. 1. Молекулы алканов и циклоалканов.
Дополнительные группы в структурной формуле записывают через черту или в скобочках. Циклоалканы обозначают геометрической фигурой, в углах которой по умолчанию находятся группы -CH2.
Гомологи и номенклатура
Названия веществ составляются по номенклатуре ИЮПАК следующим образом:
Простейший алкан – метан – содержит один атом углерода. Он образуют гомологический ряд алканов. Простейший циклоалкан – циклопропан, имеющий форму треугольника.
Гомологические ряды предельных углеводородов и их физическая характеристика приведены в таблице.
Класс
Гомологи
Формула вещества
Физические свойства
Плотность алканов не превышает единицы, поэтому соединения плавают на поверхности воды. Температуры плавления и кипения увеличиваются с увеличением молекулярной массы. Плотность, температуры плавления, кипения циклоалканов выше, чем у алканов.
Изомерия
Для алканов, начиная с бутана, характерна изомерия углеродного скелета, а начиная с гептана – оптическая изомерия.
Оптическая изомерия – образование стереоизомеров, которые зеркально повторяют друг друга.
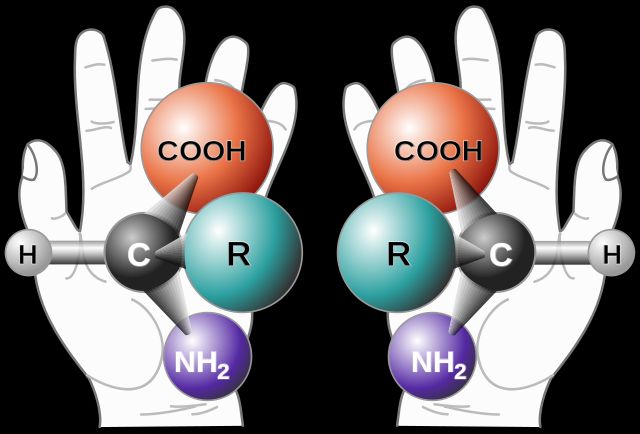
Рис. 2. Оптическая изомерия алканов.
Циклоалканам свойственны три вида изомерии:
Количество изомеров возрастает с увеличением числа атомов углерода в гомологическом ряду. Например, октан (C8H18) имеет 18 изомеров, а гектан (C100H202) – 5,921·10 39 . Теоретическое число изомеров высчитывается по специальной формуле.
Свойства
Насыщенные углеводороды активны под действием температуры и катализаторов. Вступают в реакции присоединения и замещения. Химические свойства циклоалканов зависят от количества атомов углерода в молекуле вещества. Ниже приведены основные свойства насыщенных углеводородов.
| Вложение | Размер |
|---|---|
| 10_klass.docx | 56.88 КБ |
Предварительный просмотр:
Познавательные : развитие мышления учащихся (анализ и синтез, аналогия, умение сравнивать), работа с информацией в разных видах – текст, таблица, схема, рисунок.
Регулятивные : умение планировать работу, проводить контроль и коррекцию своей работы.
Коммуникативные : умение представлять работу группы, аргументировать свою точку зрения.
Оборудование : таблицы, модели строения атомов.
I. Работа в группах, обсуждение вопросов и выступления учащихся. Вопросы – карточки тянут по жребию лидеры групп.
1. Дайте классификацию углеводородов, их общие формулы, определения. Привести по 2 примера каждой группы углеводородов.
Что называется изомерией? Какие виды изомерии вы знаете. Приведите примеры.
2. Что называется гомологами? Назовите общие формулы гомологических рядов алканов, алкенов и алкинов. Приведите примеры 5 представителей каждого ряда. Назовите их.
В чем причина многообразия органических соединений?
3. Рассмотрите в сравнительном плане электронные и пространственные строение этана, этилена, ацеитилена, бензола.
Сравните общие признаки и отличия связей в этих соединениях. Используйте таблицы.
4. Сравните химические свойства предельных, непредельных и ароматических углеводородов. Сделайте вывод об общих и специфических свойствах углеводородов.
Читайте также:

