Углекислый газ конспект урока 9 класс
Обновлено: 05.07.2024
Предмет: химия. Класс: 9. Базовый учебник: О.С.Габриелян. Химия. 9 класс. Учебник для общеобразовательных учреждений. Рекомендовано МОиН РФ, 12-е издание, стереотипное. Дрофа, М., 2007. Тип урока: урок усвоения новых знаний. Технология: развитие критического мышления через чтение и письмо. Методы: поисковый; репродуктивный, исследовательский. Формы работы: индивидуальная; работа в парах, группах. Оборудование и реактивы: Учебник химии 9 класса, рабочая тетрадь, карточки с заданиями для группы, тематические тесты, таблицы ПСХЭ, растворимости. Лабораторное оборудование для опыта: прибор для получения газов, разбавленная соляная кислота, порошок мела, лакмус, известковая вода, гидрокарбонат натрия, колба, пробирки, спиртовка, спичка, пипетка, держатель.
| Вложение | Размер |
|---|---|
| konspekt_uroka_po_himii_po_teme_uglekislyy_gaz.docx | 116.09 КБ |
Предварительный просмотр:
Базовый учебник : О.С.Габриелян. Химия. 9 класс. Учебник для общеобразовательных учреждений. Рекомендовано МОиН РФ, 12-е издание, стереотипное. Дрофа, М., 2007.
Тип урока : урок усвоения новых знаний.
Технология: развитие критического мышления через чтение и письмо.
Методы: поисковый; репродуктивный, исследовательский.
Формы работы: индивидуальная; работа в парах, группах.
Оборудование и реактивы :
Учебник химии 9 класса, рабочая тетрадь, карточки с заданиями для группы, тематические тесты, таблицы ПСХЭ, растворимости.
Лабораторное оборудование для опыта: прибор для получения газов, разбавленная соляная кислота, порошок мела, лакмус, известковая вода, гидрокарбонат натрия, колба, пробирки, спиртовка, спичка, пипетка, держатель.
Цели урока: Познакомить с одним из представителей оксида углерода – углекислым газом, его строением, физическими и химическими свойствами, развивать умения работать с химическим оборудованием и реактивами, сравнивать, анализировать, делать выводы, прививать интерес к предмету, воспитывать навыки коллективной работы.
- познакомить учащихся с углекислым газом как кислотным оксидом, раскрыть его свойства, биологическое значение и применение.
- продолжить формирование умений устанавливать причинно-следственные связи через умения прогнозировать свойства веществ на основе их строения, кислотно-основных свойств веществ;
- продолжить развитие предметных компетенций: умение составлять уравнения реакций, получать информацию из различных источников, конспектировать, выбирать главное, развивать умение учащихся работать с дополнительной литературой.
- продолжить формирование коммуникативных компетенций при работе в группах;
- развивать критическое мышление через чтение информационного текста;
- воспитывать умение внимательно слышать и слушать другое мнение;
- прививать чувство ответственности за состояние нашей природы на основе формирования представлений о химической грамотности, экономической и экологической целесообразности использования оксида углерода (IV).
Организационный момент урока
Проверка домашнего задания.
Актуализация знаний учащихся:
Приветствие учащихся, создание доброжелательной рабочей атмосферы, проверка готовности рабочего места ученика.
-Ребята, как вы понимаете следующее высказывание:
« Чтобы переварить знания, надо поглощать их с аппетитом? (Анатоль Франс)
-Я желаю вам на сегодняшнем уроке успешного усвоения нового материала.
- Прежде чем приступить к изучению новой темы вспомним пройденный материал.
-Почему алмаз и графит состоят из одного и того же химического элемента, но так отличаются по физическим свойствам?
-Какие ещё вещества, состоящие из атомов углерода, вы знаете?
- Где применяются данные вещества?
Возьмите чистый листок бумаги, подпишите .
Выберите из предложенных утверждений только те, которые справедливы:
I вариант - для алмаза.
II вариант – для графита.
- Прозрачный, бесцветный.
- Очень твердый.
- Ковалентная неполярная связь.
- Не проводит электрический ток.
- Используют как добавку в смазке.
- Непрозрачный, серого цвета, с металлическим блеском.
- Электропроводен.
- Атомная кристаллическая решетка.
- Легко расслаивается на отдельные мельчайшие пластинки.
- При обычных условиях химически инертен, при высокой температуре становится активным.
Учитель предлагает определить, о каком веществе идёт речь (читается одно утверждение по порядку):
1.Это вещество относится к оксидам.
3.Он образуется при прокаливании карбонатов.
4.Он не горит и не поддерживает горение, поэтому эти свойства позволяют использовать его в огнетушителях для тушения пожаров.
Выводит учащихся на тему урока.
Определяют вещество – углекислый газ.
Приветствие учителя, настрой на работу.
-Нужно учиться с удовольствием, тогда все будет понятно и легко.
Слушают учителя, настраиваются на работу, отвечают на вопросы.
-Разновидности элемента – графит и алмаз
- Имеют разное строение кристаллических решёток
Уголь, сажа. Возможный вариант - карбин, фуллерен
Уголь как топливо, в медицине - таблетки активированного угля (карбален), в противогазах, в фильтрах для очистки воды; сажа – крем для обуви, наполнитель для получения резиновых покрышек, для приготовления чёрной типографской краски, картриджи.
Выполняют работу на отдельных листах
Взаимопроверка в парах
I вариант – 1, 2, 3, 4, 8, 10
II вариант – 3, 5, 6, 7, 8, 9, 10
Учащиеся слушают учителя, участвуют в беседе.
II. Основная часть
(изучение нового материала)
Формулировка темы урока, его цели.
Мотивация учебной деятельности
Постановка учебной проблемы
Изучение нового материала
Учитель просит записать тему урока.
-Из материалов урока вы узнаете, какие еще названия есть у данного вещества, а также познакомитесь с его физическими и химическими свойствами. Вы узнаете, как получают углекислый газ и где его используют.
-Углерод и его соединения имеют огромное значение для человека, широко распространены в природе. Тот факт, что в человеческом организме содержится 16 кг атомов углерода (это составляет 1 333 333 моль вещества или 8*10 41 степени атомов) говорит об углероде как основе всего живого.
-Как вы думаете, с какими еще кислородными соединениями углерода мы с вами можем познакомимся в течение урока?
К кислородным соединениям углерода относятся оксиды углерода (II и IV), угольная кислота и её соли: карбонаты (мрамор, мел, известняк, аргонит) и гидрокарбонаты (питьевая сода).
- С чего мы начинаем традиционно изучение веществ?
Учитель предлагает написать формулу углекислого газа, найдите степень окисления углерода, определите тип химической связи в молекуле.
Углекислый газ – вещество, которое имеет множество названий: оксид углерода (IV), диоксид углерода или же двуокись углерода. Также его еще называют угольным ангидридом. Он является совершенно бесцветным газом, который не имеет запаха, с кисловатым вкусом. Углекислый газ тяжелее воздуха, растворим в воде. При температуре ниже -78 °С кристаллизуется и становится похожим на снег.
Шотландский химик Джозеф Блэк (1728–1799) в 1754 году установил, что известковый минерал мрамор (карбонат кальция) при нагревании разлагается с выделением газа и образует негашеную известь (оксид кальция):
CaCO 3 CaO + CO 2
Выделяющийся газ можно было вновь соединить с оксидом кальция и вновь получить карбонат кальция:
CaO + CO 2 CaCO 3
Несколько лет спустя Кавендиш обнаружил еще два характерных физических свойства углекислого газа – его высокую плотность и значительную растворимость в воде.
Содержание углекислого газа в атмосфере относительно небольшое, около 0,03% (по объему). Углекислый газ , сосредоточенный в атмосфере, имеет массу 2200 биллионов тонн.
Углекислый газ легко пропускает ультрафиолетовые лучи, которые поступают на Землю от Солнца и обогревают её.
В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов , вследствие чего принимает участие в процессе глобального потепления .
В минувшие геологические эпохи в атмосфере содержалось значительно больше углекислого газа, и средняя годовая температура на Земле была значительно выше, чем сейчас. Вычисления показывают, что при полном удалении углекислого газа из атмосферы, средняя температура земной поверхности понизилась бы на 20º.
В 60 раз больше углекислого газа содержится в растворенном виде в морях и океанах.
В течение каждого года из атмосферы извлекается примерно 1/50 часть всего содержащегося в ней CO 2 растительным покровом земного шара в процессе фотосинтеза , превращающего минеральные вещества в органические.
Основная масса углекислого газа в природе образуется в результате различных процессов разложения органических веществ . Углекислый газ выделяется при дыхании растений, животных, микроорганизмов. Непрерывно увеличивается количество углекислого газа, выделяемого различными производствами . Углекислый газ содержится в составе вулканических газо в, выделяется он и из земли в вулканических местностях.
Содержание этого газа в воздухе выше 3 % оказывает вредное влияние на организм человека. При содержании во вдыхаемом воздухе более 10% углекислого газа наступает остановка дыхания, потеря сознания, человек и другие животные погибают. Но так ли бесполезен для нас углекислый газ? У здорового человека содержание СО 2 в крови должно составлять 6-6,5% от объёма всех растворённых там газов. А если это содержание углекислого газа по какой-то причине уменьшается, происходит спазм сосудов. Организм сужает просвет бронхов и кровеносных сосудов, стремясь уменьшить выброс углекислого газа и восстановить нужное его содержание в крови. При этом замедляется транспорт кислорода к клеткам, и, чтобы клетки не испытывали кислородного голодания, сердце увеличивает частоту биений, повышая кровяное давление. Так возникает гипертония, которая может привести к инсульту, т.е. прорыву кровеносных сосудов (чаще в мозгу).
Следовательно, от содержания углекислого газа в крови зависит не только здоровье, но и жизнь.
В промышленности углекислый газ получается главным образом как побочный продукт обжига известняка, спиртового брожения и др.
Получение в лаборатории
В химических лабораториях либо пользуются готовыми баллонами с жидким углекислым газом, либо получают CO 2 в аппаратах Киппа или приборе для получения газов действием соляной кислоты на куски мрамора:
CaCO 3 + 2HCl CaCl 2 + CO 2 + H 2 O
Физические свойства СО 2 .
Учитель предлагает выявить среди перечисленных свойств те, которые характерны углекислому газу, аргументируя свой ответ .
-Выберите из перечисленных свойств те, которые характерны углекислому газу:
- Бесцветная жидкость;
- Бесцветный газ;
- Твёрдое вещество;
- Не растворим в воде;
- Плохо растворим в воде;
- Хорошо растворим в воде;
- Без запаха;
- Имеет кислый запах;
- Имеет резкий запах;
- Легче воздуха;
- Тяжелее воздуха;
- Легко сжижается и затвердевает, превращаясь в снегообразную массу;
- Не сжижается и не затвердевает.
- Горит синеватым пламенем
- Не поддерживает горение.
-Напоминаю, для того, чтобы найти плотность газа по воздуху, необходимо молярную массу газа разделить на молярную массу воздуха, которая равна 29 г/моль.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Класс 9 А Дата 04.02.21г.
Тема урока: Углекислый газ
Цель урока: сформировать знания об оксиде углерода (IV).
Задачи урока:
- познакомить учащихся с углекислым газом как кислотным оксидом, раскрыть его свойства, биологическое значение и применение.
- продолжить формирование умений устанавливать причинно-следственные связи через умения прогнозировать свойства веществ на основе их строения, кислотно-основных свойств веществ;
- продолжить развитие предметных компетенций: умение составлять уравнения реакций, получать информацию из различных источников, конспектировать, выбирать главное, развивать умение учащихся работать с дополнительной литературой.
- продолжить формирование коммуникативных компетенций при работе в группах;
- развивать критическое мышление через чтение информационного текста;
- воспитывать умение внимательно слышать и слушать другое мнение;
- прививать чувство ответственности за состояние нашей природы на основе формирования представлений о химической грамотности, экономической и экологической целесообразности использования оксида углерода (IV)
Формируемые УУД:
Познавательные УУД : физические и химические свойства, применение оксида углерода (IV), составление уравнений реакций и решение логических задач.
Коммуникативные УУД : добывать недостающую информацию с помощью логических суждений, формулируют свои мысли, участвуют в совместной деятельности, учебном диалоге.
Регулятивные УУД: планируют свои действия в соответствии с поставленной целью, учитывают выделенные учителем ориентиры действия в новом учебном материале.
Оборудование: видеопроектор, ПСХЭ, таблица растворимости, известковая вода, прибор для получения газов, мел, раствор соляной кислоты.
Ход урока
1. Организационный момент.
2. Мотивация.
Чтоб появиться я сумел,
Прокаливают белый мел.
Меня дает огонь в печи,
И пламя маленькой свечи.
И стоит только сделать вздох, чтоб я на свет явится мог.
Растеньям пользу приношу,
Пожар затухнуть заставляю.
Я в газированной воде
И в воздухе летаю.
Я в хлебе, в соде, я везде
Повсюду обитаю.
О каком соединении идет речь?
3. Актуализация знаний.
Беседа по степеням окисления и валентностям углерода. Повторение: классификация и химические свойства оксидов.
4.Изучение нового материала.
Оксид углерода ( IV ) CO 2 , углекислый газ .
Физические свойства. Бесцветный газ, хорошо растворим в воде, в 1.5 раза тяжелее воздуха.
Хим. свойства. Углекислый газ – кислотный оксид.
2. Вз-е с основными оксидами: CaO + CO2 → CaCO3.
3. Вз-е со щелочами:
4. Окислительные свойства при нагревании: CO 2 + 2 Mg 2 MgO + C .
Качественная реакция на углекислый газ: помутнение известковой воды.
При дальнейшем пропускании СО2 раствор снова становится прозрачным:
1. В промышленности при разложении известняка: CaCO 3 CaO + CO 2 ↑.
2. При сгорании топлива: CH 4 + 2 O 2 CO 2 ↑ + 2 H 2 O .
4. В природе при медленном окислении (дыхание, гниение, брожение).
5. Закрепление нового материала.
1. Неметаллические свойства у углерода более выражены,
чем неметаллические свойства
1) кислорода 2) фтора 3) хлора 4) кремния.
2. Свойства оксидов в ряду CO2 →B2O3 →BeO изменяются от
1) кислотных к амфотерным 3) основных к кислотным
2) амфотерных к основным 4) основных к амфотерным
3. Значения высшей и низшей степени окисления углерода соответственно равны
1) +2 и -4 2) +4 и -2 3) +2 и -4 4) +4 и -4
4. В соединениях NH4HCO3 и C2H2 степени окисления углерода соответственно равны
1) – 1, + 4 2) +2, +2 3) + 2, + 4 4) + 4, - 1
5. Электроотрицательность углерода больше, чем электроотрицательность
1) кислорода 2) азота 3) серы 4) кремния.
6. Высшую степень окисления углерод имеет в соединении
7. Такую же степень окисления, как и в СН4, углерод имеет в соединении 1) СО, 2) Al4C3, 3) CaCO3, 4) CO2.
8. Углерод вступает в реакцию с
- кислородом и соляной кислотой,
- оксидом железа (II) и водородом,
- сульфатом натрия и гидроксидом меди(II),
- кремниевой кислотой и хлоридом бария.
9. Сколько веществ, указанных в ряду CuCl2, Fe2O3, Al(OH)3, O2 - реагируют с углеродом
1) одно, 2) два, 3) три, 4) четыре.
10. Сколько веществ из указанных в ряду:
H2SO4, Ca(OH)2, CuO, H2O – реагируют с оксидом углерода (IV) при комнатной температуре?
1) 1, 2) 2, 3) 3, 4) 4.
11. При добавлении раствора карбоната натрия к раствору бромоводородной кислоты
1) выпадает осадок 3) выпадает осадок и выделяется газ
2) выделяется газ 4) видимых изменений не происходит
12. Углекислый газ реагирует с каждым из двух веществ:
13. С раствором карбоната калия реагирует
1) оксид магния 3) гидроксид меди (II)
2) оксид углерода (II) 4) азотная кислота
14. С оксидом углерода (IV) реагирует
15. В реакцию с оксидом углерода (IV) вступает каждое из двух веществ
- фосфорная кислота и вода, 3) гидроксид натрия и вода,
- оксид магния и сера, 4) оксид железа (III) и водород.
16. При взаимодействии оксида углерода (IV) с оксидом калия образуется(-ются)
- соль и кислород, 3) основание и кислород,
- основание, 4) соль.
17. Формула соединения углерода, проявляющего токсичные свойства
18. Карбонат кальция реагирует с
6.Домашнее задание:
7. Рефлексия.
Учащимся необходимо выбрать 3 слова из 12, которые наиболее точно передают его состояние на уроке:
Цель: сформировать знания об оксиде углерода (IV).
Обучающая – углубить и обобщить знания о углекислом газе, рассмотреть химические свойства , способы получения и применении углекислого газа качественную реакцию на оксид углерода (IV) .
Воспитывающая – продолжить формированию научного мировоззрения, формировать умение устанавливать взаимосвязь состава, строения и свойств изучаемых веществ, физиологическое действие на организм человека.
Развивающая - способствовать развитию логического мышления (умения сравнивать, обобщать, делать выводы) .
Формируемые УУД:
Познавательные УУД : физические и химические свойства, применение оксида углерода (IV), составление уравнений реакций и решение логических задач.
Коммуникативные УУД : добывать недостающую информацию с помощью логических суждений, формулируют свои мысли, участвуют в совместной деятельности, учебном диалоге.
Регулятивные УУД: планируют свои действия в соответствии с поставленной целью, учитывают выделенные учителем ориентиры действия в новом учебном материале.
Тип урока: Комбинированный частично поисковый урок.
Технология обучения : проблемного обучения
Форма организации ПД: фронтальная, индивидуальная, парная .
Метод обучения: словесные (беседа), работа с наглядными материалами, практические, демонстрационный эксперимент, частично- поисковый.
Необходимое оборудование и реактивы: компьютер, проектор, экран, презентация, раздаточный материал. Аппарат Киппа, заправленный мрамором и раствором HCl, раствор Ca(OН) 2 , пипетка, колба, стаканы, свеча, спички, лучинки, индикаторы, пластиковые трубочки, колба, стеклянные стаканы.

Урок можно использовать в рамках предметной недели естественно-математического цикла.
Тема. Углекислый газ. Угольная кислота и её соли. Круговорот углерода в природе.
Тип урока: урок изучения новой темы.
Образовательные:
1.Рассмотреть состав, строение, свойства, применение угольной кислоты и ее солей, круговорот углерода в природе.
2.Закрепить знания о средних и кислых солях на примере карбонатов и гидрокарбонатов, их взаимопревращениях.
3.Закрепить умение составлять уравнения реакций.
4.Изучить качественную реакцию на углекислый газ и карбонат – ион.
5.Ознакомить с практическим применением карбонатов и гидрокарбонатов.
Развивающие:
1.Продолжать развивать умение наблюдать, анализировать, делать выводы при выполнении предложенных заданий.
2.Развивать наблюдательность, память, умение сравнивать.
Воспитательные:
2.Продолжить развитие познавательных интересов учащихся.
3.Воспитывать культуру речи, трудолюбие, усидчивость.
4.Воспитание положительного отношения к знаниям, инициативности, способности преодолевать трудности для достижения цели.
Оборудование: учебник, тетрадь, раздаточный материал (тесты для самостоятельной работы), таблица Менделеева, презентация, видеоролики, таблица растворимости.
Штатив с пробирками, индикаторы.
Реактивы: мел, сода, соляная кислота, гидроксид натрия, хлорид кальция, карбонат натрия,
Здоровьесберегающая:
Закрепить навыки безопасного обращения с реактивами и оборудованием.
Использовать методические приемы, позволяющие предотвратить переутомление учащихся, повысить их внимание.
Методы обучения:
объяснительно - иллюстративный (таблицы, презентация, видео)
словесный (рассказ, объяснение, беседа)
демонстрационный (лабораторный опыт)
Формы организации познавательной деятельности учащихся:
самостоятельная работа с текстом учебника, выполнение письменных заданий.
Педагогические приемы:
(определение цели и задачи урока, создание благоприятных условий деятельности)
(беседа, постановка проблемы, ее обсуждение, работа с учебником, наблюдение)
(восприятие, осмысление, запоминание информации, мотивация деятельности).
Структура урока
1.Организационный момент 1-2 мин
Организация внимания и порядка в классе, взаимное приветствие, проверка присутствующих, мотивация их деятельности, проверка готовности класса к уроку, формулирование темы урока в сотрудничестве с учащимися.
Вот опять звенит звонок - начинается урок.
Первым делом гоним лень,
На уроке не молчать,
Всем работать, отвечать!
В мире много, интересного,
Нам порою неизвестного.
Миру знаний нет предела. Так скорей, друзья, за дело!
“Сами, трудясь, вы сделаете все и для близких, и для себя, а если при труде успеха не будет, будет неудача – не беда, пробуйте еще”. Д.И. Менделеев
2.Проверка домашнего задания
Для проверки усвоения знаний, для оценивания предлагает проверочный тест:
Выберите из предложенных утверждений те, которые справедливы для угарного газа
1. Бесцветный газ, без запаха.
2. Газообразный при обычных условиях.
5. Хорошо растворим в воде.
6. Плохо растворим в воде.
7. Газ легче воздуха.
8. Газ тяжелее воздуха.
9. Проявляет кислотные свойства.
10.Степень окисления углерода +2.
11.Степень окисления углерода +4.
12. В реакциях может быть и окислителем, и восстановителем.
13. В реакциях может быть только окислителем.
14. При пропускании через известковую воду наблюдается помутнение.
Индивидуальная. Учащиеся выполняют тест письменно
Парная. Осуществляют взаимопроверку (обмениваются тетрадями)
Актуализация знаний обучающихся: ( 3 мин)
Какой химический элемент мы изучаем?
Какие соединения образует углерод?
Какой высший оксид образует углерод?
Какие соединения углерода мы уже изучили?
( Ответ: оксид углерода (II))
А какие соединения предстоит изучить?
(Ответ: углекислый газ, угольную кислоту и её соли)
Фронтальная беседа:
Формула и названия угарного газа
Симптомами отравления газом
Темнеет в глазах.
Мышечная слабость, дрожь во всем теле.
Первую помощь при отравлении угарным газом.
Расстегните ворот и стягивающую одежду.
Обеспечьте покой и непрерывный доступ свежего воздуха.
Разотрите энергичными движениями тело пострадавшего.
На голову и грудь положите холодный компресс.
Если пострадавший в сознании, напоите его теплым чаем, кофе.
Как действует угарный газ на организм
Источники угарного газа
Угарный газ выделяется при пожарах, в банях, в дачных и сельских домах с печным отоплением, на городской кухне при неполном сгорании природного газа.
Угарный газ может исходить из любого источника, работающего на горючем топливе. Легковые автомобили, камины, катера, дровяные, керосиновые обогреватели, древесно-угольные грили и газовые устройства, использующиеся в нагревателях воды, печах, сушилках.
Мотивация учебной деятельности, постановка цели урока
Открывая бутылку лимонада, или любого другого газированного напитка мы сталкиваемся с нашей незнакомкой. Это она, угольная кислота. Любая газированная вода представляет собой раствор углекислого газа в воде.
Открывая бутылку газированной воды, мы видим, как выделяется газ, разбрызгиваясь вокруг. Это происходит от того, что молекулы угольной кислоты крайне неустойчивы, а в бутылке она находится под большим давлением, когда мы открываем крышку, она сразу разлагается, выделяя углекислый газ.
Что образуется при растворении углекислого газа в воде?
Назовите формулу угольной кислоты.
Составляют уравнение реакции угольной кислоты
Изучение нового материала
Оксид углерода (IV) СO2 – углекислый газ.
Физические свойства:
(Совместно с учителем описывают физические свойства углекислого газа)
Углекислый газ, бесцветный, без запаха, растворимость в воде - в 1V H2O растворяется 0,9V CO2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO2 называется "сухой лёд"); не поддерживает горение.
Благодаря тому, что оксид углерода (IV) не поддерживает горения, им заполняют огнетушители.
Работа с учебником стр 123 применение углекислого газа.
Получение: (учащиеся совместно с учителем записывают уравнения реакций)
1.Термическим разложением солей угольной кислоты (карбонатов).
Обжиг известняка – в промышленности:
CaCO3 t=1200˚C → CaO + CO2
2.Действием сильных кислот на карбонаты и гидрокарбонаты в лаборатории:
3. Сгорание углеродсодержащих веществ:
4. При медленном окислении в биохимических процессах (дыхание, гниение, брожение)
Химические свойства углекислого газа:
1) с водой даёт непрочную угольную кислоту:
2) реагирует с основными оксидами и основаниями, образуя соли угольной кислоты
Качественная реакция на углекислый газ видео-опыт
Цель: научится распознавать углекислый газ.
Ответы учащихся: Помутнение известковой воды Ca(OH)2 за счёт образования белого осадка
Составляют уравнение реакции:
Угольная кислота и её соли
Химическая формула - H2CO3

Структурная формула – все связи ковалентные полярные:
Характеристика угольной кислоты составляется в ходе беседы с классом. Учащиеся классифицируют угольную кислоту по известным признакам, записывают уравнения диссоциации по ступеням.
Как электролит – очень слабая кислота, диссоциирует на ионы в малой степени, поэтому изменяет окраску индикатора слабо.
Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
Для угольной кислоты характерны все свойства кислот
1) Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор - лакмус краснеет в водном растворе:
2) с активными металлами
3) с основными оксидами
4) с основаниями
Соли угольной кислоты – карбонаты и гидрокарбонаты
Стадия осмысления (получение новой информации)
Учитель: так как угольная кислота двухосновная, то ей соответствуют соли двух типов.
Ответы учащихся: Средние CaCO3 и Кислые Ca(HCO3)2).
Учитель: Дайте названия этим солям
Ответы учащихся: (Карбонат кальция) и (Гидрокарбонат кальция)
Учитель: Что можно сказать о растворимости карбонатов и гидрокарбонатов?
(работа с таблицей растворимости)
Ответы учащихся: растворимы только соли K + , Na + , NH4 + , гидрокарбонаты все растворимы в воде.
На демонстрационном столе карбонаты (учащиеся описывают физические свойства)
Оборудование: стакан с водой, карбонаты, стеклянная палочка.
Все карбонаты – твёрдые белые кристаллические вещества.
Большинство из них в воде не растворяются.
Гидрокарбонаты растворяются в воде (растворяют в воде).
Карбонаты в природе, область их применения:
CaCO3 - мел, мрамор, известняк
NaHCO3 – питьевая сода
K2CO3 -(поташ, в золе растений)
Na2CO3 – сода, кальцинированная сода
Na2CO3 x 10H2O – кристаллическая сода
Закройте глаза, расслабьте тело,
Представьте – вы птицы, вы вдруг полетели!
Теперь в океане дельфином плывете,
Теперь в саду яблоки спелые рвете.
Налево, направо, вокруг посмотрели,
Открыли глаза, и снова за дело!
Химические свойства карбонатов
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями (демонстрация)
2) Разложение гидрокарбонатов при нагревании
3) Разложение нерастворимых карбонатов при нагревании
4) Взаимодействие с кислотами
Цель: научиться распознавать карбонаты.
Учитель: В пробирку с мелом приливаем несколько капель раствора сильной кислоты.
Составляют уравнение реакции:
5) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
Учитель: Особенностью солей угольной кислоты является их способность превращаться друг в друга.
Видео – опыт "Взаимопревращение карбонатов и гидрокарбонатов"
Какой вывод можно сделать из наблюдаемых явлений?
Что происходит, если дольше пропускать углекислый газ через мутный осадок?
Ответы учащихся: при пропускании углекислого газа через мутный раствор карбоната кальция осадок растворяется.
Составляют уравнение реакции:
Учитель: При избытке углекислого газа в присутствии воды карбонаты могут превращаться в гидрокарбонаты. Именно наличием этой соли и объясняется временная жесткость воды. Почему временная? Потому что, при нагревании растворимый гидрокарбонат кальция снова превращается в нерастворимый карбонат:
Составляют уравнение реакции:
Эта реакция приводит к образованию накипи на стенках котлов, домашних чайников.
Жёсткость воды
Использование жёсткой воды приводит к образованию накипи. Анализ показывает, что жёсткая вода содержит большое количество растворимых солей кальция и магния.
Жёсткость воды


временную жёсткость постоянную жёсткость
Временная жёсткость воды или карбонатная
обусловлена присутствием в воде гидрокарбонатов кальция и магния.
Она легко устраняется кипячением:
Ca(HCO3)2 Са СO3 + H2O + CO2
Действием известкового молока или соды
Постоянная или некарбонатная жёсткость
обусловлена присутствием в воде других растворимых солеё кальция или магния.
Она устраняется добавлением соды

CaCl2+ Na2CO3
Круговорот углерода в природе
Работа с учебником стр. 126-127 читать (обсуждение совместно с учителем)
Закрепление знаний:
Осуществить превращения и указать типы реакций:
Стадия размышления (Составление синквейна)
2. Средние, кислые
3.Образуют, защищают, создают
Рефлексия учебной деятельности:
– Какую цель мы ставили на уроке?
– Вы достигли цели урока?
- Тема урока мне понятна
-Я доволен своей работой на уроке
- На самостоятельной работе у меня все получилось
мне было трудно
Китайская мудрость гласит:

Урок новых знаний по теме "Оксиды углерода (углекислый газ)". В урок включено задание PISA (естественнонаучная грамотность).
Технологическая карта учебного занятия
Тип занятия: урок новых знаний.
Цель занятия: сформировать знания об оксиде углерода (IV).
Планируемые результаты:
- личностные: воспитание бережного отношения к своему здоровью, окружающей природе, развитие ответственного отношения к учёбе, познавательного интереса к химии, используя данные о значении изучаемых веществ и явлений в окружающей жизни, развитие коммуникативных умений и навыков, формирование умений парной и групповой работы.
- метапредметные: формирование научного мировоззрения (о реальности существования этого оксида и связанных с ним превращений), раскрытие причинно-следственных связей, развитие умений самостоятельно ставить и формулировать для себя новые задачи, определять способы действий и соотносить с планируемыми результатами.
- предметные: систематизировать знания учащихся о кислотных оксидах на примере оксида углерода ( IV ), усвоить строение, физические свойства, химические свойства, получение и применение углекислого газов, качественную реакцию на углекислый газ, физиологическое действие на организм углекислого газа, продолжить работу по развитию умений сравнивать, составлять уравнения реакций, получать информацию из сети Интернет.
Педагогические технологии: педагогика сотрудничества, проблемного обучения, ИКТ.
Методы обучения: беседа, объяснение, дискуссия, постановка и решение учебных проблем, устный опрос, демонстрация презентации.
Оборудование: мрамор, соляная кислота, известковая вода, спички, пробирка с газоотводной трубкой, пробирки, держатель, спиртовка, пробирочный штатив, лучина.
Этапы занятия
Дидактические задачи этапа
Формы организации деятельности
Дидактические средства
Время, мин.
Создать учебную или образовательную ситуацию, осуществить постановку учебной задачи, осуществить целеполагание.
Создать условия для решения учебной задачи, организовать процесс познания, коммуникации.
Развить умения оценивать свою работу обучающимися, на основе понятных для ребят критериев оценивания.
Технические средства обучения. Раздаточный материал.
Подвести итоги совместной и индивидуальной деятельности учеников.
Технические средства обучения
Конспект урока
Организационный этап (Учитель создает условия для доброжелательной обстановки на уроке).
I . Мотивационно-целевой этап
Учитель задаёт учащимся загадку для постановки цели урока.
Чтоб появиться я сумел,
Прокаливают белый мел.
Меня даёт огонь в печи
И пламя маленькой свечи.
И стоит только сделать вздох,
Чтоб я на свет явиться мог.
Я в газированной воде,
Я в хлебе, в соде, я везде.
Учитель: О каком веществе идёт речь?
Ученики: Углекислый газ.
Учитель: Правильно, молодцы. Попробуйте теперь сформулировать цель нашего урока.
(Ученики предлагают свои варианты).
II . Операционно-деятельностный этап
(Осуществляется процесс познания нового материала в виде лекции).
С +4 О -2 2 – оксид углерода ( IV ), углекислый газ – газ, без цвета, запаха, вкуса, тяжелее воздуха, растворим в воде, не поддерживает дыхание и горение.
В воздухе, содержащем 3% СО2, зажжённая свеча гаснет. При содержании углекислого газа в воздухе 4% возникает головная боль, учащение пульса, повышение кровяного давления.
С +4 О -2 2 – ковалентная полярная связь.

1) В промышленности: обжиг известняка.
2) В лаборатории: действием сильных кислот на карбонаты.
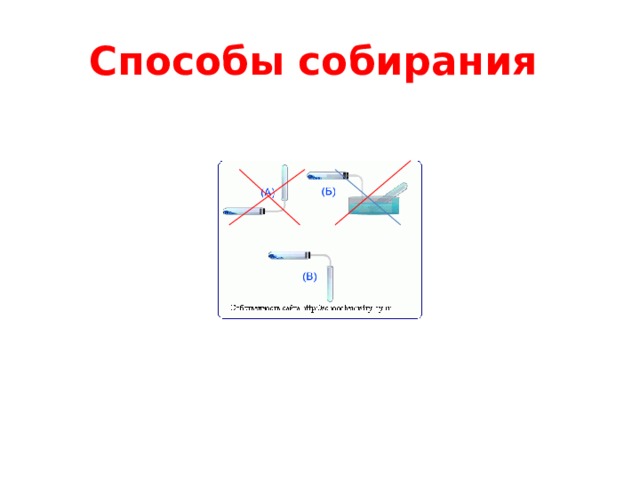
Способы собирания:
Учитель: Ребята, перед вами рис. 1. Вы знаете физические свойства углекислого газа. Скажите, пожалуйста, как можно собрать углекислый газ?
(После обсуждения ученики приходят к выводу, что собрать углекислый газ можно, используя только один вариант (рис. 2).






Рис. 1 Рис. 2
Эксперимент (получение углекислого газа в лаборатории и его распознавание).
(Учитель проводит демонстрационный опыт, предварительно спросив у ребят, как можно распознать углекислый газ)
Распознавание:
1) горящая лучинка гаснет, т.к. углекислый газ не поддерживает горение;
2) помутнение известковой воды:
Химические свойства:
СО2 – солеобразующий (кислотный) оксид.
Несмотря на то, что углекислым газом тушат пожары, им нельзя потушить горящий магний:
СО2 + 2 Mg → 2 Mg О + С
Углекислый газ применяется:
в производстве газированных напитков;
для тушения пожаров;
III . Контрольно-оценочный этап
ТЕСТО ДЛЯ ХЛЕБА

При приготовлении теста для хлеба повар смешивает муку, воду, соль и дрожжи. После этого тесто помещают на несколько часов в какую-нибудь ёмкость, чтобы начался процесс брожения. При брожении в тесте происходят химические процессы: дрожжи (одноклеточный гриб) преобразуют крахмал и сахар, содержащиеся в муке, в углекислый газ и спирт.
В результате брожения тесто поднимается. Почему тесто поднимается?
A Тесто поднимается, потому что в нем образуется спирт, который переходит
B Тесто поднимается, потому что в нем размножаются одноклеточные грибы.
C Тесто поднимается, потому что в нем образуется углекислый газ.
D Тесто поднимается, потому что при брожении вода превращается в пар.
ОЦЕНКА ВЫПОЛНЕНИЯ ЗАДАНИЯ
Ответ принимается полностью – 1 балл.
C. Тесто поднимается, потому что в нем образуется углекислый газ.
Ответ не принимается
Тип вопроса: с выбором ответа
Компетенция: научное объяснение явлений
Содержание: физические системы
Область применения: связь естествознания и технологии
Контекст: личностный
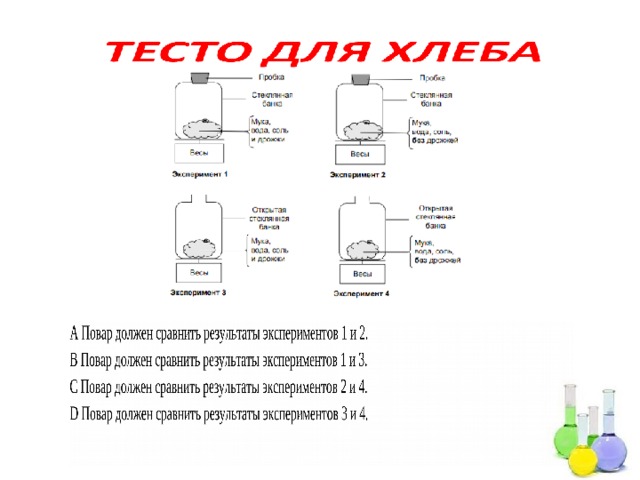
Через несколько часов после приготовления теста повар взвешивает его и обнаруживает, что масса теста уменьшилась.
В начале каждого из четырех экспериментов, изображенных на рисунках, масса теста одна и та же. Результаты каких двух экспериментов должен сравнить повар, чтобы выяснить, являются ли дрожжи причиной уменьшения массы теста?

A Повар должен сравнить результаты экспериментов 1 и 2.
B Повар должен сравнить результаты экспериментов 1 и 3.
C Повар должен сравнить результаты экспериментов 2 и 4.
D Повар должен сравнить результаты экспериментов 3 и 4.
ОЦЕНКА ВЫПОЛНЕНИЯ ЗАДАНИЯ
Ответ принимается полностью – 1 балл.
D. Повар должен сравнить результаты экспериментов 3 и 4.
Ответ не принимается
Тип вопроса: с выбором ответа
Компетенция: распознавание и постановка научных вопросов
Содержание: естественнонаучные объяснения (знание о науке)
Область применения: связь естествознания и технологии
Контекст: личностный
Дрожжи в тесте в результате химической реакции превращают крахмал и сахар, содержащиеся в муке, в углекислый газ и спирт.
Откуда появляются атомы углерода, входящие в состав углекислого газа и спирта?
Является ли это верным объяснением
появления атомов углерода?
Некоторые атомы углерода поступают из сахара.
Некоторые атомы углерода входят в состав молекулы соли.
Некоторые атомы углерода поступают из воды.
ОЦЕНКА ВЫПОЛНЕНИЯ ЗАДАНИЯ
Ответ принимается полностью – 1 балл.
Три верных ответа: Да, Нет, Нет в указанном порядке.
Ответ не принимается
Тип вопроса: комплексный с выбором ответа
Компетенция: научное объяснение явлений
Содержание: физические системы
Область применения: связь естествознания и технологии
Контекст: личностный
Когда подошедшее дрожжевое тесто ставят в печь, пузырьки газа и пара в тесте расширяются.
Почему газ и пар расширяются при нагревании?
A Их молекулы становятся больше.
B Их молекулы двигаются быстрее.
C Число их молекул увеличивается.
D Их молекулы сталкиваются реже.
ОЦЕНКА ВЫПОЛНЕНИЯ ЗАДАНИЯ
Ответ принимается полностью – 1 балл.
В. Их молекулы двигаются быстрее.
Ответ не принимается
Тип вопроса: с выбором ответа
Компетенция: научное объяснение явлений
Содержание: физические системы
Область применения: связь естествознания и технологии
Контекст: личностный
IV . Рефлексивно-обобщающий этап.
Учитель: Прошу ответить на вопросы:
1. Сегодня я узнал.
2. Было интересно.
4. Урок дал мне для жизни.
Учащиеся: Отвечают на вопросы.
Домашнее задание: конспект урока.
Учитель: И.В. Моисеева

Чтоб появиться я сумел, Прокаливают белый мел. Меня даёт огонь в печи И пламя маленькой свечи. И стоит только сделать вздох, Чтоб я на свет явиться мог. Я в газированной воде, Я в хлебе, в соде, я везде.

Строение молекулы

Способы собирания
Способы собирания

ТЕСТО ДЛЯ ХЛЕБА

ТЕСТО ДЛЯ ХЛЕБА
При приготовлении теста для хлеба повар смешивает муку, воду, соль и дрожжи. После этого тесто помещают на несколько часов в какую-нибудь ёмкость, чтобы начался процесс брожения. При брожении в тесте происходят химические процессы: дрожжи (одноклеточный гриб) преобразуют крахмал и сахар, содержащиеся в муке, в углекислый газ и спирт.

ТЕСТО ДЛЯ ХЛЕБА
В результате брожения тесто поднимается. Почему тесто поднимается?
A Тесто поднимается, потому что в нем образуется спирт, который переходит газообразное состояние.
B Тесто поднимается, потому что в нем размножаются одноклеточные грибы.
C Тесто поднимается, потому что в нем образуется углекислый газ.
D Тесто поднимается, потому что при брожении вода превращается в пар.

ТЕСТО ДЛЯ ХЛЕБА
Через несколько часов после приготовления теста повар взвешивает его и обнаруживает, что масса теста уменьшилась.
В начале каждого из четырех экспериментов, изображенных на рисунках, масса теста одна и та же. Результаты каких двух экспериментов должен сравнить повар, чтобы выяснить, являются ли дрожжи причиной уменьшения массы теста ?
ТЕСТО ДЛЯ ХЛЕБА
Дрожжи в тесте в результате химической реакции превращают крахмал и сахар, содержащиеся в муке, в углекислый газ и спирт.
Откуда появляются атомы уг лерода, входящие в состав углекислого газа и спирта?

ТЕСТО ДЛЯ ХЛЕБА
Является ли это верным объяснением
появления атомов углерода?
Некоторые атомы углерода поступают из сахара.
Некоторые атомы углерода входят в состав молекулы соли.
Некоторые атомы углерода поступают из воды.

ТЕСТО ДЛЯ ХЛЕБА
Когда подошедшее дрожжевое тесто ставят в печь, пузырьки газа и пара в тесте расширяются.
Читайте также:

