Связь между давлением и средней кинетической энергией молекул газа конспект
Обновлено: 08.07.2024
Как известно, многие вещества в природе могут находиться в трех агрегатных состояниях: твердом, жидкоми газообразном.
Учение о свойствах вещества в различных агрегатных состояниях основывается на представлениях об атомно-молекулярном строении материального мира. В основе молекулярно-кинетической теории строения вещества (МКТ) лежат три основных положения:
· все вещества состоят из мельчайших частиц (молекул, атомов, элементарных частиц), между которыми есть промежутки;
· частицы находятся в непрерывном тепловом движении;
· между частицами вещества существуют силы взаимодействия (притяжения и отталкивания); природа этих сил электромагнитная.
Значит, агрегатное состояние вещества зависит от взаимного расположения молекул, расстояния между ними, сил взаимодействия между ними и характера их движения.
Сильнее всего проявляется взаимодействие частиц вещества в твердом состоянии. Расстояние между молекулами примерно равно их собственным размерам. Это приводит к достаточно сильному взаимодействию, что практически лишает частицы возможности двигаться: они колеблются около некоторого положения равновесия. Они сохраняют форму и объем.
Свойства жидкостей также объясняются их строением. Частицы вещества в жидкостях взаимодействуют менее интенсивно, чем в твердых телах, и поэтому могут скачками менять свое местоположение – жидкости не сохраняют свою форму – они текучи. Жидкости сохраняют объем.
Газ представляет собой собрание молекул, беспорядочно движущихся по всем направлениям независимо друг от друга. Газы не имеют собственной формы, занимают весь предоставляемый им объем и легко сжимаются.
Существует еще одно состояние вещества – плазма. Плазма - частично или полностью ионизованный газ, в котором плотности положительных и отрицательных зарядов практически одинаковы. При достаточно сильном нагревании любое вещество испаряется, превращаясь в газ. Если увеличивать температуру и дальше, резко усилится процесс термической ионизации, т. е. молекулы газа начнут распадаться на составляющие их атомы, которые затем превращаются в ионы.
Модель идеального газа. Связь между давлением и средней кинетической энергией.
Для выяснения закономерностей, которым подчиняется поведение вещества в газообразном состоянии, рассматривается идеализированная модель реальных газов – идеальный газ. Это такой газ, молекулы которого рассматриваются как материальные точки, не взаимодействующие друг с другом на расстоянии, но взаимодействующие друг с другом и со стенками сосуда при столкновениях.
Идеальный газ– это газ, взаимодействие между молекулами которого пренебрежимо мало. (Ек>>Ер)
Идеальный газ – это модель, придуманная учеными для познания газов, которые мы наблюдаем в природе реально. Она может описывать не любой газ. Не применима, когда газ сильно сжат, когда газ переходит в жидкое состояние. Реальные газы ведут себя как идеальный, когда среднее расстояние между молекулами во много раз больше их размеров, т.е. при достаточно больших разрежениях.
Свойства идеального газа:
1. расстояние между молекулами много больше размеров молекул;
2. молекулы газа очень малы и представляют собой упругие шары;
3. силы притяжения стремятся к нулю;
4. взаимодействия между молекулами газа происходят только при соударениях, а соударения считаются абсолютно упругими;
5. молекулы этого газа двигаются беспорядочно;
6. движение молекул по законам Ньютона.
Состояние некоторой массы газообразного вещества характеризуют зависимыми друг от друга физическими величинами, называемыми параметрами состояния.К ним относятся объем V, давление p и температура T.

Объем газаобозначается V. Объем газа всегда совпадает с объемом того сосуда, который он занимает. Единица объема в СИ м 3 .
Давление– физическая величина, равная отношению силы F, действующей на элемент поверхности перпендикулярно к ней, к площади S этого элемента.
p=F/S Единица давления в СИ паскаль [Па]
До настоящего времени употребляются внесистемные единицы давления:
техническая атмосфера 1 ат = 9,81-104 Па;
физическая атмосфера 1 атм;
миллиметры ртутного столба 1 мм рт. ст.= 133 Па;
Как возникает давление газа? Каждая молекула газа, ударяясь о стенку сосуда, в котором она находится, в течение малого промежутка времени действует на стенку с определенной силой. В результате беспорядочных ударов о стенку сила со стороны всех молекул на единицу площади стенки быстро меняется со временем относительно некоторой (средней) величины.
Давление газавозникает в результате беспорядочных ударов молекул о стенки сосуда, в котором находится газ.
Используя модель идеального газа, можно вычислить давление газа на стенку сосуда.
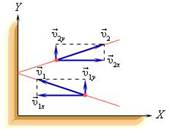
В процессе взаимодействия молекулы со стенкой сосуда между ними возникают силы, подчиняющиеся третьему закону Ньютона. В результате проекция υx скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция υy скорости, параллельная стенке, остается неизменной.
Приборы, измеряющие давление, называют манометрами.Манометры фиксируют среднюю по времени силу давления, приходящуюся на единицу площади его чувствительного элемента (мембраны) или другого приемника давления.
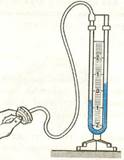



Жидкостные манометры:
1. открытый – для измерения небольших давлений выше атмосферного
2. закрытый - для измерения небольших давлений ниже атмосферного, т.е. небольшого вакуума
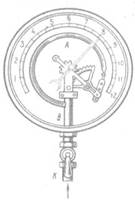
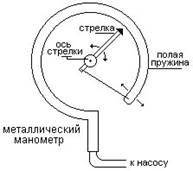
Металлический манометр– для измерения больших давлений.
Основной его частью является изогнутая трубка А, открытый конец которой припаян к трубке В, через которую поступает газ, а закрытый – соединен со стрелкой. Газ поступает через кран и трубку В в трубку А и разгибает её. Свободный конец трубки, перемещаясь, приводит в движение передающий механизм и стрелку. Шкала градуирована в единицах давления.
Лекция по физике
Подготовила Коробейникова Е. Е.
План
Основные положения молекулярно – кинетической теории.
Модель идеального газа. Связь между давлением и средней кинетической энергией.
Свойства идеального газа.
Давление. Закон Паскаля.
Приборы для измерения давления.
Основное уравнение молекулярно – кинетической теории.
Уравнение состояния идеального газа.
Как известно, многие вещества в природе могут находиться в трех агрегатных состояниях: твердом, жидкоми газообразном.
Учение о свойствах вещества в различных агрегатных состояниях основывается на представлениях об атомно-молекулярном строении материального мира. В основе молекулярно-кинетической теории строения вещества (МКТ) лежат три основных положения:
· все вещества состоят из мельчайших частиц (молекул, атомов, элементарных частиц), между которыми есть промежутки;
· частицы находятся в непрерывном тепловом движении;
· между частицами вещества существуют силы взаимодействия (притяжения и отталкивания); природа этих сил электромагнитная.
Значит, агрегатное состояние вещества зависит от взаимного расположения молекул, расстояния между ними, сил взаимодействия между ними и характера их движения.
Сильнее всего проявляется взаимодействие частиц вещества в твердом состоянии. Расстояние между молекулами примерно равно их собственным размерам. Это приводит к достаточно сильному взаимодействию, что практически лишает частицы возможности двигаться: они колеблются около некоторого положения равновесия. Они сохраняют форму и объем.
Свойства жидкостей также объясняются их строением. Частицы вещества в жидкостях взаимодействуют менее интенсивно, чем в твердых телах, и поэтому могут скачками менять свое местоположение – жидкости не сохраняют свою форму – они текучи. Жидкости сохраняют объем.
Газ представляет собой собрание молекул, беспорядочно движущихся по всем направлениям независимо друг от друга. Газы не имеют собственной формы, занимают весь предоставляемый им объем и легко сжимаются.
Существует еще одно состояние вещества – плазма. Плазма - частично или полностью ионизованный газ, в котором плотности положительных и отрицательных зарядов практически одинаковы. При достаточно сильном нагревании любое вещество испаряется, превращаясь в газ. Если увеличивать температуру и дальше, резко усилится процесс термической ионизации, т. е. молекулы газа начнут распадаться на составляющие их атомы, которые затем превращаются в ионы.
Модель идеального газа. Связь между давлением и средней кинетической энергией.
Для выяснения закономерностей, которым подчиняется поведение вещества в газообразном состоянии, рассматривается идеализированная модель реальных газов – идеальный газ. Это такой газ, молекулы которого рассматриваются как материальные точки, не взаимодействующие друг с другом на расстоянии, но взаимодействующие друг с другом и со стенками сосуда при столкновениях.
Идеальный газ– это газ, взаимодействие между молекулами которого пренебрежимо мало. (Ек>>Ер)
Идеальный газ – это модель, придуманная учеными для познания газов, которые мы наблюдаем в природе реально. Она может описывать не любой газ. Не применима, когда газ сильно сжат, когда газ переходит в жидкое состояние. Реальные газы ведут себя как идеальный, когда среднее расстояние между молекулами во много раз больше их размеров, т.е. при достаточно больших разрежениях.
Свойства идеального газа:
1. расстояние между молекулами много больше размеров молекул;
2. молекулы газа очень малы и представляют собой упругие шары;
3. силы притяжения стремятся к нулю;
4. взаимодействия между молекулами газа происходят только при соударениях, а соударения считаются абсолютно упругими;
5. молекулы этого газа двигаются беспорядочно;
6. движение молекул по законам Ньютона.
Состояние некоторой массы газообразного вещества характеризуют зависимыми друг от друга физическими величинами, называемыми параметрами состояния.К ним относятся объем V, давление p и температура T.
Объем газаобозначается V. Объем газа всегда совпадает с объемом того сосуда, который он занимает. Единица объема в СИ м 3 .
Давление– физическая величина, равная отношению силы F, действующей на элемент поверхности перпендикулярно к ней, к площади S этого элемента.
p=F/S Единица давления в СИ паскаль [Па]
До настоящего времени употребляются внесистемные единицы давления:
техническая атмосфера 1 ат = 9,81-104 Па;
физическая атмосфера 1 атм;
миллиметры ртутного столба 1 мм рт. ст.= 133 Па;
Как возникает давление газа? Каждая молекула газа, ударяясь о стенку сосуда, в котором она находится, в течение малого промежутка времени действует на стенку с определенной силой. В результате беспорядочных ударов о стенку сила со стороны всех молекул на единицу площади стенки быстро меняется со временем относительно некоторой (средней) величины.
Давление газавозникает в результате беспорядочных ударов молекул о стенки сосуда, в котором находится газ.
Используя модель идеального газа, можно вычислить давление газа на стенку сосуда.
В процессе взаимодействия молекулы со стенкой сосуда между ними возникают силы, подчиняющиеся третьему закону Ньютона. В результате проекция υx скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция υy скорости, параллельная стенке, остается неизменной.

Приборы, измеряющие давление, называют манометрами.Манометры фиксируют среднюю по времени силу давления, приходящуюся на единицу площади его чувствительного элемента (мембраны) или другого приемника давления.




Жидкостные манометры:
1. открытый – для измерения небольших давлений выше атмосферного
2. закрытый - для измерения небольших давлений ниже атмосферного, т.е. небольшого вакуума
Металлический манометр– для измерения больших давлений.
Основной его частью является изогнутая трубка А, открытый конец которой припаян к трубке В, через которую поступает газ, а закрытый – соединен со стрелкой. Газ поступает через кран и трубку В в трубку А и разгибает её. Свободный конец трубки, перемещаясь, приводит в движение передающий механизм и стрелку. Шкала градуирована в единицах давления.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Конспект урока
Тема лекции: Модель идеального газа. Связь между давлением и средней кинетической энергией молекул идеального газа. Работа газа.
Цель: на примерах из жизни пояснить необходимость появления модели идеального газа. Познакомить с основными свойствами идеального газа. Дать понятие средней квадратичной скорости молекул газа.
Оборудование: карты с тестами.
Тип урока: изучение нового материала.
Проверка готовности к уроку.
Фронтальный опрос по пройденной теме: тест на 5-7 минут.
Чему равен абсолютный ноль температуры по шкале Цельсия?
2. Какой термометр даёт наиболее правильные показания температуры?
3. Можно ли на опыте охладить тело до абсолютного нуля?
Б. Можно даже ниже абсолютного нуля;
В. Нет, ни при каком опыте.
4. За ноль градусов по шкале Цельсия приняли
А. Температуру таяния льда;
Б. Температуру 273 0 ;
В. Температуру – 273 0 .
5. Можно ли обычным термометром определить температуру одной капли горячей воды?
В. Можно, если термометр ртутный.
6. Температура у любых тел, находящихся в состоянии теплового равновесия
В. Может быть одинаковой или нет, в зависимости от теплопроводности тела.
1. Можно ли температуру измерить непосредственно?
А. Можно только косвенным путём.
Б. Можно любым прибором, имеющим контакт с нагретым телом.
В. Можно и тем, и другим способом.
2. Что принимается за абсолютный ноль?
А. Температура таяния льда при нормальном давлении;
Б. Температура 273 градуса.
В. Температура, при которой прекращается хаотичное поступательное движение
3. Какое существует соотношение между температурами по шкале Цельсия и
А. Т = t 0 C + 273
Б. Т = 273 - t 0 C
В. t 0 C = 273 – Т
4. Каковы необходимые и достаточные условия для протекания процесса теплообмена?
А. Разность давления.
Б. Различные вещества должны находиться в контакте.
В. Разность температур.
5. Можно ли измерить точно температуру неточным термометром?
Б. Полученный результат зависит от разности температур.
6. Какие молекулы в атмосфере движутся быстрее: молекулы азота или молекулы
А. Скорость молекул одинакова.
Б. Скорость у молекул азота больше скорости молекул кислорода.
В. Скорость у молекул кислорода больше скорости молекул азота.
3. Объяснение нового материала:
Из повседневной жизни известно, что при нагревании вещества расширяются. При этом немного расширяются и сами молекулы. Этот факт существует во всех реальных газах. Чтобы газовые законы были более просты, используют физическую модель идеального газа.
Идеальным газом называется такое состояние газа, при котором он обладает следующими свойствами:
Нет межмолекулярных сил взаимодействия.
Взаимодействие возникает только при столкновении, при этом удар абсолютно упругий, т.е. нет обмена энергиями.
Молекулы не имеют объёма, т.е. являются материальными точками.
Давление создаётся только непосредственно при ударах о стенку сосуда с газом.
Все молекулы движутся хаотически по всем направлениям в пространстве.
Скорости молекул разные, поэтому, говоря о скорости молекул идеального газа, нужно ввести понятие средней скорости.
V 2 = V1 2 + V 2 2 +…+ V n 2 / n , но так как молекулы движутся по трём направлениям в пространстве, то скорость любой молекулы идеального газа можно записать в таком виде:
V 2 = V Х 2 + V У 2 + V Z 2 , так как
V Х 2 = V У 2 = V Z 2 , то V 2 =3V Х 2 → V Х 2 = 1/3 V 2 .
Находим связь между давлением и кинетической энергией движения молекул
Хотя вокруг нас находятся реальные газы, но тем не менее, законы при использовании насосов, накачивание камер автомобилей, давление газов в баллонах используются газовые, то есть для идеального газа.
К ним относятся: закон Бойля – Мариотта (при постоянной температуре); Гей – Люссака (при постоянном давлении); Шарля (при постоянном объёме). Эти три закона создаются из основного уравнения состояния газа, который связывает все три макропараметра газа (формула Клапейрона – Менделеева).
Газ очень хорошо сжимается и расширяется, что приводит к совершению работы по изменению объёма газа.
Домашняя работа:
Изучить материал лекции;
Ответить на вопросы письменно:
- как будет меняться температура кипения воды (увеличиваться или уменьшаться), если сосуд с водой опускать в глубокую шахту?
Закрепление:
Дано: V 2 = 10 6 (м/с) 2 , n = 3 10 25 м -3 , m 0 = 5 10 26 кг. Найти: Р.
Решение: Р = 1/3 n m0 V 2 → Р = 1/3 · 3 10 25 · 5 10 26 = 5 · 10 5 (Па).
Ответ: 5 · 10 5 Па.
Дано: V = 1м 3 , Р= 1,2· 10 5 Па, N= 2· 10 25 , V = 600м/с. Найти: m0
Решение: Р = 1/3 n m0 V 2 → m0 = 3Р/n V 2 = 3Р V / N = 3 · 1.2·10 5 · 1 / 2· 10 25 =
= 0,5·10 -25 = 5 · 10 -26 (кг)
Ответ: 5 · 10 -26 кг
Дано: Р = 10 5 Па, n = 2.7 · 10 25 м -3 . Найти: Ē
Р = 2/3 n Ē. → Ē = 3Р / 2 n = 3·10 5 / 2 ·2,7 · 10 25 = 0,6 · 10 -20 (Дж)
Основное уравнение молекулярно-кинетической теории устанавливает связь между давлением идеального газа и средней кинетической энергией его молекул.
Вывод основного уравнения МКТ основывается на допущениях модели идеального газа и утверждении: давление газа является результатом ударов молекул о стенку сосуда.
Определим давление газа на стенку площадью $S$ сосуда $ABCD$.

Каждая молекула массой $m_0$, отскакивая от стенки после упругого соударения со стенкой, передает ей импульс $2m_υ_x$, где $υ_x$ — проекция скорости молекулы $υ↖$ на ось $О_х$, перпендикулярную стенке. Всего за одну секунду суммарный импульс, получаемый стенкой от всех молекул, равен $2m_υ_Z$, где $Z$ — число таких столкновений (за $1$ с) всех молекул. Очевидно, что $Z=n=/$, где $n$ — концентрация молекул в единице объема; $N$ — число всех молекул. Число $Z$ пропорционально также скорости молекул $υ_x$ и площади стенки $S:Z∼nυ_S$. Поскольку все направления при хаотичном движении молекул газа равновероятны, то из всех молекул, имеющих составляющую скорости $υ_x$, только половина движется в сторону стенки $CD$ вторая половина — в сторону $АВ$ (т. е. в обратную). Поэтому $Z=/nυ_S$, а полный импульс, переданный стенке за $1$ с, равен $2m_nυ_x^S$. Поскольку изменение импульса точки (тела) за единицу времени равно действующей на него силе $F=/$, то $F=m_nυ_x^S$. В действительности, поскольку речь идет о большом количестве молекул, движущихся с разными скоростями, силу следует усреднить: $F↖=
Сила эта зависит, таким образом, от среднего квадрата скорости $>↖$.
Поскольку вследствие хаотичности движения все направления равноправны, то
С другой стороны, известно, что квадрат модуля любого вектора равен сумме квадратов его проекций на оси координат, поэтому:
Усредняя это выражение по всем молекулам и учитывая $υ^2=υ_x^+υ_y^+υ_z^$, получим:
С учетом последней формулы $F↖=/m_n↖$
Следовательно, давление на стенку сосуда равно:
Это основное уравнение молекулярно-кинетической теории. Это уравнение — первое количественное соотношение, полученное в МКТ.
Уравнение $p=/=/m_n↖$ позволяет получить связь между давлением и средней кинетической энергией молекул $↖=
Давление идеального газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема.
Важно подчеркнуть, что здесь речь идет о средней кинетической энергии молекул газа. Это означает, что давление газа — величина, органически связанная с тем, что газ состоит из большого числа молекул. Нет смысла говорить о давлении, создаваемом несколькими молекулами. Давление газа — понятие, имеющее статистический характер (так называют понятия, имеющие смысл только для систем с очень большим числом частиц).
Абсолютная температура
Согласно основному уравнению МКТ, давление $р$ прямо пропорционально средней кинетической энергии $E↖$ поступательного движения молекул:
где $n$ — объемная концентрация молекул. Заменив в $p=/n↖$ $n$ отношением числа молекул $N$ к объему газа $V(n=/)$, получим:
В состоянии теплового равновесия при постоянном объеме средняя кинетическая энергия данной массы газа должна иметь вполне определенное значение, как и температура. Согласно формуле $/=/↖$, это означает, что отношение $/$ для данной температуры должно быть одним и тем же для любых идеальных газов. То, что это действительно так, было подтверждено экспериментально для разных газов, находящихся в условиях теплового равновесия при постоянном объеме (измерялось давление).
Таким образом, величина $Θ=/$, которую, в отличие от микропараметра $↖$, легко измерить, является вполне однозначной характеристикой теплового состояния газа, как и температура. Измеряется $Θ$ (как и энергия) в джоулях. Зависит она только от температуры и может рассматриваться как естественная мера температуры. Однако в силу укоренившейся привычки измерять температуру в градусах был введен коэффициент пропорциональности $k$ между температурой $Θ$, выраженной в энергетических единицах, и температурой $Т$, выраженной в градусах:
Температура $Т$, определяемая равенством $Θ=kT$, называется абсолютной температурой.
Значения температуры, определенной по формуле $/=/↖$, всегда положительны в силу положительности $Θ=/$ (ни давление, ни объем, ни число частиц отрицательными быть не могут). Поэтому минимальным значением температуры является нуль. Температура может равняться нулю, если давление либо объем равны нулю. Из принятого определения температуры следует, что нулем температуры является температура, при которой прекращается хаотическое движение молекул. Она называется абсолютным нулем температуры.
Температура, как и давление, определяется средней кинетической энергией молекул идеального газа. Поэтому температура, как и давление, является статистической величиной (статистической называется величина, имеющая смысл только для систем, содержащих очень большое число частиц). Нельзя говорить о температуре одной или нескольких молекул.
Абсолютную шкалу температур ввел английский ученый У. Кельвин в 1850 г. Нулевая температура по абсолютной шкале (ее называют также шкалой Кельвина) соответствует абсолютному нулю, а каждая единица температуры по этой шкале равна градусу по шкале Цельсия.
Единица абсолютной температуры является одной из семи основных единиц СИ и измеряется в кельвинах (обозначается буквой $К$).
Связь между температурами, измеренными по шкалам Цельсия $t$ и Кельвина $Т$, описывается формулой:
Абсолютный нуль равен $-273.15°$С. Как правило, при расчетах пользуются округленным значением абсолютного нуля ($-273°$С).
Коэффициент пропорциональности к в формуле $Θ=kT$ называется постоянной Больцмана в честь Л. Больцмана — одного из основателей молекулярно-кинетической теории газа. Этот коэффициент составляет $k=1.38^$ Дж/К.
Постоянная Больцмана связывает температуру $Θ$ в энергетических единицах с температурой $Т$ в кельвинах. Это одна из наиболее важных постоянных в молекулярно-кинетической теории.
Температура как мера кинетической энергии
Из основного уравнения молекулярно-кинетической теории, записанного в форме $p=/↖$
и определения абсолютной температуры согласно $/=kt$
Средняя кинетическая энергия хаотического поступательного движения молекул газа пропорциональна абсолютной температуре.
Из полученного результата однозначно следует, что абсолютная температура есть мера средней кинетической энергии движения молекул.
Соотношение между температурой и кинетической энергией справедливо не только для разреженных газов (идеальных газов), но также для любых тел, подчиняющихся законам механики Ньютона. Оно справедливо и для жидкостей, и для твердых тел, атомы которых колеблются около положения равновесия.
Уравнение $р = nkТ$
Из формулы $p=/n↖$ может быть получена зависимость давления газа от абсолютной температуры $Т$ и концентрации его молекул, если воспользоваться выражением для средней кинетической энергии:
где $k$ — постоянная Больцмана.
Из формулы $p=nkT$ очевидно, что при одинаковых давлениях и температурах концентрация молекул у всех газов одинакова.
Отсюда следует известный закон Авогадро: в равных объемах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
Средняя скорость теплового движения молекул может быть также выражена через абсолютную температуру, если в формуле $E↖=/kT$ заменить $E↖$ на $↖>/$:
Квадратный корень из этой величины называется средней квадратичной скоростью:
Уравнение Менделеева-Клапейрона (уравнение состояния идеального газа)
Уравнение состояния идеального газа — это зависимость между параметрами идеального газа — давлением $р$, объемом $V$ и абсолютной температурой $Т$, определяющими его состояние:
где $В$ зависит от массы газа $m$ и его молекулярной массы $М$. В таком виде уравнения впервые получено в 1834 г. французским ученым Б. П. Э. Клапейроном и называется уравнением Клапейрона.
В 1874 г. Д. И. Менделеев вывел уравнение состояния для одного моля идеального газа: $pV=RT$, где $R$ — универсальная газовая постоянная. Если молярная масса газа $М$, то
Уравнение состояния в форме $pV=/RT$ называется уравнением Клапейрона-Менделеева. Оно объединяет газовые законы Гей-Люссака, Бойля—Мариотта, Авогадро, Шарля.
Уравнение состояния $pV=/RT$ может быть получено из зависимости давления от температуры $p=nkT$, если в нее подставить концентрацию молекул $n$ из выражения
где $N_А$ — постоянная Авогадро, $N$ — число молекул в теле.
В результате получим:
Внутренняя энергия идеального одноатомного газа
Поскольку молекулы идеального газа не взаимодействуют друг с другом, их потенциальная энергия считается равной нулю. Внутренняя энергия идеального газа определяется только кинетической энергией беспорядочного поступательного движения его молекул. Для ее вычисления нужно умножить среднюю кинетическую энергию одного атома $E↖=/kT$ на число атомов $N=/N_A$.
Учитывая, что $kN_A=R$, получим значение внутренней энергии идеального газа:
Внутренняя энергия идеального одноатомного газа прямо пропорциональна его температуре.
Если воспользоваться уравнением Клапейрона-Менделеева, то выражение для внутренней энергии идеального газа можно представить в виде:
Следует отметить, что, согласно выражению для средней кинетической энергии одного атома $(E↖=/kT)$ и в силу хаотичности движения, на каждое из трех возможных направлении движения или каждую степень свободы по оси $X,Y$ и $Z$ приходится одинаковая энергия $/$.
Число степеней свободы — это число возможных независимых направлений движения молекулы.
Газ, каждая молекула которого состоит из двух атомов, называется двухатомным. Каждый атом может двигаться по трем направлениям, поэтому общее число возможных направлений движения — $6$. За счет связи между молекулами число степеней свободы уменьшается на одну, поэтому число степеней свободы для двухатомной молекулы равно пяти.
Средняя кинетическая энергия двухатомной молекулы равна $/kT$. Соответственно внутренняя энергия идеального двухатомного газа равна:
Формулы для внутренней энергии идеального газа можно обобщить:
где $i$ — число степеней свободы молекул газа ($i = 3$ для одноатомного и $i=5$ для двухатомного газа).
Для идеальных газов внутренняя энергия зависит только от одного макроскопического параметра — температуры и не зависит от объема, т. к. потенциальная энергия равна нулю (объем определяет среднее расстояние между молекулами).
Для реальных газов потенциальная энергия не равна нулю. Поэтому внутренняя энергия в термодинамике в общем случае однозначно определяется параметрами, характеризующими состояние этих тел: объемом ($V$) и температурой ($Т$).
Изопроцессы в газах
Изопроцессами называются процессы, протекающие при неизменном значении одного из параметров: давления ($р$), объема ($V$), температуры ($Т$).
В идеальном газе эти процессы подчиняются газовым законам.
Газовыми законами называются количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра.
Закон Бойля-Мариотта
Закон Бойля-Мариотта — один из основных газовых законов, он описывает изотермические процессы в газе.
Процесс изменения состояния термодинамической системы при постоянной температуре называется изотермическим.
Для данной массы произведение давления газа на его объем постоянно, если температура газа не меняется.
$pV=const$ при $T=const$
Этот закон был экспериментально открыт английским ученым Р. Бойлем в 1662 г., в 1676 г. его сформулировал также французский ученый Э. Мариотт.
Закон строго выполняется только для идеальных газов. Для реальных газов он выполняется достаточно хорошо при небольших давлениях и высоких температурах. Так, при давлении $100$ атм. и температуре $0°$С отклонение измеренного значения $рV$ от расчетного составляет $7%$. Закон Бойля-Мариотта, как и другие газовые законы, является следствием уравнения состояния идеального газа.
Графики зависимости $p(V)$ при $T=const$ ($p=/$) называются изотермами и представляют собой равносторонние гиперболы (площади $S_1=S_2$). Чем выше температура, тем выше лежит соответствующая ей изотерма.

Закон Шарля
Давление $p$ данной массы газа при постоянном объеме пропорционально температуре.
$p=constT$ при $T=const$
Закон был открыт французским физиком Ж. Шарлем в 1787 году.
Процесс изменения состояния термодинамической системы при постоянном объеме называется изохорным (от греч. hora — пространство).
Закон Шарля, как и другие газовые законы, является следствием уравнения состояния идеального газа:
Согласно $
/=const$ при $V=const$, давление газа линейно зависит от температуры при постоянном объеме. Эта зависимость изображается прямой, которая называется изохорой. С ростом объема газа при постоянной температуре давление его, согласно закону Бойля—Мариотта, падает. Поэтому изохора, соответствующая большему объему, лежит ниже изохоры, соответствующей меньшему объему.
В соответствии с $
/=const$ при $V=const$, все изохоры начинаются в точке $Т=0$ (давление идеального газа при абсолютном нуле равно нулю).
Изохорный процесс используется в газовых термометрах постоянного объема.

Закон Гей-Люссака
При постоянном давлении $р$ объем $V$ идеального газа меняется линейно с температурой.
где $V_0$ — начальный объем, $t$ — разность начальной и конечной температур. Коэффициент теплового расширения идеальных газов $α=(/)K^$ одинаков для всех газов.
Процесс изменения состояния термодинамической системы при постоянном давлении называется изобарным (от греч. baros — вес, тяжесть).
Закон открыт французским ученым Ж. Гей-Люссаком в 1802 г. и независимо от него Дж. Дальтоном в 1801 г.
Закон Гей-Люссака, как и другие газовые законы, является следствием уравнения состояния идеального газа. Это становится очевидным, если в $V=V_0(1+αt)$ заменить $t$ абсолютной температурой $T=t+273.15$, а коэффициент расширения $α$ — его численным значением $/$:
Для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется.
Согласно $/=const$ при $p=const$, объем газа линейно зависит от температуры при постоянном давлении:
Эта зависимость графически изображается прямой, которая называется изобарой.

Различным давлениям соответствуют разные изобары. С ростом давления объем газа при постоянной температуре, согласно закону Бойля—Мариотта, уменьшается, поэтому изобара, соответствующая более высокому давлению $р_2$, лежит ниже изобары, соответствующей более низкому давлению $р_1$.
В области низких температур все изобары идеального газа сходятся в точке $Т=0$, но это не означает, что объем реального газа действительно обращается в нуль. При низких температурах все газы обращаются в жидкости, а к жидкостям уравнение состояния не применимо.
Основные положения молекулярно-кинетической теории (МКТ)
1. Все тела состоят из мельчайших частиц — атомов и молекул. Между этими частицами существуют промежутки.
2.Атомы и молекулы находятся в постоянном хаотическом движении движении. С ростом температуры скорость этого движения увеличивается.
3. Атомы и молекулы взаимодействуют друг с другом. Притягиваются или отталкиваются. Силы их взаимодействия имеют электрическую природу)
Броуновское движение — тепловое движение мельчайших частиц, взвешенных в жидкости или газе.
Диффузия — проникновение молекул одного вещества в промежутки между молекулами другого.
Количество вещества и молярная масса
![]()
Моль -1 ) — количество атомов или молекул в одном моле вещества или в 12 граммах углерода.
Молярная масса ( ) — масса одного моля вещества.
![]()
![]()
Количество молекул ( ) в веществе можно рассчитать как произведение количества вещества на число Авагадро.
![]()
Идеальный газ
Идеальный газ — газ размерами молекул которого и взаимодействием между ними можно пренебречь . Большинство газов вплоть до давления приблизительно 10 атм. можно рассматривать как идеальные. Создана данная идеальная абстракция для упрощения расчётов и выделения основных параметров таких как давление , объём , температура.
Основное уравнение МКТ идеального газа. Связывает давление газа (макроскопическую величину) со скоростью и массой молекул (микроскопическими величинами).
![]()
![]()
![]()
Концентрация молекул — количество молекул в единице объема вещества (число молекул в кубическом метре).
![]()
Температура
Температура в житейском понимании этого слова можно сказать что это мера нагретости тела.
Абсолютная температура — количественная мера средней кинетической энергии хаотического поступательного движения молекул. Измеряется в градусах по шкале Кельвина. За начало отсчета принят абсолютный ноль температуры — состояние когда при неизменном объеме газ оказывает нулевое давление на стенки сосуда в котором он находится.
Связь абсолютной температуры со средней кинетической энергией поступательного движения молекул.
![]()
![]()
Дж/К.) — коэффициент пропорциональности связывающий кинетическую энергию молекул с абсолютной температурой.
Шкала Цельсия — относительная температурная шкала связная с фазовыми переходами воды. За ноль в шкале Цельсия принимается температура плавления льда, а за 100 градусов температура кипения воды.
Связь абсолютной температуры по шкале Кельвина с относительной температурой по шкале Цельсия.
Средняя квадратичная скорость
![\[\upsilon_<KB></p>
<p> = \sqrt<\overline <\upsilon^2>> = \sqrt > = \sqrt <\mu>>\]](https://newtonov.ru/wp-content/ql-cache/quicklatex.com-1dd52130dd6888506f7144aca8c8ad4f_l3.jpg)
Газовые законы
Универсальная газовая постоянная ( Дж/(моль К)) — произведение постоянной Больцмана на число Авогадро.
Уравнение состояния идеального газа:
Уравнение Менделеева-Клапейрона:
![]()
Уравнение Клапейрона:
![]()
Изотермический процесс — термодинамический процесс, происходящий в физической системе при постоянной температуре.
Закон Бойля-Мариотта
Изобарный процесс — термодинамический процесс, происходящий в физической системе при постоянном давлении.
Закон Шарля
![]()
Изохорный процесс — термодинамический процесс, происходящий в физической системе при постоянном объеме.
Закон Гей-Люссака
![]()
Влажность
Влажность — показатель содержания воды в телах и средах.
Абсолютная влажность — физическая величина, показывающая массу водяных паров, содержащихся в 1 м³ воздуха или плотность водяного пара в воздухе
Относительная влажность ( ) — отношение парциального давления паров воды ( ) в газе к давлению насыщенного пара ( ) при данной температуре.
![]()
Насыщенный пар — пар находящийся в термодинамическом равновесии с жидкостью или твердым телом (льдом). Другими словами можно сказать что это такое состояние пара, когда количество испарившейся жидкости будет равно количеству конденсированного пара. Если говорить о влажности в таком состоянии она будет равна 100%.
Закон Дальтона Давление смеси газов, химически не взаимодействующих между собой, равно сумме парциальных давлений каждого из компонентов смеси.
Читайте также:

