Серебро конспект по химии
Обновлено: 07.07.2024
Рисунок 1. Структура серебра и его внешний вид.
Серебро имеет структуру в виде кристаллов неправильной формы. Часто в ней попадаются зерна разных размеров. Они связаны решетчатым каркасом в виде гранецентрированного куба (атомы расположены на каждой вершине куба и в центре граней).
В природе металл встречается в виде самородков (содержат 95 —99% серебра и примеси золота, платины, меди и других металлов) и в составе примерно 60 минералов. В таблице 1 приведены минералы, которые встречаются чаще остальных.
| Название минерала | Дополнительные компоненты | Содержание серебра, % |
| электрум | золото | 20-28 |
| аргентит | сера | 87 |
| гессит | теллур | 63 |
| науманит | селен | 73 |
| дискразит | сурьма | до 74 |
| кераргирит | хлор | 75 |
| прустит | сера и мышьяк | 65 |
Таблица 1. Содержание серебра в разных минералах.
Также в качестве примеси серебро обнаружено во всех медных и свинцовых рудах. Именно из них получают до 80% всего добываемого серебра. Содержание серебра в рудах цветных металлов составляет 10—100 грамм на тонну, в золото-серебряных рудах 200—1000 грамм на тонну.
Серебряные руды разбросаны по всему миру, но лидерами по его добыче являются Мексика и Перу, за которыми с небольшим отрывом следуют Китай, Чили и Австралия. В России этот металл добывают из серебряно-свинцовых руд Урала, Алтая, Северного Кавказа.
Физические и химические свойства
Физические свойства
Таблица 1. Основные физические свойства серебра.
Химические свойства серебра обусловлены положением в таблице Д.И. Менделеева. Особенность строения атома серебра заключается в наличии одного электрона на пятой орбитали. Электронная формула: 1s22s22p63s23p63d104s24p64d105s1.
Серебро не взаимодействует:
- с растворами разбавленных соляной и серной кислот, щелочами;
- с водой: растворимость серебра в воде — 0,04 мкг/л;
- с кислородом, углеродом, хлором в обычных условиях, азотом и кремнием.
1. С неметаллами:
а) сера в обычных условиях:
2 A g + S → A g 2 S сульфид серебра I.
б) галогены при нагревании с образованием галогенидов серебра I:
2 A g + B r 2 → t ° 2 A g B r бромид серебра I.
в) кислород при повышении давления и температуры до 170 °С образует на поверхности серебра пленку:
4 A g + O 2 → t ° 2 A g 2 O .
г) селен, теллур, фосфор, мышьяк и углерод при нагревании с образованием бинарных соединений типа: A g 2 S e селенид серебра, A g 3 P фосфид серебра, A g 4 C карбид серебра и т.п.
P + 3 A g → t ° A g 3 P .
а) в газообразном виде:
- с сероводородом на воздухе с образованием на поверхности металла темного налета: 4 A g + O 2 + 2 H 2 S → A g 2 S + 2 H 2 O ;
- с хлороводородом при нагревании: 2 A g + 2 H C l → t ° A g C l + H 2 .
б) H N O 3 , горячая H 2 S O 4 конц, HCl в присутствии свободного кислорода:
- 3 A g + 4 H N O 3 р а з б → 3 A g N O 3 н и т р а т с е р е б р а I и л и л я п и с + N O + H 2 O ;
- A g + 2 H N O 3 к о н ц → A g N O 3 + N O 2 ↑ + H 2 O ;
- 2 A g + 2 H 2 S O 4 к о н ц → t ° A g 2 S O 4 + S O 2 ↑ + H 2 O ;
- 4 A g + 4 H C l + O 2 → 4 A g C l + 2 H 2 O .
в) концентрированные HCl и HBr, медленно:
- 2 A g + 4 Н С l → 2 H [ A g C l 2 ] + Н 2 ;
- 2 A g + 4 Н В r → 2 H [ A g B r 2 ] + Н 2 .
3. С цианидами в присутствии кислорода воздуха с образованием дицианоаргентатов (I):
4 A g + 8 N a C N + O 2 + 2 H 2 O → 4 N a [ A g ( C N ) 2 ] д и ц и а н о а р г е н т а т н а т р и я + 4 N a O H .
4. С хлоридом железа (травление):
A g + F e C l 3 → A g C l + F e C l 2 .
5. Со ртутью серебро образует жидкий сплав — амальгаму.
Способы получения
1. Пирометаллургический способ позволяет получать серебро как побочный продукт при переработке свинцово-цинковых руд. Проходит в несколько стадий:
- руду смешивают с жидким цинком → интерметаллиды цинка с серебром A g 2 Z n 3 , A g 2 Z n 5 всплывают серебристым слоем на поверхности жидкого свинца;
- серебристый слой снимают, цинк удаляют перегонкой;
- свинец из остатка удаляют реакцией с кислородом: он выводится в виде оксида свинца (IV);
- далее серебро очищается электролитически.
2. Цианидное выщелачивание позволяет выделять серебро из тех руд, где оно содержится в малых количествах. Метод включает следующие стадии:
- обработка серебросодержащей руды раствором цианида натрия → серебро переходит в анионный комплекс N a [ A g ( C N ) 2 ] ;
- фильтрование через цинковую пыль, в ходе которого цинк вытесняет серебро: 2 N a [ A g ( C N ) 2 ] + Z n → N a 2 [ Z n ( C N ) 4 ] + 2 A g ↓ ;
- обработка серебряного осадка серной кислотой для удаления примесей;
- далее полученный остаток промывают, фильтруют, выпаривают и сплавляют в слитки.
3. При переработке медных руд серебро извлекают из анодного шлама методом электролитического рафинирования меди.
4. Амальгамный метод извлечения серебра уже не используется, но интересен с точки зрения истории:
- руда смешивается со ртутью → амальгама серебра;
- ртуть удаляют отгонкой → сырое серебро;
- сырой металл подвергают электролитическому очищению (аффинажу) в р-ре A g N O 3 с осаждением серебра высокой степени чистоты (99,9%) на катоде.
Сферы применения
- Ювелирное дело: изготовление украшений и посуды, декоративных изделий.
- Чеканка монет, медалей и других наград.
С середины XX века примерно 70% добываемого серебра расходуется промышленностью:
При подготовке к уроку учащиеся класса получают задание по анализу отдельных вопросов и делятся на экспертные группы: “историки”, “геологи”, “физики”, “химики – теоретики”, “химики – экспериментаторы”, “технологи”, “врачи”.
1. Серебро – химический элемент.
Учитель: На основании положения атома серебра в периодической системе дайте характеристику как типичному d-элементу.
Ученик: Серебро – химический элемент с порядковым номером 47, номер периода 5, большой, нечетный 7 ряд, номер группы 1, побочная подгруппа, d-элемент, металл, электронная конфигурация [Кr]4d 10 5s 1 .
Учащиеся на доске изображают электронно-графическую формулу атома серебра, отмечают характерные степени окисления: 0, +1; отмечая признаки проскокa электронов, о возможности проявления степеней окисления +2, +3.
Серебро известно человечеству с древнейших времен. Это связано с тем, что в свое время серебро, равно как золото, часто встречалось в самородном виде – его не приходилось выплавлять из руд. Это предопределило довольно сильное присутствие серебра в культурных традициях различных народов. В Ассирии и Вавилоне серебро считалось священным металлом и являлось символом Луны. В средние века серебро и его соединения были очень популярны среди алхимиков. На русском “серебро”, на немецком “зильбер”, на английском “сильвер” – эти слова восходят к древнеиндийскому слову “сарпа”, которым обозначили Луну и Серп – древнейшее орудие земледельца. Латынское слово “аргентум” означает “белое”. С середины 18 века серебро становится традиционным материалом для изготовления посуды. Кроме того, серебро и по сей день используется для чеканки монет.
- Определенная часть благородных и цветных металлов встречаются в природе в самородной форме. Известны и документально подтверждены факты нахождения не просто больших, а огромных самородков серебра. Так, например, в 1447г. на руднике “Святой Георгий” был обнаружен самородок серебра весом 20 т. Глыбу серебра размером 1х1х2,2 м выволокли из горной выработки, устроили на ней праздничный обед, а затем раскололи и взвесили. В Дании, в музее Копенгагена, находится самородок весом 254 кг, обнаруженный в 1666 г. на норвежском руднике Конгсберг.
- В настоящее время в здании парламента Канады хранится одна из добытых на месторождении Кобальт самородных пластин серебра, получившая за свои размеры название “серебряный тротуар”, она имела длину около 30 м и содержала 20 т серебра.
- Известны более 50 природных минералов серебра; в них серебро связано с серой, селеном, теллуром или галогенами, из которых важное промышленное значение имеют лишь 15-20, в том числе: самородное серебро; электрум (золото-серебро); кюстелит (серебро-золото); аргентит Ag2S (серебро-сера).
Серебро встречается в природе в самородном состоянии и в виде соединений. Серебро– редкий элемент; в земной коре его почти в тысячу раз меньше, чем меди и его содержание составляет 7х10 -6 весовых процента (золота в 20 раз меньше), по распространенности серебро на 67-месте среди элементов. Серебром богаты страны Центральной Европы ( Чехии, Германии, Австрии, Испании, Франции, Англии), Южной Америки (Перу, Чили, Мексики, Боливии), Канады.
4. Физические свойства серебра.
Учитель: Какова кристаллическая решетка серебра? Исходя из этого, назовите известные Вам физические свойства серебра, отмечая самые привлекательные из них.
Не стоит забывать и о “фамильном серебре”: ковкость, пластичность, бактерицидность делали посуду предметом роскоши. Это был символ достатка и респектабельности. В этом никто не мог переплюнуть графа Орлова, фаворита Екатерины Великой. Его респектабельность состояла из 3275 серебряных предметов, на изготовление которых более 2 тонн серебра.
5. Химические свойства серебра.
a. Взаимодействие с простыми веществами
Учитель: Какова химическая активность серебра по положению в электрохимическом ряду напряжения металлов?
Учитель: С какими простыми веществами реагирует серебро?
В работу включаются учащиеся из группы “химиков – теоретиков”.
На доске составляются левые части уравнений химических реакций; учащиеся в духе соревнования дописывают правую часть уравнений.
4Ag + O2—> 2Ag2O (при обычных условиях с кислородом реакция не идет)
Учитель: Что происходит с серебром во время грозы?
Учитель: Почему серебряные изделия чернеют на воздухе и на кожном покрове?
2Ag + S—> Ag2S (черный осадок)
Серебро также темнеет при продолжительном контакте с белком и кожей нездорового человека, отсюда и поверье о том, что серебро обладает даром предвидеть тяжелое заболевание своего хозяина. Чёрное вещество на серебре – это окись серебра и сульфид серебра в разных пропорциях.
Учитель: Почему при работе с галогенами нужно снимать серебряные изделия?
2Ag + Cl2—> 2AgCl (серебро хорошо реагирует с галогенами)
b. Взаимодействие со сложными веществами
Учитель: Возможно ли протекание следующих уравнений химических реакций:
Ответ: Серебро – благородный металл (находится в ряду напряжений металлов после водорода, с разбавленными растворами кислот, кроме HNO3, реакция не идет)
Учитель: Составьте уравнения следующих реакций (на доске представляется схема левой части уравнений):
Учитель: Возможно ли протекание следующих уравнений химических реакций:
Ag +CuSO4 —> (реакция не протекает, так как атом серебра в электрохимическом ряду напряжений металлов находится после атома меди).
Вывод: Серебро – малоактивный металл (электродный потенциал равен 0), восстановительные свойства выражены слабо.
c. Химические свойства соединений серебра со степенью окисления +1
1) Взаимодействие с неорганическими веществами
Учитель: Как из нитрата серебра можно получить оксид серебра (I)
Ag2 O – оксид серебра – твердое вещество темно–коричнего цвета. Проявляет амфотерные свойства
AgNO3 нитрат серебра (ляпис) – кристаллы белого цвета. Самая известная соль элемента №47. Обладает прижигающим и вяжущим действием. На коже оставляет след.
Учитель: Какие ионы можно определять с помощью раствора нитрата серебра AgNO3 ? (Приложение 1).
AgNO3 + NaГ —> Ag Г + NaNO3; Г=Cl, Г=Br, Г=J, .
Учащиеся составляют уравнения химических реакций качественного анализа в молекулярном ионном видах с указанием цвета осадков.
Группа химиков-экспериментаторов осуществляет качественный анализ, результаты исследований представляет вниманию класса.
Учитель: Какие изменения происходят с соединениями серебра со степенью окисления +1 при термическом разложении?
Разложение AgBr используется в фотоделе:
Учитель: В чем проявляются основные свойства ?
Учитель: Какие свойства имеют соединения Ag +1 с точки зрения ОВР?
Учитель: Соединения Ag +1 – комплексообразователи.
Соединения Ag +1 легко восстанавливаются до Ag 0 :
Но хлорид серебра не растворяется даже в концентрированной азотной кислоте.
2) Взаимодействие аммиачного раствора оксида серебра (I) с органическими веществами.
Учитель: Как можно качественно обнаружить концевую тройную связь у алкинов?
Ответ: Концевую тройную связь у алкинов можно обнаружить с помощью аммиачного раствора оксида серебра (I). При этом с ацетиленом образуется взрывчатое вещество ацетитиленида серебра (I) темно-серого цвета, применяемое в военном деле для взрывных работ.
Данная реакция не характерна для алкинов с положением тройной связи в других позициях: реакция не идет с бутином-2.
Учитель: Какие функциональные группы у кислородсодержащих органических соединений можно качественно обнаружить с помощью аммиачного раствора оксида серебра (I)?
Ответ: C помощью аммиачного раствора оксида серебра (I) определяется альдегидная группа у альдегидов, моносахаридов (глюкозы), дисахаридов: восстанавливающихся сахаров– лактозы и мальтозы. При этом идет реакция “серебряного зеркала” с выпадением блестящего зеркального налета (использовалась для производства зеркал), где является окислителем.
Учитель: В двух пробирках находятся растворы муравьиной и уксусной кислот. Как экспериментально можно обнаружить данные кислоты?
Ответ: Оба раствора кислот является бесцветными жидкостями со специфическим запахом, изменяют цвет лакмуса в красный, метилоранжа – розовый. Под действием соды – вскипают. Но у муравьиной кислоты в результате внутренней перегруппировки атомов имеется альдегидная группа. Поэтому единственной карбоновой кислоте характерна реакция “серебряного зеркала”.
6. Получение серебра (выступает группа “технологов”).
Поскольку месторождения серебра редки и выработаны, его получают из руд таких металлов, как медь и свинец, в которых всегда содержится примесь серебра:
1) Пирометаллургический способ получения серебра.
Серебро выделяют из неочищенного свинца. Сначала к свинцу добавляют жидкий цинк, который не смешивается со свинцом, но дает прочные интерметаллиды с серебром: Ag2Zn3, Ag2Zn5. В жидком свинце эти интерметаллиды не растворяются, а всплывают на поверхность (образуется серебристая поверхность). Ее снимают, удаляют Zn перегонкой, а свинец удаляют в виде оксида:
Далее серебро очищается электролитически.
2) Серебро получают в виде побочного продукта при переработке медных руд. При очистке электролизом “черновой меди” в электролит (раствор CuSO4) переходят примеси металлов, стоящих в ряду напряжений до меди, а в осадок (шлам) выпадает Ag, Au, платиновые металлы и т.д.– металлы, стоящие в ряду напряжений до меди.
7. Применение серебра.
Учитель: На основании изученных физико-химических свойств серебра и его соединений выделите наиболее важные отрасли применения серебра.
Серебро используется в качестве катализатора в фильтрах противогазов.
Ацетиленид серебра (карбид) изредка применяется как мощное инициирующее взрывчатое вещество (детонаторы).
Еще более эффективно действует слабый раствор комплексного соединения серебра с аммиаком, применяющийся в медицине под названием аммарген (производное от слов “аммиак” и “аргентум”). Нитраты серебра в виде раствора аммаргена широко применяются для промывания ран или слизистой оболочки при различных воспалительных состояниях, а также используются в изготовлении различных антибактериальных средств.
Физиологическое действие (выступает группа “врачей”).
Обычно серебро поступает с водой и пищей в ничтожно малых количествах– всего 7 микрограммов в сутки. И при этом такое явление, как дефицит серебра, пока нигде не описано.Серебро не относится к жизненно важным биоэлементам. Серебро – это тяжелый металл. Пить воду с ионами серебра не стоит. Серебро – клеточный яд. Постоянное употребление серебра даже в малых дозах может вызвать хроническое заболевание, связанное с повышенным содержанием серебра в организме – аргирию (аргентоз, аргироз). ПДК для серебра – 50 мкг/л. При длительном употреблении может возникать поражение почек, неврологические расстройства, нарушение пищеварения, головные боли и хроническая усталость. При попадании в организм больших доз растворимых солей серебра наступает острое отравление, сопровождающееся некрозом слизистой желудочно-кишечного тракта. Первая помощь при отравлении – промывание желудка раствором хлорида натрия, при этом образуется нерастворимый хлорид серебра, который и выводится из организма. Ион Ag + , попадая на тело, вызывает ожог.
Многих людей интересует серебро - химический элемент, который ассоциируется с роскошью, дорогими изделиями, уникальными технологиями в науке и технике. Этот элемент занимает особое место во всей таблице Менделеева, так как всегда, буквально во всей известной человечеству истории, он был материалом для изготовления монет, уникальных предметов быта и прочих ценных вещей. Серебряные монеты известны еще в самых древних цивилизациях, и они продолжают выпускаться в наше время.
Также материал играет важную роль в науке, медицине, промышленности, уникальных технологиях, где выставляются серьезные требования к чистоте используемых веществ. Многих людей интересует не столько химия серебра, как различные связанные с ним поверья, легенды и сказки. Это также занимает большой пласт общечеловеческой культуры и показывает важность рассматриваемого элемента для людей.
История металла
Такое вещество, как серебро, известно человечеству уже очень много тысячелетий, если не сотен тысяч лет. В самых древних мифах, сказаниях и повестях можно встретить упоминания о сделанных из него деньгах и предметах. Свое название материал получил от праславянского наречия, которое было распространено на территории нынешней России, Германии и балтийских стран.

Причина такой ранней известности вещества во многих культурах состоит в том, что в отличие от других металлов, которые добывают путем переплавки, руда рассматриваемого материала не требует этой процедуры. Очень часто серебро встречалось древним людям в виде уже готовых к обработке самородков. То есть, не нужны были никакие сложные технологии, чтобы просто брать его и активно использовать в своих целях.
Происхождение названия
Степень принадлежности слова к той или иной культуре установить очень сложно, если вообще возможно. Существует также и греческое слово, обозначающее серебро árgyros, откуда пошло латинское argentum, принятое международным сообществом в качестве основного названия в международной системе и таблице Менделеева.
Нахождение в природе
Если рассматривать состав земной коры, то в ней на серебра примерно 70 миллиграмм на 1 тонну. Это не так много. С древних времен серебреные монеты и предметы имели высокую ценность, что уже указывает на то, что материал является редким и ценным.

Сплавы материала встречаются реже, нежели чистая руда, но при нынешнем развитии технологий легко обрабатываются с целью выделения необходимой фракции.
Интересно отметить, что нередко копателям удавалось обнаружить не руду, а самородки, при этом огромного размера. Истории известен случай, когда был найдет самородок серебра на целых 20 тонн веса! Также находили и другие самородные объекты весом в 500-600 килограммов.
Крупнейшие месторождения серебра в мире
Распределение драгоценного ресурса по поверхности планеты крайне неравномерно. Наиболее интенсивно добыча материала происходит в Перу – это государство является безусловным лидером по количеству получаемого здесь серебра. В среднем, за один год в этой стране добывается около 110 миллионов унций вещества.

Польша является также одним из лидеров по добыче серебра, хотя мало кто догадывается об этом. Здесь добывается около 40,5 миллионов унций серебра.
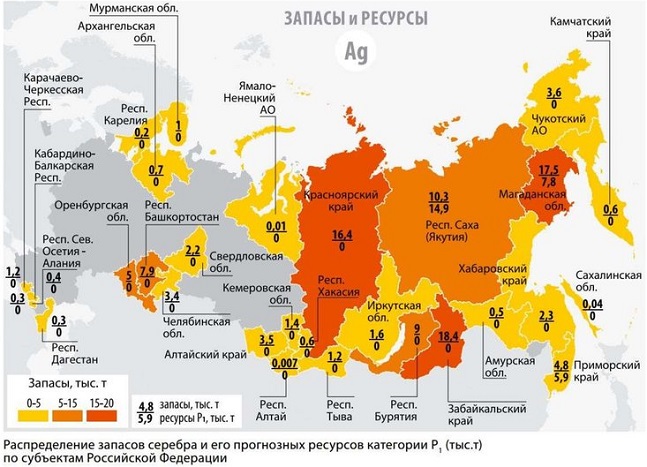
Россия и постсоветские страны имеют около 12-15% от мировых запасов серебра. Горнодобывающая промышленность здесь достаточно развита и дает тонны материала ежегодно. Австралия также входит в перечень счастливчиков, которым повезло с рассматриваемым ресурсом. В остальных частях мира серебра не так много, но всегда есть вероятность обнаружить его пока неизвестные месторождения.
Физические свойства
Масса вещества достаточно высока, что обуславливается тем, что его плотность равна целых 10,5 г/см³. Это больше, чем у другого популярного металла – меди, но меньше, нежели у известного каждому свинца.

Плавление серебра начинается при температуре 962°C, что является достаточно высоким значением. Именно поэтому металл считается тугоплавким и используется, к примеру, для пайки сложных соединений в качестве припоя.
В комнатных условиях вещество имеет высокий уровень электропроводности, также отличается высокой теплопроводностью. Оксид, хлорид, сульфид, гидроксид серебра активно используются в научной деятельности и промышленности для решения целого спектра задач.
Химические свойства
Максимальная валентность рассматриваемого металла составляет 1, так как она соответствует номеру группы, где он находится в таблице Менделеева. Ионы серебра слабо реагируют на другие элементы, включая даже серную и соляную кислоту.

Молярная масса равна 107,8 а.е.м. (вес атома такой же), цвет тонкой фольги с чистого материала напоминает фиолетовый, если же берется самородок, то он ярко-светлый, серебристый.
Окисление вещества происходит крайне слабо и только в специальных условиях. Для этого приходится использовать плазменные технологии, озон или обработку ультрафиолетовым излучением. Электронная конфигурация серебра выглядит так: 4d^10 5s^1. Кристаллическая решетка – кубическая, а если быть более точным - кубическая гранецентрированная.
Сфера применения серебра
Существует масса применений рассматриваемого материала, благодаря чему он и имеет столь высокую стоимость и авторитет среди самых широких масс людей.

Вот основные случаи его использования:
Техническое применение в науке и промышленности. Надежные контакты для электрического соединения обрабатываются серебром. Так как материал плавится при очень высокой температуре, почти 1000 градусов, то его применяют везде, где важно выдерживать высокотемпературную среду.
Удельный вес вещества позволяет использовать его в составе различных припоев, к примеру, большой популярностью пользуется медно-серебряный припой.
Используется среди драгоценных металлов в области создания ювелирных изделий.
Также металл применяется для создания высококачественных зеркал с повышенной отражающей способностью, в СВЧ-электротехнике.
Серебро известно своими дезинфицирующими свойствами, поэтому используется для очищения воды от микробов.
В химии существует не одна формула применения серебра для науки, химической промышленности и массы других задач. С его помощью проводятся всевозможные пробы, делаются качественные сварные швы, создается сложная электроника.
Заключение
Argentum – известнейший во всем мире химический элемент, который активно используется в огромном количестве случаев. Значение серебра для современной цивилизации сложно переоценить – во многих сферах деятельности оно буквально незаменимо.
Получение металла из земной породы в наше время поставлено на крупный поток, поэтому человечество получает тонны драгоценного материала для своих нужд ежегодно.
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.


- MnO2 - пиролюзит
- MnO(OH) - бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 - браунит

Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + C = (t) Mn + CO
-
Реакции с неметаллами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.

При нагревании марганец вытесняет водород из воды.
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.

Соединения марганца (II)
Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо восстановлением оксида марганца (IV) до оксида марганца (II).
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II).
Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV).
Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие соли.

Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если выпадает осадок, выделяется газ или образуется слабый электролит.
При действии сильных окислителей ион Mn 2+ способен переходить в ион Mn 7+
Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II).

В реакциях с щелочами марганец переходит в СО +6, в кислой среде - принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2 (гидролиз карбоната натрия идет по аниону, среда - щелочная)

Соединения марганца (VI) - MnO3, H2MnO4 - неустойчивы, в свободном виде не получены. Обладают кислотными свойствами. Наиболее устойчивые соли - манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.

Соединения марганца (VII) - неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 - проявляют кислотные свойства. Соли марганцовой кислоты - перманганаты.
В различных средах - кислотной, нейтральной и щелочной - марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
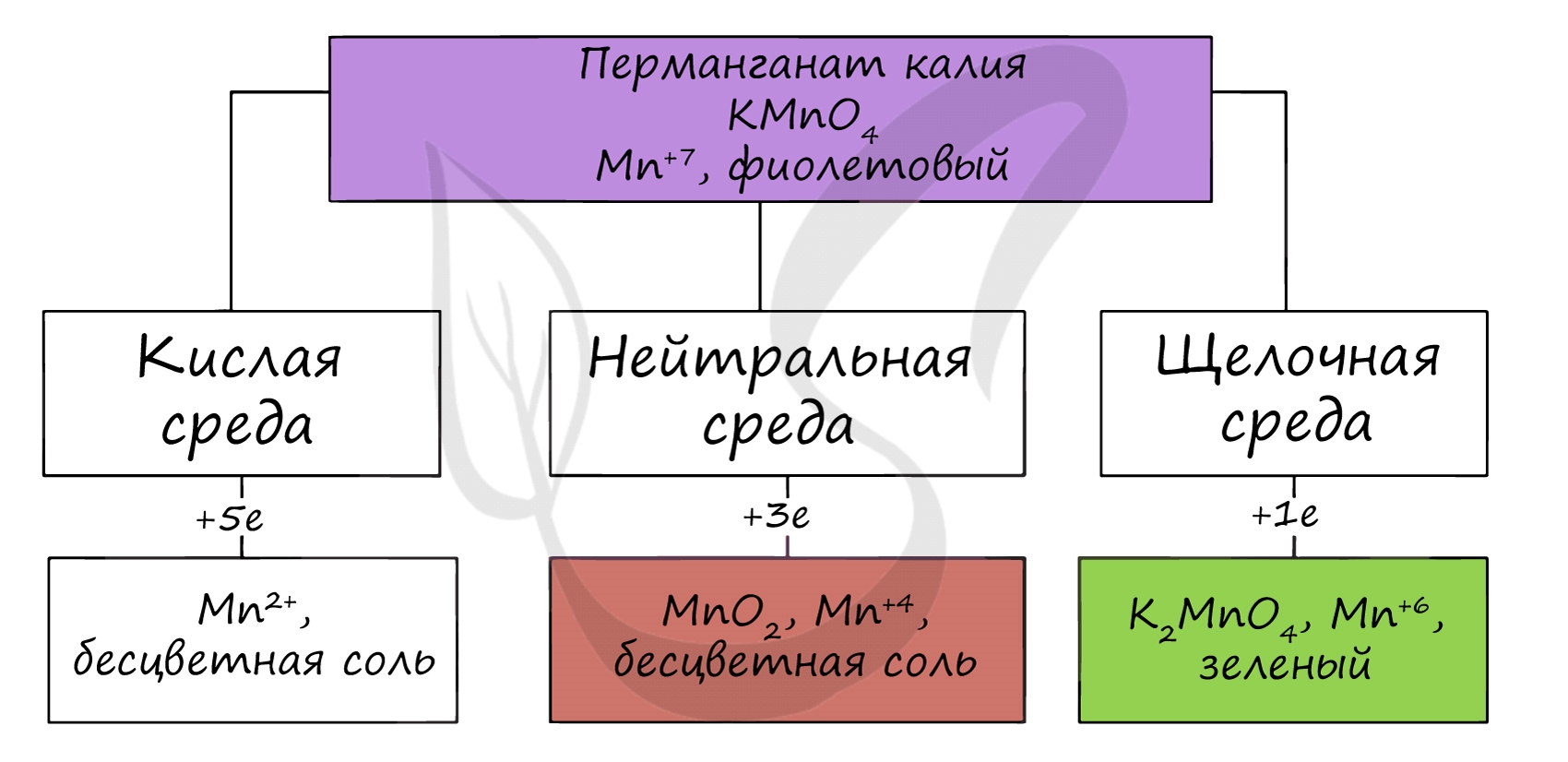
Оксид марганца (VII) получают в реакции перманганата с сильными кислотами.
При растворении оксида марганца (VII) (кислотного оксида) в щелочи образуются соли марганцовой кислоты - перманганаты.
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II).
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
При нагревании перманганата калия (в быту - марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.

При стоянии в растворе постепенно разлагается водой.
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) - Mn 2+ , в щелочной - Mn 6+ .
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke - зубец. С древнейших времен известен сплав меди с цинком - латунь.

Для цинка характерна постоянная степень окисления +2.

- ZnS - цинковая обманка, сфалерит
- ZnO - цинкит
- ZnCO3 - симсонит, цинковый шпат
- 2ZnO*SiO2*H2O - гемиморфит

Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка различными восстановителями: чаще всего C, также возможно CO и H2.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2

Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
-
Реакции с неметаллами (и аммиаком :)
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.

Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
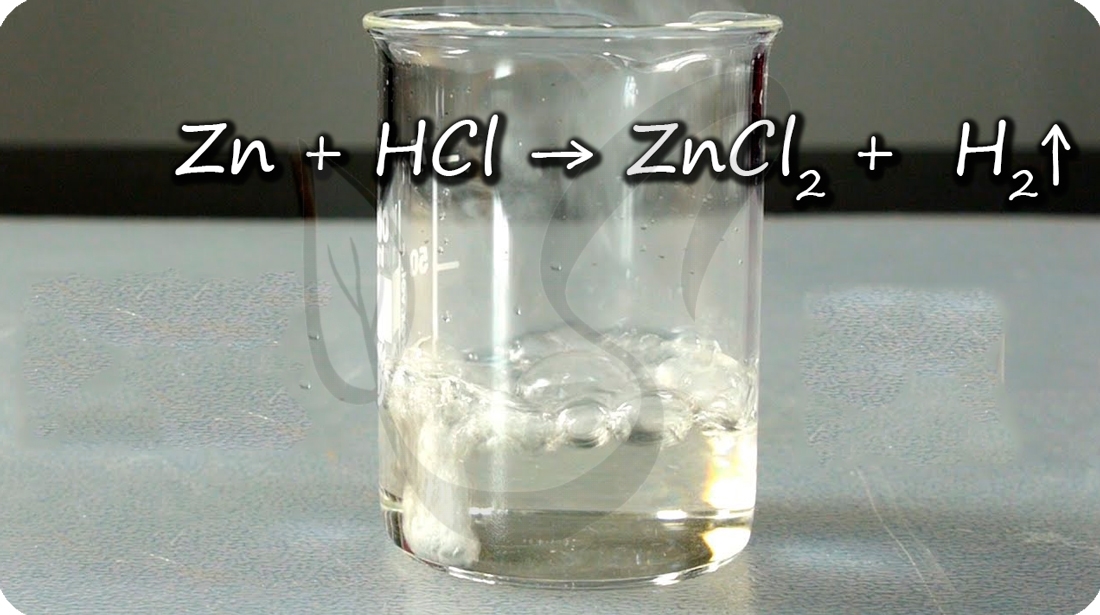
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями. При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка (II)
Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или при разложении нитрата цинка.
Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2
Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами.

Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
При прокаливании комплексные соли распадаются, вода испаряется.
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом, серебро обладает низкой реакционной способностью.

-
Реакции с неметаллами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов. При нагревании с серой получается сульфид серебра.
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.

В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра - аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:

