План конспект урока углерод
Обновлено: 07.07.2024
Цель урока : формирование системы знаний об углероде как элементе, и как о простом веществе.
Задачи урока:
- познакомить с явлением адсорбции и его практическим применением;
- познакомиться с химическими свойствами углерода;
- охарактеризовать его биологическое значение.
Планируемые результаты обучения:
Личностные УУД . Развитие умений давать оценку и самооценку .
Регулятивные УУД . Вырабатывать умение извлекать, преобразовывать, анализировать информацию, представленную в различных формах .
Познавательные УУД . Освоение таких способов деятельности, как умение наблюдать и делать выводы, объяснять наблюдения .
Коммуникативные УУД . Вырабатывать умение извлекать, преобразовывать, анализировать информацию, представленную в различных формах .
Деятельность учителя
Деятельность учащихся
Планируемые результаты УУД
Формы организации взаимодействия на уроке
Оценка результатов деятельности ученика
Организационный. Самоопределение к деятельности.
Приветствует, проверяет готовность к уроку, желает успеха.
Включение в деловой ритм
Ученики настраиваются на работу, проверяют на столах наличие учебника, тетрадей, письменных принадлежностей
Личностные УУД : умение соблюдать дисциплину на уроке, уважительно относиться к учителю и одноклассникам.
Регулятивные УУД: умение организовать выполнение заданий учителя
Устная оценка учителя
Актуализация темы урока.
Угадывая название элемента, учащиеся называют тему урока.
Личностные УУД : умение соблюдать дисциплину на уроке, уважительно относиться к учителю и одноклассникам.
Регулятивные УУД: умение организовать выполнение заданий учителя
Коммуникативные УУД: умение воспринимать информацию на слух, отвечать на вопросы учителя
Устная оценка учителя
Постановка учебной задачи
Конкретизирует цель и задачи урока
Называют цели урока. Воспринимают информацию
Регулятивные УУД: самостоятельное формулирование цели и задач, планирование, прогнозирование
Устная оценка учителя
Освоение темы урока
1. Физические свойства углерода
Задаёт вопросы: о каких веществах говорится в загадке? (Уголь, алмаз, графит). Как они связаны с углеродом? (Являются аллотропными модификациями углерода).
Предлагает дать определение понятию: аллотропия.
Раздаёт на пару учащихся карточки с текстами об аллотропных модификациях углерода. (см. Приложение 1).
Задаёт вопрос: с какой целью используют активированный уголь в медицине?
Предлагает дать определения понятиям: адсорбция, адсорбент.
Задаёт вопрос: где ещё используют это свойство? (Противогазы, фильтры).
2. Химические свойства
Делит учащихся на 2 группы, раздаёт карточки с заданием (см. Приложение 2).
3. Биологическая роль углерода
Раскрывает роль углерода в природе.
1.Отвечаю на вопросы. Дают определение понятиям и записывают в тетрадь. По карточкам дают характеристику аллотропным модификациям. Обсуждают ход опыта.
2. Делятся на группы.
Выполняют задания, изучаю химические свойства углерода.
3. Отвечают на вопросы.
Наблюдают за опытом. Записывают уравнение химической реакции.
Личностные УУД : умение соблюдать дисциплину на уроке, уважительно относиться к учителю и одноклассникам.
Регулятивные УУД : умение организовать выполнение заданий учителя, делать выводы по результатам работы.
Коммуникативные УУД: умение воспринимать информацию на слух, отвечать на вопросы учителя, умение работать в группах.
Познавательные УУД: умение структурировать учебный материал, выделять в нем главное, использовать источники.
1.Устная оценка, самооценка
Этап 5. Подведение итогов урока. Рефлексия.
Предлагает подвести итог урока – представляет вниманию учащихся кроссенс (пересечение смыслов), который представляет собой таблицу с картинками. В центре таблицы находится то, о чём будет идти речь. Учащимся необходимо найти логическую связь между картинками (см. Приложение 3).
Предлагает провести самооценку работы за урок и подсчитать полученные баллы
Предлагает ответить на вопросы, чтобы оценить свою работу и настроение на уроке.
Обобщают изученный материал, выполняют задание
Проводят самооценку и ставят заработанные баллы в листок самоконтроля
Оценивают свою работу и настроение.
Личностные УУД: самооценка на основе успешности, адекватное понимание причин успеха/неуспеха в учебной деятельности
Коммуникативные УУД : умение выражать свои мысли
Познавательные УУД: рефлексия. Контроль и оценка процесса и результатов деятельности
Алмаз — прозрачное кристаллическое вещество, самое твёрдое из всех природных веществ. Он служит эталоном твёрдости, которая по десяти бальной системе оценивается высшим баллом 10. Такая твёрдость алмаза обусловлена особой структурой его атомной кристаллической решётки. Она имеет форму тетраэдра, где все связи между атомами углерода одинаково прочные. Благодаря высокой прочности алмазы применяются для изготовления наконечников для буров, с помощью которых ищут нефть, из алмазов делают свёрла, шлифовальные инструменты, стеклорезы. Кристаллы алмаза обычно бесцветные, но бывают синего, голубого, красного и чёрного цветов. Они имеют очень сильный блеск благодаря высокой светопреломляющей и светоотражающей способности - люминесценция. Обработанные, специально огранённые алмазы — это дорогие украшения — бриллианты.
Крупнейшие месторождения алмазов находятся в Южной Африке, а в России их добывают в Якутии.
Аморфный углерод
В жизни часто приходится иметь дело с аморфным углеродом в виде сажи, кокса и угля. Это состояние углерода с неупорядоченной структурой. В природе не встречается. Его получают искусственно из различных соединений, содержащих углерод. Сажу получают преимущественно при разложении метана. Она используется для изготовлении типографской краски, косметической туши, картриджей. Добавка сажи к резине при производстве автопокрышек повышает их прочность и увеличивает срок службы. Кокс представляет собой в основном свободный углерод, он получается при нагревании каменного угля без доступа воздуха. Кокс применяется в доменных печах при выплавке чугуна из руд. Древесный уголь получается при нагревании без доступа воздуха древесины. Он применяется в качестве топлива в кузнечных горнах, жаровнях, самоварах, используется в металлургии при выплавке некоторых цветных металлов и особо чистых сортов чугуна, т. к. не содержит вредных примесей, имеющихся в коксе. Специальные сорта угля используют в качестве адсорбентов — поглотителей газов и растворённых веществ.
Класс: 9.
Автор УМК: Габриелян О.С.
Тип урока: урок изучения нового материала.
Вид урока: смешанный
Цель урока. Обеспечить усвоение учащимися на уровне восприятия, осмысления и первичного запоминания знаний состава, строения, свойств и применения углерода; закрепить знания обучающихся об аллотропии. Формирование базовых компетентностей современного человека: учебно-познавательной, информационной, коммуникативной, личностного совершенствования.
Задачи урока:
- Образовательные: повторить строение атома и аллотропию на примере углерода. Рассмотреть строение, сравнение свойств и применение алмаза и графита. Познакомить учащихся с явлением адсорбции и его практическом значении. Изучить химические свойства углерода. Рассмотреть круговорот углерода в природе.
- Развивающие: развивать у учащихся умения сравнивать и анализировать теоретические сведения, применять их на практике, делать выводы; развивать логическое мышление.
- Воспитательные: формировать естественно - научное мировоззрение; информационную культуру; чувство патриотизма на примере научной деятельности русских ученых – химиков (Ловиц Т.Е., Зелинского Н.Д.); бережного отношения к природным ресурсам.
Оборудование и реактивы. Периодическая таблица химических элементов Д.И.Менделеева. Модели кристаллических решеток алмаза и графита, иллюстрации с картин В. Боровиковского и фотографии сокровищ Алмазного фонда, образцы изделий из графита (карандаши, электроды и др.) и сажи (тушь, краски, резина и др.), древесный уголь, таблетки карболена, растворы чернил, вишневого компота, сока свеклы; одеколон. Стеклянная трубка диаметром 1,5–2 см (или пробирка с дырявым дном), штатив, вата, речной песок, стакан, колба, прибор для восстановления меди из оксида меди, противогаз, кукурузные палочки, пипетка.
Межпредметные и внутрипредметные связи.
Межпредметная связь с предметами: искусство, география, физика, биология, экология, ОБЖ, геометрия.
- химия 8 класс – строение атома, химические связи, способы очистки веществ, аллотропия, кристаллические решетки, окислительно-восстановительные свойства;
- химия 9 класс – получение и химическое свойства металлов, химические элементы в клетках живых организмов;
- химия 10 класс – строение атома углерода, получение метана, природные источники углеводородов;
- химия 11 класс – валентные возможности атомов химических элементов, неметаллы.
Ход урока
I. Организационный момент
Приветствие. Проверка готовности учащихся к учебным занятиям.
II. Актуализация знаний
Учитель выразительно читает стихотворение:
Из меня состоит все живое,
Я – графит, антрацит и алмаз,
Я на улице, в школе и в поле,
Я в деревьях и в каждом из вас.
Учитель: о каком химическом элементе идет речь в этом стихотворении?
Угадывая название элемента, учащиеся называют тему урока и вместе с учителем формулируют его цель.
- Изучить строение атома углерода, опираясь на положение в таблице Менделеева;
- Рассмотреть аллотропные модификации углерода;
- Изучить химические свойства углерода и познакомиться с его применением.
III. Изучение нового материала
1. Строение и свойства атомов
Учитель: охарактеризуйте строение атома углерода на основании его положения в Периодической системе химических элементов, ответив на вопросы и используя материал электронного учебника:
- Каков химический знак углерода?
- Положение в периодической системе Д.И.Менделеева (номер периода и его вид, номер группы и тип подгруппы, номер элемента).
- Каков заряд ядра?
- Какова атомная масса?
- Сколько протонов в ядре атома?
- Сколько нейтронов в ядре атома?
- Сколько электронов в атоме углерода?
- Электронная формула атома.
- Чему равна высшая степень окисления?
- Чему равна низшая степень окисления?
- Какие свойства будет проявлять углерод, вступая в химическое взаимодействие?
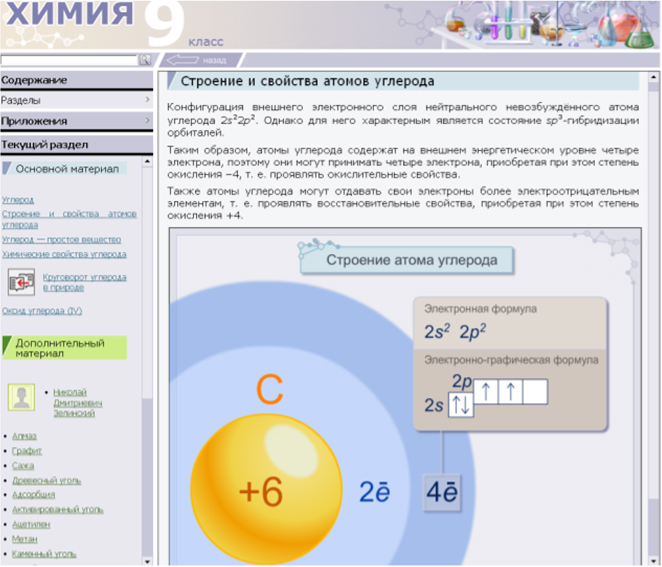
Учащиеся характеризуют положение углерода в ПСХЭ,
определяют его порядковый номер и составляют электронную формулу атома, делают соответствующую запись в тетради:
- химический знак – С
- второй период малый, IV группа, главная подгруппа, номер элемента – 6
- заряд ядра +6
- Ar(C) = 12
- 6 протонов
- 6 нейтронов
- 6 электронов
- +6С 2 e 4 e
- высшая степень окисления +4
- низшая степень окисления –4
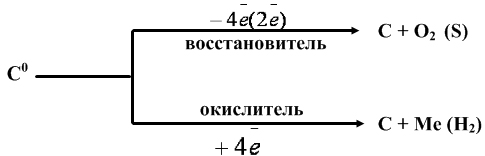
Исходя из строения атома, прогнозируют окислительно-восстановительные свойства углерода:
2. Аллотропия
Учитель: Почему углерод – это графит, антрацит и алмаз?
Учащиеся: Углерод образует несколько простых веществ.
Учитель: Как называется такое явление?
Учащиеся: аллотропия – способность атомов одного химического элемента образовывать несколько простых веществ. Эти простые вещества называются – аллотропными видоизменениями или модификациями.
Учитель: каковы причины аллотропии углерода?
Учащиеся: различное строение кристаллических решеток.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Тема: Углерод – химический элемент. Строение атома, элекроотрицательность и степени окисления. Углерод – простое вещество. Аллотропные модификации (алмаз, графит) и их свойства. Химические свойства: горение, восстановление оксидов металлов, взаимодействие с металлами и водородом . Лабораторный опыт № 11. Адсорбционные свойства угля.
Образовательная: дать уч-ся представление о положении подгруппы углерода в ПСХЭ, особенностях строения атомов элементов этой подгруппы, возможных степенях окисления углерода, его аллотропных модификациях и их свойствах. Дать представление о химических свойствах углерода: горении, восстановлении оксидов Ме, взаимодействии с Ме и водородом.
Развивающая: на примере аллотропных модификаций углерода показать уч-ся многообразие природных соединений и зависимость их свойств от строения.
Воспитательная: продолжить развитие навыков у уч-ся самостоятельной работы с учебником, раздаточным материалом, умения делать выводы из полученной информации.
Тип урока: лекция + элементы самостоятельной работы.
Ход урока: I . Организация класса.
II . Повторение:
Индивидуальные задания.
Закончить уравнения реакций, назвать продукты реакций:
Составить уравнения реакций по схеме:
Новый материал.
Углерод - химический элемент:
положение подгруппы углерода в ПСХЭ (уч-ся дают сами)
Элементы IVA-группы.
Радиус атома растёт
Металличес-кие свойства усиливаются
строение атома углерода (отвечает уч-ся кат. А)
возможные степени окисления углерода (рассказ учителя).
Углерод может проявлять ст. ок -4 , +2 , +4. Все соединения углерода делятся на 2 особые группы: органические и неорганические. Орг соединения все без исключения содержат углерод (их более 12 млн в-в)
2. Углерод - простое вещество. Имеет несколько аллотропных модификаций: алмаз, графит, карбин, фуллерен. (СД «Наглядная химия. Неметаллы)
Алмаз – кристаллическое вещество, прозрачное, сильно преломляет лучи света, очень твёрдое, не проводит электрический ток, плохо проводит тепло. Каждый атом углерода находится в состоянии sp 3 -гибридизации.
Алмаз.
Графит.
Графит – наиболее устойчивая при комнатной температуре аллотропная модификация углерода. Самое тугоплавкое простое вещество на Земле t плав. = 3500 0 С
Алмаз и графит взаимопревращаемы: Алмаз –1000 0 С, б/возд. Графит
Графит -- 1600 0 С, 10 4 МПа Алмаз
Карбин – мелкокристаллический порошок серого цвета, полупроводник. Его кристаллы состоят из линейных цепочек углеродных атомов, соединенных чередующимися тройными и одинарными связями, или двойными связями, углерод находится в состоянии sp -гибридизации: -С≡С-С≡С-С≡С-С≡С-
По твердости карбин превосходит графит, но значительно уступает алмазу.
Фуллерен - искусственно полученная модификация углерода, состоящая из молекул C 60, C 70, …. C 1020. Эти молекулы составлены из атомов углерода, объединенных в пяти и шести угольники с общими ребрами. Это черные вещества с металлическим блеском, обладающие свойствами полупроводников. При давлении порядка 2·10 5 атм и комнатной температуре фуллерен превращается в алмаз.
Уголь : древесный уголь, активированный уголь, каменный уголь, кокс и их применение и образование.
Пиролиз древесины – разложение при нагревании без доступа воздуха с образованием продуктов: древ уголь, орг кислоты, метанол, метан, вода, орг смолы.
Адсорбция и десорбция.
Лабораторный опыт№ 11. Адсорбционные свойства угля
Работа по плану учебника стр. 151.
Как восстановитель. Взаимодействие с фтором: углерод обладает низкой реакционной способностью, из галогенов реагирует только с фтором.
Как восстановитель. Взаимодействие с кислородом:
2С + О2(недост) = 2СО (угарный газ),
Как окислитель. Взаимодействие с другими неметаллами: не взаимодействует с азотом и фосфором.
C + N 2 не идёт
C + 2 H 2– t , Ni à CH 4 C + P не идёт
Взаимодействие с водой: при пропускании водяных паров через раскаленный уголь образуется оксид углерода (II) и водород:
C + H 2 O ( пар ) = t = CO + H 2 .
Восстановительные свойства: углерод способен восстанавливать многие металлы из их оксидов:
2ZnO + C –t à 2Zn + CO
4 С + Fe 3 O 4 – t à 3Fe + 4CO
C + 2CuO = 2Cu + CO2
Концентрированные серная и азотная кислоты при нагревании окисляют углерод до оксида углерода (IV):
Карбиды- это соединения углерода с металлами.
Ионные, или солеобразные
Имеют прочные ковалентные связи в атомной решетке, поэтому очень стабильны и химически инертны.
Цель урока: рассмотреть строение и свойства аллотропных модификаций углерода.
- 1. Познакомить со строением аллотропных модификаций углерода, физическими и химическими свойствами.
- 2. Развивать память, мышление, познавательный интерес.
- 3. Формировать научное мировоззрение, пробуждать интерес к изучению химии.
- Организационный момент.
- Актуализация знаний.
- Изучение нового материала.
- Строение атома углерода.
- Аллотропные модификации углерода.
- Химические свойства углерода.
- Применение углерода.
I. Организационный момент.
II. Актуализация знаний.
III. Изучение нового материала.
Человек познакомился с углеродом даже раньше, чем научился добывать огонь, встречаясь со сгоревшими от удара молнии лесами. Когда же человек овладел искусством добывания огня, углерод стал его постоянным спутником.
Первым, кто показал, что углерод есть простое вещество, был Лавуазье, который исследовал процесс сжигания угля. Он же доказал, что алмаз и графит – аллотропные модификации углерода.
В 1819 г. Гитон де Морво перевёл алмаз в графит, а затем и в углекислый газ путем осторожного нагревания. Но обратный перевод графита в алмаз оказался не под силу науке того времени. Только в 1955 г. группе английских ученых удалось получить первые в мире искусственные алмазы. Синтез проводили при температуре 3000°С.
1. Строение атома.
Учащиеся разбирают строение атома углерода, записывают электронную формулу, прогнозируют возможные степени окисления углерода.
2. Аллотропные модификации углерода.
Для углерода характерно несколько аллотропных модификаций: алмаз, графит, уголь.
а) Алмаз – это прозрачное, твердое кристаллическое вещество. Имеет очень сильный блеск, является изолятором, при нагревании до 1000° С переходит в графит. Алмаз имеет тетраэдрическую кристаллическую решетку, в которой все атомы расположены друг от друга на одинаковом расстоянии, и каждый из них образует прочные связи с соседними атомами, что объясняет высокую твердость алмаза.
Искусственно ограненные алмазы называются бриллиантами и являются предметом роскоши.
б) Графит – это темно-серое, жирное на ощупь кристаллическое вещество с металлическим блеском, имеет сложную структуру, т. к. кристаллическая решетка графита состоит из бесконечных плоских параллельных слоев, слои связаны между собой сравнительно слабо и легко отделяются друг от друга. Этим и объясняется малая механическая прочность графита. Он проводит тепло и электрический ток, очень тугоплавкий, при температуре 1200°С его можно перевести в алмаз.
в) Древесный уголь получается при нагревании без доступа воздуха древесины. Очень важным свойством угля является адсорбция.
Адсорбция – это способность поглощать различные вещества (газы, запахи, растворенные в воде краски).
3. Химические свойства.
При комнатной температуре углерод инертен. Реакционная способность усиливается при повышении температуры.
1) Взаимодействие с кислородом:
С + О2 = СО2.2) Взаимодействие с водородом при высоких температурах (600-1000°С):
С + 2Н2 = СН4 (метан).3) Восстановление металлов из их оксидов:
С + 2СuO = 2Cu + CO2.4) Взаимодействие с металлами:
3С + 4 Al = Al4C3 (карбид алюминия).5) Взаимодействие с концентрированными кислотами:
С + 2H2SO4 = 2SO2 ↑ + CO2 ↑ + 2H2O.4. Применение.
Углерод используют в качестве адсорбента, в производстве синтетического бензина, при получении резины, для получения искусственных алмазов, в медицине, углерод является составной частью крема для обуви.
Читайте также:

