Оксиды и ангидриды карбоновых кислот конспект кратко
Обновлено: 05.07.2024
2.2. Реакции нуклеофильного замещения.
Функциональные производные карбоновых кислот.
2.3. Реакции по a -углеродному атому.
2.6. Дикарбоновые кислоты.
КАРБОНОВЫЕ КИСЛОТЫ
1. Методы получения.
2. Химические свойства.
2.1. Кислотные свойства.
2.2. Реакции нуклеофильного замещения.
Функциональные производные карбоновых кислот.
2.3. Реакции по a -углеродному атому.
2.6. Дикарбоновые кислоты.
1. Методы получения
- Замещение водорода группы COОН под
действием оснований (кислотные свойства). - Взаимодействие с нуклеофильными реагентами
по карбонильному атому углерода (образование функциональных производных и
восстановление) - Реакции по a -углеродному атому
(галогенирование) - Декабоксилирование
- Из карбоновых кислот и спиртов (реакция этерификации).
- Из хлорангидридов или ангидридов и
спиртов.
RCOX + R OH ® RCOOR + HX
X=Cl, OCOR - Переэтерификация.
- Из солей карбоновых кислот и
алкилгалогенидов. - Внутренняя этерификация g - и d -оксикарбоновых кислот.
- Взаимодействие с магний- и литий-органическими соединениями.
-
Окисление первичных спиртов и альдегидов.
Окислители: KmnO 4 в кислой или нейтральной среде, K 2 Cr 2 O 7 в кислой среде.
В качестве окислителей используют
KMnO 4, Na2Cr2O7 , кислород в присутствии солей Co и Mn.
RC є N + H2O + NaOH ® RCOONa + NH3
2. Химические
свойства
Карбоновые кислоты содержат карбоксильную группу , в которой непосредственно связаны между
собой карбонильная группа и гидроксил. Их взаимное влияние обуславливает новый
комплекс свойств, отличных от свойств карбонильных соединений и
гидроксилпроизводных. Реакции с участием карбоновых кислот протекают по
следующим основным направлениям.
2.1. Кислотные
свойства
Карбоновые кислоты – одни из самых сильных органических кислот. Их водные
растворы имеют кислую реакцию.
Причины высокой кислотности карбоновых кислот и
ее зависимость от природы заместителей в углеводородном радикале были
рассмотрены ранее (см. лек. №4).
Карбоновые кислоты образуют соли при
взаимодействии с активными металлами и большинством оснований.
При взаимодействии с сильными неорганическими
кислотами карбоновые кислоты могут проявлять основные свойства, присоединяя
протон по карбонильному атому кислорода.
Протонирование карбоновых кислот используется
для активации карбоксильной группы в реакциях нуклеофильного замещения.
За счет присутствия в молекуле одновременно
кислотного и основного центров карбоновые кислоты образуют межмолекулярные
водородные связи и существуют в основном в виде димеров (см. лек. №2).
2.2. Реакции нуклеофильного замещения.
Функциональные производные карбоновых кислот.
Основной тип реакций карбоновых кислот –
взаимодействие с нуклеофилами с образованием функциональных производных.
Взаимопревращения, связывающие карбоновые кислоты и их функциональные
производные, приведены на схеме.
Представленные на схеме соединения содержат
ацильную группу В ходе
их взаимопревращений она в неизменном виде переходит из одного соединения в
другое, соединяясь с нуклеофилом. Такие процессы называют ацилированием,
а карбоновые кислоты и их функциональные производные – ацилирующими
реагентами. В общем виде процесс ацилирования может быть представлен
следующей схемой.
Таким образом, ацилирование представляет собой
процесс нуклеофильного замещения у карбонильного атома углерода.
Рассмотрим механизм реакции в общем виде и
сравним его с Ad N -реакциями
альдегидов и кетонов. Как и в случае карбонильных соединений, реакция начинается
с атаки нуклеофила по карбонильному атому углерода, несущему эффективный
положительный заряд. При этом разрывается p -связь углерод-кислород и образуется тетраэдрический
интермедиат. Пути дальнейшего превращения интермедиата у карбонильных и
ацильных соединений различны. Если карбонильные соединения дают продукт присоединения, то ацильные соединения отщепляют группу X и дают продукт замещения.
Причина разного поведения ацильных и
карбонильных соединений – в разной стабильности потенциальной уходящей группы X.
В случае альдегидов и кетонов это — гидрид-анион Н — или карбоанион R — , которые вследствие своей высокой основности являются
чрезвычайно плохими уходящими группами. В случае ацильных соединений Х
значительно более стабильная уходящая группа (Cl — ,
RCOO — , RO — , NH2 — ), что делает возможным ее отщепление в виде аниона
Х — или сопряженной кислоты
НХ.
Реакционная способность по отношению к
нуклеофилам у карбоновых кислот и их функциональных производных меньше, чем у
альдегидов и кетонов, так как эффективный положительный заряд на карбонильном
атоме углерода у них ниже за счет + М- эффекта группы Х.
Активность ацильной группы повышается в условиях
кислотного катализа, так как при протонировании возрастает эффективный
положительный заряд на атоме углерода и облегчается его атака
нуклеофилом.
По ацилирующей способности производные
карбоновых кислот располагаются в следующий ряд в соответствии с уменьшением
+М-эффекта группы Х.
В этом ряду предыдующие члены могут быть получены из
последующих ацилированием соответствующего нуклеофила. Процесс получение более
активных ацилирующих реагентов из менее активных практически не идет из-за
неблагоприятного положения равновесия вследствие более высокой основности
уходящей группы по сравнению с атакующим нуклеофилом. Все функциональные
производные могут быть получены непосредственно из кислот и превращаются в них
при гидролизе.
Хлорангидриды и ангидриды
Методы получения
Хлорангидриды получают взаимодействием
карбоновых кислот с галогенидами фосфора и серы.
RCOOH + SOCl2 ® RCOOCl + SO2 +
HCl
RCOOH + PCl5 ® RCOOH + POCl3 +
HCl
Ангидриды образуются из карбоновых кислот под
действием оксида фосфора (V).
Cмешанные ангидриды могут быть получены
ацилированием солей карбоновых кислот хлорангидридами.
Реакции нуклеофильного замещения в
хлорангидридах и ангидридах.
Хлорангидриды и ангидриды — наиболее реакционноспособные производные
карбоновых кислот. Их реакции с нуклеофилами протекают в мягких условиях, без
катализатора и практически необратимо.
При использовании смешанных ангидридов с
нуклеофилом соединяется остаток более слабой кислоты, а анион более сильной
кислоты играет роль уходящей группы.
В
биохимических реакциях ацилирования важную роль играют смешанные ангидриды
карбоновых кислот и фосфорной кислоты – ацилфосфаты и замещенные ацилфосфаты. С
нуклеофилом соединяется остаток органической кислот, а ацилфосфат-анион
выполняет роль хорошей уходящей группы.
Сложные эфиры
Методы получения
RCOO — Na + + R Cl ® RCOOR + NaCl Важнейшим методом получения сложных эфиров является реакция этерификации. Реакция протекает как нуклеофильное замещение в
карбоксильной группе.
Карбоновые кислоты являются слабыми ацилирующими
реагентами из-за значительного +М-эффекта группы ОН. Использование сильных
нуклеофилов, которые одновременно являются и сильными основаниями (например,
основной катализ), в данном случае невозможно, так как они переводят карбоновые
кислоты в еще менее реакционноспособные соли карбоновых кислот. Реакцию проводят
в условиях кислотного катализа. Роль кислотного катализатора состоит, как уже
говорилось, в увеличении эффективного положительного заряда на атоме углерода
карбоксильной группы, и, кроме того, протонирование ОН группы на стадии
отщепления превращает ее в хорошую уходящую группу – Н 2 О.
Все стадии реакции этерификации
обратимы. Для смешения равновесия в сторону процесса этерификации используют
избыток одного из реагентов или удаление продуктов из сферы реакции.
Реакции нуклеофильного замещения в
алкоксикарбонильной группе.
Сложные эфиры – более слабые ацилирующие
реагенты, чем ангидриды и хлорангидриды. S N -реакции в алкоксикарбонильной группе протекают в более
жестких условиях и требуют кислотного или основного катализа. Важнейшими
реакциями этого типа являются гидролиз, аминолиз и
переэтерификация .
Сложные эфиры гидролизуются с образованием карбоновых кислот под действием
кислот или щелочей.
Кислотный гидролиз сложных эфиров – это реакция обратная этерификации.
Механизм кислотного гидролиза включает те же стадии, что
и процесс этерификации, но в обратной последовательности.
Щелочной гидролиз сложных эфиров требует
эквимолярных количеств щелочи и протекает необратимо.
RCOOR + NaOH ® RCOO — Na + + R OH
Суть щелочного катализа состоит в использовании
вместо слабого нуклеофила — воды, более сильного нуклеофила –
гидроксид-иона.
Необратимость процесса
обеспечивается низкой реакционной способностью по отношению к нуклеофилам
продукта гидролиза – карбоксилат-аниона.
В реакции переэтерификации роль нуклеофила
выполняет молекула спирта. Процесс катализируется кислотами или
основаниями.
Механизм реакции аналогичен гидролизу сложных
эфиров. Переэтерификация – обратимый процесс. Для сдвига равновесия вправо
необходимо использовать большой избыток исходного спирта. Реакция
переэтерификации находит применение для получения сложных эфиров жирных кислот
из триацилглицеридов (см. лек. 18)
Сложные эфиры ацилируют аммиак и амины с
образованием амидов карбоновых кислот.
Амиды карбоновых кислот
Строение амидной группы
Амидная группа встречается во многих биологически важных соединениях,
прежде всего в пептидах и белках (пептидная связь). Её электронное и
пространственное строение во многом определяет их биологическое
функционирование.
Амидная группа представляет собой р- p -сопряженную систему, в которой происходит
дополнительное перекрывание р-орбитали атома азота с p -орбиталью связи
углерод-кислород.
Такое распределение электронной плотности
приводит к увеличению энергетического барьера вращения вокруг связи С-N до 60 –
90 кДж/моль. В результате амидная связь имеет плоское строение, а длины связей
C-N и С=О имеют значения соответственно меньше и больше своих обычных
величин.
Отсутствие свободного вращения вокруг связи C-N
приводит к существованию у амидов цис- и транс-изомеров. Для
большинства амидов предпочтительной является транс-конфигурация.
Пептидная связь также имеет транс-конфигурацию, в которой боковые радикалы аминокислотных остатков
наиболее удалены друг от друга
Методы получения
-
Ацилирование аммиака или аминов
хлорангидридами или ангидридами.
RCOX + 2R NH2 ® RCONHR + R NH3X
RCOOR + R \ NH2 ® RCONHR \ + R OH
RCOOH + R NH2 ® RCOONH3R RCOONHR + H2O
Реакции нуклеофильного замещения в
карбоксамидной группе.
Амиды — наименее реакционноспособные производные карбоновых кислот. Для них
известны реакции гидролиза, которые протекают в жестких условиях под действием
водных растворов кислот или щелочей.
Механизмы реакций аналогичны гидролизу сложных
эфиров. Однако, в отличие от гидролиза эфиров, кислотный и щелочной гидролиз
амидов протекают необратимо.
2.3. Реакции по a -углеродному
атому
Карбоновые кислоты, содержащие a -водородные атомы,
взаимодействуют с бромом в присутствии фосфора с образованием исключительно a -бромпроизводных
(реакция Гелля – Форгальда — Зелинского )
Галоген в a -галогензамещенных кислотах легко замещается под
действием нуклеофильных реагентов. Поэтому a -галогензамещенные кислоты
являются исходными веществами в синтезе широкого круга замещенных по a -положению
кислот, в том числе a -амино- и a -гидроксикислот.
2.4.
Декарбоксилирование
Декарбоксилирование – это элиминирование CO2 из карбоновых кислот или их солей. Декарбоксилирование
проводят путем нагревания в присутствии кислот или оснований. При этом, как
правило, происходит замещение карбоксильной группы на атом водорода.
Незамещенные монокарбоновые кислоты
декарбоксилируются в жестких условиях.
Декарбоксилирование облегчается при наличии
электроноакцепторных заместителей в a -положении.
Важное значение имеет ферментативное
декарбоксилирование кето-, амино- и гидроксикислот в организме ( см. лек. №14 и
16).
Декарбоксилирование путем нагревания (сухой
перегонки) кальциевых и бариевых солей карбоновых кислот – метод получения
кетонов.
2.5.
Восстановление.
Карбоновые кислоты, хлорангидриды, ангидриды и сложные эфиры
восстанавливаются LiAlH4 до первичных
спиртов.
Хлорангидриды могут быть восстановлены до
альдегидов (см. лек. № 11).
При восстановлении амидов карбоновых кислот
образуются амины.
3. Дикарбоновые кислоты
Дикарбоновые кислоты содержат две карбоксильные группы. Наиболее доступными
являются кислоты линейного строения, содержащие от 2 до 6 атомов углерода. Их
строение и методы получения представлены в таблице 9.
Таблица 9. Методы получения и свойства дикарбоновых кислот.
Химические свойства дикарбоновых кислот в
основном аналогичны свойствам монокарбоновых кислот. Они дают все реакции,
характерные для карбоксильной группы. При этом могут быть получены
функциональные производные (хлорангидриды, ангидриды, сложные, эфиры, амиды) как
по одной, так и по обеим карбоксильным
группам. Дикарбоновые кислоты имеют большую кислотность, чем монокарбоновые,
вследствие –I-эффекта карбоксильной группы. По мере увеличения расстояния между
карбоксильными группами кислотность дикарбоновых кислот уменьшается (см. табл.
9).
Кроме того, дикарбоновые кислоты имеют ряд
специфических свойств, которые определяются наличием в молекуле двух
карбоксильных групп.
Отношение дикарбоновых кислот к
нагреванию.
Превращения дикарбоновых кислот при нагревании
зависят от длины цепи, разделяющей карбоксильные группы, и определяются
возможностью образования термодинамически стабильных пяти- и шестичленных
циклов.
При нагревании щавелевой и малоновой кислот
происходит декарбоксилирование.
Янтарная, глутаровая и малеиновая кислоты при
нагревании легко отщепляют воду с образованием пяти- и шестичленных циклических
ангидридов.
Адипиновая кислота при нагревании
декарбоксилируется с образованием циклического кетона – циклопентанона.
Реакции поликонденсации
Дикарбоновые кислоты взаимодействуют с диаминами и диолами с
образованием соответственно полиамидов и полиэфиров, которые используются в
производстве синтетических волокон.
Биологически важные дикарбоновые
кислоты.
Щавелевая кислота образует труднорастворимые соли, например,
оксалат кальция, которые отлагаются в виде камней в почках и мочевом пузыре.
Янтарная кислота участвует в обменных процессах, протекающих в
организме. Является промежуточным соединением в цикле трикарбоновых кислот.
Фумаровая кислота, в отличие от малеиновой, широко распространена в природе, участвует в процессе
обмена веществ, в частности в цикле трикарбоновых кислот.
Ангидридами называют производные карбоновых кислот, у которых атом водорода карбоксильной группы замещен на ацильную группу.
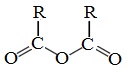
Классификация. Номенклатура
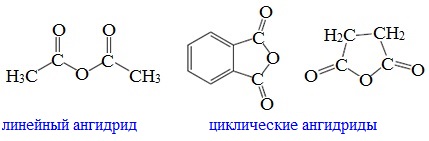
Ангидриды являются продуктами дегидратации карбоновых кислот. Различают линейные и циклические ангидриды карбоновых кислот:
Линейные ангидриды, в молекулу которых входят остатки разных кислот, в том числе и минеральных, называются смешанными ангидридами.
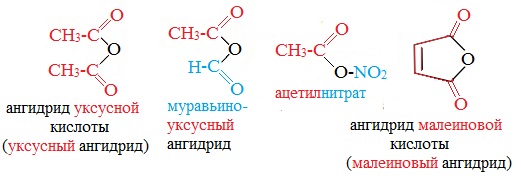
Названия ангидридов образуют из тривиальных названий соответствующих кислот:
Способы получения
1. Дегидратация карбоновых кислот
Линейный ангидриды можно получить из карбоновых кислот при взаимодействии с сильными водоотнимающими реагентами (P2O5, ангидрид трифторуксусной кислоты С4F6O3).Циклические ангидриды получают отщеплением воды от дикарбоновых кислот при их нагревании:
2. Взаимодействием галогенангидридов с солями карбоновых кислот
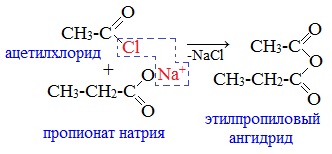
Линейные ангидриды получают взаимодействием хлорангидридов с натриевыми или калиевыми солями карбоновых кислот:
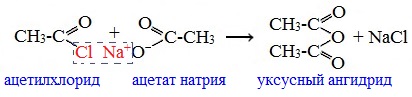
3. Взаимодействие карбоновых кислот с кетенами
Ангидриды получают при взаимодействии карбоновых кислот с кетенами:
Данный метод используется в промышленности для получения уксусного ангидрида.
Первый представитель гомологического ряда – ангидрид муравьиной кислоты – нестабилен.
Физические свойства
Ангидриды карбоновых кислот представляют собой бесцветные жидкости или кристаллические вещества. Низшие представители гомологического ряда обладают раздражающим запахом. Ангидриды карбоновых кислот малорастворимы в воде и медленно с ней реагируют.
Характеристика реакционной способности
Ангидриды карбоновых кислот, подобно галогенангидридам, являются весьма активными электрофильными реагентами . Связи в молекулах ангидридов карбоновых кислот сильно поляризованы.
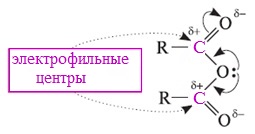
Ангидриды карбоновых кислот имеют менее выраженный электрофильный характер, чем галогенангидриды, но проявляют большую электрофильность по сравнению с карбоновыми кислотами, поскольку у них атом кислорода, проявляющий +М-эффект, приходится на две ацильные группы:
Ангидриды карбоновых кислот легко реагируют с различными нуклеофильными реагентами и используются для введения в их структуру ацильных групп.
Химические свойства
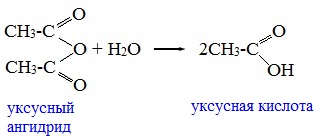
1. Взаимодействие с водой (гидролиз)
При взаимодействии с водой ангидриды медленно гидролизуются с образованием соответствующих кислот:
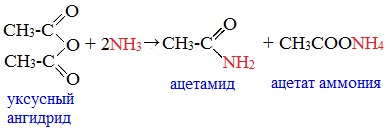
2. Взаимодействие с аммиаком (аммонолиз)
При взаимодействии линейных ангидридов с аммиаком, первичными или вторичными аминами образуются амиды карбоновых кислот:
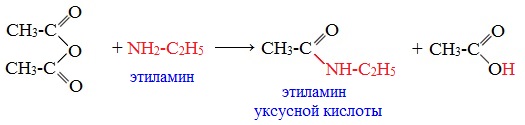
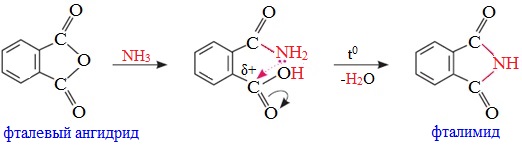
Циклические ангидриды реагируют с аммиаком и первичными аминами с образованием неполных амидов дикарбоновых кислот, которые при нагревании циклизуются в имиды:
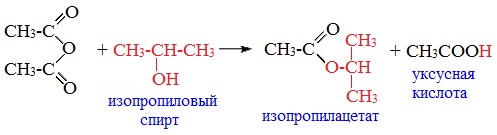
3. Взаимодействие со спиртами (алкоголиз)
При обработке линейных ангидридов спиртами образуются сложные эфиры:
Циклические ангидриды реагируют со спиртами с образованием неполных (кислых) эфиров дикарбоновых кислот:
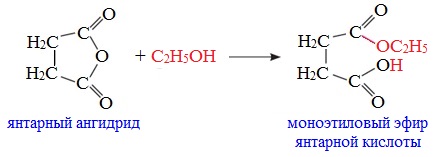
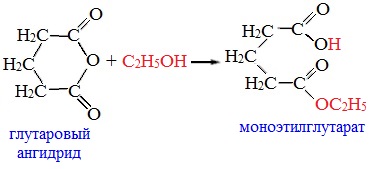
4. Реакции α-водородного атома
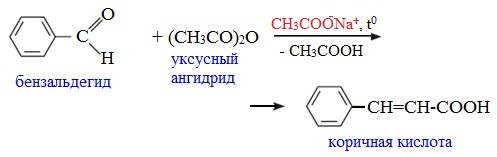
Как и в случае карбоновых кислот, в молекулах ангидридов атомы водорода при α-углеродных атомах подвижны. С участием связи С-Н в α-положении ангидриды карбоновых кислот в присутствии оснований (соли карбоновых кислот, третичные амины) вступают в реакцию конденсации с ароматическими альдегидами, образуя ненасыщенные аренкарбоновые кислоты.
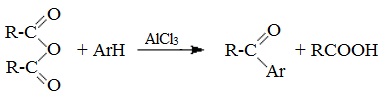
5. Образование ароматических кетонов
При взаимодействии ангидридов с аренами в присутствии хлорида алюминия образуются кетоны (реакция Фриделя-Крафтса):
Отдельные представители
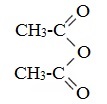
Уксусный ангидрид (CH3CO)2O — бесцветная жидкость с резким запахом (т.кип.140 0 С), раздражает слизистые оболочки глаз и дыхательных путей, вызывает ожоги кожи. С водой медленно реагирует, образуя уксусную кислоту, растворяется в этаноле, эфире, бензоле, уксусной кислоте.
Применяется в качестве ацетилирующего реагента в производстве ацетилцеллюлозы, винилацетата, диметилацетамида, лекарственных средств (ацетилсалициловой кислоты и др.).
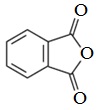
Фталевый ангидрид — белое кристаллическое вещество (т.пл.130,8 0 С), легко возгоняется, растворим в этаноле. Обладает свойствами ароматических соединений. Легко реагирует с фенолами и их производными.

Используют в синтезе лекарственных препаратов (фталазол, фтазин и др.), в производстве алкидных смол, пластификаторов, красителей.

Рубрики: ОРГАНИЧЕСКАЯ ХИМИЯ

Карбоновые кислоты
Ключевые слова конспекта: Карбоновые кислоты. Предельные одноосновные карбоновые кислоты. Муравьиная кислота. Уксусная кислота.
Понятие и формулы карбоновых кислот
Органические вещества, содержащие в молекуле карбоксильную группу, связанную с углеводородным радикалом, называют карбоновыми кислотами .

Органических кислот великое множество. Мы будем знакомиться с предельными одноосновными карбоновыми кислотами, в молекулах которых с предельным углеводородным радикалом связана одна карбоксильная группа. Общая формула этих кислот СnН2n+1СООН, или RCOOH.
Однако в молекуле первого представителя гомологического ряда предельных одноосновных карбоновых кислот вместо углеводородного радикала с карбоксильной группой связан атом водорода. Эту кислоту называют муравьиной кислотой, её формула НСООН.
Формулы, а также тривиальные и международные названия некоторых представителей гомологического ряда предельных одноосновных карбоновых кислот приведены в таблице.
Физические свойства и способы получения карбоновых кислот
Низшие карбоновые кислоты — жидкости с резким запахом, хорошо растворимые в воде. По мере роста углеводородного радикала растворимость кислот падает, температуры кипения и плавления увеличиваются. Пальмитиновая и стеариновая кислоты — твёрдые вещества, нерастворимые в воде.

Основным способом получения карбоновых кислот служат реакции окисления. Исходные вещества в подобных синтезах — спирты и альдегиды:
Пищевую уксусную кислоту получают биотехнологическим путём — сбраживанием сахарсодержащих растворов при действии особых микроорганизмов.
Химические свойства карбоновых кислот

Следует учесть, что химические свойства карбоновых кислот, как и кислот неорганических, обусловлены их способностью диссоциировать с образованием катиона водорода:
Почему же в уравнении электролитической диссоциации соляной кислоты ставится знак равенства, а в аналогичном уравнении для уксусной кислоты — знак обратимости? Дело в том, что в отличие от соляной кислоты уксусная является слабой, распаду на ионы в водном растворе подвергается только небольшая часть её молекул.
Благодаря наличию в растворе катионов водорода карбоновые кислоты проявляют все характерные для кислот свойства: имеют кислый вкус, изменяют окраску индикаторов, реагируют с активными металлами, основными и амфотерными оксидами, основаниями, солями. Рассмотрим свойства карбоновых кислот на примере уксусной кислоты СН3СООН.

Уксусная кислота реагирует с активными металлами с образованием солей (ацетатов) и выделением водорода:

Оксиды металлов реагируют с уксусной кислотой с образованием соли металла и воды:

При взаимодействии уксусной кислоты со щелочами или нерастворимыми в воде основаниями также образуются соль и вода:

Одно из важнейших химических свойств карбоновых кислот вам уже знакомо. В присутствии концентрированной серной кислоты в качестве катализатора кислоты реагируют со спиртами, образуя сложные эфиры. Сама реакция вам уже знакома, это реакция этерификации. Так, в результате взаимодействия уксусной кислоты и этилового спирта образуется сложный эфир — этиловый эфир уксусной кислоты:
Нахождение в природе и применение карбоновых кислот
Карбоновые кислоты широко распространены в природе. Они содержатся во фруктах и ягодах, не только придавая им кисловатый вкус, но и предохраняя их от порчи и поражения вредителями.
Муравьиная кислота выделяется железами внутренней секреции муравьёв и некоторых видов медуз. Жжение листьев крапивы также обусловлено раздражением кожи муравьиной кислотой.
Области применения карбоновых кислот в промышленности, в технике и технологии, в быту также весьма обширны. Муравьиную кислоту применяют для протравливания текстиля и бумаги, обработки кожи, получения лекарственных средств, как консервант фруктовых соков и зелёных кормов. Она входит в состав средства для местной анестезии. Её также используют при крашении тканей и бумаги.
Уксусную кислоту используют как приправу к пище, как растворитель лаков, для производства лекарственных средств, например аспирина, для получения пластмасс, ядохимикатов, красителей. В продаже встречается уксусная эссенция — 70%-ный раствор уксусной кислоты. С кислотой такой концентрации необходимо обращаться очень осторожно! Её пары могут вызвать ожоги дыхательных путей, а употребление внутрь неразбавленной уксусной эссенции смертельно опасно. Хранить эссенцию нужно в месте, недоступном для детей и домашних животных.

Методы синтеза лактонов (циклических сложных эфиров)
Физические свойства и строение сложных эфиров
Сложные эфиры являются бесцветными жидкостями или кристаллическими веществами с приятным запахом. Температура кипения сложных эфиров обычно ниже чем температура близких по молекулярной массе карбоновых кислот. Это свидетельствует об уменьшении межмолекулярных взаимодействий, что объясняется отсутствием межмолекулярных водородных связей.
Полярность связей в молекуле сложного эфира подобна полярности связи в карбоновых кислотах.
Основное отличие от карбоновых кислот – отсутствие подвижного протона, вместо него находится углеводородный остаток. Электрофильный центр находится на карбонильном и алкильном углеродном атоме. В то же время карбонильный кислород обладает основностью.
Объектами нуклеофильной атаки могут быть ацильный или алкильный углерод. В то же время кислотность водородных атомов при a -углеродном атоме радикала кислоты обусловливает склонность сложность эфиров к реакции конденсации.
Реакции нуклеофильного замещения
Различают кислотнокаталитический гидролиз и основной гидролиз (омыление). Кислотный гидролиз представляет собой обратимую реакцию.
Механизм этой реакции – см в разделе Кислотно-каталитическая этерификация – Химические свойства карбоновых кислот.
Реакция омыления необратима. Основание не только ускоряет реакцию гидролиза, но выступает в качестве реагента. Эффективность реакции обусловлена высокой нуклеофильной активностью гидроксил-анионов.
RCOOR' + NaOH ® RCOONa + R'OH
Реакция катализируется кислотами или основаниями.
а) Реакция с магнийорганическими соединениями подобна реакции с галогенангидридами.
б) Взаимодействие с Li-органическими соединениями.
Реакции восстановления.
Реакции конденсации
Конденсация Кляйзена – наиболее важная в синтетическом отношении реакция. Ее стехиометрический результат заключается в автоконденсации этилацетата, катализируемая этилатом натрия.
Условия равновесия неблагоприятны для всех трех стадий. Поэтому равновесие брутто-реакций существенно смещено в левую сторону.
Факторами смещения равновесия могут быть: отгонка этилового спирта, применение избытка этилата натрия. Последний метод оказывается эффективным, так как этанол более слабая кислота, чем енол сложного эфира, и избыток этилата смещает равновесие нацело вправо вследствие превращения b -кетоэфира в соль енола.
Очевидно, что продукт конденсации необходимо получить из соли енола и выделять в условиях, предотвращающих обратную реакцию распада на исходные реагенты. Наилучшим методом оказывается "замораживание" реакционной смеси для чего ее вливают в избыток холодной кислоты.
Для протекания конденсации Кляйзена необходимы следующие структурные предпосылки: исходный эфир должен иметь водородный атом при a -углеродном атоме, чтобы могли осуществиться реакции, представленные в механизме (реакции (1)-(3)) и два водородных атома при a -углероде, для того чтобы оказалось возможным смещение равновесия реакции в сторону продукта за счет образования енолят-аниона ацетоуксусного эфира.
Очевидно, что этилизобутират не вступает в присутствии этилата натрия в реакцию автоконденсации, поскольку в продукте конденсация отсутствует a -водородные атомы.
Конденсация Кляйзена может быть проведена между двумя сложными эфирами, но поскольку при этом возможно образование четырех различных продуктов, в результате реакции часто получают сложные смеси. Этого удается избежать, если один из сложных эфиров не содержит a -водородных атомов и легко реагируется с карбанионом. Реакции в этом случае напоминают перекрестную альдольную конденсацию. К числу применимых для этой цели сложных эфиров, не содержащих a -водородные атомы и обладающих высокой реакционной способностью относятся эфиры бензойной, муравьиной, щавелевой и угольной кислот.
Читайте также:

