Оксиды 7 класс конспект урока
Обновлено: 06.07.2024
Автор: Ирина Егоровна Гаан
Населенный пункт: г. Славгород, с. Нововознесенка
Должность, предмет: учитель, химия
Класс (для учителей)
Квартал, год г.Славгород, с.Нововознесенка
Схема конспекта урока
Аттестуемый педагог (ФИО) _Гаан Ирина Егоровна_____________________________________________________________________
Город, район г.Славгород, с.Нововознесенка__________________________________________________________________________
Предмет (или должность)__химия_____________________________________________________________________________________
Средства, обеспечивающий учебный процесс на уроке: Рудзитис Г.Е. Химия 8 класс: учеб. для общеобразоват. учреждений/ Рудзитис Г.Е., Фельдман Ф.Г – М.: Просвещение, 2016. – 212с; дидактически материал М.А. Радецкий – М.: Просвещение, 2018 г., рабочая тетрадь Н.И. Горбусева – М. Просвеение 2019 г, таблицы, компьютер ИКТ.
урок изучения нового материала.
Цель урока: Создать условия для усвоения обучающимися класса неорганических соединений оксидов, их классификации и номенклатуре. Задачи урока:
Образовательные: - формировать у обучающихся представления о классе оксидов, умение их называть и классифицировать;
Развивающие: - развивать логическое мышление через умение анализировать, сравнивать, обобщать, делать выводы, - развивать внимание обучающихся; - развивать химическую речь обучающихся.
Воспитательные: -воспитание мотивации к предмету химия, - воспитание ответственного и бережного отношения к окружающей среде.
Развитие самостоятельности, уважения друг к другу, терпимости.
Научиться обобщать полученную информацию, классифицировать объекты по предложенным критериям, выполнять учебное задание в соответствии с планом, оценивать свои учебные достижения.
Основные виды деятельности учащихся:
Составлять химические формулы оксидов по их названиям и валентности элементов. Записывать уравнения реакций получения оксидов. Доказывать основный и кислотный характер оксидов.
Беседа, объяснение, постановка и решение учебных проблем.
Этапы урока
Деятельность учителя
Деятельность учащихся
Формируемые УУД
1.Организационный этап. Актуализация знаний.
Цель: 1) выявить степень подготовки обучающихся к уроку, создать положительный настрой класса на учебную деятельность. 2) формирование у учащихся способности самостоятельно ставить учебные цели на урок.
Задача: 1) создать положительный эмоциональный настрой. 2) создание проблемной ситуации
2) Что заметили интересного в написанных формулах веществ? Как Вы думаете, с какими соединениями мы будем сегодня работать? Подумайте, как можно назвать вещества, которые состоят из двух элементов и в которых есть кислород? Следовательно тема нашего урока? (Слайд 2)
Какая цель нашего урока? (Слайд 3)
Цели обучающихся: 1) получить возможность узнать цели, задачи урока, подготовиться к продуктивной работе на уроке 2) выявить проблему и определить пути решения.
Выделяют проблему, предлагают тему урока, планируют свою работу.
Коммуникативные: Уметь оформлять свои мысли в устной и письменной форме Познавательные: Уметь анализировать результаты, ориентироваться в своей системе знаний: отличать новое от уже известного с помощью учителя.
2.Этап опроса учащихся по заданному на дом материалу
Цель: выявить степень усвоения заданного материала, возможные затруднения, помочь их ликвидировать.
Задача: развития логики и навыков общения; усиления мотивации к изучению нового материала.
Ход этапа урока:
Ребята давайте вспомним какие вещества называются простыми и сложными. (Слайд 4) В большинстве ли случаях при взаимодействии веществ с кислородом образуются оксиды? Все химические элементы образуют оксиды? Назовите те химические элементы, которые с кислородом не соединяются?
Цель: оценить степень готовности к уроку
Регулятивные: Уметь самостоятельно обнаруживать и формулировать учебную проблему, определять цель, составлять план решения проблемы.
3.Этап изучения нового материала.
Задача: знать значение оксидов; уметь отличать кислотные оксиды от основных; применять полученные знания.
Метод: дискуссия, работа в группах, парах для проговаривания материала
Ход этапа урока:
Следовательно Оксиды – это (Слайд 5). Классификация оксидов (Слайд 6). Одним оксидам соответствуют основания, а другим – кислоты. Поэтому оксиды классифицируют на основные и кислотные. Но есть оксиды, которым соответствуют и основания, и кислоты – амфотерные оксиды.
Физические свойства оксидов, бывают твердые, жидкие и газообразные (Слайд 8).
Ребята давайте разделимся на две группы (группа основные оксиды и группа кислотные оксиды) и пользуясь учебником на странице 134, расскажем друг другу о химических свойствах, и запишем их.
Физминутка в виде игры (Слайд 9-17)
Ребята вам уже известно какое значение имеет вода в природе, промышленности и в быту, многие оксиды так же широко применяются. Так например для получения стали и чугуна используют оксид железа, оксид кальция для получения гашенной извести.
А вы знаете как получают оксиды (Слайд 18). Оксиды образуются: 1) при горении простых и сложных веществ. 2) при разложении сложных веществ: а) нерастворенных оснований; б) кислот; в) солей.
Работают с учебником §40
Проговаривают материал, анализируют записи (номенклатуры) оксидов, их классификации
Познавательные: Уметь добывать новые знания: находить ответы на вопросы, используя учебник, свой жизненный опыт и информацию, полученную на уроке.
Коммуникативные: Уметь оформлять свои мысли в устной форме; слушать и понимать речь других (обучение в сотрудничестве).
4. Этап закрепления изученного материала.
Цель: формирование способностей использовать полученные знания.
Задача: закрепить полученные знания.
Метод: самостоятельная работа
Ход этапа урока:
Работа по карточкам:
В каком из предложенных вариантов приведены формулы только кислотных оксидов.
В каком из предложенных вариантов приведены формулы только основных оксидов.
II. Цель: применения полученных знаний на практике
Задача: закрепление полученных знаний.
Метод: работа в группах.
Ход этапа урока:
Из формул CuO, Fe2O3, NaCl, SiO2,H2O,CuSO4 выпишите отдельно оксиды металлов и оксиды неметаллов. Назовите их по международной номенклатуре. (Слайд 19)
2. (Повышенный уровень)
Составьте формулы названных в тексте оксидов:

Оксиды
(названия, классификация, получение)
Ключевые слова конспекта: оксиды, названия оксидов, классификация оксидов, получение оксидов, химические свойства, степень окисления.
Оксиды — сложные вещества, молекулы которых состоят из атомов двух химических элементов, один из которых — кислород . Атом кислорода в оксидах всегда имеет степень окисления –2 . (Подробнее про степень окисления смотрите в конце статьи)
К примеру, оксидом является соединение P2O5. А вот РН3 и H3PO4 — не являются оксидами, потому что в состав РН3 не входит атом кислорода, а в состав H3PO4 входят атомы трёх химических элементов, а не двух.
Названия оксидов
Если оксид образован химическим элементом с переменной валентностью, то после названия элемента, нужно указать его валентность. Например: Fe2О3 — оксид железа (III), FеО — оксид железа (II). Если у элемента постоянная валентность, то ее не обозначают в названии.
Некоторые оксиды имеют особые (тривиальные) названия: Н2О — вода, СО — угарный газ, СО2 — углекислый газ и др.
Если элемент образует оксиды в нескольких степенях окисления, то оксид с наименьшей валентностью – низший оксид, а с наибольшей – высший оксид. Так, оксид хрома (II) СгО – низший оксид, а оксид хрома (VI) СгO3 – высший оксид.
Часто используют и другие наименования оксидов. Например, по числу атомов кислорода (современная международная номенклатура): если оксид содержит только один атом кислорода, то его называют монооксидом (устаревшее — окись), если два — диоксидом (устаревшее — двуокись), если три — то триоксидом (устаревшее — триокись, трёхокись) и т. д.
Современная международная номенклатура оксидов состоит в использовании приставок по числу атомов в формульной единице оксида (моно-, ди-, три-, тетра-, пента-, гекса-, гепта-). Например: монооксид углерода CO, диоксид углерода СО2, триоксид серы SO3.
Классификация оксидов
Многие оксиды могут реагировать с кислотами или основаниями. Продуктами таких реакций являются соли. Поэтому такие оксиды называются солеобразующими.
Однако существует небольшая группа оксидов, которые к таким реакциям не способны. Такие оксиды называются несолеобразующими (безразличными): H2O, CO, N2O, NO, F2O. Безразличные оксиды образуются только неметаллами.
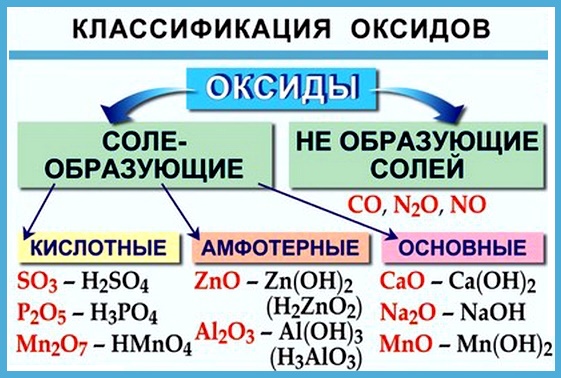
Вот некоторые правила образования солеобразующих оксидов:
- неметаллы образуют только кислотные оксиды;
- металлы могут образовывать разные оксиды — основные, амфотерные, кислотные — в зависимости от валентности металла.
Предсказать свойства оксида металла может помочь эта схема.
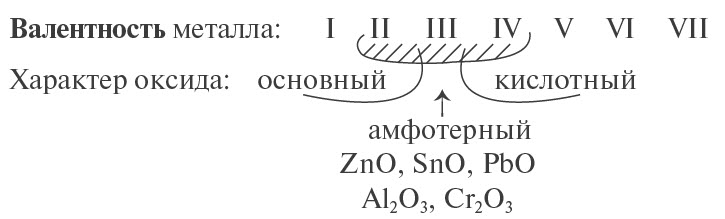
Основные оксиды металлов от кислотных оксидов металлов отличить легко: малая валентность металла — основный оксид; большая — кислотный. Валентность металлов в амфотерных оксидах — III. Но есть и исключения. Поэтому желательно запомнить формулы наиболее часто встречающихся амфотерных оксидов.
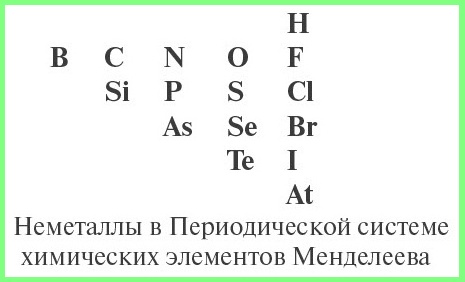
Схема определения типа оксида:
- определить, не является ли данный оксид несолеобразующим;
- определить, какой элемент входит в состав оксида: металл или неметалл, для чего нужно знать из таблицы Менделеева символы элементов — неметаллов.
- если в состав оксида входит атом неметалла — то оксид кислотный;
- для атома металла определить валентность, и по схеме определить характер оксида: основный, амфотерный или кислотный.
- Сг2О3 — амфотерный, так как хром — металл с низкой валентностью III;
- N2O3 — кислотный оксид, так как азот — неметалл;
- CrO3 — кислотный оксид, так как хром — металл с высокой валентностью VI.
Получение оксидов
Oксиды образуются при взаимодействии простых и сложных веществ с кислородом:
4Аl + 3O2 = 2Аl2O3; Si + O2 = SiO2;
SiH4 + 2O2 = SiO2 + 2Н2O; 2Н2S + 3O2 = 2SO2 + 2Н2O.
В реакциях с простыми веществами из одних оксидов могут получаться другие оксиды:
Fe2O3 + С = 2FeO + СО; 2CuO + Н2 = Сu2O + Н2O.
Oксиды образуются при разложении некоторых сложных веществ, обычно при нагревании:
СаСO3 = СаО + СO2; 2Аl(ОН)3 = Аl2O3 + 3Н2O.
Химические свойства оксидов
1. При разложении (при нагревании) неустойчивых оксидов – оксида серебра Ag2O и оксида ртути (II) HgO – образуется соответствующий металл и кислород:
2Ag2O = 4Ag + O2 ↑, 2HgO = 2Hg + O2 ↑.
2. Некоторые oксиды при нагревании образуют другие оксиды. Так, из красного оксида хрома (VI) получается зеленый оксид хрома (III): 4СrO3 = 2Сr2O3 + 3O2 ↑.
3. Некоторые oксиды металлов и неметаллов реагируют с водой:
СаО + Н2O = Са(ОН)2, SO3 + Н2O = Н2SO 4 .
4. Oксиды металлов обычно реагируют с оксидами неметаллов:
СаО + SO2 = CaSO3, MgO + СO2 = MgCO3.
Реакции оксидов с основаниями, кислотами и солями будут рассмотрены позже.
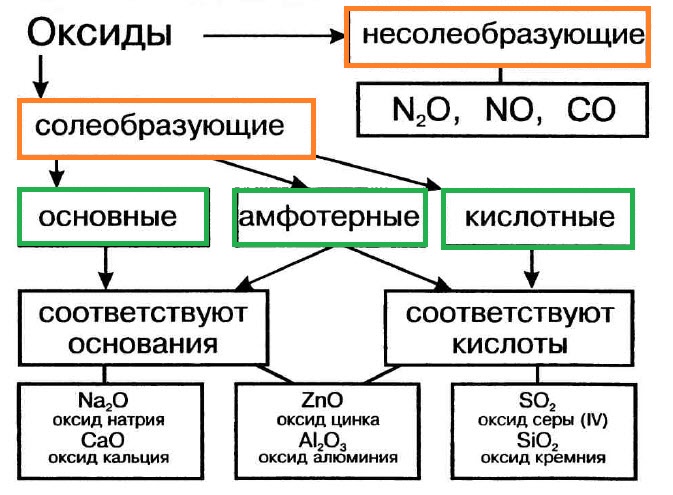
Оксиды (справочная таблица)

Степень окисления (закись, окись, перекись)
Степень окисления (окислительное число) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций. Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов: она не является истинным зарядом атома в молекуле. Понятие степень окисления часто используют в неорганической химии вместо понятия валентность.
Степень окисления атома любого элемента в свободном (несвязанном) состоянии (простое вещество) равна нулю, так, например, атомы в молекулах имеют нулевую степень окисления. Алгебраическая сумма степеней окисления всех атомов в формуле нейтрального соединения всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в комплексном ионе (катионе либо анионе) должна быть равна его общему заряду.
Степень окисления кислорода равна −2 во всех соединениях, где кислород не образует простой ковалентной связи O—O, то есть в подавляющем большинстве соединений — оксидах. Так, степень окисления кислорода в абсолютном большинстве случаев равна −2 (H2O, H2SO4, NO, CO2 и CH3OH), но в пероксиде водорода (H2O2 или HO—OH), она равна −1.
Закись — низшая степень окисления. Соединение элементов низкой степени окисления с кислородом. Пример: Cu2O — закись меди, оксид меди(I).
Окись — промежуточная степень окисления. Соединение элементов средней степени окисления с кислородом. Пример: СО — окись углерода (бытовое название: угарный газ), оксид углерода (II), монооксид углерода.
Перекись — высшая степень окисления вещества. Соединение элементов высокой степени окисления с кислородом. Пример: Н2О2 — перекись водорода, пероксид водорода (НЕ оксид !)
Пероксиды (перекиси) — соединения, содержащие атомы кислорода, соединённые между собой (O—O), называются пероксидами (перекисями) и супероксидами. Они не относятся к категории оксидов. Пероксиды легко выделяют кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для органических веществ и сегодня в русском языке часто используют термин перекись. Пероксиды многих органических веществ взрывоопасны. Наиболее известна ПЕРЕКИСЬ ВОДОРОДА (HO—OH) — жидкость, состоящая из водорода и кислорода, обычно продается в водных растворах. Раствор перекиси водорода используется как отбеливающие и дезинфицирующие средство. Концентрированная перекись водорода — опасное взрывчатое вещество и используется как окислитель для ракетного топлива.

В данной разработке предоставлен развернутый план-конспект урока по теме "Оксиды", на котором учащиеся впервые знакомятся с данным классом соединений.

Содержимое разработки
План-конспект урока по химии на тему:
Тема: Оксиды – соединения элементов с кислородом
Цель урока: сформировать представление об оксидах как соединениях химических элементов с кислородом
Образовательные:
Создать условия для формирования представлений учащихся о составе, номенклатуре и физических свойствах оксидов
Продолжить формирование умений составлять уравнения химических реакций, расставлять коэффициенты
Развивающие:
Развивать познавательную активность и умения работать в группах
Развивать у обучающихся умение логически мыслить, сопоставлять, обобщать и делать выводы.
Развивать умение наблюдать окружающий мир, задумываться над его сутью, возможностью влияния на происходящие вокруг нас процессы.
Воспитательные:
Воспитание убежденности в познаваемости химической составляющей картины мира.
Формирование эстетического вкуса при наблюдении красоты явлений природы.
Воспитание бережного отношения к своему здоровью.
1. Словесные: рассказ, эвристическая беседа.
2. Наглядные: лабораторный опыт
3. Практические: наблюдение, описание наблюдений, проведение лабораторных опытов.
Тип урока: комбинированный
I. Ориентировочно-мотивационный этап
1. Организационный момент
2. Анализ практической работы
3. Совместное целеполагание
4. Актуализация опорных знаний и субъектного опыта учащихся
II. Операционно-познавательный этап
1. Изучение нового материала
2. Закрепление нового материала
III. Оценочно-рефлексивный этап
1. Выводы учителя
3. Домашнее задание
I. Ориентировочно-мотивационный этап
1. Организационный момент:
Взаимное приветствие учителя и учащихся
Организация внимания учащихся
2. Анализ практической работы:
Ученики получают тетради для контрольных работ, выполняют в них работу над ошибками. Учитель выполняет консультирующую функцию. Задания, в которых допустило ошибки подавляющее большинство учеников, анализируются около доски (уравнения реакций простых и сложных веществ с кислородом).
3. Совместное целеполагание:
2) Способы получения оксидов
3) Название оксидов
4) Физические свойства оксидов
5) Оксиды в природе
4. Актуализация опорных знаний:
Прежде чем перейти к изучению новой темы, давайте вспомним правила составления формул веществ по их валентность.
Запись на доске:
CO ClO FeO CaO AlO
(один ученик работает у доски и составляет формулы соединений)
II. Операционно-познавательный этап
1. Изучение нового материала
1) Ребята, посмотрите на формулы, написанные на доске.
Это сложные или простые веществ? Почему?
Сколько химических элементов входит в состав этих веществ?
Какой химический элемент присутствует в составе каждого вещества?
Откройте стр. 115 ваших учебников и прочитайте, какое определение дано в нем. Запишите себе на последней странице тетрадей новое слово в химический словарь.
2) Сейчас мы попытаемся понять, каким же образом образуются оксиды?
Взгляните на формулу первого оксида СО, как вы думаете, какие простые вещества вступали в реакцию, чтобы образовался данный оксид? (углерод и кислород). Запишем уравнение реакции:
Значит оксиды образуются в результате реакции простых веществ с кислородом.
Запишем уравнения реакций получения остальных оксидов (один ученик работает у доски):
3) Итак, ребята, теперь давайте посмотрим, как же давать названия оксидам.
Единственный момент, на который вы должны обратить внимание: постоянную или переменную валентность имеет элемент, входящий в состав оксида.
Аналогично дадим название другим оксидам.
Ca + O2 = 2CaO (оксид кальция)
4) Сейчас ребята, переходим к изучению физических свойств оксидов. Для этого выполним лабораторный опыт. В ваших лабораторных лотках стоят образцы оксидов, а на столах лежат протоколы, которые необходимо заполнить, вы будете определять агрегатное состояние, цвет и запах выданных вам оксидов. Но прежде чем приступить к выполнению опыта вспомним основные правила техники безопасности, которые вы должны соблюдать. (Один из учащихся отвечает с места).
Заполнение таблиц учитель дублирует на слайде.
Лабораторный опыт №5
Ознакомление с образцами оксидов
1) Рассмотрите выданные вам образцы оксидов и ознакомьтесь с ними по плану: а) агрегатное состояние б) цвет в) запах
Цели: познакомить обучающихся с классификацией оксидов, их физическими и химическими свойствами; развивать умение составлять химические уравнения, проводить химический эксперимент, соблюдая правила техники безопасности.
Планируемые результаты обучения:
а) в ценностно-ориентационной сфере – целеустремленность, отношение к труду; воспитание культуры общения при работе в группе, взаимопомощи, умения слушать и аргументировать;
б) в трудовой сфере – готовность к осознанному выбору дальнейшей образовательной траектории;
в) в познавательной – умение управлять своей познавательной деятельностью.
Метапредметные:
а) использование основных интеллектуальных операций: формулирование гипотез, анализ и синтез, сравнение, систематизация;
б) умение определять цели и задачи деятельности, выбирать средства реализации цели и применять их на практике;
в) использование различных источников для получения химической информации.
а) в познавательной сфере – знать определение и классификацию оксидов; уметь классифицировать, называть и составлять формулы по названию оксидов;
б) в ценностно-ориентировочной сфере – анализировать последствия для окружающей среды применения данных веществ.
Оборудование: компьютер, проектор, 3 шкатулки.
Реактивы: CuO , H 2 O , Fe 2 O 3 , CaO , CO 2, Cr 2 O 3 ), Al 2 O 3 , MnO 2 , песок.
Организационный момент.
Подготовка обучающихся к восприятию материала и работе на уроке.
Приветствие, проверка отсутствующих и готовности к уроку (личностные результаты – создание положительного настроя).
Актуализация, постановка проблемы.
Значение веществ, которые мы с вами сегодня будем изучать, для
нашей планеты и конкретно для человека очень большое. Там, где нет этих веществ, нет жизни. Эти вещества образуют минералы, руды, глины, редкий минерал, который доминирует на нашей планете.
Что же это за вещества, вы ответите через несколько минут, когда
разгадаете три загадки.
На столе перед вами три шкатулки – в них разные вещества, относящиеся к теме нашего сегодняшнего урока.
Перед вами шкатулка №1. Древний философ Фалес из Милета еще в VI веке до нашей эры назвал это вещество первым началом и сущностью всего.
Он дождь, и град, и снег,
Туман и гололед,
Носитель благ, предвестник бед,
- Что это за вещество? (Учащиеся отвечают.)
- Ответ прост – это вода. Вода покрывает 71% площади поверхности Земли, или 361 млн км 2 . Объем воды на планете составляет 1,5 млрд км 2 . Запишите формулу воды на доске.
Прочитаем стихотворение ( один обучающийся читает отрывок стихотворения о воде).
Из атомов мир создавала Природа:
Два атома легких взяла водорода,
Прибавила атом один кислорода
И получилась частица воды,
Море воды, океаны и льды…
А что в шкатулке №2?
Подсказка №1. Это газ, необходимый растениям для фотосинтеза.
Подсказка №2. Это газ, выделяемый нами при выдохе.
- Ответ готов? Верно, это углекислый газ.
Содержание углекислого газа в атмосфере относительно невелико – всего 0,03-0,04%. Растения, благодаря фотосинтезу, усваивают углекислый газ из атмосферы, превращая минеральные вещества в органические – глюкозу, крахмал. В воздухе, выдыхаемом человеком, углекислого газа 4%.
Запишите формулу углекислого газа на доске.
Прочитаем стихотворение ( один обучающийся читает отрывок стихотворения об углекислом газе).
И на Земле появились растения,
Жизнь появилась: дыханье, горение…
Первые птицы и первые звери,
Первые люди, что жили в пещере…
Огонь добывали при помощи трения,
Хотя и не знали причины горения.
И последняя шкатулка. Для того чтобы разобраться, что же в ней, послушайте отрывок из стихотворения:
Стал кислород чуть не всюду начинкой,
С кремнием он обернулся песчинкой,
В воздух попал кислород, как ни странно,
Из голубой глубины океана.
- Что произошло с кремнием при соединении с кислородом? Правильно, образовался оксид кремния (IV) – песок.
Запишите на доске формулу оксида кремния (IV).
Вы разгадали три загадки. Получили три разных вещества. Первое – вода – жидкость, без которой немыслимо существование на Земле.
Второе вещество – углекислый газ, необходимый растениям для фотосинтеза, а значит для питания и жизни.
Третье вещество – твердое - оксид кремния (IV) – главный компонент почти всех горных пород.
- Отгадайте, пожалуйста, еще одну загадку.
С кислородом ходит парой,
То металл, то неметалл он,
Дружбу связями скрепит
Всем известный класс … (оксид).
3. Формирование новых знаний и способов действия.
Для работы используем следующий план исследования:
- Итак, ребята, вы окунулись в мир оксидов. Что такое оксиды? Запишем определение в инструктивную карту (шаг №1).
Оксиды – сложные вещества, молекулы которых состоят из двух химических элементов, один из которых – кислород.
Атому кислорода я посвящаю стихи.
Оксидов всех творец,
В инструктивной карте (шаг №2) в предложенном перечне веществ выберите формулы веществ, относящиеся к оксидам. Обведите их в овал. Проверим результаты вашего поиска (устно).
Сравните состав данных оксидов. Назовите сходные признаки. Выделите различия в составе данных оксидов (в некоторых оксидах атом кислорода связан с атомами металлов, например, MgO , Na 2 O , CrO , K 2 O , CaO , Cr 2 O 3 ; имеются оксиды, в которых атом кислорода связан с атомами неметаллов: H 2 O , CO 2 , CO , SO 3 , N 2 O 5 , SO 2 ).
Задание: Подчеркните оксиды металлов одной чертой, оксиды неметаллов - двумя чертами.
Оксиды делятся на две группы: солеобразующие и несолеобразующие.
Несолеобразующие оксиды - это оксиды, которые не взаимодействуют ни с кислотами, ни со щелочами и не образуют солей (NO, N 2 O , CO ).
Солеобразующие оксиды - это оксиды, которые взаимодействуют с кислотами или щелочами с образованием соли и воды.
Солеобразующие оксиды делятся на основные, кислотные, амфотерные.
Кислотные оксиды – оксиды неметаллов, при взаимодействии со щелочами образуют соль и воду.
Посмотрим демонстрационный эксперимент ( видеоролик №1 «Пропускание углекислого газа через воду и через раствор известковой воды)
- Что наблюдаем? Верно. Прозрачная вода стала мутной.
Запишем уравнение реакции.
CO 2 + Ca ( OH ) 2 = CaCO 3 ↓ + H 2 O
Основными называют оксиды, которые при взаимодействии с кислотами образуют соль и воду.
Запишем уравнение реакции.
CuO + H 2 SO 4 = CuSO 4 + H 2 O
Существует группа оксидов, которые вступают в реакцию с кислотами и щелочами. Такие оксиды называют амфотерными.
Амфотерные оксиды – оксиды, которые проявляют свойства как основных, так и кислотных оксидов.
Амфотерные оксиды: оксид алюминия Al 2 O 3 , оксид цинка ZnO , оксид бериллия BeO и др.
Их оксиды реагируют как с кислотами, так и со щелочами, образуя соли.
Обратите внимание и запомните: неметаллы образуют только кислотные оксиды. Металлы с валентностью меньше четырех преимущественно образуют основные оксиды: оксиду марганца ( II ) MnO соответствует основание Mn ( OH ) 2 . Металлы с валентностью меньше четырех – кислотные оксиды: оксиду марганца ( VII ) Mn 2 O 7 соответствует кислота HMnO 4 .
А запомнить это правило вам помогут четверостишия.
Неметаллы, знай, мой друг,
Строго все себя ведут:
Коль в оксиды он подался –
Металл хотел запутать нас,
Но я найду опору:
Валентность меньше четырех –
Ну, а уж если повезло,
Валентность пять и выше –
Я буду помнить всем назло:
Переходим к следующему этапу – исследованию номенклатуры оксидов.
СаО – оксид кальция
К 2 О – оксид калия
CuO – оксид меди ( II )
Cu 2 O – оксид меди ( I )
Если элемент образует несколько оксидов, то нужно указывать валентность элемента.
По инструктивной карте, пользуясь шагом №3, дайте названия всем выделенным оксидам (устная работа).
По инструктивной карте, шаг №4, назовите другие пары оксидов, образованные элементами с переменной валентностью.
Задание: Составьте формулы двух оксидов, где фосфор имеет валентность III и V.
Демонстрация образцов оксидов ( CuO , H 2 O , Fe 2 O 3 , CaO , CO 2, Cr 2 O 3, MnO 2 ).
- Посмотрите на образцы оксидов. Что вы можете сказать об их физических свойствах?
Оксиды в природе бывают в трех агрегатных состояниях: твердые, жидкие, газообразные. Оксиды имеют разный цвет.
- Назовите оксиды: твердые, жидкие, газообразные.
По инструктивной карте, пользуясь шагом №5, вставьте формулы оксидов, которым соответствуют физические свойства, описанные в стихотворении.
А теперь рассмотрим химические свойства оксидов.
1) Химические свойства основных оксидов.
а) Взаимодействие с водой.
Многие оксиды взаимодействуют с водой. Основные оксиды образуют растворимые основания – щелочи.
- Все ли основные оксиды взаимодействуют с водой? (Только оксиды активных металлов взаимодействуют с водой.)
- Как вы определили, что образовалась щелочь? (По малиновой окраске индикатора фенолфталеина)
Запишем уравнения реакций:
СаО + Н 2 О = Са(ОН) 2
Fe 2 O 3 + H 2 O ≠
б) Взаимодействие с кислотами.
- Все ли основные оксиды взаимодействуют с кислотами при обычных условиях? (Только основные оксиды, образованные активными металлами взаимодействуют с кислотами при обычных условиях, остальные – при нагревании.)
- Какие вещества образуются при взаимодействии основных оксидов с кислотами? (Соль и вода)
Запишем уравнения реакций.
CaO + 2HCl = CaCl 2 + H 2 O
Fe 2 O 3 + 6HCl t = 2FeCl 3 + 3H 2 O
в) Взаимодействие основных оксидов с кислотными оксидами.
MgO + CO 2 = MgCO 3
2) Химические свойства кислотных оксидов.
а) Взаимодействие с водой.
- Все ли кислотные оксиды взаимодействуют с водой? (Нет)
- Какие вещества образуются в результате взаимодействия кислотных оксидов с водой? (Кислоты)
Запишем уравнения реакций.
P 2 O 5 + 3H 2 O = 2H 3 PO 4
б) Взаимодействие с основаниями.
3) Химические свойства амфотерных оксидов.
а) Взаимодействие с кислотами.
PbO + 2 HNO 3 = Pb ( NO 3 ) 2 + H 2 O
б) Взаимодействие с o щелочами.
PbO + 2NaOH = Na 2 PbO 2 + H 2 O
Бывает двойственный оксид,
Он, позабыв и честь, и стыд,
То к сильной кислоте спешит,
То где-то щелочь сторожит.
И тем и другим поклоняется.
Как такой оксид называется?
По инструктивной карте (шаг №6), закончите уравнения химических реакций, отражающие химические свойства оксидов.
Наше исследование одного из классов неорганических соединений по плану закончено, но мы с вами будем, и в дальнейшем знакомится и изучать свойства таких веществ, как оксиды. Нам предстоит узнать много нового и интересного. В заключении еще несколько интересных видеороликов про оксиды. Но… Сначала отгадаем загадки!
Взяли магний подожгли,
Искры яркие видны.
Это что ж произошло?
Получили магний О.
В минеральной воде я бурлю,
В топочном газе летаю,
Растениям пользу несу,
Пожар затухать заставляю.
- На каком свойстве основано применение углекислого газа в огнетушителях?
Стадия рефлексии.
Сформулируем вывод урока. (На уроке познакомились с классом неорганических веществ – оксидами, выяснили их общие признаки, классификацию, познакомились со свойствами оксидов.)
- Что нового узнали на уроке?
- Что вызвало особый интерес?
- С каким настроением ухожу с урока?
4. Домашнее задание.
Проведите исследование, используя интернет-источник и другую справочную литературу, об использовании оксидов в ювелирной промышленности.
Инструктивная карта.
Оксиды – это ________________ вещества, состоящие из ______________ элементов, один из которых ________________ .
В предложенном перечне веществ выберите формулы веществ, относящиеся к оксидам. Обведите их в овал.
HCl, MgO, H 2 SO 4 , H 2 O, Na 2 O, NaOH, HNO 3 , CO 2 , K 2 SO 4 , CrO, Ca(OH) 2 , CO, ZnSO 4 , SO 3 , Na 2 CO 3 , N 2 O 5 , KOH, K 2 O, K 3 PO 4 , SO 2 , NH 3 , H 3 PO 4 , CaO, Cr 2 O 3 , Fe(OH) 3
Читайте также:
- Конспект уроку 3 клас спільнокореневі слова корінь слова
- Конспект мастер класса для детей
- Анализ программ с помощью трассировочных таблиц 11 класс конспект урока босова
- Конспект занятия по художественной литературе в старшей группе на тему посуда
- Культурное пространство империи в первой половине 19 века художественная культура конспект урока

