Общая характеристика металлов 9 класс химия конспект
Обновлено: 05.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Учитель химии А.В.Мазанова
Тема урока: Общая характеристика металлов
Дидактическая цель: создание условий для осознания и осмысления учебной информации посредством интерактивного включения учащихся в образовательный процесс
Задачи урока:
1. (достижение предметного результата). Знать строение и физические металлов, уметь объяснить связь строения атома и физических свойств.
2. (достижение метапредметного результата). Продолжить развивать умение генерировать идеи, выявлять причинно-следственные связи, искать аналогии и работать в команде, пользоваться альтернативными источниками информации
3. (достижение личностного результата) . Формирование умений управлять своей учебной деятельностью, подготовка к осознанию выбора дальнейшей образовательной траектории.
Тип урока: изучение и первичное закрепление нового учебного материала.
Методы обучения : проблемный, эвристический.
Формы организации познавательной деятельности: фронтальная, групповая, индивидуальная
Критерии успеха:
Я знаю особенности строения атома металла
Я могу показать зависимость физических свойств металла от его строения
Оборудование урока:
Загрузить презентацию (550 кБ)
Цели урока: познакомить учащихся с основными понятиями темы, со значением металлов в практической жизни человека
Планируемые результаты обучения:
- понятие металлической связи и металлической решетки;
- физические свойства металлов;
- роль металлов в уральском регионе, нахождение металлов в природе и значимость металлов в жизни человека;
- Давать общую характеристику металлов как элемента по положению в периодической системе и строению атома;
- Объяснять физические свойства металлов исходя из строения металлической кристаллической решетки.
Оборудование: презентация, наборы металлов (цинк, медь, алюминий), атласы с картой Свердловской области.
Ход урока
Сегодня мы приступаем к изучению нового раздела неорганической химии – химии металлов. (слайд 1)
М.В. Ломоносов также посвятил металлам вдохновенные строки:
I. Актуализация знаний
- Что вы знаете о металлах?
- Что вы хотите узнать? (какими свойствами физическими обладают и от чего они зависят? Как на практике используются металлы?)
- Для чего вам это нужно знать? (слайд 3)
Ребята отвечают на вопросы учителя, формируются цели урока
Цели: (слайд 4)
- Выяснить особенности строения металлов
- Познакомиться с физическими свойствами металлов
- Выяснить, от чего зависят физические свойства
- Познакомиться, как связаны физические свойства и использование металлов
Чтобы ответить на эти вопросы мы должны с вами выполнить большую работу по изучению нового материала и приобретению знаний.
II. Изучение нового материала
О каких металлах идет речь:
К группе черных отношусь,
В тяжелой металлургии – главный.
Своею ролью я горжусь –
и в эритроцитах содержусь.
(железо)
Царем металлов меня считают
И благородным называют,
Пленяю я блестящей желтизной,
Ничто не сравнится с моей красотой
(золото)
Свободный – я красный,
В растворах солей – голубой,
В сельском хозяйстве я встречусь с тобой,
Мягко и быстро коваться могу.
Чтобы меня угадать,
Состав малахита и бронзы надо знать.
(медь)
С древних времён по средние века были известны только 7 металлов, которые соотносились с известными тогда планетами: Солнце – золото (Au), Юпитер – олово (Sn), луна – серебро (Ag), Марс – железо (Fe), Меркурий – ртуть (Hg), Сатурн – свинец (Pb), Венера – медь (Cu). (слайд 5)
Не зря в истории человечества выделяют века: медный, бронзовый, железный (слайд 6)
- почему именно в таком порядке?
- в каком веке мы живем?
- какие металлы добываются и перерабатываются на Урале? (слайд 7)
- по карте определите основные месторождения металлических руд и покажите их на карте
На Урале известны многочисленные месторождения высококачественных железных руд (горы Магнитная, Высокая, Благодать, Качканар), медных руд (Медногорск, Карабаш, Сибай, Гай), редких цветных металлов, золота, серебра, платины, лучших в стране бокситов, каменных и калийных солей (Соликамск, Березники, Берёзовское, Важенское, Ильецкое) (слайд 8)
Но металлы есть не только на нашей планете. Так на Луне обнаружено большое количество самородного железа. А где расположены металлы в периодической системе?
Пользуясь ПСХЭ, ответьте на вопрос:
Каких элементов больше: металлов или неметаллов?
Изобразите строение атома:
- группа – литий
- группа – магний
- группа – алюминий
Каковы особенности строения атомов металлов? (слайд 9)
- На внешнем уровне 1–3 электрона – но почему полоний, висмут тоже металлы?
- Большие атомные радиусы. Какой способностью восстановительной или окислительной обладают атомы металлов?
- Легко отдают валентные электроны (восстановительная способность)
Как располагаются металлы в периодической системе? (слайд 10)
1 группа – щелочные металлы(слайд 11)
2 группа – щелочноземельные металлы, (слайд 12)
Как изменяются свойства металлов в ПС?
От чего зависят свойства металлов?
Металлическими называют решётки, в узлах которых находятся атомы и ионы металла, между ними свободные электроны. (Слайд 13)
Учитель: Итак, металл – это вид атомов, способных легко отдавать при химических реакциях электроны, входить в состав химических соединений в виде положительно заряженных ионов, а также образовывать простые вещества с характерными для металлов физическими свойствами. Рассмотрите образцы металлов (на столах пластинки трех металлов – медь, алюминий и цинк)
- в каком агрегатном состоянии находятся металлы?
1. Твердые (исключение ртуть – жидкий металл при комнатной температуре)
А алюминий и цинк можно отличить по цвету? А как отличим?
Пластичность – способность изменять свою форму при ударе, прокатываться в тонкие листы, вытягиваться в проволоку.
В чем причина пластичности металлов? В этом нам поможет разобраться следующий опыт: две стеклянные пластинки смачиваем водой и прижимаем друг к другу. Они легко скользят друг по другу, но их трудно разъединить. Прослойка воды имитирует свободные электроны, а значит причина пластичности – также особое строение кристаллической решетки.
Какие еще свойства присущи металлам? электропроводность, теплопроводность, металлический блеск, твердость.
Учитель: Как можно объяснить наличие общих физических свойств у такого большого числа разнообразных простых веществ?
Учащиеся делают вывод: причина в особенностях металлической связи, структуре кристаллов металлического типа.
Учитель: Действительно, электрическая проводимость металлов объясняется движением свободных электронов. Почему при нагревании электрическая проводимость металлов уменьшается? (стр. 30 учебника Габриеляна, 9 класс)
- в чем причина электропроводности металлов, какие металлы самые лучшие проводники тока, что такое сверхпроводимость? – отвечают на вопросы)
Чем обусловлена теплопроводность, и как она изменяется при нагревании? (стр30).
металлический блеск (из-за отражения света от их поверхности). (слайд 14)
Как блеск может применяться на практике?
Высокая отражающая способность позволяет использовать металлы при производстве зеркал, оптических линз, кровельных изделий. Алюминий используется для создания помех в радиолокации, для производства теплостойкой защитной одежды для пожарных.
Другие свойства (слайд 15)
плотность:
- лёгкие ρ 3 – Li, K, Ca, Al.
- тяжёлые ρ > 5 г/см 3 – Sn, Pb, Hg, Fe, Os.
Как это свойство применяется на практике?
Многие лёгкие металлы используются для производства лёгких сплавов в машиностроении, авиа – и судостроении. Снижение массы машины даёт преимущества в скорости, дальности, высоте. Тяжёлые металлы для производства гирь, монет, решёток, цепей, тяжёлых машин.
температура плавления:
Как это свойство применяется на практике?
Тугоплавкие металлы используются для изготовления нитей накаливания электроламп, при производстве жаропрочных сталей.
Твердость
Твердые и мягкие
Ковкость (слайд 16), где используется?
Итак, какими физическими свойствами обладают металлы? (слайд 17) Почему?
III. Закрепление
– Поясните, почему металлы использованы именно таким образом, а не наоборот (слайд 18)

- какие металлы относят к черным, цветным, драгоценным?
- какие металлы самые распространенные на земле? (алюминий, железо, кальций)
IV. Подведение итогов

Образовательная: обобщить и ситематизировать знания обучающихся об особенностях строения атомов металлов главных и побочных подгрупп, их химических свойствах. Закрепить навыки сравнения и обобщения химической активности металлов в электрохимическом ряду напряжений металлов.
Развивающая: развивать интерес к предмету, формировать умение обобщать и сравнивать, логически рассуждать, применять свои знания на практике.
Воспитательная: воспитывать умение работать в группе, помогать другим.
Методы обучения: беседа, демонстрация опытов, фронтальная работа с классом, групповая работа учащихся, контроль и самопроверка знаний учащимися.
I. Организационный момент.
Учитель приветствует учащихся, определяет готовность к уроку.
Актуализация знаний.
Цель нашего урока: обобщить ваши знания по данной теме, дополнить их новыми, полученными при проведении познавательных опытов, расширить кругозор и подготовиться к экзамену по химии.
План урока:
1. Происхождение металлов.
2. Положение металлов в периодической системе химических элементов Д.И.Менделеева. Щелочные и щелочноземельные металлы .
3. Особенности строения атомов металлов (Сравнение с неметаллами)
4. Химические свойства металлов.
Изучение нового материала
- У учащихся лежат на партах различные металлические предметы (ложка алюминиевая, гвоздь железный, медная проволока, разные пластинки)
- Каждый ученик называет металл
Жизнь без металлов невозможна,
И эта аксиома непреложна:
Твердые, блестящие, ток проводящие,
Для человека металлы – друзья настоящие!
- Какую роль играют металлы для организма? (железо – гемоглобин, кальций – укрепляет кости, магний – источник энергии)
2. Положение металлов в периодической системе химических элементов Д.И.Менделеева. Щелочные и щелочноземельные металлы.
- Каждый период (кроме 1) начинается с активного элемента – металла. Их называют щелочными. Свое название они получили от названия соответствующих им гидрооксидов, хорошо растворимых в воде, - щелочей (обратиться к таблице растворимости) NaOH, LiOH
- 2 А группа – тоже типичные металлы (Ca, Sr, Ba – щелочноземельные)
- Элементы побочных групп – все металлы
Особенности строения атомов металлов (Сравнение с неметаллами)
Сравним строение K O
Ca Cl
Al
Атомы металлов имеют на внешнем энергетическом уровне от 1 до 3 электронов. Отсюда вытекает самое характерное химическое свойство всех металлов – их восстановительная способность, т.е способность отдавать внешние электроны, превращаясь в положительные ионы.
Проверим на примере реакции взаимодействия 2Na + Cl = 2NaCl (ОВР)
На примере получившегося вещества NaCl (что будет происходить с электронами)
Химические свойства металлов.
Перед выполненем лабораторных опытов необходимо помнить
о правилах техники безопасности:
Не приступайте к выполнению опыта, не получив инструкции от учителя.
Твердые вещества необходимо набирать только сухим шпателем.
Наливайть жидкость в пробирку необходимо осторожно.
При выяснении запаха веществ необходимо осторожно направлять его к себе ладонью руки.
Нагревая пробирку с жидкостью, необходимо держите ее так, чтобы отверстие пробирки было направлено в сторону от самого себя, и от других учащихся. .
В случае ожога, пореза или попадания едкой и горячей жидкости на кожу или одежду немедленно обращайтесь к учителю.
1. Взаимодействие металлов с неметаллами
2Na + Cl2 = 2NaCl
2. Взаимодействие металлов с водой. (рис104, с 130)
3. Взаимодействие металлов с растворами кислот (рис 97 с.121)
Условия: - металл находится левее Н
- должна образоваться растворимая соль
- не рекомендуется использовать ШМ, т.к. они прореагируют с водой
- по особому реагируют концентрированная серная и азотная кислоты, при этом водород не образуется.
Zn + 2HCl = ZnCl2 + H2
2CH3COOH + Zn = (CH3COO)2Zn + H2
4. Взаимодействие металлов с растворами солей
Условия: - металл находится левее Н
- должна образоваться растворимая соль
- не рекомендуется использовать ШМ, т.к. они прореагируют с водой
Рис.98 с. 121
Fe + CuSO4 = Cu + FeSO4(растворимая соль)
V. Закрепление знаний, умений, навыков.
Используя знания о химических свойствах металлов, объясните, почему нельзя:
1. Хранить литий на воздухе (окисляется и изменяет свои свойства)
2. Использовать для прекращения горения натрия воду:( натрий - щелочной металл, в результате взаимодействия натрия с водой выделяется кислород, горение не прикратиться, если взрыва не будет. нужно кварцевым песком засыпать.)
3.Хранить кислые щи в алюминиевой посуде: (Кислые щи нельзя хранить в алюминиевой посуде,потому что оксид алюминия(т.е. Al2O3) который защищает алюминий, растворяется под действием кислоты, и алюминий начинает взаимодействовать с водой.)
А1. Электронная конфигурация атома металла:
1) 1s 2 2s 2 2p 4 3) 1s 2 2s 2 2p 2
2) 1s 2 2s 2 2p 6 3s 1 4) 1s 2
А2. В какую частицу превратится атом, отдав электроны до завершения внешнего уровня? Са 0 – 2 е →
А3. Из приведённых ниже формул веществ выпишите формулы щелочных металлов:

К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?
Общая характеристика
Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
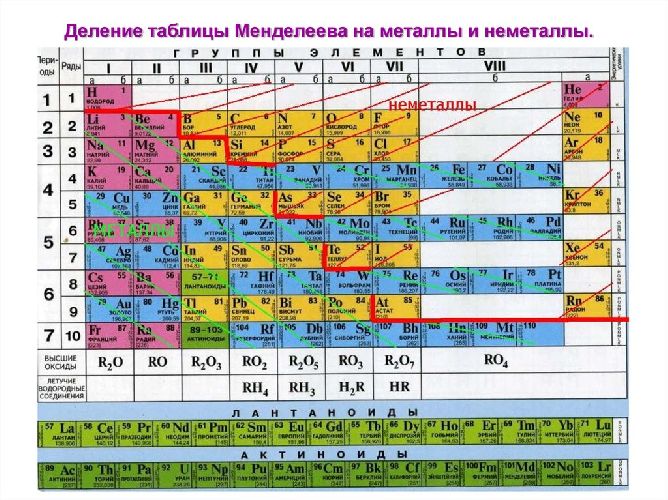
Рис. 1. Список металлов.
Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие. К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов. Образующиеся положительные ионы устойчивы, так как имеют завершенную внешнюю электронную оболочку.
Физические и химические свойства
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.

Рис. 2. Металлы в таблице Д.И. Менделеева.
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т.д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см 3 ), самый тяжелый – осмий (плотность 22,5 г/см 3 ). Металлы с плотностью больше 5 г/см 3 относят к тяжелым, меньше 5 г/см 3 – к легким металлам.
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают

Рис. 3. Металлы главных подгрупп.
Нахождение металлов и способы их получения
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Что мы узнали?
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.
Читайте также:

