Марганец конспект по химии
Обновлено: 09.07.2024
"Марганец и его соединения" одна из сложных тем для выпускников, вопросы по которой очень часто встречаются в ЕГЭ и на базовом, и на повышенном уровнях.
В матераиале дается краткое теоретическое введение, затем задания для самостоятельной работы, которые можно использовать и как проверочные вопросы при подготовке к итоговой аттестации.
| Вложение | Размер |
|---|---|
| Задания для самостоятельной работы по теме "Марганец и его соединения" при подготовке к ЕГЭ | 22.16 КБ |
Предварительный просмотр:
Марганец является элементом побочной подгруппы VII группы. Это
С повышением степени окисления марганца ослабевают основные и усиливаются кислотные свойства оксидов и гидроксидов. MnO и Mn 2 O 3 и соответствующие им гидроксиды Mn(OH) 2 и Mn(OH) 3 имеют основной характер. Нерастворимый в воде Mn(OH) 2 на воздухе вследствие окисления кислородом постепенно переходит в бурый Mn(OH) 3 :
4Mn(OH) 2 + O 2 + 2H 2 O = 4Mn(OH) 3
Окончательным продуктом окисления является коричневый оксид- гидроксид марганца:
4Mn(OH) 3 + O 2 + 2H 2 O = 4Mn(OH) 4 = 4MnO(OH) 2 + 4H 2 O
Соли марганца (II) и их концентрированные растворы обычно окрашены в светло-розовый цвет. Соединения марганца (II) – восстановители.
Оксид марганца (IV) MnO 2 – темно-бурое нерастворимое в воде вещество, наиболее устойчивое кислородное соединение марганца при обычных условиях. Обладает слабо выраженными амфотерными свойствами. С концентрированной H 2 SO 4 он дает крайне неустойчивую соль Mn(SO 4 ) 2 , а при сплавлении со щелочами образует манганиты:
MnO 2 + 2KOH = K 2 MnO 3 + H 2 O.
MnO 2 − сильный окислитель, при этом он восстанавливается до солей марганца (II): MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O.
Действием более сильных окислителей MnO 2 может быть окислен до соединений Mn (VI), Mn (VII):
2MnO 2 + 4KOH + O 2 = 2K 2 MnO 4 + 2H 2 O.
K 2 MnO 4 − манганат калия, соль не выделенной в свободном состоянии марганцовистой кислоты H 2 MnO 4 . Не получен и оксид Mn (VI) – MnO 3 . Растворы манганатов окрашены в темно-зеленый цвет, присущий ионам MnO 4 2− . Они устойчивы только в сильнощелочной среде, при разбавлении раствора водой манганаты диспропорционируют:
3K 2 MnO 4 + 2H 2 O = 2КMnO 4 + MnO 2 + 4KOH.
Все производные Mn (VI) являются окислителями, особенно в кислой среде. Однако при действии более сильных окислителей они превращаются в соединения марганца (VII): K 2 MnO4 + Сl 2 = 2КMnO 4 + 2KCl.
Оксид марганца (VII) Mn 2 O 7 – зеленовато-черная жидкость, сильный окислитель. Растворим в воде. Отвечающая ему марганцовая кислота HMnO 4 известна только в растворах. Эти растворы, а также растворы ее солей (перманганаты), окрашены в фиолетово-малиновый цвет, характерный для иона (MnO 4 ) − . При нагревании перманганаты разлагаются с выделением кислорода: 2КMnO 4 = K 2 MnO 4 + MnO 2 + O 2 .
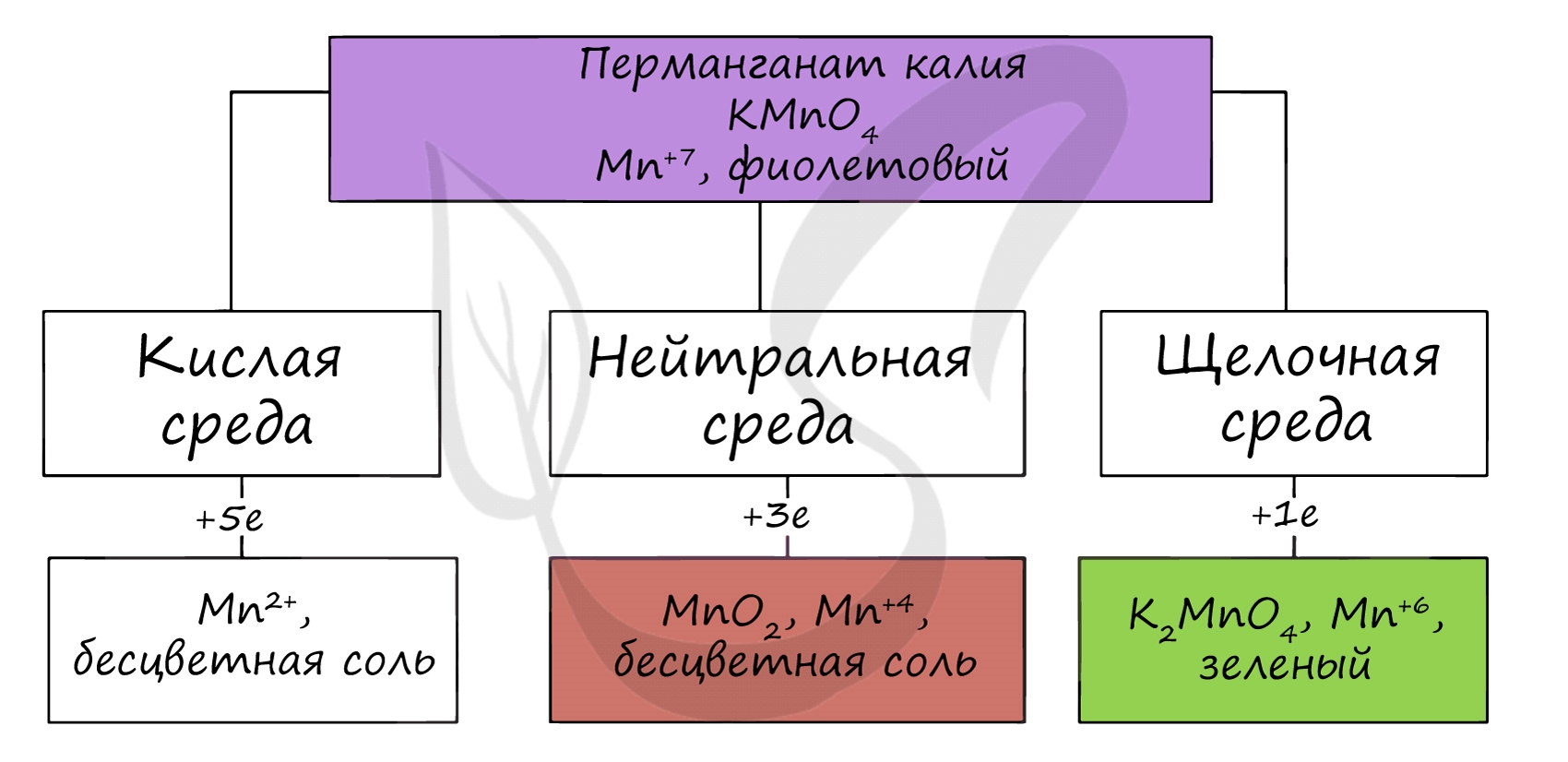
Производные Mn (VII) – сильные окислители. В кислой среде они восстанавливаются до солей марганца (II), в нейтральной, а также в слабокислой и слабощелочной – до MnO 2 , в сильнощелочной до манганатов, которые затем постепенно переходят в соединения Mn (IV).
Задачи и упражнения для самостоятельного решения
1 . Как получить сульфат марганца (II) из: а) оксида марганца (II);
б) металлического марганца;
Составить соответствующие уравнения реакций.
2 . Какая масса перманганата калия потребуется для окисления 7,6 г FeSO 4 в
кислой среде? ( Ответ : 1,58 г).
3 . Расставить коэффициенты в уравнении реакции:
KMnO 4 + PH 3 + H 2 SO 4 = H 3 PO 4 + ….
Какая масса H 3 PO 4 образуется, если в реакции участвовало 17 г PH 3 ?
4 . Под действием HNO 3 манганаты диспропорционируют следующим
образом: 3K 2 MnO 4 + 4HNO 3 = 2KMnO 4 + MnO 2 + 4KNO 3 + 2H 2 O.
Какой объем раствора HNO 3 (ρ = 1,185 г/мл) с массовой долей 30 % необходим для получения 9,48 г перманганата калия? ( Ответ : 21,3 мл).
5 . Как получить соединения марганца (VI) из соединений с более высокой и с более низкой степенью окисления? Составить соответствующие уравнения реакций.
6 . Окисление сульфата железа (II) перманганатом калия в нейтральной среде
протекает по уравнению KMnO 4 + FeSO 4 + Н 2 О = FeОНSO 4 + ….
Какая масса перманганата калия потребуется для окисления 7,6 г FeSO 4 ?
7 . Закончить уравнения реакций: а) MnO + H 2 SO 4 = …;
б) Mn 2 O 7 + KOH = …;
в) MnSO 4 + KClO 3 + KOH = сплавление K 2 MnO 4 + ….
8 . Закончить уравнения реакций, в которых соединения марганца проявляют свойства: а) окислительные Fe(OH) 2 + KMnO 4 + H 2 O = …;
б) восстановительные MnSO 4 + PbO 2 + HNO 3 = …;
в) окислительные и восстановительные одновременно K 2 MnO 4 + H 2 O = ….
9 . Почему оксид марганца (IV) может проявлять и окислительные и
восстановительные свойства? Закончить уравнения реакций:
а) MnO 2 + KI + H 2 SO 4 = …;
б) MnO 2 + KNO 3 + KOH = ….
10 . Как меняется степень окисления марганца при восстановлении KMnO 4 в кислой, щелочной и нейтральной среде? Закончить уравнения реакций:
а) KMnO 4 + К 2 SO 3 + H 2 SO 4 = …;
б) KMnO 4 + К 2 SO 3 + КОН = …;
в) KMnO 4 + К 2 SO 3 + H 2 O = ….
11 . Восстановление перманганата калия сульфатом железа (II) в кислой
среде протекает по уравнению KMnO 4 + FeSO 4 + H 2 SO 4 =….
На восстановление KMnO 4 израсходовано 47 мл 0,208 н. раствора FeSO 4 . Какая масса KMnO 4 содержалось в исходном растворе? ( Ответ : 0,154 г).
12 . Закончить уравнения реакций: а) Mn + H 2 SO 4 (разб.) = …;
в) MnCl 2 + H 2 O ↔ …;
г) Mn + HNO 3 (разб.) = ….
13 . Окисление сульфата железа (II) перманганатом калия в щелочной среде протекает по уравнению KM nO 4 + FeSO 4 + КОН = FeОНSO 4 + ….
Какая масса перманганата калия потребуется для окисления 7,6 г FeSO 4 ?
14 . Как можно перевести в растворимое состояние марганец? Составить
соответствующие уравнения реакций.
15 . Закончить уравнения реакций: NaNO 2 + KMnO 4 + H 2 SO 4 = ….
16 . Закончить уравнения реакций: а) KMnO 4 + H 2 SO 4 (конц.) = …;
б) Mn 2 O 7 + HCl = …;
в) Mn 2 O 7 + NaOH = …;
17 . Закончить уравнения реакций: а) K 2 MnO 4 + Cl 2 = …;
б) Mn(NO 3 ) 2 + H 2 O ↔ …;
в) MnSO 4 + H 2 O ↔ …;
Реакции б), в), г) написать в молекулярном и ионно-молекулярном виде.
По теме: методические разработки, презентации и конспекты

Бинарные соединения – оксиды и летучие водородные соединения
урок знакомит более подробно с оксидами, их применением, физическими и химическими свойствами. также даётся основное правило современной международной номенклатуры .

Важнейшие классы неорганических соединений. Генетическая связь между классами неорганических соединений.
Цели:1)Обобщить и систематизировать знания учащихся о составе, номенклатуре важнейших классов неорганических соединений, химических свойствах, генетической связи ; совершенствовать навыки состав.

важнейшие классы бинарных соединений - оксиды и летучие водородные соединения
презентация по данной теме может быть использована для проведения урока химии в 8 классе по программе Габриеляна О.С. Содержит 12 слайдов, позволяющие актуализировать знания обучающихся по ранее изуче.

"Основные классы неорганических соединений. генетическая связь неорганических соединений"
Заключительный урок обобщения по химии в 8 классе.

Урок по теме "Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения."
Открытый урок по химии по теме "Важнейшие классы бинарных соединений - оксиды и летучие водородные соединения". с применением интерактивной приставки MIMIO.

презентация на тему "Марганец"
Данная презентация может быть использована при изучении химии в 11 классе на профильном уровне (УМК Габриелян О. С.).
Постерная презентация по теме "Марганец"
Постерная презентация является продуктом творческой работы учащихся и может быть использована при изучении соответствующей темы. Содержит материал достаточный для изучения темы на профильном уровне.
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.


- MnO2 - пиролюзит
- MnO(OH) - бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 - браунит

Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + C = (t) Mn + CO
-
Реакции с неметаллами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.

При нагревании марганец вытесняет водород из воды.
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.

Соединения марганца (II)
Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо восстановлением оксида марганца (IV) до оксида марганца (II).
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II).
Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV).
Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие соли.

Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если выпадает осадок, выделяется газ или образуется слабый электролит.
При действии сильных окислителей ион Mn 2+ способен переходить в ион Mn 7+
Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II).

В реакциях с щелочами марганец переходит в СО +6, в кислой среде - принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2 (гидролиз карбоната натрия идет по аниону, среда - щелочная)

Соединения марганца (VI) - MnO3, H2MnO4 - неустойчивы, в свободном виде не получены. Обладают кислотными свойствами. Наиболее устойчивые соли - манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.

Соединения марганца (VII) - неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 - проявляют кислотные свойства. Соли марганцовой кислоты - перманганаты.
В различных средах - кислотной, нейтральной и щелочной - марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
Оксид марганца (VII) получают в реакции перманганата с сильными кислотами.
При растворении оксида марганца (VII) (кислотного оксида) в щелочи образуются соли марганцовой кислоты - перманганаты.
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II).
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
При нагревании перманганата калия (в быту - марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.

При стоянии в растворе постепенно разлагается водой.
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) - Mn 2+ , в щелочной - Mn 6+ .
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke - зубец. С древнейших времен известен сплав меди с цинком - латунь.

Для цинка характерна постоянная степень окисления +2.

- ZnS - цинковая обманка, сфалерит
- ZnO - цинкит
- ZnCO3 - симсонит, цинковый шпат
- 2ZnO*SiO2*H2O - гемиморфит

Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка различными восстановителями: чаще всего C, также возможно CO и H2.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2

Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
-
Реакции с неметаллами (и аммиаком :)
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.

Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями. При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка (II)
Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или при разложении нитрата цинка.
Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2
Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами.

Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
При прокаливании комплексные соли распадаются, вода испаряется.
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом, серебро обладает низкой реакционной способностью.

-
Реакции с неметаллами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов. При нагревании с серой получается сульфид серебра.
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.

В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра - аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Марганец — элемент 4-го периода и VII B-группы Периодической системы, порядковый номер 25. Электронная формула атома [ 18 Аr]Зd 5 4s 2 ; характерные степени окисления + VII,+ VI, +IV, +III, +II и 0.
Шкала степеней окисления марганца:
По электроотрицательности (1,60) марганец занимает промежуточное положение между типичными металлами (Na, К, Са, Мg) и неметаллами (F, O,N, Cl). Соединения Мn ‖‖ — оксид и гидроксид — проявляют основные свойства, соединения Мn ‖‖‖ и Мn IV — амфотерные свойства, для соединений Мn VI и Мn VII характерно почти полное преобладание кислотных свойств. Марганец образует многочисленные соли и бинарные соединения.
В природе — четырнадцатый по химической распространенности элемент (восьмой среди металлов; второй, после железа, тяжелый металл).
Марганец М n . Серебристо-белый (с серым оттенком) металл, более твердый и хрупкий по сравнению с железом. В виде мелкого порошка пирофорен. На воздухе покрывается оксидной пленкой. Пассивируется в воде, поглощает водород, но не реагирует с ним.
При нагревании сгорает в кислороде воздуха, реагирует с хлором и серой:
Mn →( O 2 , до450 o C ) MnO 2 →( O 2 , до 800 o C ) Mn 2 O 3
Mn→ MnO +( Mn II Mn 2 II ) O 4 “ окалина “ ( O2, выше 800 o C)
Mn+Cl 2 →MnCl 2 , (200 o C) Mn+S→ MnS (до1580 o C)
В ряду напряжений марганец стоит левее водорода, из разбавленных кислот НCl и Н 2 SO 4 вытесняет водород:
Взаимодействует с кислотами-окислителями при нагревании, также образуя соли марганца (II):
Получение марганца в промышленности — восстановление пиролюзита МnO 2 или гаусманита (Мn II Mn II I )O 4 коксом или алюминием:
МnO 2 + С (кокс) = М n + СO 2 (600 °С)
3(Мn II Mn III )O 4 + 8Аl = 9 М n + 4А1 2 O 3 (700-900 °С)
Наиболее чистый марганец выделяют электролизом раствора из солей марганца (П), например:
2MnSO 4 +2H 2 O→ 2 Mn ↓+ O 2 ↑+2H 2 SO 4 (40 o C, эликтролиз)
Промышленно важен сплав с железом — ферромарганец (> 70 % Мn), его получают восстановлением оксидных руд марганца и железа.
Применяется марганец для изготовления специальных и тугоплавких сплавов, зеркального чугуна и марганцевых твердых сталей, в качестве катализатора в органическом синтезе.
Оксид марганца (IV) М nO 2 . Черный, с коричневым оттенком, при нагревании разлагается. Из раствора осаждается в виде черного гидрата МnO 2 nН 2 O. Не проявляет амфотерных свойств в силу малой реакционной способности по отношению к воде, разбавленным кислотам НCl и Н 2 SO 4 , азотной кислоте и щелочам в растворе. Типичный окислитель в растворе и расплаве, менее характерны свойства восстановителя.
Уравнения важнейших реакций:
В природе самое распространенное соединение марганца — минерал пиролюзит
Манганат калия К 2 MnO 4 . Оксосоль. Темно-зеленый, плавится под избыточным давлением О 2 . В растворе устойчив только в сильнощелочной среде. Зеленая окраска раствора отвечает иону МnO 4 2- . Медленно разлагается при разбавлении раствора водой, быстро — при подкислении. Проявляет окислительно-восстановительные свойства.
Качественная реакция — появление фиолетовой окраски при подкислении раствора. Промежуточный продукт при синтезе КMnO 4 .
Уравнения важнейших реакций:
Получение: сплавление МnO 2 с сильными окислителями (KNO 3 , КClO 3 ).
Перманганат калия КМ nO 4 . Оксосоль. Красно-фиолетовый (почти черный). При нагревании разлагается без плавления. Умеренно растворим в воде ( интенсивно-фиолетовая окраска раствора отвечает иону МnO 4 ), гидролиза нет. Медленно разлагается в воде, серной кислоте, щелочах. Сильный окислитель в растворе и при сплавлении; в сильнокислотной среде восстанавливается до Мn II , в нейтральной среде – до Mn IV в сильнощелочной среде — до Мn VI

Качественная реакция на ион МnO 4 — исчезновение фиолетовой окраски раствора при восстановлении в кислотной среде.
Применяется как окислитель углеводородов до карбоновых кислот, реактив в фотографии, антисептик в медицине, средство для очистки газов и отбеливания тканей, твердый источник кислорода. Распространенный окислитель в лабораторной практике. Уравнения важнейших реакций:
2МnO 4 — + 16Н + +10I — = 5I 2 +2Мn 2+ + 8Н 2 O
2МnO 4 — + 6Н + + 5SO 3 2- =2Мn 2+ + 5SO 4 2- + ЗН 2 O
МnO 4 — + 8Н + + 5Fе 2+ = Мn 2+ + 5Fе 3+ + 4Н 2 O
2МnO 4 — + 6Н + + 5NO 2 — = 2Мn 2+ + 5NО 3 — + 3Н 2 O
2МnO 4 — + 2Н 2 O + ЗМn 2+ = 5МnO 2 ↓ + 4Н + (50-80 °С)
Загрузить презентацию (824 кБ)
Обучающая – изучение и закрепление нового материала по данной теме, а также обучение навыкам самостоятельной работы с конспектом, справочной литературой, компьютерным текстом и тестами, применение теоретических знаний к решению задач и объяснению результатов проведенных опытов;
Развивающая – развитие умений анализировать и делать выводы, устанавливать причины полученных результатов, развитие навыков самостоятельной и коллективной работы;
Воспитательная – привитие интереса к изучаемому предмету, к самоорганизации и культуре труда, а также чувства бережного отношения к природным ресурсам и охраны окружающей среды.
Наглядные пособия: таблицы “Периодическая система Д.И.Менделеева”, “Электрохимический ряд напряжений металлов”, “Растворимость соединений”, карточки-задания с уравнениями реакций, с цепочками превращений, методическое пособие “Окислительно-восстановительные реакции”, учебники;
Компьютерное обучение: компакт-диск “Общая и неорганическая химия” (раздел “Характеристика d-элементов”).
Ход занятия
I. Организационный момент.
Приветствие, отметка в журнале отсутствующих, ознакомление с темой и планом работы на данном занятии.
II. Повторение.
Преподаватель напоминает, что мы продолжаем изучать свойства d-элементов. Какие d-элементов (переходные) мы уже прошли? (правильно, это элементы I-ой группы – серебро, медь, II-ой группы – цинк, ртуть, элемент VI-ой группы - хром). Что же характерно для всех этих переходных элементов? (Правильно, образование комплексных соединений, часто сами вещества и их растворы бывают окрашены, а также что все d-элементы- металлы) [2]. Вспомним электронные конфигурации d-элементов. Какой или какие слои заполняются электронными (правильно, предвнеший d-слой и внешний s-слой). Напоминаю, что именно из-за наличия d-оболочки свойства этих элементов отличаются от свойств элементов основных групп. Поэтому их выделили в так называемые побочные подгруппы.
III. Объяснение нового материала.
(По ходу объяснения материала учащиеся ведут записи в своих тетрадях, т.е. составляют конспект лекций – подготовка к традиционному вузовскому обучению. Кроме этого, постоянно идет диалог учитель-ученик для лучшего понимания и усвоения нового материала).
Например, учитель говорит: “А теперь, давайте рассмотрим историю открытия данного элемента”. Выходит 1-й докладчик по данной теме (история открытия марганца). 2-й докладчик выступает по теме “Нахождение марганца в природе”, 3-й – “Получение”.
Заканчивается прохождение новой темы выступлением учащегося по применению марганца и его биологической роли (Применение, биологическая роль).
IV. Закрепление пройденного материала.
Для этого учитель делит учеников на три рабочие группы: “Теоретики”, “Экспериментаторы” и “Промышленники” (каждый ученик заранее подготовил себе персональный бейджик с названием своей группы и своим именем с целью формирования у учащихся чувства ответственности за порученное дело и полученный результат, уважения к себе и своим сверстникам, а также для поднятия уровня собственной самооценки).
Каждая группа получает некоторое задание, в ходе выполнения которого идет активная проработка нового и закрепление пройденного раннее материала, поиск нестандартных решений, формируются чувства коллективизма, навыки самостоятельной работы.
Задание группе -теоретиков. После занятий в классе на рабочем столе был найден листок с написанными уравнениями химических реакций. Середину листа закрывало большое коричневое пятно. Попробуйте восстановить уравнения.
Задание группе –экспериментаторов [4]. Даны следующие вещества: KI, H2SO4, KMnO4, NaOH, FeSO4 ·7H2O, H2O2, H2O.
1.Назовите указанные вещества.
2.Выберите те из них, которые относятся к :
а) окислителям;
б) восстановителям.
3. Вспомните влияние среды на характер протекания ОВР и напишите уравнения полуреакций в ионном виде для следующих веществ:
Превращения KMnO4 в:
а) кислой среде;
б) щелочной среде;
в) нейтральной среде;
а) кислой среде;
б) щелочной среде.
4. Напишите все возможные ОВР между указанными вначале веществами в молекулярной форме. Уравняйте их методом электронно-ионного баланса. Укажите на количественный критерий возможности протекания данных ОВР (использование справочника).

Марганец -серебристо-белый (с серым оттенком) металл, более твердый и хрупкий по сравнению с железом. В виде мелкого порошка пирофорен. На воздухе покрывается оксидной пленкой. Пассивируется в воде, поглощает водород, но не реагирует с ним.

Рений относится к группе переходных металлов. Как простое вещество рений при нормальных условиях представляет собой плотный блестящий серебристо-белый металл.
В ряду Mn – Tc – Re химическая активность понижается. Mn – металл средней активности, в ряду напряжений стоит до водорода и растворяется в соляной и серной кислотах:
С увеличением степени окисления усиливается кислотный характер оксидов и гидроксидов. (RO – основные; R2O7 – кислотные, им соответствуют кислоты HRO4).
Электронная формула атома [ 18 Аr]Зd 5 4s 2 ; характерные степени окисления + VII,+ VI, +IV, +III, +II и 0.

Металл средней активности. На воздухе покрывается тонкой плёнкой оксидов. Реагирует с неметаллами, например, с серой:
Mn + S → MnS
Растворяется в кислотах:
Mn + 2HCl → MnCl2 + H2 ↑
(При этом образуются соединения двухвалентного марганца).
Читайте также:

