Конспект урока сложные эфиры
Обновлено: 07.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Продолжить формирование системы знаний о классах органических соединений и генетической связи между ними; способствовать закреплению понимания взаимосвязи химического строения веществ, свойств и применения на примере сложных эфиров.
Задачи урока.
1. Закрепить знания о механизме реакции этерификации.
2. Дать понятия о физических свойствах сложных эфиров, их номенклатуре.
3. Развить понятие о водородной связи, взаимном влиянии атомов, воздействии этих явлений на свойства веществ.
4. Способствовать развитию эрудиции, логического и ассоциативного мышления учащихся.
5. Развитие социальной активности учащихся через установление межпредметных связей химии с историей, биологией, медициной, литературой.
Методы и приемы: словесные, наглядные, практические – в логической взаимосвязи.
Оборудование и реактивы: Для демонстрации: пластиковая бутылка, лучина, спиртовка, спирт, спички, фрукты.
Для лабораторной работы: спиртовки, спирт, спички, пробирки, держатели, газоотводные трубки, уксусная кислота, изоамиловый спирт, вода.
I . Оргмомент.
II . Подготовка к изучению нового материала.
III Изучение нового материала.
Сложные эфиры – производные кислородсодержащих кислот (карбоновых и минеральных), в которых атом водорода гидроксильной группы замещен на углеводородный радикал.

Бутиловый эфир пропионовой кислоты
Пропионово бутиловый эфир
Мы подробно изучим сложные эфиры, являющиеся производными карбоновых кислот.
Выведем общую формулу сложных эфиров, образованных остатками предельных карбоновой кислоты и спирта. С n H 2 n O 2
Какие виды изомерии характерны для сложных эфиров? (Углеродного скелета, положения, межклассовая с карбоновыми кислотами.)
Задание по группам: Запишите изомерные вещества состава:
относящиеся к разным классам. Назовите все вещества.
Получение сложных эфиров:
1. Реакция этерификации
Задание по группам: Запишите уравнения реакций этерификации между следующими веществами:
масляной кислотой и этиловым спиртом (ананас)
масляной кислотой и бутиловым спиртом (персик)
масляной кислотой и метиловым спиртом (яблоко)
муравьиной кислотой и амиловым спиртом (пентанолом) (вишня)
бензойной кислотой и этиловым спиртом (жасмин)
уксусной кислотой и изобутиловым спиртом (банан)
уксусной кислотой и октиловым спиртом (апельсин)
уксусной кислотой и изоамиловым спиртом (груша)
Назовите получившиеся сложные эфиры разными способами (по международной и тривиальной номенклатуре ).
Взаимодействие хлорангидридов карбоновых кислот и спиртов СН3С-С l +НО-С2Н5
3. Взаимодействие хлорангидридов карбоновых кислот и алкоголятов щелочных металлов
4. Взаимодействие ангидридов карбоновых кислот и спиртов СН3СОССН3+НОСН3
5. Если в реакцию вступают двухосновные карбоновые кислоты и двухатомные спирты, то они могут друг с другом вступать в реакции поликонденсации (Что это за реакция?) с получением полиэфиров. Например, реакция между терефталевой (1,4-бензолдикарбоновой) кислотой и этиленгликолем (записать реакцию на доске).
Полученное вещество – полиэтилентерефталат (ПЭТ).
Давайте сами получим сложный эфир. Для этого проведем лабораторную работу по получению уксусноизоамилового эфира (изоамилацетата, изоамилового эфира уксусной кислоты)
Прежде всего нужно вспомнить правила техники безопасности при работе с кислотами и спиртовкой.
Правила техники безопасности при работе с концентрированной серной кислотой:
Наливать кислоту с помощью стеклянной палочки, остерегаться попадания кислоты на кожу, одежду, в глаза.
В случае ожога немедленно сообщить учителю, промыть большим количеством проточной воды, затем обработать раствором питьевой соды.
Правила техники безопасности при работе со спиртовкой:
Зажигать спиртовку спичкой, а не от другой спиртовки.
Не переносить горящую спиртовку с места на место.
Пробирку в держателе закреплять не слишком туго.
Вначале нагревать всю пробирку, а затем ту часть, где находится вещество.
Пробирку направлять не на себя и не на других людей.
Пламя спиртовки гасить колпачком.
Физические свойства сложных эфиров.
Сложные эфиры низших спиртов и низших карбоновых кислот – летучие жидкости с приятным фруктовым или цветочным ароматом, нерастворимые или плохо растворимые в воде с температурами кипения ниже, чем у изомерных карбоновых кислот. Почему? (Между молекулами сложных эфиров и молекулами сложных эфиров и воды не образуются водородные связи.)
Сложные эфиры высших карбоновых кислот и высших спиртов называются воски. Это твердые, пластичные, легко размягчающиеся вещества, чаще без запаха, обладают водоотталкивающим, смягчающим действием.
Применение сложных эфиров:
Из ПЭТ изготовляют пластиковые бутылки, прозрачные пленки, предметы быта. Это термопластичный полимер, который при 170 0 С переходит в вязкотекучее состояние. Из нитей ПЭТ получают синтетическое волокно – лавсан. Он не подвергается усадке, не боится влаги, устойчив против щелочей, кислот, бактерий, света, имеет высокую прочность на разрыв. Применяется для производства фильтров, войлока, технического сукна, брезентов, транспортерных лент, электроизоляции, тканей, в том числе тюли. Для изготовления тканей его сочетают с хлопком, льном, шерстью. Такие ткани не выгорают, стойки к истиранию и смятию, быстро высыхают. Их нельзя гладить горячим утюгом.
Так как сложные эфиры обладают приятным запахом, они используются в косметической и пищевой промышленности в качестве ароматизаторов.
Многие сложные эфиры применяются в качестве растворителей лаков и красок.
Из восков изготавливают политуры, смазки, пропиточные составы для бумаги (вощеная бумага) и кожи, они входят и в состав косметических кремов и лекарственных мазей.
IV . Рефлексивный тест.
Я узнал(а) много нового.
Мне это пригодится в жизни.
На уроке было над чем подумать.
На все возникшие у меня в ходе урока вопросы я получил(а) ответы.
На уроке я поработал(а) добросовестно и цели урока достиг(ла).
V . Домашнее задание. п.21, упр.3,9,10,11 (учебник О.С.Габриелян. Химия. Профиль. 10 класс.)

Процесс получения сложных эфиров носит название реакции этерификации. Эта реакция с использованием общих формул описывается уравнением

Именно реакцией этерификации в 1759 г. в результате взаимодействия уксусной кислоты с этиловым спиртом был получен первый сложный эфир — этиловый эфир уксусной кислоты:

Обратите внимание на то, как строится название сложного эфира. Оно состоит из четырёх слов, указывающих на название углеводородного радикала и исходной кислоты. Например, продукт взаимодействия муравьиной кислоты с метиловым спиртом — метиловый эфир муравьиной кислоты:
Катион водорода в схеме реакции указывает на то, что реакция этерификации протекает в присутствии кислоты в качестве катализатора.
Сложные эфиры с небольшой молекулярной массой представляют собой легковоспламеняющиеся жидкости с характерным, часто приятным запахом. Они нерастворимы в воде, но прекрасно растворяют различные органические вещества.
Нахождение в природе и применение сложных эфиров
Сложные эфиры широко распространены в природе. Неповторимый аромат цветов и фруктов часто обусловлен присутствием веществ именно этого класса. Сложные эфиры с большой молекулярной массой представляют собой твёрдые вещества — воски. Пчелиный воск — это смесь сложных эфиров, образованных карбоновыми кислотами и спиртами с длинными углеводородными цепями.
Синтетические сложные эфиры используют в пищевой промышленности в качестве добавок для придания фруктовых запахов напиткам и кондитерским изделиям. Благодаря хорошей растворяющей способности сложные эфиры входят в состав растворителей лаков и красок.
Жиры, их строение и свойства
Люди стали использовать жиры в повседневной жизни значительно раньше, чем задумались об их химическом строении. Животные и растительные жиры — важные компоненты пищи. Жиры необходимы для построения клеточных мембран и как источник энергии, поскольку калорийность жиров в 2 раза выше, чем других питательных веществ — углеводов и белков. У позвоночных животных жиры откладываются в жировой ткани, сосредоточенной в основном в подкожной жировой клетчатке и сальнике. В растениях жиры содержатся в сравнительно небольших количествах, за исключением семян масличных растений, в которых содержание жиров может быть более 50%.
Жиры используют не только в пищевой промышленности. Их используют в качестве смазки, косметических и лекарственных средств, для приготовления масляных красок и олифы.
В 1779 г. шведский химик К. Шееле получил из оливкового масла вязкую жидкость, сладкую на вкус, — простейший трёхатомный спирт глицерин. Вскоре выяснилось, что глицерин входит в состав молекул любых жиров. Позднее французский химик М. Шеврёль доказал, что, помимо глицерина, при нагревании жиров в присутствии кислоты образуются и карбоновые кислоты.

Общую формулу жиров можно представить в следующем виде:
В состав жиров чаще всего входят остатки карбоновых кислот, содержащих чётное число атомов углерода и неразветвлённую углеродную цепь. Наиболее часто в составе жиров встречаются остатки пальмитиновой, стеариновой и олеиновой кислот. В одной молекуле кислотные остатки могут быть различными, поэтому в общей формуле жиров углеводородные радикалы R обозначены разными цифрами.
Сравните состав стеариновой (С17Н35СООН) и олеиновой (С17Н33СООН) кислот. У стеариновой кислоты углеводородный радикал отвечает формуле СnН2n+1, т. е. является предельным. Следовательно, стеариновая кислота относится к предельным карбоновым кислотам. В углеводородном радикале олеиновой кислоты на два атома водорода меньше, поскольку в нём содержится одна двойная углерод-углеродная связь. Олеиновая кислота относится к непредельным карбоновым кислотам.
Жиры животного происхождения имеют твёрдую консистенцию (есть и исключения, например жидкий рыбий жир). В состав молекул твёрдых жиров входят остатки предельных кислот. Растительные жиры, которые часто называют растительными маслами, образованы остатками непредельных кислот, имеют жидкую консистенцию (исключение — твёрдое пальмовое масло). Кстати, название олеиновой кислоты произошло от латинского слова oleum — масло.
Жиры гидрофобны, т. е. нерастворимы в воде, но хорошо растворяются в органических растворителях: этиловом спирте, гексане, тетрахлорметане.

Жиры проявляют все характерные для сложных эфиров химические свойства. Главное из них — это гидролиз. Молекулы воды атакуют связи между кислотным остатком и фрагментом глицерина, в результате чего происходит распад молекулы жира:

Для жира, образованного стеариновой кислотой (такое вещество называют тристеаратом глицерина), уравнение реакции гидролиза выглядит следующим образом:
В качестве катализатора гидролиза жиров выступают кислоты. Такой гидролиз так и называют — кислотный гидролиз. Жирные руки трудно отмыть холодной водой, но стоит только протереть их ломтиком лимона, как они становятся заметно чище. Даже при таком непродолжительном контакте с лимонной кислотой жир частично гидролизуется.

Гидролиз жиров в присутствии щелочей называют щелочным гидролизом:
Щёлочь действует как катализатор, а также связывает образующиеся кислоты, превращая их в соли карбоновых кислот. Соли не способны вступать в реакцию этерификации с глицерином, и гидролиз становится необратимым. Неслучайно бытовые средства для удаления жира и засоров в раковинах более чем наполовину состоят из щёлочи.
Щелочной гидролиз жиров называют также омылением. Это название обусловлено тем, что образующиеся при этом натриевые и калиевые соли высших карбоновых кислот являются мылами.

Твёрдые жиры животного происхождения более ценны и дорогостоящи, чем жидкие растительные масла. Можно ли превратить жидкий жир в твёрдый химическим путём? Если вы вспомните, что растительные масла, в отличие от животных жиров, содержат остатки непредельных кислот, то нетрудно догадаться: гидрированием двойных связей С=С растительные масла превращают в аналог твёрдых жиров. Полученный продукт называют саломасом, его используют для приготовления маргарина и других продуктов питания:
Подобный процесс в больших масштабах проводят на жировых комбинатах.
Двойные связи непредельных кислот в жидких жирах сохраняют способность к реакциям полимеризации. Это свойство используют при изготовлении олифы — натуральной (на основе льняного или конопляного масла) или синтетической. При нанесении на деревянную поверхность олифа под действием кислорода воздуха полимеризуется с образованием прочной защитной плёнки. Олифу используют и при изготовлении и разбавлении масляных красок.


образовательные: дать учащимся понятия о составе и строении сложных эфиров, отработать умение выделять общие существенные свойства, на основе которых вещества объединяются в класс сложных эфиров, рассмотреть получение и применение сложных эфиров, дать понятие о реакции этерефикации.
развивающие: формировать умения составлять формулы сложных эфиров и называть их, умения составлять реакции гидролиза и этерефикации, развить знания учащихся о закономерностях химических реакций, об условии смещения химического равновесия, развитие логического мышления, внимания, памяти
воспитательные: воспитание познавательной активности, доброжелательности, уважения друг к другу, воспитание культуры общения
Тема урока: Сложные эфиры
образовательные: дать учащимся понятия о составе и строении сложных эфиров, отработать умение выделять общие существенные свойства, на основе которых вещества объединяются в класс сложных эфиров, рассмотреть получение и применение сложных эфиров, дать понятие о реакции этерефикации.
развивающие: формировать умения составлять формулы сложных эфиров и называть их, умения составлять реакции гидролиза и этерефикации, развить знания учащихся о закономерностях химических реакций, об условии смещения химического равновесия, развитие логического мышления, внимания, памяти
воспитательные: воспитание познавательной активности, доброжелательности, уважения друг к другу, воспитание культуры общения
Оборудование: образцы фруктовых эссенций, цветы, фрукты (лимон, апельсин), пихтовое и эфкалиптовое масла, мыло разных видов, духи и одеколоны, лаки
I Организационный момент
II Подготовка к восприятию нового материала
Обратите внимание на демонстрационный стол, вы видите на нем различные вещества. Это фрукты, лаки, духи, одеколоны, мыло разных видов. Как вы думаете, что объединяет все эти вещества между собой?
Выслушиваются ответы учащихся.
Правильно. Объединяет все эти вещества – наличие приятного запаха.
Послушайте гимн всем этим веществам
Управляют целым миром
В барбариске и ириске,
В мармеладке, в шоколадке,
В лепестках сирени майской –
Всюду их незримый след.
Несравненной розы алой
Они пленяют белый свет.
Чашка кофе по утрам и
От насморка бальзам,
Сливки с капельками жира-
Это сложные эфира.
Если спирт и кислота
Участвуют в реакции-
Фронтальный опрос
Какие вещества относятся к одноатомным спиртам? Приведите примеры первых пяти представителей гомологического ряда спиртов (метанол, этанол, пропанол, бутанол, пентанол). Формулу веществ записываются на доске.
Какая общая формула спиртов? (С nН2n +1 или R-ОН)
Какие вещества относятся к классу карбоновых кислот? Приведите примеры первых пяти представителей гомологического ряда кислот (метановая, этановая-уксусная, пропановая, бутановая-мсляная, пентановая-валериановая) . Формулу веществ записываются на доске.
Со сложными эфирами мы встречались, когда изучали свойства карбоновых кислот и спиртов. Давайте вспомним их химические свойства . Мы знаем, что при взаимодействии кислот со спиртами образуются новые вещества.
Записываем химическую реакцию.
С Н3СОО Н + ОН-С2Н5 → СН3СОО - С2Н5 + Н2О
этиловый эфир уксусной кислоты
Из данной реакции можно сделать вывод, что такое сложные эфиры. Сложные эфиры можно рассматривать как производные карбоновых кислот, в молекулах которых атом водорода карбоксильной группы замещен углеводородным радикалом или как производные спиртов, в молекулах которых гидроксильная группа замещена кислотным остатком органических кислот.

R – C
Где R и R′ - одинаковые и различные углеводородные радикалы
Номенклатура
Сложные эфиры в большинстве случаев называют по тем кислотам и спиртам, которые участвуют в их образовании, причем на первом месте в названии стоит кислота, а на втором спирт – кислота+спирт+эфир
СН3СОО - СН3 - уксуснометиловый эфир (или метиловый эфир уксусной кислоты)
СН3 -СН2-СОО – С2Н5 - пропионовоэтиловый эфир (или этиловый эфир пропионовой кислоты)
Н- СОО - СН3 - муравьинометиловый эфир (или метиловый эфир муравьиной кислоты)
Н- СОО - С2Н5 – (или метилметаноат)
СН3СОО - С2Н5 - этилацетат(или этилэтаноат)
Задание учащимся –
Дать названия по международной номенклатуре записанным выше спиртам
Составьте формулы эфиров
3. Запишите реакции этерефикации
А) пропановая кислота и этанол
Б) бутановая кислота и метанол
В) уксусная кислота и пропанол
Для сложных эфиров характерны следующие виды изомерии:
изомерия углеродной цепи (начиная с бутановой кислоты, по спиртовому остатку – с пропилового спирта)
2. межклассовая изомерия (например, для состава С3Н6О2 соответствует карбоновая кислота – пропановая – СН2-СН2-СООН и метилацетат - СН3СОО - СН3 )
Для состава С4Н8О2 - СН3 ––СН2––СН2––СООН (масляная /бутановая/ кислота) и СН3 ––СН2––СООН (2- метил пропановая /изомасляная/ кислота)
У сложных эфиров может быть изомерия в зависимости от состава углеводородного радикала. Для состава С4Н8О2соответствует три изомера
изомерия положения кратной связи (характерна для сложных эфиров, содержащих непредельную кислоту или непредельный спирт).
Физические свойства
Сложные эфиры широко распространены в природе. Приятные ароматы цветов, плодов и ягод в значительной степени обусловлены присутствующими в них сложными эфирами. Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, нерастворимые в воде жидкости. Многие из них имеют приятный запах. Например:
НСООС2Н5 – этилформиат –запах рома
НСООС4Н9 –бутилформиат – запах вишни
НСООС5Н11 – амилформиат – запах вишни
СН3СОО - С2Н5 - этилацетат – запах свежести
Химические свойства
Характерное свойство сложных эфиров – взаимодействие их с водой. т.е. реакция гидролиза. При гидролизе образуется равновесная смесь эфир и воды с продуктами гидролиза

Этилацетат уксусная кислота этиловый эфир
Гидролиз сложных эфиров является обратной реакцией реакции этерефикации, протекающей в присутствии кислоты или щелочи.
Задание учащимся - напишите реакцию гидролиза этилформиата, этилацетата.
Сложные эфиры в основном получают из природных продуктов
Получают путем взаимодействия карбоновых кислот и спиртов в присутствии минеральных кислот, такие реакции называются реакциями ЭТЕРЕФИКАЦИИ
Сложные эфиры получают взаимодействием спиртов с галогенангидридами и ангидридами кислот
Ацилхлорид этиловый эфир уксусной кислоты
Применение: Синтетические сложные эфиры в виде фруктовых эссенций используются наряду с другими душистыми веществами в производстве фруктовых вод, кондитерских изделий, при изготовлении духов и одеколонов. Некоторые сложные эфиры служат растворителями ( этиловый эфир уксусной кислоты и изоамиловый эфир уксусной кислоты), для получения пластмассы (метилакрилат, метилметакрилат), волокна нитрона.
Задача № 1 Вычислите массовую долю углерода в метиловом эфире муравьиной кислоты
Решение: 100% х%
Задача № 2 Вычислите массовую долю водорода в этиловом эфире пропионовой кислоты
Задача № 3 Вычислите массу сложного эфира, который образуется при
взаимодействии11,5 г этилового спирта с уксусной кислотой.

Р ешение: 11,5 г х г

С Н3СОО Н + ОН-С2Н5 → СН3СОО - С2Н5 + Н2О х= 22 г
Ответ:22 г эфира образуется
Задача № 4 При взаимодействии этилового спирта с уксусной кислотой массой30 г образовался эфир, вычислите сколько эфира образовалось?
Решение : 30 г х г
Ответ: 44 г эфира
Задача № 5 При взаимодействии этанола массой 23 г с этановой кислотой массой 18 г образуется сложный эфир. Напишите его формулу и вычислите массу образовавшегося эфира.
Решение: 23 г 18 г х г
ν (СН3СОО Н) 18 = 0,3 г/Моль
m (СН3СОО - С2Н5) = 0,3 · 88 =26,4 г
Ответ: 26,4 г эфира
Задача № 6 Вычислите массу эфира, который образовался при взаимодействии 34,5 г этилового спирта с 48 г уксусной кислоты.
Решение: 34,5 г 48 г х г
ν (СН3СОО Н) 48 = 0,8 г/Моль
m (СН3СОО - С2Н5) = 0,75 · 88 =66 г
Ответ: 66 г эфира
Задача № 7 При взаимодействии 15 г уксусной кислоты с 18 г этилового спирта образуется сложный эфир уксусной кислоты. Определите массу полученного сложного эфира (г), если практический выход в массовых долях составляет 70% от теоретического.
Решение: 15 г 18 г х г 70%
ν (СН3СОО Н) 15 = 0,25г/Моль
m (СН3СОО - С2Н5) = 0,25 · 88 = 22 г (теор)
22 г - 100% = 15,4 г
Ответ: масса образовавшегося эфира – 15,4 г, при 70% выходе
Задача № 8 При нагревании метанола массой 2,8 г и уксусной кислоты массой 4,5 г получили метилацетат массой 6,6 г. Вычислите массовую доля выхода сложного эфира по сравнению с теоретически возможным выходом (в %)
Решение: 4,5 г 2,8 г 6,6 г х
ν (СН3СОО Н) 4,5 = 0, 075г/Моль
ν (СН3 ОН) 2,8 = 0, 087 г/Моль
m (СН3СОО - СН3) = 0,075 · 74 = 5,5 г (теор)

В видеоуроке есть определение класса, общая формула, состав и строение, номенклатура и изомерия сложных эфиров, тривиальные названия, физические и химические свойства, получение и применение основных представителей сложных эфиров.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Сложные эфиры"
Сложные эфиры – это функциональные производные карбоновых кислот, в которых гидроксильная группа замещена остатком спирта или фенола.
Так, сложный эфир этилэтаноат состоит из остатка карбоновой кислоты – этановой и остатка спирта – этанола. Пропилэтаноат состоит из остатка карбоновой кислоты – этановой и остатка спирта – пропанола.
Сложные эфиры содержат сложноэфирную группу. Для сложных эфиров, как и для карбоновых кислот? можно использовать формулу CnH2nO2, которая отражает молекулярный состав.
Назовём следующие сложные эфиры. Первый эфир называется пропилэтаноат, или пропиловый эфир уксусной кислоты. Второй эфир называется этилметаноат, или этиловый эфир муравьиной кислоты.

Для сложных эфиров возможно существование структурных изомеров. Например, составим структурные изомеры состава С5Н10О2. Это метилбутаноат, припилэтаноат, метил-2-метилпропаноат.
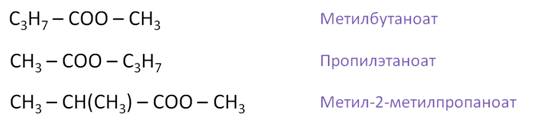
Кроме того, для сложных эфиров характерна межклассовая изомерия с карбоновыми кислотами.
Сложные эфиры, в составе которых низшие карбоновые кислоты и спирты, − летучие, малорастворимые и практически нерастворимые в воде жидкости. Они хорошо растворимы в органических растворителях.
Многие эфиры имеют приятный запах: запах ананаса имеет бутиловый эфир бутановой кислоты, запах груш – изоамиловый эфир этановой кислоты, абрикосами пахнет пентиловый эфир бутановой кислоты, запах жасмина напоминает бензиловый эфир этановой кислоты, запах хризантенм – бензиловый эфир метановой кислоты.
Получить сложные эфиры можно несколькими способами. Например, в реакции карбоновых кислот и спиртов в присутствии минеральных кислот. Так, в реакции уксусной кислоты с этанолом образуется сложный эфир – этилэтаноат, или этиловый эфир уксусной кислоты.

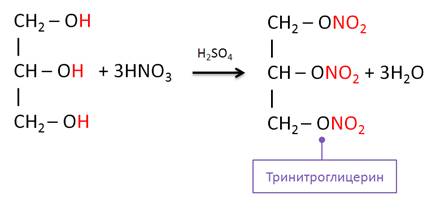
Сложный эфир можно получить и в реакции глицерина и азотной кислоты, в результате данной реакции образуется тринитроглицерин.
Для сложных эфиров характерны реакции горения. Например, составим реакцию горения метилформиата. При горении образуется углекислый газ и вода.
Важная реакция сложных эфиров – это реакция их с водой в присутствии кислоты или щёлочи. Эта реакция называется гидролизом. Гидролиз – реакция обратная реакции этерификации. Так, в результате гидролиза этилэтаноата в присутствии сильной минеральной кислоты, образуется этановая кислота и этанол. Эта реакция является обратимой.
В результате щелочного гидролиза этилэтаноата образуется этаноат натрия и этанол. Этот гидролиз необратим и называется омылением.

Сложные эфиры встречаются в виде эфирных масел, жиров, восков.
Воски – это сложные эфиры высших карбоновых кислот и высших спиртов. Пчелиный воск на 70 % состоит из сложного эфира, главным образом, из пальмитиновой кислоты и миристилового спирта. Из воска изготавливают политуры, смазки, пропиточные составы для бумаги и кожи, они входят в состав косметических кремов и мазей.
Сложные эфиры применяют в парфюмерии при производстве духов, в производстве бытовой химии, сложные эфиры составляют основу эссенций для приготовления фруктовых вод, кондитерских изделий, сложные эфиры применяют как растворители органических веществ, при производстве полимерных материалов, в частности пластификаторов, в лакокрасочной промышленности, в производстве искусственных волокон, при производстве лекарственных средств (валидола, аспирина). Сложные эфиры – основа органического стекла.
Таким образом, сложные эфиры – это функциональные производные карбоновых кислот, у которых гидроксильная группа замещена на остаток спирта. Сложные эфиры широко распространены в природе. Сложные эфиры образуются в реакциях между спиртами и кислородсодержащими кислотами. Сложные эфиры гидролизуются растворами минеральных кислот и щелочей. Сложные эфиры применяются во многих областях промышленности.
Читайте также:

