Конспект урока по химии вещества молекулярного и немолекулярного строения
Обновлено: 07.07.2024
Ключевые слова конспекта: строение веществ, кристаллические решетки, электроотрицательность.
Молекулярное и немолекулярное строение веществ
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. Вещества при заданных условиях могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном. Свойства веществ зависят также и от характера химической связи между частицами, которые их образуют — молекулами, атомами и ионами. По типу связи различают вещества молекулярного и немолекулярного строения.
Вещества, которые состоят из молекул, называются молекулярными. Связи между молекулами в таких веществах очень слабые, значительно слабее, чем между атомами в середине молекулы. Уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость, а затем в газ (сублимация газа). Температура плавления и кипения веществ, которые состоят из молекул, повышается с увеличением молекулярной массы. К молекулярным веществам относятся вещества с атомной структурой (C, Si, Li, Na, K, Cu, Fe, W), среди них имеются металлы и неметаллы.
Простые вещества — неметаллы могут иметь молекулярное и атомное строение. Молекулярное строение при н. у. имеют газы (H2, N2, F2, Cl2, O3) либо твердые вещества (I2, P4, S8), а также единственная жидкость (Br2). Все эти вещества имеют молекулярное строение и обладают летучестью. В твердом состоянии они легкоплавкие и могут сублимироваться. Температуры кипения и плавления низкие.
К веществам немолекулярного строения относятся ионные соединения. Такие структуры имеют большинство соединений металлов с неметаллами: все соли (NaCl, K2SO4), некоторые гидриды (LiH) и оксиды (CaO, MgO, FeO), основания (NaOH, KOH). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Кристаллические решетки
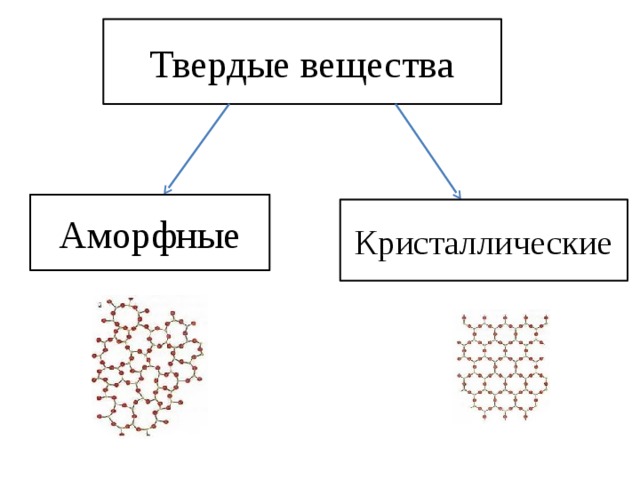
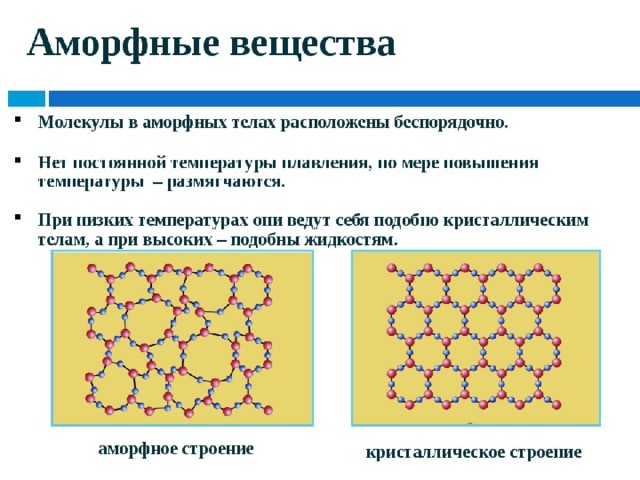
Твердые вещества принято делить на кристаллические и аморфные.
Аморфные вещества не имеют четкой структуры, в них не существует закономерного расположения отдельных частиц. Следовательно, аморфные вещества не имеют и четкой температуры плавления. При нагревании они постепенно размягчаются и переходят в текучее состояние. К аморфным веществам относится большинство органических веществ (воск, стекло, полиэтилен, парафин, пластилин, смолы).
Кристаллические вещества характеризуются структурированным, упорядоченным расположением составляющих их частиц в строго определенных точках пространства, расположенных на определенном расстоянии друг от друга. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки расположения частиц, составляющих кристаллическую решетку, называют узлами решетки.

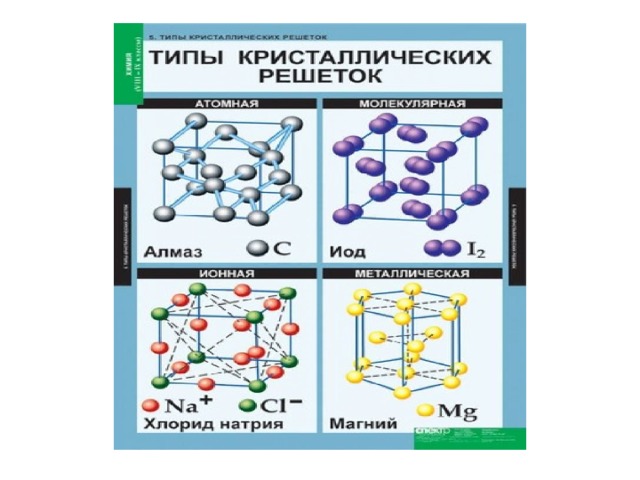
Тип кристаллической решетки определяется видом частиц, расположенных в ее узлах, и характером связи между этими частицами. Различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
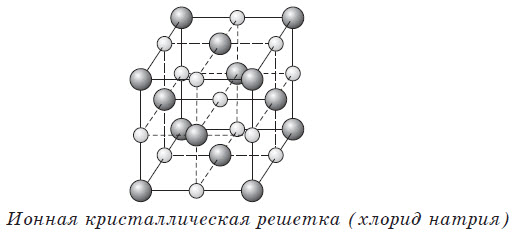
Ионные кристаллические решетки в своих узлах содержат ионы. Их образуют вещества с ионной связью, которая связывает как простые (Na + , Cl – ), так и сложные (OH – ) ионы. Таким образом, ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксиды металлов. Например, кристалл NaCl состоит из перемежающихся положительных ионов Na + и отрицательных Cl – , которые образуют решетку куба. Связи в таком кристалле прочные, вещества с такой решеткой имеют высокую прочность и твердость, они тугоплавкие.
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены прочными ковалентными связями. Примером вещества с таким типом кристаллической решетки может быть алмаз — аллотропное видоизменение углерода.

Молекулярными называют кристаллические решетки, в узлах которых расположены молекулы. Химические связи у этих молекул могут быть как полярными (HCl, H2O), так и неполярными (N2, O2).

Несмотря на то, что атомы в молекулах связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного взаимодействия. Вещества с молекулярным типом решеток имеют низкую прочность, низкие температуры плавления, они летучи. Молекулярные кристаллические решетки имеют большинство органических соединений (нафталин, глюкоза, сахар).

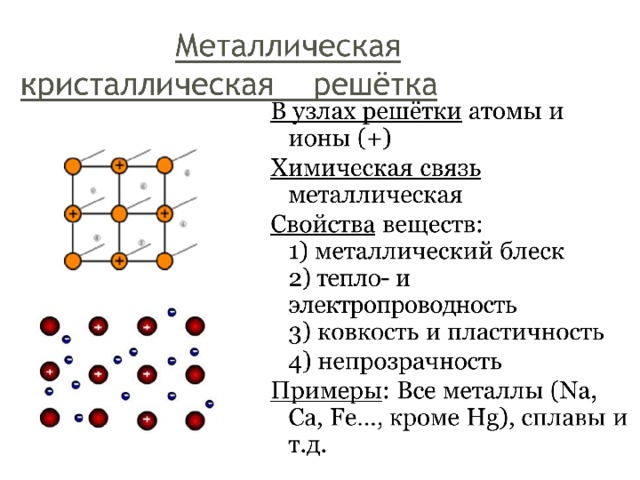
Вещества с металлической связью имеют металлические кристаллические решетки. В узлах таких решеток расположены атомы и ионы (атомы металла переходят в ионы и отдают внешние электроны в общее пользование). Такая внутренняя структура металла определяет его характерные свойства: ковкость, пластичность, электро- и теплопроводность, металлический блеск.
Электроотрицательность
В основе образования химических связей лежит явление электроотрицателъности. В ходе химических взаимодействий одни атомы отдают электроны, другие их присоединяют.
Электроотрицательность — это условная величина, характеризующая относительную способность атома приобретать отрицательный заряд.
Фактически электроотрицательность выражает способность атома оттягивать к себе общие электронные пары, участвующие в образовании химической связи.
Электроотрицательность атома определяет характер его свойств: сильнее всего металлические свойства проявляются у элементов, атомы которых легко отдают электроны, а неметаллические — соответственно у элементов, атомы которых легко их присоединяют.
Абсолютные значения электроотрицательности элементов выражаются числами, затрудняющими их практическое применение для вычислений, поэтому в химии используют значения относительной электроотрицателъности. Условно за единицу принимают значение электроотрицательности лития (Li).
Чем меньше значение относительной элетроотрицательности, тем ярче выражены металлические свойства элемента. У всех металлов в периодической системе значение относительной электроотрицательности, как правило, меньше 2. У неметаллов это значение, как правило, превышает 2.
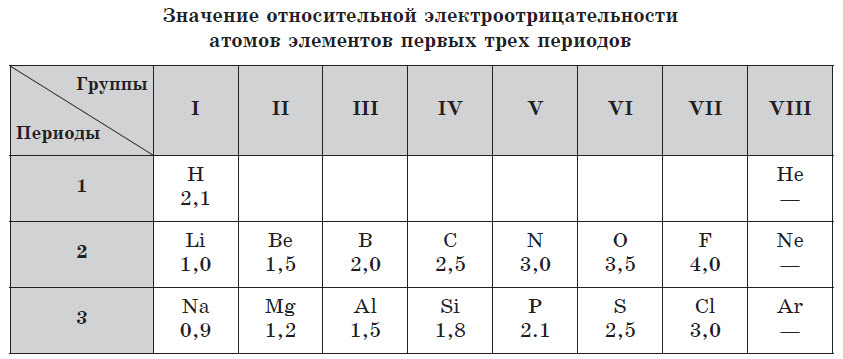
Электроотрицательность элементов также изменяется периодически: в периодах возрастает слева направо, а в главных подгруппах — снизу вверх.
При образовании химических связей электроны переходят или смещаются к атомам элементов, которые обладают большей электроотрицательностью.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Цель урока: Расширить знания о веществе, строении веществ. Научить обучающихся, использовать знания по физике для определения веществ молекулярного и немолекулярного строения.
Необходимое оборудование: мультимедийный проектор, модели кристаллических решеток.
Новые понятия: закон постоянства состава вещества, вещества молекулярного и немолекулярного строения, кристаллическая решетка, молекулярная, ионная кристаллические решетки.
Начинаем наш урок с диктанта (химический диктант на листочках, 20 элементов). 2-3 минуты. Во время сбора листочков, оглашение оценок за предыдущий диктант.
А теперь ответьте на такие вопросы (4-5минут):
На что делят все вещества? (простые и сложные вещества)
Дайте определения этим понятиям. (Простыми веществами называют вещества состоящие из одного вида атомов. Сложными называют вещества состоящие из двух или более атомов разного вида).
Как химические элементы образуют вещества? (Химические элементы между собой образуют химическую связь посредством электронов).
Из чего состоят вещества? (Вещества состоят из атомов и молекул).
Так о чем мы будем с вами разговаривать? (О веществах и их строении).
В конце 19 века Жозефом Луи Прустом был отрыт закон постоянства состава вещества, который гласил: Качественный и количественный состав соединений молекулярного строения является постоянным независимо от способов получения и местонахождения. Запишите его, пожалуйста, в тетрадь. Вы знаете, что формула воды Н2О, но есть вода: речная, морская, дождевая, ключевая, дистиллированная. При этом формула воды остается неизменной, где бы ее не брали и как бы ее не получали. Вот об этом данный закон. (5 минут)
Вещества делят на молекулярного и немолекулярного строения. В веществах молекулярного строения атомы связаны ковалентными связями, а немолекулярного строения - ионной связью. Из курса физики вы знаете, что вещества имеют агрегатные состояния. Какие?
Газообразные. Правильно. А вот теперь посмотрим, какие вещества, какие агрегатные состояния имеют. А чем характерно твердое агрегатное состояние? (3 минуты)
Правильно, сахар имеет кристаллическое строение. Кристаллическая структура — такая совокупность атомов, в которой с каждой точкой кристаллической решетки связана определенная группа атомов. Запишите в тетрадь. А теперь запишем какие кристаллические решетки бывают:
Металлические. (5 минут)
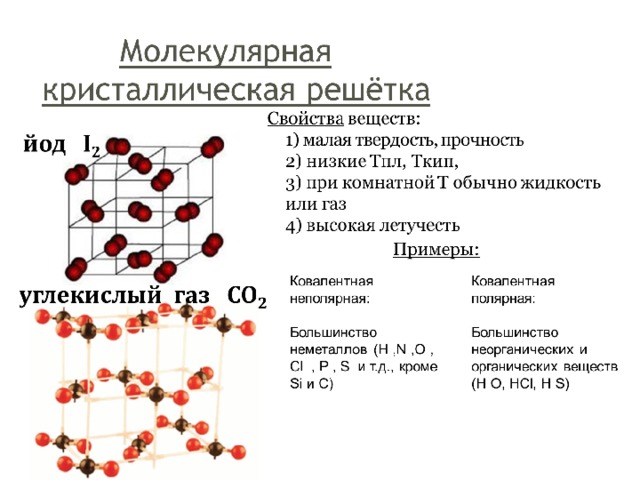
Так выглядят молекулярные кристаллические решетки (йод, углекислый газ). В узлах решетки находятся молекулы. Из строения кристаллической решетки можно сказать о свойствах веществ молекулярного строения.
Молекулярные вещества — это вещества, мельчайшими структурными частицами которых являются молекулы
Молекулы — наименьшая частица молекулярного вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
Молекулярные вещества имеют низкие температуры плавления и кипения и находятся в обычных условиях в твердом, жидком или газообразном состоянии.
Например:
Рассмотрим строение некоторых молекулярных веществ. (10 минут)
А у веществ с немолекулярным строением в узлах кристаллической решетки находятся атомы или ионы.
Немолекулярные вещества — это вещества, мельчайшими структурными частицами которых являются атомы или ионы.
Немолекулярные вещества находятся в стандартных условиях в твердом агрегатном состоянии и имеют высокие температуры плавления и кипения.
Например:
натрий хлорид NaCl — твердое вещество, tпл=801°С; tкип=1465°С
медь Cu — твердое вещество, tпл=1083°С; tкип=2573°С;
кремний Si — твердое вещество, tпл=1420°С; tкип=3250°С;

6. Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состояли исходные вещества.

Тема урока: Вещества молекулярного и немолекулярного строения. Типы кристаллических решеток.

Агрегатные состояния вещества
ГАЗООБРАЗНОЕ
ТВЕРДОЕ
ЖИДКОЕ

в узлах решётки
Вид связи между частицами
Физические свойства веществ
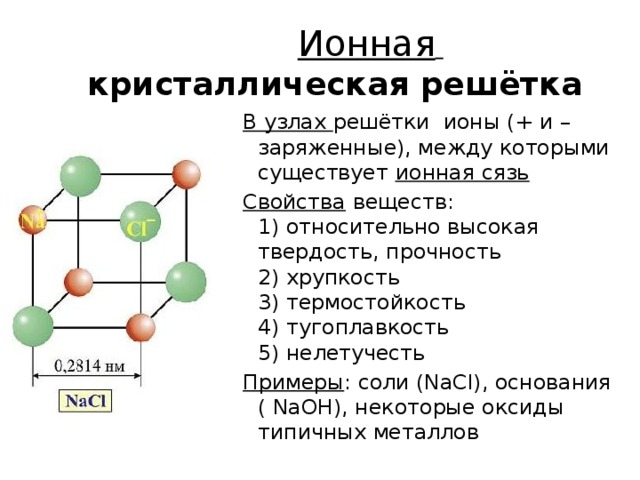
Ионная кристаллическая решётка
В узлах решётки ионы (+ и – заряженные), между которыми существует ионная сязь
Свойства веществ: 1) относительно высокая твердость, прочность 2) хрупкость 3) термостойкость 4) тугоплавкость 5) нелетучесть
Примеры : соли (NaCl), основания ( NaOH), некоторые оксиды типичных металлов
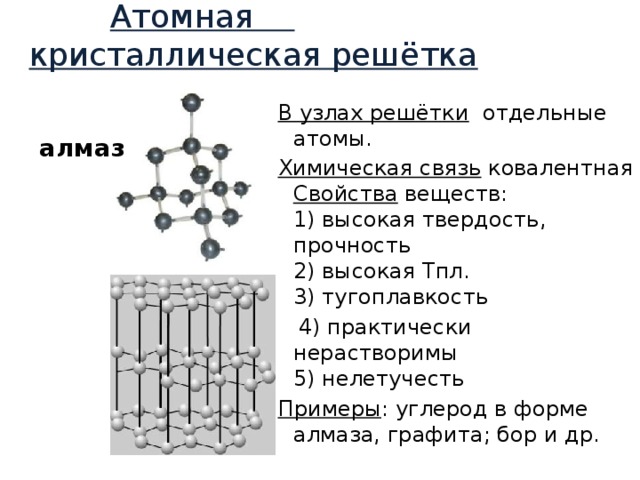
Атомная кристаллическая решётка
В узлах решётки отдельные атомы.
Химическая связь ковалентная Свойства веществ: 1) высокая твердость, прочность 2) высокая Тпл. 3) тугоплавкость
4) практически нерастворимы 5) нелетучесть
Примеры : углерод в форме алмаза, графита; бор и др.
Вещества бывают молекулярного и немолекулярного строения.
Молекулярные вещества -это вещества , мельчайшими структурными частицами которых являются молекулы.

Молекулярные вещества имеют:
- Низкие температуры плавления и кипения;
- Находятся в стандартных условиях в твердом, жидком или газообразном состоянии;
- Например:
вода - жидкость; t пл = 0 o С; t кип = 100 o С;
кислород - газ; t пл = -219 o С; t кип = -183 o С;
оксид азота(V)- твердое в-во;t пл = 30,3 o С; t кип = 45 o С;

. К молекулярным веществам относятся:
Немолекулярные вещества - это вещества, мельчайшими структурными частицами которых являются атомы или ионы.
- находятся в стандартных условиях в твердом состоянии;
- имеют в стандартных условиях высокие температуры плавления и кипения;
натрий хлорид- твердое в-во; t пл = 801 o С; t кип = 1465 o С;
медь твердое в-во; t пл = 1083 o С; t кип = 2573 o С;

К немолекулярным веществам относятся:
-простые вещества металлы и их сплавы: Cu, Na, Fe;
-соединения металлов с неметаллами: NaH, Na 2 SO 4 ,CuCl 2
Состоят из атомов разных химических элементов
Состоят из атомов одного элемента
Молекулярные оксиды неметаллов, водордные соединения неметаллов, кислоты органические и неорганические
Немолекулярные оксиды металлов и SiO 2 , соли, основания и амфотерные гидроксиды, бинарные соединения металлов и неметаллов.
Молекулярные остальные неметаллы H 2 ,O 2 ,N 2
Немолекулярные Рn, Si,C

Виртуальная лаборатория
Получение сульфида железа

Химическое соединение
- Вещества можно смешать в любых массовых отношениях, т.е. состав смесей переменный .
- Вещества водящие в состав смесей, сохраняют свои свойства.
- Вещества входящие в состав смеси, можжно разделить физическими способами
- Механическое смешивание не сопровождается выделением теплоты или другими признаками химических реакций
- Состав химических соединений постоянный.
- Вещества образующие соединения, свои свойства не сохраняют, таккак получается химическое соединение с другими свойствами.
- Химическое соединение можно разложить с помощью химических реакций.
- Об образовании химических соединений можно судить по признакам химических реакций.
Закрепление

-80%
Молекулы - наименьшая частица молекулярного вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
Молекулярные вещества имеют низкие температуры плавления и кипения и находятся в стандартных условиях в твердом, жидком или газообразном состоянии.
Вода – самое известное и весьма распространенное вещество на нашей планете: поверхность Земли на 3 / 4 покрыта водой, человек на 65 % состоит из воды, без воды невозможна жизнь, так как в водном растворе протекают все клеточные процессы организма. Вода – молекулярное вещество. Это одно из немногих веществ, которое в природных условиях встречается в твердом, жидком и газообразном состояниях, и единственное вещество, для которого в каждом из этих состояний есть свое название. Особенностями строения воды вызваны ее необычные свойства. Например, при замерзании вода увеличивается в объеме, поэтому лед плавает в своем расплаве – жидкой воде, а наибольшая плотность воды наблюдается при 4 o С, поэтому зимой большие водоемы до дна не промерзают. На свойствах воды основана и сама шкала температур Цельсия (0 o – температура замерзания, 100 o – температура кипения). С причинами этих явлений и с химическими свойствами воды вы познакомитесь позже.
Немолекулярные вещества
Немолекулярные вещества - это вещества, мельчайшими структурными частицами которых являются атомы или ионы .
Немолекулярные вещества находятся в стандартных условиях в твердом агрегатном состоянии и имеют высокие температуры плавления и кипения.
Например, Поваренная соль - твердое вещество, t пл =801°С; t кип =1465°С; Железо
Железо – серебристо-белый, блестящий, ковкий металл. Это немолекулярное вещество. Среди металлов железо занимает второе место после алюминия по распространенности в природе и первое место по значению для человечества. вместе с другим металлом – никелем – оно образует ядро нашей планеты. Чистое железо не имеет широкого практического применения. Знаменитая Кутубская колонна, расположенная в окрестностях Дели, высотой около семи метров и весом 6,5 т, имеющая возраст почти 2800 лет (она поставлена в IX в. до н. э.) – один из немногих примеров использования чистого железа (99,72 %); возможно, что именно чистотой материала и объясняется долговечность и коррозионная устойчивость этого сооружения.

Обобщить и углубить знания учащихся о зависимости свойств веществ от природы химической связи и типа кристаллической решетки.
Цели урока: Обобщить и углубить знания учащихся о зависимости свойств веществ от природы химической связи и типа кристаллической решётки. Развивать умения предсказывать свойства веществ по их строению и определять строение веществ по их свойствам.
Демонстрации: 1. Модели кристаллических решёток, коллекция кристаллов. 2. Опыты, раскрывающие взаимосвязь строения вещества с его свойствами ( возгонка йода; нагревание кварца, серы, поваренной соли).
Оборудование урока: Мультимедийное оборудование. Модели кристаллических решёток алмаза, хлорида натрия, йода, льда, магния. Коллекция кристаллов: поваренная соль, горный хрусталь, нафталин, йод, фенол, сера, графит, лёд. Спиртовка, тигли, лабораторный штатив, колба, щипцы.
Все окружающие нас вещества ( слайд №2), а также искусственно полученные химические соединения имеют молекулярное и немолекулярное строение. Различают два состояния твёрдых тел – кристаллическое и аморфное ( вспомните аллотропию кремния). Наиболее устойчивым твёрдым состоянием является кристаллическое состояние. Напомню вам, что в идеальном кристалле вещества частицы его чередуются в строго определённом порядке в любом выбранном направлении. Если эти частицы условно соединить прямыми, то получится решётка правильной геометрической формы, так называемая кристаллическая решётка. Точки пересечения прямых, образующих такую условную решётку, называются узлами кристаллической решётки ( рассмотреть модель кристаллической решётки алмаза). В зависимости от характера частиц, образующих кристалл, и от природы связи между ними различают четыре типа кристаллических решёток ( слайд №3).
1. Ионная кристаллическая решётка ( слайд №4). Если в узлах кристаллической решётки расположены ионы противоположных знаков, между которыми действуют электростатические силы взаимодействия, то такие решётки называются ионными. Такую решётку имеют кристаллы большинства солей, некоторых оксидов и гидроксидов. Например, кристалл хлорида натрия ( рассмотреть модель кристаллической решётки), в котором каждый ион натрия окружён шестью ионами хлора, а каждый хлорид-ион – шестью ионами натрия. Такой кристалл нужно рассматривать, как одну гигансткую молекулу, в которой нельзя выделить отдельные молекулы соли. Давайте попробуем нагреть кристалл поваренной соли.
Опыт 1. Нагревание кристалла поваренной соли.
Из опыта видно, что никакого изменения не произошло. Это объясняется тем, что связи между ионами прочны и вещества с такими решётками обладают высокими температурами плавления, твёрдостью, но хрупкостью. В твёрдом состоянии не проводят электрический ток и тепло, но их растворы и расплавы электропроводны и они диссоциируют в полярных растворителях.
2. Атомная кристаллическая решётка ( слайд №5).
Если в узлах кристаллической решётки находятся атомы, соединённые ковалентными связями, то такие решётки называются атомными. Таким примером может служить алмаз ( рассмотреть модель кристаллической решётки алмаза), в котором каждый атом углерода связан четырьмя связями с другими атомами углерода. Чтобы разрушить кристалл с атомной решёткой нужно разорвать множество прочных ковалентных связей, энергия которых велика. Отсюда, вещества с таким типом решёток имеют высокую твёрдость, тугоплавкость, не проводят тепло и электрический ток ( кроме германия и кремния – полупроводники) и практически не растворимы ни в каких растворителях. Нагреем кристалл кварца и убедимся в ниже сказанном.
Опыт 2. Нагревание кварца.
Элементы, которые образуют простые вещества с атомными решётками расположены в средней части периодической системы Д.И, Менделеева (слайд №8). К ним относятся бор, углерод, кремний, германий, мышьяк, селен, теллур. Они граничат с металлами и неудивительно, что некоторые из них обладают полупроводниковыми свойствами. Также, такие решётки имеют ( слайд №5) и кристаллы сложных веществ – кварц, карбид кремния и др.
3. Молекулярные решётки (слайд №6).
В их узлах находятся полярные ( рассмотреть кристаллическую решётку льда) и неполярные ( рассмотреть кристаллическую решётку йода) молекулы, атомы которых соединены ковалентными полярными и неполярными связями , а сами молекулы связаны между собой слабыми межмолекуляр-ными силами притяжения. Поэтому веществам с такой решёткой свойственны низкие температуры плавления и кипения,
Опыт 3. Нагревание серы.
малая твёрдость, высокая летучесть;
Опыт 4. Возгонка йода.
многие из них при комнатной температуре жидкости или газы, не проводят ток и нерастворимы или малорастворимы в полярных растворителях. Такую решётку образуют ( слайд №8) молекулы простых веществ, элементы которых расположены в конце периодической системы. К ним относятся водород и галогены, азот, кислород, фосфор, сера и благородные газы ( кроме радона). А также ( слайд №6) молекулы сложных неорганических веществ: воды, аммиака, углекислого газа и органических веществ: бензола, фенола, метана и пр.
4. Металлическая решётка( слайд №7).
В узлах таких кристаллических решёток находятся положительные ионы и атомы металлов, а между узлами относительно свободные электроны ( рас-смотреть модель кристаллической решётки магния). Между ними и возни-кает металлическая связь, характерная для металлов в твёрдом и жидком состоянии. Атомы металлов имеют большие радиусы и их валентные электроны слабо удерживаются в атомах и перемещаются по всему кристаллу. К тому же на их небольшое число приходится много свободных орбиталей. Например, в атоме алюминия девять вакантных орбиталей и всего три валентных электрона. Напомню вам, что металлическая связь не направлена и не обладает насыщаемостью ( в отличии от ковалентной). Из-за такой специфичности металлической связи все металлы ковкие и пластичные, с металлическим блеском и непрозрачные, хорошо проводят тепло и электрический ток. Вначале периодической системы Д.И. Менделе-ева ( слайд №8) расположены химические элементы, атомы которых образу-ют металлы.
Теперь вернёмся к нашей коллекции кристаллов. Так, почему же эти вещества, находясь в одном агрегатном состоянии, обладают разными свойствами? Правильно. Потому, что они имеют разные типы кристалличес-ких решёток.
Закрепление. А сейчас вам предлагается небольшой тест на время ( слайды №№ 9-13).
1. Молекулярной структуры не имеет:
1) йод 2) графит 3) углекислый газ (тв) 4) метан (тв)
2. Молекулярное строение имеет:
1) вода 2) оксид натрия 3) оксид кремния (IV) 4) алмаз
3. Атом является структурной единицей:
1) метана 2) водорода 3) кислорода 4) кремния
4. Кристаллическую структуру, подобную структуре алмаза, имеет:
1) кремнезём 2) оксид натрия 3) оксид углерода (II) 4) белый фосфор
5. Для веществ с атомной кристаллической решёткой характерна:
1) высокая твёрдость 2) низкая температура плавления 3) низкая температура кипения 4) летучесть
6. В узлах кристаллических решёток веществ молекулярного строения находятся:
1) атомы 2) молекулы 3) атомы и молекулы 4) молекулы и ионы
7. Типами кристаллической решётки хлорида натрия, алмаза и льда соответственно являются:
1) ионная, молекулярная, атомная 2) молекулярная, атомная, ионная 3) атомная, ионная, молекулярная 4) ионная, атомная, молекулярная
8. Нафталин – лёгкоплавкое кристаллическое вещество потому, что имеет кристаллическую решётку:
Читайте также:

