Конспект урока по химии 8 класс количество вещества моль молярная масса презентация
Обновлено: 07.07.2024
Презентация на тему: " 8 класс Количественные измерения в химии. Количество вещества. Моль Покровская Наталия Васильевна, учитель химии ГОУ СОШ 939 г.Москва." — Транскрипт:
1 8 класс Количественные измерения в химии. Количество вещества. Моль Покровская Наталия Васильевна, учитель химии ГОУ СОШ 939 г.Москва
3 Тема урока: Количественные измерения в химии. Количество вещества. Моль.
4 Цель урока: Научиться рассчитывать по формулам массу вещества, количество вещества
5 Задачи урока: Образовательная: сформировать понятие о количестве вещества, единицах его измерения, о взаимосвязи физико-химических величин (массы, количества вещества и числа молекул). Развивающая: развить умение решения задач с использованием формул. Воспитательная: прививать нормы социальной жизни, воспитывать умение работать в группе.
6 Какие физические величины можно использовать для определения меры веществ? В каких единицах измеряются эти физические величины?
8 =158,988 л 1 карат = 0,2 г 1 баррель нефти
10 ? Можно ли найти число частиц в порции вещества?
12 Число всех песчинок в пустыне Сахара = 3 моль.
14 Число частиц в одном моль вещества называется числом Авогадро (N А ) N А = 6, /моль
15 Н2ОН2ОН2ОН2О Число Авогадро больше числа всех капель воды на Земле
16 Обозначение: ν (ню), или n ν (ню), или n Единица измерения: моль Количество вещества
17 Относительная молекулярная масса MrМассаг Число частиц H 2 Mr = 2 H 2 Mr = 2 2 г2 г2 г2 г 6, H 2 O Mr = 18 H 2 O Mr = г 6, CO 2 Mr = 44 CO 2 Mr = г 6, P 4 Mr =124 P 4 Mr = г 6, Na Аr = 23 Na Аr = г 6,
18 1 моль вещества – 6, частиц Сколько частиц содержат 3 моль вещества? Сколько частиц содержат 0,5 моль вещества? 3 6, = 18, ,5 6, = 3,
19 В общем виде: N = ν N A N – число частиц ν – количество вещества N A – число Авогадро
20 [ Mr = M ][ Mr = M ][ Mr = M ][ Mr = M ] Mr(H 2 O)= 18 M(H 2 O)= 18 г/моль Молярная масса (М) – это суммарная масса всех частиц, входящих в 1 моль вещества.
21 Можно ли найти массу, зная количество вещества? Можно ли найти массу, зная количество вещества?
23 Что тяжелее: Что тяжелее: 1 моль атомов кислорода 1 моль атомов кислорода или 1 моль атомов фосфора? или 1 моль атомов фосфора? Почему? Почему? M(O) = 16 г/моль M(P) = 31 г/моль
24 Задача. Найти массу 3 моль атомов серы Дано ν (S) = 3моль M(S) = 32 г/моль Найти m(S) Решение m = ν M m = 3 32 = 96 (г) Ответ: m(S) = 96 г
25 Равные массы, но разные объемы, потому что. m = V ρ
26 1 моль любого газа (н.у.) занимает объем 22,4 л V M = 22,4л/моль
27 ν = V/V m V = ν V m
28 m= ν M V = ν V m N = ν N A Выучить.
29 Сколько ложек сахарного песка вы кладете в чашку чая? вы кладете в чашку чая?Рассчитайте: 1)какое количество сахарозы вы выпиваете с чаем; вы выпиваете с чаем; 2) сколько молекул сахарозы ( C 12 H 22 O 11 ) содержится в этом количестве, если содержится в этом количестве, если в 1 чайной ложке в 1 чайной ложке примерно 5 г сахарозы. примерно 5 г сахарозы.
Загрузить презентацию (289 кБ)
Тип урока: Урок изучения и первичного закрепления знаний.
Цели и задачи урока:
а) Ввести понятие о количестве вещества и единицах его измерения: моль, ммоль, кмоль.
б) Дать представление о постоянной Авогадро.
в) Показать взаимосвязь массы, количества вещества и числа частиц.
г) Научить решать задачи по химии.
д) Научить выполнять задания по образцу и переносу знаний в новую ситуацию.
а) Формирование познавательной потребности.
б) Формирование стремления к глубокому усвоению знаний.
в) Воспитание аккуратности в оформлении и записи задач.
а) Развивать умения применять знания на практике.
б) Развивать логическое мышление учащихся.
в) Развивать умение анализировать условия.
г) Развивать умение работать в должном темпе, организованность.
Методы, используемые на уроке: Объяснительно-иллюстративный, репродуктивный.
Формы работы: Общеклассная, парная.
- Организация начала.
- Проверка домашнего задания.
- Подготовка к активной учебно-познавательной деятельности.
- Усвоение новых знаний.
- Закрепление знаний.
- Первичная проверка понимания.
- Подведение итогов урока.
- Информация о домашнем задании.
1. Приветствие и подготовка учащихся к уроку.
2. Проверка домашнего задания:
- Что такое неметаллы?
- Что такое аллотропия?
- Какие аллотропные модификации имеют атомы О, Р, С, Sn?
- Проверить таблицу №3, перенесённую в тетрадь из учебника со стр.54.
3. - Сегодня на уроке вы познакомитесь с новым для вас понятием - количество вещества, моль, молярная масса. Научитесь решать задачи по химии, связанные с этими понятиями. Записываем тему урока в тетради: Количество вещества. Молярная масса вещества. Но сначала вспомним:
- Что такое химия?
- Что показывает относительная атомная масса, как обозначается, как найти её значение?
- Как обозначается относительная молекулярная масса, как найти её значение?
4. - Мы вспомнили, что химия - это наука о веществах, их свойствах и превращениях. Для получения определённого количества продукта в химической лаборатории или на заводе необходимо брать строго определённые количества исходных веществ. Подумайте, в чём удобнее измерять вещества?
- Давайте оставим пока химию и представим, что у нас есть куча картошки. Как нам удобнее пересчитать её? Конечно мешками.
Допустим, что в 1 мешке - 6 *10 23 картофелин, а мешков 20 штук, тогда количество картошки мы найдём умножив количество мешков на количество картофелин в 1 мешке:
N = 20 мешков * 6 *10 23 картофелин = 120 * 10 23 картофелин
- Для подсчёта количества вещества, пользуются не мешками, а такой единицей измерения как МОЛЬ. И в 1 моль вещества содержится 6 *10 23 частиц этого вещества.
МОЛЬ - ЭТО ТАКОЕ КОЛИЧЕСТВО ВЕЩЕСТВА, В КОТОРОМ СОДЕРЖИТСЯ 6 * 10 23 ЧАСТИЦ (молекул или атомов) ЭТОГО ВЕЩЕСТВА. (Презентация, слайд 1.)
Записываем это определение в тетрадь.
- 6 *10 23 - число постоянное и названо в честь итальянского учёного Амедео Авогадро, называется постоянная Авогадро и обозначается NA.
Чтобы найти число молекул вещества в определённом количестве вещества надо:
где N - число молекул
NA - постоянная Авогадро, молек./моль
n - количество вещества, моль
Следовательно, n = N / NA и NA = N / n (Презентация, слайд 2.)
- Показать простые и сложные вещества количеством 1 моль.
- Как вы думаете я отмеряла эти вещества? Считала количество молекул и атомов? Нет, я их просто взвешивала.
МАССА 1 МОЛЬ ВЕЩЕСТВА НАЗЫВАЕТСЯ ЕГО МОЛЯРНОЙ МАССОЙ, обозначается М и измеряется в г/моль. (Презентация, слайд 3.)
Записываем это определение в тетрадь.
- 1 моль Fe весит 56г a М(Fe) = 56 г/моль
- 1 моль S весит 32г a M(S) = 32 г/моль
- 1 моль Na Cl весит 59г a M(NaCl) = 59 г/моль
- 1 моль CuSO4 весит 160г a M(CuSO4) = 160 г/моль (Презентация, слайд 4.)
- Если я возьму 64 г серы, сколько это будет молей? Как вы это нашли? Значит, чтобы найти количество вещества нужно его массу разделить на молярную массу:
n = m / M и, следовательно, m = n* M и M = m/n. (Презентация, слайд 5.)
5. - Теперь решим простые задачи:
Задача 1. (Презентация, слайд 6.)
Найти массу 24 * 10 23 молекул озона.
Дано Формулы Решение О3 m = M * n n = 24 *10 23 /6 *10 23 = 4 моль N = 24 * 10 23 молекул n = N/NA M(O3) = 48 г/моль m = ? m = 48 *4 = 192 г
Задача 2. (Презентация, слайд 6.)
Сколько молекул содержится в 111г гидроксида кальция Ca(OH)2?
Дано Формула Решение Ca(OH)2 N = NA * n M(Ca(OH)2) = 74 г/моль m = 111г n = m/M n = 111/74 = 1,5 моль N = ? N = 6 *10 23 *1,5 = 9 *10 23 молекул
- Вы знаете, что основная единица измерения массы - это грамм, величина в 1000 раз большая - килограмм, а в 1000 раз меньшая - миллиграмм. Такая же зависимость прослеживается относительно физико-химических величин и их единиц. Рассмотрим таблицу, лежащую перед вами на парте: (Презентация, слайд 7.)
| Величина, её обозначение | Единицы величины | ||
| Основная | В 1000 раз большая | В 1000 раз меньшая | |
| Масса, m | г | кг | мг |
| Количество вещества, n | моль | кмоль | ммоль |
| Молярная масса, М | г/моль | кг/кмоль | мг/ммоль |
| Постоянная Авогадро, NA | 6 *10 23 в 1 моль | 6 *10 26 в 1 кмоль | 6 *10 20 в 1 ммоль |
(Две последние строки таблицы оставлены для внесения в неё на следующем уроке объёма и молярного объёма.)
- Решим задачки устно: (Презентация, слайд 8.)
1. Сколько молекул кислорода содержится в 2 моль его? Какую массу будет иметь это количество кислорода?
2. Какую массу имеют 5 кмоль водорода? Сколько молекул водорода содержится в этом его количестве?
3. Сколько весят 3*10 20 молекул воды?
6. - Повторим то, что мы с вами прошли на уроке:
1. Как обозначается количество вещества и в чём измеряется?
2. Сколько частиц содержит 1 моль любого вещества, как эта величина называется?
3. Чтобы отмерить 1 моль вещества, что надо сделать?
4. Что называется молярной массой, как обозначается, в чём измеряется, чему численно равна?
7. Подведение итогов урока, выставление оценок.
8. Домашнее задание: п.15, №2,3 - письменно (Учебник - О.С.Габриелян, Химия-8, Часть 1.)
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам

Описание презентации по отдельным слайдам:



Как вы думаете, сколько штук (частиц) в 1 килограмме?


Можно измерить или рассчитать м, см, км ι Длина Измеряется или рассчитывается Л, мл V Объем Измеряется или рассчитывается г, кг m Масса Как определяется Единица измерения Обозначение Величина

Восьмиклассник Костя зашел в магазин и попросил продавщицу продать ему 10 молей поваренной соли. Что ответила Косте продавщица?

Количество вещества. МОЛЬ. Молярная масса.


Количество вещества – Физическая величина, характеризующая ещё одну сторону вещества. Измеряет число частиц, входящих в определённую порцию вещества.

1 моль – это такое количество любого вещества, которое содержит столько же структурных элементов, сколько атомов содержится в 12г углерода. Экспериментально найдено, что 1 моль вещества содержит 6,02∙1023 частиц (молекул, атомов, ионов) постоянная Авогадро - NA

Вещества количеством вещества 1 моль

Масса 1 моль вещества называется МОЛЯРНОЙ МАССОЙ – М (г/моль) = Mr

Установим взаимосвязь основных величин

Пример Вычислить массы метана CH4 и этана С2H6, взятых в количестве ν = 2 моль каждого. Решение Молярная масса метана M(CH4) равна 16 г/моль; молярная масса этана M(С2Н6) = 2 • 12+6=30 г/моль. Отсюда: m(CH4) = 2 моль • 16 г/моль = 32 г; m(С2Н6) = 2 моль • 30 г/моль = 60 г.


Домашнее задание. §16 (15), №1-3.

Задачи Определите массу кислорода количеством вещества 3,6 моль. Определите массу одной молекулы воды. m = M ∙ N/NA Вычислите число молекул, содержащихся в углекислом газе массой 11 г. N = m / M ∙ NA

Формула Относит. Молекул. масса (Mr) Количество вещества (n, моль) Молярная масса (М, г/моль) Масса (m, грамм) Количество частиц (N) H2O 18 1 18 18 6,02∙1023 CO2 44 2 NaCl 3,74 CH4 2,83 H2 12,04∙1023 NH3 5 O2 1 32

Молярный объём газов Закон Авогадро

Чему равен объём этих газов?


Закон Авога́дро в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул. 1811 г. Амедео Авогадро (1776—1856), профессор физики в Турине.

Первое следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объём. В частности, при нормальных условиях, (т.е. при 0° С (273К) и 101,3 кПа), объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm = 22,4 (л/моль)

Количество вещества (моль) =

ХЛОР Cl2 кислород O2

Закрепление N , n = ? А. 22,4 л. Б. 44,8 л. В. 112 л. Г. 224 л.

Всегда 22,4 л/моль л/моль Vm Молярный объём Измеряется или рассчитывается: л, мл V Объём Расчет: моль υ Количество вещества Рассчитывается по таблице Менделеева = Mr г/моль M Молярная масса Измеряется или рассчитывается г, кг m Масса Как определяется Единица измерения Обозначение Величина

Решить задачи: Определить массу молекулы аммиака (NH3) Сколько молекул содержится в кислороде массой 0,16кг? Какой объём занимают 100 моль ртути? Найти число атомов в алюминиевом предмете массой 135г. Подсчитать число молекул, содержащихся 1 кг углекислого газа; найти массу одной молекулы.

Реши одну задачу своего варианта . Вариант 1 Вариант 2 1-й уровень Найдите количество вещества сульфата алюминияAl2(SO4)3массой 34,2 г. 1-й уровень Найдите количество вещества карбоната кальцияCaCO3массой 25 г. 2-й уровень Найдите объем (н.у.), число молекул для 132 г оксида углерода (IV) СО2. 2-й уровень Найдите объем (н.у.), число молекул для 15 гNO.
- подготовка к ЕГЭ/ОГЭ и ВПР
- по всем предметам 1-11 классов
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 933 человека из 80 регионов

Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 24 человека из 17 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- ЗП до 91 000 руб.
- Гибкий график
- Удаленная работа
Дистанционные курсы для педагогов
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 611 019 материалов в базе
Материал подходит для УМК
§ 16. Количество вещества
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
Свидетельство и скидка на обучение каждому участнику
Другие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарий
- 25.10.2020 1612
- PPTX 594.2 кбайт
- 373 скачивания
- Оцените материал:
Настоящий материал опубликован пользователем Мацкан Ирина Фёдоровна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
40%
- Подготовка к ЕГЭ/ОГЭ и ВПР
- Для учеников 1-11 классов
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Рособрнадзор предложил дать возможность детям из ДНР и ЛНР поступать в вузы без сдачи ЕГЭ
Время чтения: 1 минута
Школы граничащих с Украиной районов Крыма досрочно уйдут на каникулы
Время чтения: 0 минут
Отчисленные за рубежом студенты смогут бесплатно учиться в России
Время чтения: 1 минута
В Россию приехали 10 тысяч детей из Луганской и Донецкой Народных республик
Время чтения: 2 минуты
Время чтения: 2 минуты
В приграничных пунктах Брянской области на день приостановили занятия в школах
Время чтения: 0 минут
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.

№ слайда 1

№ слайда 2
Ведь он принесёт тебе ЗНАНИЯ!

№ слайда 3
Тема урока: Количественные измерения в химии. Количество вещества. Моль.

№ слайда 4
Цель урока: Научиться рассчитывать по формулам массу вещества, количество вещества

№ слайда 5
Задачи урока: Образовательная: сформировать понятие о количестве вещества, единицах его измерения, о взаимосвязи физико-химических величин (массы, количества вещества и числа молекул). Развивающая: развить умение решения задач с использованием формул. Воспитательная: прививать нормы социальной жизни, воспитывать умение работать в группе.

№ слайда 6
Какие физические величины можно использовать для определения меры веществ? В каких единицах измеряются эти физические величины?

№ слайда 7

№ слайда 8
=158,988 л 1 карат = 0,2 г 1 баррель нефти

№ слайда 9

№ слайда 10
? Можно ли найти число частиц в порции вещества?

№ слайда 12
Число всех песчинок в пустыне Сахара = 3 моль.

№ слайда 13

№ слайда 14
Число частиц в одном моль вещества называется числом Авогадро (NА) NА = 6,02 ∙1023 1/моль

№ слайда 15
Н2О Число Авогадро больше числа всех капель воды на Земле

№ слайда 16
Обозначение: ν (ню), или n Единица измерения: моль Количество вещества
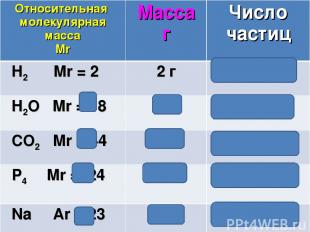
№ слайда 17
Относительная молекулярная масса Mr Масса г Число частиц H2 Mr = 2 2 г 6,02 ∙1023 H2O Mr = 18 18 г 6,02 ∙1023 CO2 Mr = 44 44 г 6,02 ∙1023 P4 Mr =124 124 г 6,02 ∙1023 Na Аr = 23 23 г 6,02 ∙1023

№ слайда 18
1 моль вещества – 6,02∙1023частиц Сколько частиц содержат 3 моль вещества? Сколько частиц содержат 0,5 моль вещества? 3 ∙ 6,02∙1023 = 18,06∙1023 0,5 ∙ 6,02∙1023 = 3,01∙1023

№ слайда 19
В общем виде: N = ν ∙ NA N – число частиц ν – количество вещества NA – число Авогадро
![[ Mr = M ] Mr(H2O)= 18 M(H2O)= 18 г/моль Молярная масса (М) – это суммарная масс](https://fs3.ppt4web.ru/images/132073/183600/310/img19.jpg)
№ слайда 20
[ Mr = M ] Mr(H2O)= 18 M(H2O)= 18 г/моль Молярная масса (М) – это суммарная масса всех частиц, входящих в 1 моль вещества.

№ слайда 21
Можно ли найти массу, зная количество вещества?

№ слайда 22

№ слайда 23
Что тяжелее: 1 моль атомов кислорода или 1 моль атомов фосфора? Почему? M(O) = 16 г/моль M(P) = 31 г/моль

№ слайда 24
Задача. Найти массу 3 моль атомов серы Дано ν (S) = 3моль M(S) = 32 г/моль Найти m(S) Решение m = ν ∙ M m = 3 ∙ 32 = 96 (г) Ответ: m(S) = 96 г

№ слайда 25
Равные массы, но разные объемы, потому что . m = V∙ ρ

№ слайда 26
1 моль любого газа (н.у.) занимает объем 22,4 л VM = 22,4л/моль

№ слайда 27
ν = V/Vm V = ν ∙ Vm
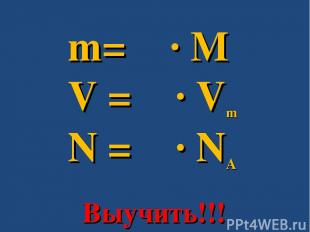
№ слайда 28
m= ν ∙ M V = ν ∙ Vm N = ν ∙ NA Выучить.

№ слайда 29
Сколько ложек сахарного песка вы кладете в чашку чая? Рассчитайте: какое количество сахарозы вы выпиваете с чаем; 2) сколько молекул сахарозы (C12H22O11) содержится в этом количестве, если в 1 чайной ложке примерно 5 г сахарозы.

№ слайда 30
Цель достигнута? Спасибо за урок!

№ слайда 31
Читайте также:
- Автоматизация звука ж конспект фронтального занятия
- Конспект занятия на сплочение коллектива в старшей группе
- Конспект логопедического занятия главные члены предложения
- Современные технологии записи и хранения информации конспект
- Права ребенка конспект по развитию речи конспект подготовительная группа

