Конспект урока кислоты 8 класс габриелян фгос
Обновлено: 06.07.2024
Цель урока: способствовать формированию знаний учащихся о классе кислот.
Образовательные: познакомить с составом, названиями, классификацией и представителями класса кислот, продолжить формирование знаний о зарядах ионов, степени окисления элементов, об индикаторах.
Развивающие: продолжить развитие памяти, логического мышления обучающихся, формирования исследовательской компетенции, формировать умение анализировать результаты лабораторных исследований, делать выводы, совершенствовать навыки работы с лабораторным оборудованием.
Воспитательные: создать условия для формирования навыков работы в парах, группах, содействовать повышению интереса к изучению химии.
Тип урока: урок изучения нового материала
Форма урока: урок-исследование
Технология: исследовательский метод обучения
Оборудование: компьютер, проектор, экран, презентация, карточки с формулами веществ на каждую парту, по 3 пробирки с растворами соляной, азотной, серной кислот, индикаторы (фенолфталеин, лакмус, метиловый оранжевый).
- Добрый день. Я рада приветствовать вас на уроке химии. Сегодня у нас не обычный урок химии, а урок-исследование. Что такое исследование?
- Исследование — один из видов познавательной деятельности человека, направленный на получение новой информации, новых знаний. Сегодня на уроке мы сделаем очередной шаг по дороге химических знаний: познакомимся с новым классов неорганических веществ. Надеюсь, что наше сотрудничество на уроке будет плодотворным.
- Послушайте загадку и определите, о каком классе веществ идёт речь?
Кислый вкус они имеют
Лакмус в них всегда краснеет
И опасны для работы
- Что вы узнали о кислотах из загадки?
Актуализация опорных знаний
- Прежде чем мы приступим к изучению новой темы, вспомните, что такое лакмус?
- Какие вещества называются индикаторами?
- Какие индикаторы вы ещё знаете?
- С какими классами неорганических веществ вы уже знакомы?
- Как изменяется окраска индикаторов в щелочной среде?
- Работаем в парах. У вас на столе лежат карточки с формулами различных веществ, распределите все вещества на группы и дайте названия. Обоснуйте свой выбор.
CuO, KOH, Ca(OH)2, HСl, Ba(OH)2, Na2O, HNO3, Al2O3, H2SO4
- Проверим (двое учащихся работает с такими же карточками у доски).
- Какие вещества называются оксидами?
- Какие вещества называются основаниями?
III. Создание проблемной ситуации
- Почему вы назвали не все вещества?
+ (Учащиеся отвечают, что им не знакомы эти вещества, и они не знают, к какому классу эти вещества относятся)
- Чем похожи формулы оставшихся веществ?
IV. Постановка проблемы исследования
- Как вы думаете можно ли эти вещества объединить в класс кислот?
- Как изменится окраска индикаторов в кислой среде?
V. Определение темы и цели исследования
- Чтобы ответить на эти вопросы, вам всем предстоит на некоторое время стать исследователями и изучить класс кислот. Определим тему и цель нашего исследования.
+ Кислоты. Познакомиться с классом кислот. (Изучить класс кислот).
- Запишем тему, цель исследования в тетрадь.
VI. Выдвижение гипотезы
- Сформулируем рабочую гипотезу для нашего исследования.
+ Кислоты - сложные вещества, в состав которых входит водород, стоящий на первом месте. Индикаторы изменяют окраску в кислой среде.
- Запишите гипотезу в тетрадь.
VII. Проверка гипотезы
Чтобы проверить гипотезу составим план нашего исследования. План составим в виде вопросов, на которые вы бы хотели получить ответы.
+ (Учащиеся составляют план, он записывается в тетради).
1. Какие вещества называются кислотами?
2. По каким признакам классифицируются кислоты?
3. Как изменяется окраска индикаторов в кислой среде?
- Начнём наше исследование со знакомства с формулами кислот.
- Перед вами ряд кислот. Назовите их. (Слайд 4)
- Найдите общий признак всех кислот.
- Если в формуле кислоты закрыть символ H, то останется кислотный остаток.
- Дадим определение, что же такое кислоты.
- Откройте учебник на с. 103, прочитайте определение кислот в учебнике.
- Какие вещества называются кислотами?
Запишем определение в тетради.
- Познакомьтесь с алгоритмом определения степеней окисления элементов в кислотах (Слайд 5)
- Определите степени окисления атомов химических элементов, образующих кислоты:
- Определите заряды ионов в кислоте: H2SO4
- Переходим к следующему этапу исследования. Используя текст учебника с.102-104 найдите признаки, по которым классифицируются кислоты, составьте схему, приведите примеры.
В тетради учащихся должна появиться схема:
По наличию кислорода
По основности
Одноосновные Двухосновные Трехосновные
- Проверим. Слайд 6
- Чтобы завершить наше исследование мы должны узнать, как изменяется окраска индикаторов в кислой среде. Работать будем в группах по инструктивным картам (Приложение)
Каждая группа изучает действие разных кислот на индикаторы:
1 группа – соляная кислота
2 группа – серная кислота
3 группа – азотная кислота.
Перед началом проведения работы вспомним правила техники безопасности.
+ (Учащиеся называют правила техники безопасности)
- Кислоты – это едкие вещества, которые при попадании на кожу вызывают химические ожоги. При обращении с ними необходимо соблюдать правила безопасной работы, которые лежат у вас на партах (Приложение)
Познакомьтесь с ними.
- Какие правила необходимо соблюдать при работе с кислотами?
- Если нет вопросов, приступаем к исследованию.
(Выполнение исследования по инструктивным карточкам и оформление отчета).
- Предлагаю группам представить свой отчёт.
+ (Представитель от каждой группы представляет отчёт о результатах работы)
- Сделаем общий вывод. Как изменяется окраска индикаторов в кислой среде?
VIII. Интерпретация полученных данных, соотнесение их с гипотезой
- Мы завершили наше исследование. На все ли вопросы мы получили ответы?
- Подтвердилась ли гипотеза исследования?
IХ. Вывод по результатам исследовательской работы
- Назовите тему, цель и гипотезу нашего исследования.
- Достигли ли мы поставленной цели?
- Посовещайтесь в группах, сделайте общий вывод по теме нашего исследования.
- У кого остались вопросы?
Х. Применение новых знаний в учебной деятельности
+1. Кислоты – это сложные вещества, состоящие из H и кислотного остатка.
−2. Кислота, формула которой H2SO4 – это одноосновная кислородосодержащая кислота.
−3. В кислой среде фенолфталеин меняет окраску на красный.
+4. В этих кислотах H2S H2CO3 H2SiO3 заряд кислотного остатка равен 2 –
+5. Вещества, формулы которых HCl, HNO3, H3PO4 - это кислоты
Самопроверка. Слайд 8.
- Проверим. Оценим выполнение работы.
ХI. Подведение итогов урока
- Что нового узнали на уроке?
- Что особенно запомнилось?
- Что вызвало затруднение?
ХII. Домашнее задание
ТЕХНОЛОГИЧЕСКАЯ КАРТА УРОКА
Методы, приёмы обучения
Приветствует учащихся, через загадку мотивирует учащихся на учебную деятельность, определение темы урока
Настраиваются на работу на уроке, определяют тему урока
Актуализация опорных знаний
Предлагает ответить на вопросы, чтобы повторить ранее изученный материал.
Организует работу в парах. Предлагает распределить вещества на группы и дать им названия.
Двое учащихся работают у доски.
Отвечают на вопросы.
Работают в парах с карточками, распределяют вещества на группы.
Создание проблемной ситуации
Выясняет, почему распределили и назвали не все вещества. Предлагает найти черты сходства и различия в формулах веществ
Отвечают на вопросы
создание проблемной ситуации
Постановка проблемы исследования
Спрашивает можно ли эти вещества объединить в класс кислот, как изменится окраска индикаторов в кислой среде.
Отвечают на вопросы
Определение темы и цели исследования
Предлагает провести исследование, определить тему и цель
Определяют тему, цель исследования, записывают в тетради
Предлагает выдвинуть гипотезу
Выдвигают общую гипотезу, записывают в тетрадь
Предлагает составить план исследования
Предлагает познакомиться с формулами кислот (слайд № 4), найти общий признак, дать определение класса.
Знакомятся с формулами кислот, их названиями, определением. Записывают определение в тетрадь.
Предлагает познакомиться с алгоритмом определения степеней окисления элементов в кислотах (Слайд 5) и определить с.о. атомов химических элементов, образующих кислоты:
Объясняет, как определить заряды ионов и предлагает определить з.и. в кислоте H2SO4
Определяют степени окисления.
Определяют заряды ионов.
Проверяют правильность выполнения задания.
Организует работу с учебником.
Организует проверку. Слайд № 6.
работа с учебником;
Организует работу в группах. Предлагает изучить, как изменяется окраска индикаторов в кислой среде. Проводит инструктаж по технике безопасности при работе с кислотами. Наблюдает за работой в группах.
Работают в группах по инструктивным картам, изучают изменение окраски индикаторов в кислой среде, делают выводы.
проведение ученического эксперимента
Интерпретация полученных данных, соотнесение их с гипотезой
Спрашивает, на все ли вопросы получили ответы, подтвердилась ли гипотеза.
Отвечают на вопросы
Вывод по результатам исследовательской работы
Предлагает сделать вывод по теме исследования
Делают общий вывод по теме исследования
Применение новых знаний в учебной деятельности
Предлагает учащимся проверить свои знания по теме. Слайд № 7.
Выполняют задание. Проверяют правильность выполнения.
Подводит итог урока.
Подводят итог урока.
Объясняет особенности домашнего задания. Слайд № 9
Записывают домашнее задание
ИНСТРУКТИВНАЯ КАРТА
1. Внимательно изучите выданный вам образец раствора кислоты. Определите агрегатное состояние, цвет, наличие запаха. Запишите ваши наблюдения в таблицу №1.
2. Перед вами три пробирки с растворами кислоты. В первую пробирку опустите фенолфталеиновую бумажку, во вторую лакмусовую, в третью пробирку добавьте несколько капель метилового оранжевого. Результаты наблюдений сравните, и запишите в таблицу № 2.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Конспект урока
Тема: Кислоты
(по учебнику О.С. Габриеляна)
учитель: Мирошникова Марина Алексеевна
Цель урока: познакомить учащихся с составом, классификацией кислот и названиями основных представителей этого класса.
- дидактические (образовательные): изучить состав, общие признаки классификации кислот, уметь составлять формулы кислот, рассмотреть названия основных представителей, продолжить знакомство учащихся со сложными ионами на примере кислотных остатков кислородных кислот, продолжить формирование знаний о различиях между зарядами ионов и степенью окисления элементов, об индикаторах;
- развивающие: развитие умственной и познавательной активности учащихся в решении проблемы, развитие практических умений и навыков при работе с химическими реактивами и химической посудой, умения обобщать и делать выводы при изучении материала темы;
- воспитательные: продолжить формирование у учащихся навыков: трудолюбие, усердие, дисциплинированность; прививать аккуратность при оформлении заданий в тетради и у доски, развитие химической речи, обогащение ее словарного запаса при устных ответах, и грамотное выполнение при самостоятельных заданиях.
Тип урока : урок формирования знаний.
Вид урока : урок-презентация.
Оборудование и реактивы : ПСХЭ, таблица растворимости, набор для практической работы учащихся: штатив с пробирками, кислоты – 2 образца (серная, лимонная), индикаторы (лакмус, метиловый оранжевый, фенолфталеин).
Этапы урока и их содержание.
Проверка домашнего задания, воспроизведение и коррекция опорных знаний учащихся.
Фронтальный опрос учащихся с целью актуализации имеющихся знаний:
- Какие классы неорганических соединений мы изучили?
- Что такое оксиды?
- Что такое основания?
- На какие группы делятся основания по растворимости в воде? С помощью какой таблицы мы сможем узнать о растворимости вещества?
- С помощью каких реакций распознают вещества? Какие вещества мы использовали на прошлом уроке для определения щелочей? Как изменяют окраску индикаторы в щелочной среде?
- Что такое степень окисления вещества? Чем отличается запись степеней окисления элементов от зарядов ионов?
С учащимися проводит фронтальную беседу.
Участвуют в фронтальном опросе.
Сегодня на уроке мы продолжим изучать основные классы неорганических соединений - класс кислоты, их состав, названия, классификацию и основных представителей этого класса.
Сообщает тему урока, цель урока.
Записывают в тетради тему урока.
Актуализация знаний
На сегодняшнем уроке мы должны познакомиться со следующим классом неорганических веществ – кислотами. Практически со всеми кислотами приходится сталкиваться ежедневно. Дождевая вода лишь на первый взгляд кажется чистой, не содержащей примеси. В ней растворено немало веществ, например углекислый газ из атмосферы. Поэтому дождевая вода является слабым раствором угольной кислоты. После летней грозы в ней оказывается еще и азотная кислота.
Вступительное слово учителя о значении и нахождении кислот.
Введение новых знаний, с учетом закономерностей процесса познания, осмысление связей и отношений в объекте изучения.
Почему они имеют такое название? Кислые на вкус. Достаточно вспомнить вкус аскорбиновой или лимонной кислот. Но ни одни химик и ни один грамотный человек даже и не подумает распознать таким образом кислоты – это может быть смертельно опасно, т.к. к кислотам относят и серную кислоту. Поэтому гораздо проще и безопаснее распознать кислоты, как и щелочи, с помощью индикаторов.
Мы должны определить изменение окраски индикаторов, знакомых нам по прошлому уроку, в кислой среде. Для этого мы используем растворы 2-х кислот: серной кислоты и лимонной кислоты, и растворы 3-х индикаторов: фенолфталеин, лакмус, метиловый оранжевый.
Какими правилами по технике безопасности мы должны придерживаться при проведении этой лабораторной работы:
- строго выполняем указания учителя;
- не пробуем вещества на вкус;
- наливать жидкость в пробирку осторожно, заранее проверив, не разбита ли она;
- пробирку держим на расстоянии 10- 15 см от глаз, на уровне глаз;
- не переливать вещества из пробирки в склянку;
- не загромождать рабочее место;
- производить опыты только в чистой посуде, закончив работу вымыть посуду;
- банки и склянки закрывать теми же пробками и крышками, какими они были закрыты.
Приступим к работе:
В образцы 2-х кислот, в 1-м штативе добавляем небольшое количество лакмуса, в образцы 2-го штатива – метилоранж, в образцы 3-го штатива – фенолфталеин.
Отмечаем окраску растворов.
Лакмус изменяет окраску в кислой среде с фиолетовой на красную, метиловый оранжевый с оранжевой на красно – розовую, фенолфталеин – остается бесцветным.
Что же объединяет все эти кислоты, кроме кислого вкуса? Обратимся к составу кислот. На экране формулы и названия некоторых кислот.
HCl –соляная кислота
HNO 3 –азотная кислота
H 2 CO 3 –угольная кислота
H 3 PO 4 –фосфорная кислота
Что общего в формулах этих кислот?
Давайте сформулируем определение кислот.
Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков.
Как правило, кислотные остатки образуют элементы – неметаллов, значит за счет ковалентных связей. Состав кислотных остатков различен, в одни остатки входит кислород, в других нет. Так же формулы этих кислот отличаются числом атомов H , который определяет особый признак кислот – основность.
По этим признакам кислоты классифицируют:
По числу атомов Н (по основности):
По наличию кислорода в кислотном остатке:
По растворимости в воде:
Запишите по одному примеру по каждой группе кислот.
По формулам кислот можно определить степени окисления химических элементов, образующих кислоты.
Перечислим правила написания степеней окисления:
- знаки записывают перед цифрой;
- указывается для каждого атома химического элемента;
- суммарная степень окисления атомов всех элементов в соединении равна нулю;
- значения степеней окисления записывают строго над химическим элементом.
Зная степень окисления элемента – неметалла, образующего кислотный остаток кислородсодержащей кислоты, можно определить, какой оксид ей соответствует.
HNO 3 → N 2 O 5 – оксид азота ( V ). Кислотам соответствуют оксиды металлов.
По формулам кислот можно определить и общий заряд ионов. Кислоты образуют ионы двух видов: ион водорода – H + и ион кислотного остатка, который будет иметь отрицательный заряд, равный основности кислот.
Повторим правила записи зарядов ионов:
- заряд иона записывают справа от химического элемента;
Самостоятельное определение для фосфорной кислоты: зарядов ионов; с.о. элементов; соответствующий оксид.
А теперь поподробнее познакомимся с некоторыми кислотами, потому, что они играют большое значение в нашей жизни.

Тип урока: комбинированный (урок изучения нового материала с элементами технологии критического мышления и самостоятельной работы).
Методы обучения: словесные (рассказ, объяснение, беседа); иллюстративные; демонстрационные; частично-поисковый, проблемный, исследовательский.
Цели урока: познакомить учащихся с составом, названиями, классификацией и представителями класса кислот
Задачи урока.
Образовательная:
сформировать знания учащихся о кислотах, их составе, значении и применении, способах классификаций и названий представителей класса кислот;
Развивающая:
совершенствовать умения экспериментировать, наблюдать, анализировать, делать выводы, умения слушать и слышать другого человека;
Воспитательные:
продолжить формирование диалектико-материалистического мировоззрения учащихся об окружающих их веществах,
обратить внимание учащихся на правила работы с кислотами.
Оснащение урока:
проектор, экран, периодическая таблица, таблица растворимости, универсальная бумага, ноутбук, лимоны, карточки с кислотами, уксусная кислота, соляная кислота.
1. Организационный момент
- Повернитесь друг к другу, посмотрите друг другу в глаза, улыбнитесь друг к другу, пожелайте друг другу хорошего рабочего настроения на уроке. Теперь посмотрите на меня. С каким настроением вы ко мне пришли? Желаю вам работать дружно, открыть что-то новое для себя. Садитесь.
2. Актуализация знаний.
Задание на классификацию соединений
3 ученика работают у доски. На доске: CaO, NaOH, HCI, Cu(OH)2 , H2SO4 , AL2O3, K2O, H3РO4 , AI(OH)3. Распределите приведенные ниже вещества на три группы. Назовите эти группы.
Остались лишние формулы, которые не относиться не к оксидам, не к основаниям, не к солям, а как же мы их назовем?
На моем столе лежат: лимоны.
Какие ассоциации вызывает у вас лимоны?
(Ученики отвечают: кислый).
А что им придает кислый вкус?
Правильно. Из своего жизненного опыта вы знаете, что многие продукты питания обладают кислым вкусом. Кислый вкус этим продуктам придают кислоты. Кислый вкус лимону придает лимонная кислота, яблоку – яблочная кислота, скисшему молоку – молочная кислота.
Значит тема нашего урока какая? (кислоты) Значит, к какому классу вы отнесете, оставшиеся вещества? Правильно, к кислотам.
Итак, сегодня мы будем изучать свойства кислот.
Запишите число и тему урока в тетрадях.
Что же нам необходимо знать о кислотах? (состав, формулы, названия, классификации, значение и применение, рН среды, правила техники безопасности).
3. Изучение нового материала
1. Состав кислот. Посмотрите на доску, здесь даны формулы кислот
Что между ними общего?
Ответ: Да, это присутствие в их составе атомов Н, с которого начинаются формулы.
Первый элемент слева в формуле – водород ( Н), справа- кислотный остаток.
Учитель: Исходя из состава, дайте определение понятию – кислота. Пользуясь учебником напишите в тетрадях определение кислот.
Кислоты - это сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка.
Перед вами лежат листы с формулами и названиями кислот, их нужно выучить.
2.Классификация кислот
? Обратите внимание на отличия в кислотных остатках. В чем заключается это отличие?
Правильно, кислотные остатки серной, фосфорной кислот содержат кислород, а кислотный остаток хлороводородной, сероводородной кислоты кислорода не содержит.
Наличие кислорода или его отсутствие – один из признаков классификации кислот. По этому признаку кислоты подразделяют на две группы: бескислородные и кислородсодержащие.
Классификация кислот
по наличию кислорода
1. бескислородные (HCl, H2S)
2.кислородсодержащие
(HNO3 ,H2SO4, H2CO3, H3PO4).
Задание 1. Посмотрите на формулы кислот. Они распределены на три группы по определенному признаку. Как вы думаете, что это за признак?
Основность – число атомов водорода в кислоте.
Значит как назовете первый столбик с кислотами (одноосновные), второй (двухосновные), третий (трехосновные).
Кислоты можно классифицировать по числу атомов водорода, т.е. по основности.
Классификация кислот
по числу атомов водорода
1.одноосновные (HCl, HNO3)
2. двухосновные (H2S, H2SO4, H2CO3)
3.трехосновные (H3PO4)
Способность растворяться в воде – еще один признак классификации кислот.
Классификация кислот по растворимости ( по таблице растворимости определяются кислоты растворимые в воде и нерастворимые). Работа с таблицей растворимости.
нерасворимая кислота- кремниевая H2SiO3.
Кислоты, которые не существуют в свободном виде: угольная и сернистая, т.к. они легко распадаются на воду углекислый газ и сернистый газ.
H 2CO3=CO2↑ + H2 O
H2 SO3= S O2↑ +H2 O
Давайте теперь сделаем выводы (допишите пропущенные слова задание 2 на ваших листах):
Вывод: Кислоты делятся на кислородсодержащие и бескислородные по наличию кислорода; по наличию атомов водорода - одноосновные, двухосновные, трехосновные; нерасворимая кислота - кремниевая H2SiO3.
ФИЗКУЛЬТМИНУТКА
3.Определение степени окисления элементов, входящих в состав кислот и зарядов ионов.
По формулам кислот можно определять степени окисления атомов химических
элементов, образующих кислоты. Перед вами лежит правило (прочитайте). Пользуясь правилом расставьте степени окисления в кислотах:
Правило определение заряда кислотного остатка по числу атомов
водорода в молекуле кислоты:
1. Водород в кислотах всегда заряжен +1.
2. Численное значение заряда кислотного остатка всегда равно числу атомов водорода в молекуле, т.е. основности данной кислоты.
Рассчитаем степени окисления элементов.
(+1)∙2+х+(-2)∙4=0 , где х- степень окисления серы; х=6
Заряды кислотных остатков определяются по основности, например:
Составим оксиды соответствующих кислот
+1 -1 +5 -2 +1 - 2 +6 -2
HNO3 -N2 O5 H 2SO4 – SO3
Бескислородные кислоты:
HCl – хлороводородная кислота Н2S – сероводородная кислота
Кислородсодержащие кислоты:
К русскому названию кислотообразующего элемента добавляют суффикс:
Если элемент проявляет высшую СО (равную № группы) +6
Если СО элемента ниже высшей +4
4.Значение и применение кислот.
Кислоты в природе Кислоты в жизни человека В организме человека В кулинарии продуктах питания В медицине В народном хозяйстве Кислотные дожди
Кислоты обладают разъедающим действием . Это свойство используется, например при консервировании. Тела микроорганизмов находящихся в консервируемых продуктах разрушаются под действием кислоты.
4.Закрепление изученного материала
Лабораторный опыт
Форма работы: групповая. Задание 1 команде (1 ряд): Исследовать окраску индикатора в уксусной кислоте. Задание 2 команде (2 ряд): Исследовать окраску индикатора в лимоне (лимонная кислота). Задание 3 команде (3 ряд): Исследовать окраску индикатора в соляной кислоте.
Прежде чем начать работу, давайте вспомним правила техники безопасности.
1. Работать с кислотами необходимо аккуратно, так как можно получить ожог или отравление. При попадании кислоты на кожу надо смыть ее струей воды.
2. Правила техники безопасности при смешивании кислоты с водой.
Сначала вода, затем кислота, иначе случится беда. Поэтому обращаться с кислотами нужно очень осторожно, не допуская их попадания на кожу или одежду.
Какую окраску приобрела универсальная бумага и в уксусной кислоте, и в лимоне, и в соляной кислоте? (оттенки красного).
На основании проведенных опытов сделаем выводы:
независимо от вида кислоты индикаторы изменяют свой цвет одинаково; а это означает, что все кислоты обладают сходными свойствами.
? С чем же это связано? (С наличием атомов водорода).
Проблемно-поисковое задание: три пробирки с растворами, но без этикеток. Среди них должна быть и кислота. Определите, в какой пробирке находится кислота.
ИГРА! Если останется время, если времени нет можно провести на следующем уроке, как актуализация знаний.
5. Домашнее задание: 1. Прочитать параграф, выучить формулы и названия кислот, подготовиться к химическому диктанту.
2. Прочитать параграф, выучить формулы и названия кислот, подготовиться к химическому диктанту + составить кроссворд.
На дерево необходимо прикрепить яблоки:
Зеленый цвет – очень интересный, мне все понравилось.
Желтый лист – мне понравился урок, но я не все понял.
Красный лист – было скучно, я ничего не выполнил.
Определенным цветом яблок можно обозначить уровни усвоения материала.
Спасибо! До свидания!
HF фтороводородная( плавиковая) кислота
HI иодоводородная кислота
HBr бромоводородная кислота
HNO2 азотистая кислота
HNO3 азотная кислота
H2S сероводородная кислота
Задание 1. Посмотрите на формулы кислот. Они распределены на три группы по определенному признаку. Дайте названия этим группам кислот.

Кислоты


______________________ _________________ ___________________
ЗНАТЬ. нерастворимая кислота - кремниевая H2SiO3.
Кислоты, которые не существуют в свободном виде: угольная и сернистая, т.к. они легко распадаются на воду углекислый газ и сернистый газ.
Задание 2. Допишите пропущенные слова.
Кислоты делятся на ________________ и __________________ по наличию _________________; на __________________, __________________ и ____________________ по количеству атомов ____________________. Нерастворимая кислота - _______________ .
Правило определение заряда кислотного остатка по числу атомов
водорода в молекуле кислоты:
1. Водород в кислотах всегда заряжен +1.
2. Численное значение заряда кислотного остатка всегда равно числу атомов водорода в молекуле, т.е. основности данной кислоты.
Как правильно называть кислоты:
HCl – хлороводородная кислота
Н2S – сероводородная кислота
2. Кислородсодержащие кислоты: К русскому названию кислотообразующего элемента добавляют суффикс:
Если элемент проявляет высшую СО (равную № группы)
Если СО элемента ниже высшей +4
Проведение опыта и оформление работы:
1. Опустите универсальную бумагу в пробирку с уксусной кислотой. Результаты наблюдений запишите в тетрадь.
Проведение опыта и оформление работы:
2. Промочите универсальную бумагу соком лимона. Результаты наблюдений запишите в тетрадь.
Проведение опыта и оформление работы:
3. Опустите универсальную бумагу в пробирку с соляной кислотой. Результаты наблюдений запишите в тетрадь.
Проведение опыта и оформление работы:
1. Опустите универсальную бумагу в пробирку с уксусной кислотой. Результаты наблюдений запишите в тетрадь.
Проведение опыта и оформление работы:
2. Промочите универсальную бумагу соком лимона. Результаты наблюдений запишите в тетрадь.
Проведение опыта и оформление работы:
3. Опустите универсальную бумагу в пробирку с соляной кислотой. Результаты наблюдений запишите в тетрадь.
УМК по химии для 8 класса О. С. Габриеляна.
Тип урока: изучение нового материала.
Форма урока: урок-исследование.
Цель урока: рассмотреть свойства кислот в свете теории электролитической диссоциации.
Задачи урока:
- Образовательные: на основе повторения и обобщения ранее изученного материала и в ходе знакомства с новым материалом углубить знания учащихся о свойствах кислот, отработать умение составления ионных уравнений реакций.
- Воспитательные: формировать мировоззренческие понятия о познаваемости природы, воспитывать чувство патриотизма и уважения к своей Родине, чувство коллективизма при работе в группах, уверенность в своих силах.
- Развивающие: развивать познавательный интерес к предмету, память, мышление, наблюдательность в ходе эксперимента; продолжить развитие навыков работы с химическими веществами и лабораторным оборудованием в процессе выполнения лабораторного опыта.
Оборудование и материалы: таблица растворимости, плакат “Химические свойства кислот”, карты-исследований, карточки-инструктажи, карточки с домашним заданием;
ТСО: проектор, видеофильм “Взаимодействие оксида меди с серной кислотой”.
Ход урока
I. Организационный момент
Приветствие учителя. Проверка готовности класса к уроку. Психологический настрой учащихся. Создание спокойной, деловой обстановки.
II. Повторение изученного материала
Я хочу начать наш урок с эпиграфа: “Один опыт я ставлю выше, чем тысячу мнений, рождённых только воображением”. Это изречение принадлежит великому русскому учёному М. В. Ломоносову. Из этих слов становится ясно, какую значимость придавал он опыту. Именно поэтому Михаил Васильевич в течение 7 лет настойчиво добивался организации химической лаборатории. “Профессор химии без лаборатории никакой пользы учинить не может, точно так же, как профессор астрономии без обсерватории”.
В итоге первая химическая лаборатория была учреждена в России в 1748 г. В ней было выполнено большое количество исследований, было сделано много открытий.
Не случайно наш урок начался со слов этого великого учёного. Сегодня мы с вами будем работать в рамках химической лаборатории, в которой, как и М.В.Ломоносов, будем проводить исследования. В нашей лаборатории мы будем изучать кислоты с точки зрения теории электролитической диссоциации. Сегодня на уроке мы рассмотрим химические свойства кислот в свете теории электролитической диссоциации. Это цель нашего урока. Тема нашего урока: “Кислоты, их классификация и свойства” (Запись даты и темы урока в тетради).
Вспомним основные понятия электролитической диссоциации:
– На какие группы делятся вещества по отношению к электрическому току? (Электролиты и неэлектролиты.)
– Дайте определение понятию “электролит”? (Это вещество, водный раствор или расплав, которого проводит электрический ток.)
– Приведите примеры электролитов? (Растворы и расплавы солей и щелочей, растворы кислот.)
– Дайте определение понятию “неэлектролит”? (Это вещество, водный раствор и расплав которого не проводит электрический ток.)
– Приведите примеры неэлектролитов? (Нерастворимые соли и основания, оксиды, простые вещества, органические вещества.)
– Дайте определение понятию “электролитическая диссоциация”? (Это распад электролита на ионы при расплавлении или растворении в воде.)
– Дайте определение кислоте из курса? (Это сложное вещество, состоящее из атомов водорода и кислотного остатка.)
Существует несколько классификаций кислот. Откройте учебник на странице 157, таблица № 10.
– Как могут классифицироваться кислоты?
Если кислоты электролиты, то они тоже могут диссоциировать. Сейчас я вам предлагаю написать диссоциацию серной и соляной кислот.
HСl → H + + Cl –
– Дайте определение кислоте с точки зрения теории электролитической диссоциации? (Это электролит, диссоциирующий в водном растворе на катион водорода и анион кислотного остатка.)
Мы повторили основные понятия, необходимые для дальнейшего изучения химических свойств кислот.
III. Изучение нового материала
Переходим к изучению химических свойств кислот.
Все химические свойства кислот представлены на плакате.
На доске прикрепляю карточки (зачитываю химические свойства)
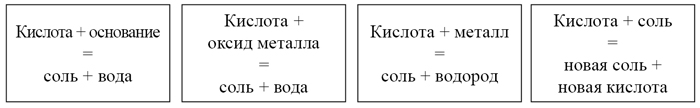
Ни одна наука не нуждается в эксперименте в такой степени как химия. Ее основные законы, теории и выводы опираются на факты, поэтому постоянный контроль опытом необходим”. Поэтому опытным путем докажем химические свойства кислот, соблюдая технику безопасности.
Инструкция “Меры безопасности при работе с кислотами”, инструкция проведения опыта), учащиеся разделены на 4 группы. Перед выполнением лабораторного опыта, учащиеся читают инструкцию (приложение 2).
Лабораторный опыт “Взаимодействие кислот с щелочами (основаниями)”
Порядок выполнения работы:
- В пробирку налейте 2 мл раствора гидроксида натрия и прибавьте 1–2 капли фенолфталеина. Что вы наблюдаете?
- К раствору щелочи с фенолфталеином приливайте по каплям соляную кислоту, периодически взбалтывая содержимое пробирки. Что вы наблюдаете?
- Составьте молекулярное и ионные уравнения проделанной реакции.
Лабораторный опыт “ Взаимодействие кислот с солями”
Порядок выполнения работы:
- В пробирку налейте 2 мл серной кислоты и прибавьте несколько капель хлорида бария. Что вы наблюдаете?
- Напишите молекулярное и ионные уравнения проделанной реакции
Лабораторный опыт “Взаимодействие кислот с металлами”
Порядок выполнения работы:
- В пробирку положите 2 гранулы цинка и прилейте соляную кислоту, закройте пробирку пробкой. Подождите некоторое время, чтобы она заполнилась водородом, затем откройте пробку и поднесите зажженную спичку к отверстию.
- Что вы наблюдаете?
- Напишите молекулярное уравнение проделанной реакции.
Лабораторный опыт “Взаимодействие кислот с основными оксидами” (видеофрагмент)
После выполнения работы 4 учащихся от каждой группы выходят к доске и пишут уравнения реакции под соответствующими карточками. В это время 4 других учащихся представляют отчет о проделанной работе.
Затем зачитываю применение кислот в быту. Уксусная и лимонная кислота применяется для удаления пятен от ржавчины на хлопчатобумажных, льняных и шерстяных белых тканях. 1 чайная ложка на 1 стакан воды, подогреть до кипения и ткань с пятном несколько раз окунуть в раствор или пятно протереть раствором, а затем кислоту тщательно смыть водой, лучше с добавлением несколько капель нашатырного спирта – для нейтрализации кислоты.
IV. Закрепление
Задание: составьте возможные уравнения реакций взаимодействия перечисленных веществ с раствором серной кислоты. Из букв, соответствующих правильным ответам, вы составите название одного из элементов четвертого периода таблицы Д. И. Менделеева.
III. Подведение итогов урока
Подведем итоги урока. Сегодня в рамках химической лаборатории мы исследовали кислоты с точки зрения теории электролитической диссоциации. Давайте ещё раз обратимся к эпиграфу, с которого мы начали наш урок: “Один опыт я ставлю выше, чем тысячу мнений рождённых только воображением”. Этим мудрым высказыванием М. В. Ломоносова давайте завершим наш урок.
IV. Домашнее задание
Учащиеся получают необычное домашнее задание разного уровня сложности “Кем вы считаете себя в химии?”: кандидатом наук, профессором или академиком. Ученые степени расположены в порядке возрастания от кандидата наук до академика. Самая высшая учёная степень – академик. Дома ученики выбирают посильный для себя вариант работы с той учёной степенью, на которую они претендуют. Каждый вариант работы включает 2 задания, одно из них носит творческий характер. К следующему уроку выполняется первое задание, на выполнение второго задания даётся одна неделя.
Читайте также:

