Конспект урока газовые законы изопроцессы
Обновлено: 05.07.2024
6) применение модели идеального газа для описания поведения реальных газов.
Глоссарий по теме
Уравнение, связывающее три макроскопических параметра давление, объём и температура, называют уравнением состояния идеального газа.
Парциальное давление – давление отдельно взятого компонента газовой смеси, равно давлению, которое он будет оказывать, если занимает весь объем при той же температуре.
Количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра называют газовыми законами (изопроцессами).
Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называют изотермическим.
Процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении называют изобарным.
Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным.
Основная и дополнительная литература по теме урока:
Мякишев Г.Я., Буховцев Б.Б., Сотский Н.Н. Физика. 10 класс. Учебник для общеобразовательных организаций М.: Просвещение, 2017. – С. 209 – 218.
Рымкевич А.П. Сборник задач по физике. 10-11 класс. - М.: Дрофа, 2009.
Открытые электронные ресурсы по теме урока:
Теоретический материал для самостоятельного изучения
Уравнение Клапейрона при m = const: отношение произведения давления и объёма к температуре есть величина постоянная для постоянной массы газа:

Если изменяется какой-либо макроскопический параметр газа постоянной массы, то два других параметра изменятся таким образом, чтобы указанное соотношение осталось постоянным.
Отношение произведения давления и объёма к температуре равно универсальной газовой постоянной для одного моля идеального газа.
Уравнение Менделеева при v = 1 моль

Произведение постоянной Больцмана и постоянной Авогадро называется универсальной газовой постоянной.

- уравнение состояния идеального газа.
Давление смеси химически невзаимодействующих газов равно сумме их парциальных давлений: закон Дальтона.

где pi– парциальное давление i-й компоненты смеси.
Парциальное давление – давление отдельно взятого компонента газовой смеси, равное давлению, которое он будет оказывать, если занимает весь объём при той же температуре.
Один моль любого газа при нормальных условиях занимает один и тот же объём равный:
V0=0,0224м 3 /моль=22,4дм 3 /моль.
Это утверждение называется законом Авогадро
Количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра называют газовыми законами (изопроцессами).
Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называют изотермическим.


Для газа данной массы произведение давления на объём постоянна, если температура газа не меняется - закон Бойля – Мариотта.
Изотерма соответствующая более высокой температуре T1, лежит на графике выше изотермы, соответствующей более низкой температуре T2.
Если значения давления и температуры в различных точках объёма разные, то в этом случае газ находится в неравновесном состоянии.
Равновесное состояние - это состояние, при котором температура и давление во всех точках объёма одинаковы.
Процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении называют изобарным.
Для газа данной массы отношение объема к температуре постоянно, если давление не изменяется - закон Гей-Люссака.



Изобара соответствующая более высокому давлению p2 лежит на графике ниже изобары соответствующей более низкому давлению p1.

Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным.
При данной массе газа отношение давление газа к температуре постоянно, если объем газа не изменяется - закон Шарля.


Изохора соответствующая большему объему V2 лежит ниже изохоры, соответствующей меньшему объему V1.

Примеры и разбор решения заданий
1. Установите соответствие между физическими величинами и приборами для их измерения. К каждой позиции первого столбца подберите нужную позицию второго и запишите в таблицу выбранные цифры под соответствующими буквами.

Цель урока: изучить связь между тремя макроскопическими параметрами газа, а конкретнее – их взаимосвязь в газовых процессах, протекающих при постоянном значении одного из этих трёх параметров, или изопроцессах: изотермических, изохорных и изобарных.
Задачи урока:
Образовательные:
- Ввести понятие об изопроцессе;
- Изучить изопроцессы (история открытия, модель установки для изучения зависимостей между термодинамическими параметрами, графики изопроцесса, математическая запись закона, объяснение с точки зрения МКТ);
- Сформировать умения выделять и описывать изопроцессы.
-Научить учащихся решать аналитические и графические задачи, используя уравнение состояния и газовые законы.
Развивающие:
- Вырабатывать умения объяснять газовые законы на основе положений МКТ;
- Научить описывать состояние и изопроцессы идеального газа, в том числе определять микро - и макропараметры; давать и объяснять графическое изображение процессов.
- Сформировать умение самостоятельно добывать знания, применять полученные знания в нестандартных ситуациях для решения графических и аналитических задач;
Воспитательные:
-Продолжить формирование познавательного интереса учащихся;
-Продолжить формирование стремления к глубокому усвоению теоретических знаний через решение задач.
- Формирование взаимопомощи, доброжелательного отношения друг к другу, развивать культуру общения и культуру ответа на вопросы.
Планируемые результаты:
• сформировать понятия о изопроцесс, изотермический, изобарный, изохорный, закон Бойля-Мариотта, Гей-Люссака, Шарля, изотерма, изохора, изобара;
• выработать умения выделять и описывать изопроцессы;
отработать навык решения аналитические и графические задачи, используя уравнение состояния и газовые законы решать аналитические и графические задачи, используя уравнение состояния и газовые законы
Метапредметные:
• Регулятивные: фиксировать индивидуальное затруднение в проблемном действии; самостоятельно решать задачи, используя имеющиеся знания; контролировать свою деятельность по ходу выполнения задания;
• Познавательные работать с разными видами информации и ориентироваться в ней; выполнять действия по образцу; использовать знаково-символичные средства при сворачивании и разворачивании информации; задавать проблемные вопросы в ходе исследовательской деятельности и отвечать на них; развивать умение анализировать, сравнивать, сопоставлять и обобщать;
• Коммуникативные: развивать умение сотрудничества со сверстниками при работе в группе; развивать умение принимать коллективное решение.
Личностные УУД:
- Осознание необходимости учения и бережного отношение к своему здоровью;
- Осознать роль газовых законов в жизни человека;
- Работать над самооценкой и адекватным пониманием причин успеха/неуспеха в учебной деятельности;
- Учиться проявлять самостоятельность в разных видах деятельности (выдвигать гипотезу, проверять ее опытным путем, делать выводы);
- Работать над осознанием ответственности за общее дело; учиться выражать свое мнение.
Место урока в разделе "Основы МКТ": урок проводился в 10 классе после изучения основ молекулярно-кинетической теории газов и понятия температура.
Организационный этап (1минута).
Постановка темы, цели и задачи урока (5 минут).
Этап изучения нового материала (3 минут).
Работа в группах (5 минут).
Валеологическая пауза (1мин)
Этап изучения нового материала (10 минут).
Применение газовых законов (4 минут)
Рефлексия, подведение итогов (1 минут).
Ход занятия
Обеспечить нормальную внешнюю обстановку для работы на уроке.
Психологически подготовить учащихся к общению.
Содержание этапа урока
Проверка подготовленности школьников к уроку.
Организация внимания школьников.
Раскрытие общих целей урока и плана его проведения.
Здравствуйте, гости дорогие! Добрый день, учащиеся! Я рада вас видеть. Сегодня мы с вами совершим увлекательное виртуальное историческое путешествие, и, надеюсь, вы откроете для себя что-то новое. Для нормальной работы нам потребуются хорошие знания законов физики, поэтому сейчас мы с вами их повторим.
2. ПОСТАНОВКА ТЕМЫ, ЦЕЛИ И ЗАДАЧ УРОКА
Образовательные задачи
Установить правильность, полноту и осознанность выполнения домашнего задания всеми учащимися.
Выявить пробелы в знаниях и способах деятельности учащихся.
Содержание этапа урока
Определение типичных недостатков в знаниях и способах деятельности учащихся и причин их появления.
По традиции опять
Начинаем как обычно
Это ведь для нас привычно.
Вы хорошо поработали над предыдущей темой (мотив достижений).
Но не усвоили ещё одну важную сторону этой темы (мотив относительной неудовлетворенности).

Итак, мы знаем уравнение, которое характеризует состояние идеального газа. . Мы видим, что если масса постоянна, то между оставшимися параметрами есть определённое соотношение.
Надо сказать, что изопроцессами называются такие процессы, которые протекают при неизменно одном из параметров газа. Другими словами изопроцесс это процесс, который протекает при постоянном давлении, или процесс который протекает при постоянном объеме, или процесс который протекает при постоянной температуре. Уравнение описывающий изопроцесс, его закономерности - газовым законом. Цель нашего урока: познакомится с законами изопроцессов иначе газовыми законами.
Получить уравнение состояния, используя те знания, что у вас уже есть достаточно просто, и вы сможете в этом убедиться. А зная это уравнение, можно вывести все три газовых закона всего за 10 минут.
Но в истории физики эти открытия были сделаны в обратном порядке: сначала экспериментально были получены газовые законы, и только потом они были обобщены в уравнение состояния. Этот путь занял почти 200 лет: около 420 г. до н.э.- Атомная теория строения вещества, 1662 - 1802гг – экспериментально установлены газовые законы, 1811 - Закон Авогадро, 1827 - Броуновское движение, 1834 - Уравнение состояния идеального газа, 1849 - Молекулярно-кинетическая теория, а более общая форма уравнения состояния идеального газа – в 1874 году Д.И.Менделеевым.
Ваша задача на уроке: повторить путь известных физиков и получить формулировки газовых законов. По сравнения с 17-18 в., для вас эта задача значительно упрощена. Но, выступая в роли исследователей, вам придется анализировать увиденное, делать выводы, объяснять результаты. Ведь как говорил Майкл Фарадей “Искусство экспериментатора состоит в том, чтобы уметь задавать природе вопросы и понимать ее ответы”.
По ходу урока вы будете весь новый материал систематизировать и заносить в таблицу:
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Дата: 22.12.15
Тема: Газовые законы. Изопроцессы в газах.
- установить связь между двумя термодинамическими параметрами при неизменном третьем параметре теоретическим способом;
-научить применять свои знания при решении задач, показать графическое объяснение изопроцессов;
-указать границы применимости теории идеальных газов на практике;
-рассмотреть следствия из уравнения состояния идеального газа.
-продолжить формировать умение принимать решения.
- воспитывать дисциплинированность, ответственное отношение к учебному труду;
- выработка таких личностных качеств, как аккуратность, внимательность при решении задач;
- показать тесную связь физики с жизнью;
- развивать творческую активность и самостоятельность учеников;
- развивать умения выделять главное, делать выводы,
- развивать физически грамотную речь, логическое мышление;
- развивать объективную самооценку.
Предметные: Знать: уравнение Менделеева-Клайперона, связь между параметрами состояния газа в изопроцессах. Уметь: решать задачи с использованием основного уравнения молекулярно-кинетической теории газов, уравнения Менделеева – Клайперона, читать графики зависимости между основными параметрами состояния газа.
Личностные: убежденность в возможности познания природы, в необходимости разумного использования достижений науки и технологий, применение полученных знаний и умений для решения практических задач повседневной жизни.
Метапредметные: овладение навыками организации учебной деятельности, постановки целей, планирования, самоконтроля и оценки результатов своей деятельности; формирование умений воспринимать, перерабатывать и предъявлять информацию в словесной, образной, символической формах; развитие монологической речи, умения выражать свои мысли и способности выслушивать собеседника.
Применяемые методы: Проблемное обучение, ИКТ, элементы ТРКМ при проведении рефлексии.
Оргмомент. Мотивация.
Актуализация опорных знаний
Вычислите давление кислорода массой 32 г в сосуде объемом 8,31м 3 при температуре 100 0 С.
Газ находится в баллоне вместимостью 8,31 л при температуре 127 0 С и давлении
100 кПа. Какое количество вещества содержится в газе?
(фронтальная беседа):
1. Перечислите основные положения МКТ.
2. Что такое количество вещества?
3. Что такое молярная масса?
4. Какой газ называют идеальным в МКТ?
5. Дайте определение и приведите примеры макроскопических параметров.
6. Дайте определение и приведите примеры микроскопических параметров.
7. Запишите основное уравнение МКТ. Чем оно замечательно?
8. Что такое температура? В каких единицах она измеряется?
9. Чему равны давление и температура газа при нормальных условиях?
10. Запишите уравнение состояния идеального газа. Чьи имена носит это уравнение и почему?
11. Какая форма уравнения состояния содержит больше информации: уравнение Клапейрона или уравнение Менделеева-Клапейрона?
12. Что такое газовые законы? (На этот вопрос учащиеся не могут дать ответ, создавая проблемную ситуацию, формулируют тему и цели сегодняшнего урока) .
Изучение нового материала:
1. Газовые законы сегодня легко можно вывести из уравнения состояния идеального газа. Но исторически этого уравнения еще не существовало. Поэтому газовые законы первоначально были получены экспериментальным путем, часто даже ученые не придавали значения полученным результатам. А только лишь спустя некоторое время, по мере формирования науки о тепловых явлениях, приходило понимание фундаментальности полученных взаимосвязей.
Количественные зависимости между двумя параметрами газа одной и той же массы при неизменном значении третьего параметра называют газовыми законами .
Процессы протекающие в идеальном газе постоянной массы при неизменном значении одного из параметров, называются изопроцессами.
Изопроцесс – это идеализированная модель реального процесса, которая приближенно отражает действительность.
Изучение изопроцессов. (Деятельность учащихся: Наблюдая анимацию данного процесса определяют его особенность и при помощи учителя записывают и формулируют закон).
T= const Изотермический процесс. (Закон Бойля-Мариотта.
Роберт Бойль; Эдм Мариотт.) pV=const. Для постоянной массы газа при неизменной температуре, произведение давления на объем есть величина постоянная. Анализируют графики изотерм.
Р = const, Изобарный процесс (закон Гей-Люссака) V / T = const . Для постоянной массы газа при неизменном давлении, отношение объема к температуре есть величина постоянная. Анализируют графики изобар.
V = const Изохорный процесс (закон Шарля). p/T=const. Для постоянной массы газа при неизменном давлении, отношение давления к температуре есть величина постоянная. Анализируют графики изохор.
3. Опорный конспект:
Связь между другими параметр.
Объяснение связи между параметрами
1662г – Роберт Бойль; 1676 г – Эдм Мариотт.)
Число ударов пропорционально числу частиц в единице объема
(n=N/V) объем увеличивается, а концентрация уменьшается следовательно давление уменьшается.

(закон Шарля, 1787 г.)
Увеличение температуры газа означает увеличение средней кинетической энергии теплового движения частиц. При постоянном объёме это приводит к увеличению числа ударов частиц о единицу площади поверхности стенки в единицу времени, то есть к увеличению давления.

Изобарный (закон Гей-Люссака ,
Рост температуры означает увеличение средней кинетической энергии теплового движения молекул газа. Чтобы поддерживать давление постоянным, необходимо не допустить увеличения числа ударов о единицу площади поверхности стенки

Закрепление материала. (устно)
Задача1. В результате изотермического процесса объем идеального газа в сосуде с давлением 1 атм., увеличился вдвое. Как изменилось давление?
Задача2. В сосуде находится идеальный газ объемом 1
при температуре 150 К. В результате изобарного расширения объем газа уменьшился вдвое. Как изменилась при этом температура?
Задача 3. №2 стр. 220
Итог урока. Рефлексия.
Продолжи фразу:
- Сегодня на уроке я…..
- Самым сложным для меня было….
- Теперь я знаю….
- Над этим мне нужно поработать дома…
Домашнее задание. §63 (повторить),§65,66
С1,С3 стр.220
№ 1, 3стр.220 (по желанию)
Вычислите давление кислорода массой 32 г в сосуде объемом 8,31м 3 при температуре 100 0 С.
Газ находится в баллоне вместимостью 8,31 л при температуре 127 0 С и давлении 100 кПа. Какое количество вещества содержится в газе?
На какой глубине h находился пузырек воздуха, если в процессе всплытия на поверхность воды, его радиус успел увеличиться в n = 2 раза? Атмосферное давление 100 кПа, плотность воды 1000 кг/м 3 . Температуру воды считать постоянной.
3.На какой глубине h находился пузырек воздуха, если в процессе всплытия на поверхность воды, его радиус успел увеличиться в n = 2 раза? Атмосферное давление 100 кПа, плотность воды 1000 кг/м 3 . Температуру воды считать постоянной.

На этом уроке мы познакомимся с изопроцессами, при которых один из макроскопических параметров газа остается постоянным. Мы исследуем зависимости других макроскопических параметров газа в различных случаях.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Газовые законы"
Напомним, что в одном из прошлых уроков мы вывели уравнение состояния идеального газа (или уравнение Менделеева-Клапейрона):
Рассматривая случаи, когда масса и один из макроскопических параметров постоянны, можно вывести количественные зависимости между двумя другими макропараметрами. Такие зависимости называют газовыми законами.
Процессы, протекающие при постоянном давлении, постоянном объеме или постоянной температуре, называют изопроцессами.
Надо сказать, что это, опять же, идеализированные модели реальных процессов, поскольку поддерживать постоянство того или иного параметра с высокой точностью достаточно сложно. Тем не менее, в лабораторных условиях это возможно.
Итак, существует три изопроцесса: изотермический, изобарный и изохорный. Изотермический процесс — это процесс, происходящий при постоянной температуре.
Изобарный процесс — это процесс, происходящий при постоянном давлении.
Изохорный процесс — это процесс, происходящий при постоянном объеме.
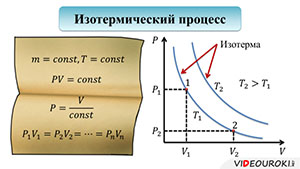
Начнем с изучения изотермического процесса. Итак, рассмотрим уравнение состояния идеального газа при постоянной массе и температуре:
Сразу заметим, что постоянная масса означает постоянное количество вещества. Тогда, правая часть уравнения становится константой.
Из этого вытекает следующий закон: для газа данной массы при постоянной температуре произведение давления газа и его объема постоянно:
Этот закон был открыт двумя учеными: Робертом Бойлем и Эдмом Мариоттом, которые пришли к такому выводу, работая независимо друг от друга. Но, свое открытие они совершили приблизительно в одно и то же время, поэтому, закон стал называться законом Бойля-Мариотта.
Из уравнения, описывающего закон Бойля-Мариотта, выразим давление через объем, чтобы построить график:
Чисто логически, вы понимаете, что если произведение объема и давления остается постоянным, то это значит, что во сколько раз уменьшится объем, во столько же раз увеличится и давление. И наоборот: во сколько раз увеличится объем, во столько же раз уменьшиться давление. График зависимости давления от объема при постоянной температуре представляет собой гиперболу:
Кривая, отображающая этот график, называется изотермой. Изотерма, соответствующая более высокой температуре, будет лежать выше на графике зависимости давления от объема, поскольку при повышении температуры при постоянном объеме, повышается давление. Отметим на графике две произвольные точки 1 и 2. Точке 1 будут соответствовать давление Р1 и объем V1. Аналогично, точке 2 будут соответствовать давление Р2 и объем V2. Тогда мы можем записать, что
Подобное равенство будет выполняться для любой пары точек, принадлежащих одной и той же изотерме.
Надо сказать, что для осуществления изотермического процесса, сжатие или расширение газа должно происходить очень медленно.
Теперь поговорим об изобарном процессе. Запишем снова уравнение состояния идеального газа и рассмотрим его при условии, что давление и количество вещества постоянно:
Соответственно, следующий газовый закон звучит так: для газа данной массы при постоянном давлении отношение объема к температуре постоянно. Этот закон открыл Жозеф Гей-Люссак, поэтому, газовый закон, соответствующий постоянному давлению, называется законом Гей-Люссака.
Если мы выразим объем через температуру, то придем к линейной зависимости:
Поэтому, график зависимости объема от температуры при постоянном давлении является прямой линией. Эта линия называется изобарой.
Изобара, соответствующая бо́льшему давлению, лежит ниже изобары, соответствующей меньшему давлению, поскольку с ростом давления объем газа уменьшается при постоянной температуре. Опять же, если мы отметим на графике две произвольные точки 1 и 2, то им будут соответствовать значения V1, T1 и V2, T2. Тогда можем записать, что
Подобное равенство будет выполняться для любой пары точек, принадлежащих одной и той же изобаре. Обратите внимание, что точки изобары вблизи абсолютного нуля обозначаются пунктиром. Дело в том, что, во-первых, абсолютный ноль недостижим, а во-вторых, при таких низких температурах, данный газовый закон перестает выполняться.
Для осуществления изобарного процесса, нужно нагревать газ, помещенный в цилиндр с подвижным поршнем (при условии, что внешнее давление постоянно).
Наконец, давайте поговорим об изохорном процессе. В этом случае, мы рассматриваем уравнение состояния идеального газа при постоянной массе и объеме:
Исходя из этого, можно заключить следующее: для газа данной массы при постоянном объеме отношение давления к температуре постоянно. Этот закон был открыт Жаком Шарлем и, соответственно, называется законом Шарля. Если теперь мы выразим давление через температуру, то опять же придем к линейной зависимости:
То есть, график зависимости давления от температуры будет являться прямой линией. Эта линия называется изохорой.
Изохора, соответствующая большему объему, лежит ниже изохоры, соответствующей меньшему объему, поскольку с ростом объема падает давление при постоянной температуре. Мы снова можем взять произвольные точки на графике. Тогда
Подобное равенство будет выполняться для любой пары точек, принадлежащих одной и той же изохоре. Изохоры вблизи абсолютного нуля обозначаются пунктиром, опять же из-за того, что данный закон перестает выполняться при абсолютном нуле.
Изохорный процесс проще всего осуществить технически: нужно взять какую-либо герметичную емкость. С нагреванием газа в этой емкости давление будет увеличиваться прямо пропорционально температуре. Именно этот закон лежит в основе создания газового термометра.
Как вы видите, все газовые законы являются частными случаями уравнения состояния идеального газа. На самом деле, сначала был открыт закон, соответствующий изотермическому процессу. В 1662 году его открыл Роберт Бойль и независимо от него в 1676 году этот закон заново открыл Эдм Мариотт. Спустя более ста лет, а точнее, в 1787 году, Жак Шарль открыл закон, соответствующий изохоному процессу. Позднее, в 1802 году Гей-Люссак открыл закон, соответствующий изобарному процессу. Наконец, в 1834 году, КлапейрОн, основываясь на газовых законах, вывел свое уравнение состояния идеального газа для постоянной массы. А через 40 лет, в 1874 году, Менделеев преобразовал это уравнение для произвольной массы газа. Но сегодня мы, так сказать, пошли в обратном направлении: от общего к частному.
Примеры решения задач.
Задача 1. Газ изотермически расширяется от объёма, равного 1 л до объёма, равного 3 л. Если начальное давление газа было равно 360 кПа, то каким станет его давление, когда газ закончит расширяться?
Задача 2. На графике показан некий процесс, происходящий с кислородом, масса которого 20 г. Определите объём газа, соответствующий указанной на графике точке.
Читайте также:

