Конспект подгруппа азота 11 класс
Обновлено: 05.07.2024
В зависимости от численности учащихся, посещающих факультативное занятие, работа может быть организована индивидуально, в парах, в группах и при выполнении заданий можно чередовать эти же формы работы.
| Вложение | Размер |
|---|---|
| plan_fakultativnogo_zanyatiya_po_himii.docx | 74.84 КБ |
Предварительный просмотр:
ГОСУДАРСТВЕННОЕ УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ
План-конспект факультативного занятия по химии в 11 классе
Хузеева Светлана Антоновна
Учитель высшей квалификационной категории
Время на работу
Форма работы учащегося
Необходимый материал для организации познавательной деятельности учащегося
Подготовка учащихся к работе на основном этапе
Актуализация знаний, подготовка к определению темы занятия через написание химического диктанта
Письменная работа в тетрадях
Определение темы занятия, вопросов для рассмотрения
Этап обобщения и систематизации знаний
Заполнение предложенных заготовок опорных конспектов
Заготовки опорных конспектов
Этап контроля и самоконтроля знаний и способов действий
Коррекция и углубление теоретических знаний по теме через самопроверку
Сравнение созданного и готового вариантов опорных конспектов
Готовые опорные конспекты по теме
Этап усвоения новых знаний и способов действий
Изучение нового материала через объяснение учителя
Составление алгоритма решения задач
Этап применения знаний и способов действий
Ликвидация пробелов в знаниях через работу с алгоритмами, консультации с учителем
Рассмотрение готовых решений, самостоятельное выполнение аналогичных заданий
Отработка практических навыков по теме
Выполнение предложенных заданий
Анализ эффективности работы на занятии
Самооценка эффективности работы на занятии, определение проблем и способов их устранения
- совершенствование умений выполнять заданий за ограниченный промежуток времени
- развитие навыка самоконтроля учебной деятельности
К концу учебного занятия учащиеся должны знать:
- Строение атома азота
- Строение молекулы азота, аммиака, азотной кислоты
- Физические и химические свойства азота, оксидов азота, аммиака, азотной кислоты, солей аммония, нитратов
- Качественные реакции на ион аммония, нитрат-ион
- Применять теоретические знания для осуществления превращений по схемам
- Расставлять коэффициенты в уравнениях химических реакций методом электронного баланса
- Решать расчетные задачи на скорость химической реакции.
3. Централизованное тестирование. Химия. Сборник тестов – Минск: Аверсев, 2018. – 109 с.
4. Централизованное тестирование. Химия. Сборник тестов – Минск: Аверсев, 2014. – 47 с.
5. Свиридов, В.В. Сборник задач и упражнений по химии. / В.В.Свиридов, Г.А.Попкович – Минск: Народная асвета, 1994. – 363 с.
6. Хвалюк, В.Н. Сборник задач по химии. 10 класс/ Хвалюк В.Н., Резяпкин В.И. – Минск: Адукацыя i выхаванне, 2003. – 159 с.
- Химия – наука о химических элементах, их соединениях и превращениях, происходящих в результате химических реакций. В курсе химии мы постоянно имеем дело с названиями химических соединений как по систематической номенклатуре, так и с тривиальными. Если называть вещества по систематической номенклатуре вы должны уметь, то тривиальные названия необходимо запомнить, чтобы решать задачи, успешно выполнять задания ЦТ. Вспомните и запишите следующие химические формулы веществ и расчетные формулы.
(ответы на слайде №2, самопроверка выполнения задания )
- Проанализировав предыдущее задания, сформулируйте тему нашего занятия. ( Соединения азота ) и предложите вопросы для рассмотрения (слайды №3, 4)
- Соединения азота, такие как аммиак, азотная кислота, соли азотной кислоты – это вещества, широко используемые в народном хозяйстве, вещества многотоннажного производства. Для их получения создаются определенные условия (это видно из уравнений реакции). Необходимо уметь рассчитывать скорость химического процесса, учитывать влияние температуры, давления. Давайте вспомним, как решаются такие задачи.
Для гомогенной реакции, протекающей в объеме, равном 3 л, количество вещества реагента за 5с изменилось с 5 моль до 2 моль. Найдите скорость реакции.
В начале занятия мы вспомнили, что скорость гомогенной реакции равна отношению изменения концентрации Δ с реагента или продукта к промежутку времени Δτ , за которое произошло такое изменение концентрации:
Концентрация с (молярная концентрация) равна отношению количества вещества к объему системы c=
Поскольку с= , то , тогда =- =0.2 моль/л -1 с -1
Ответ: 0.2 моль/л -1 с -1
На сколько градусов надо повысить температуру, чтобы скорость реакции возросла в 27 раз? Температурный коэффициент реакции равен 3.
Зависимость скорости реакции от температуры Т описывается уравнением
2 )= 1 )* ﻷ (Т2-Т1)/10 , = 1/( Δ ﻷ Δ Т/10 ) , тогда 27= или 3 3 = , Δ Т/10=3, Δ Т=30 0 С
Ответ: на 30 0 С
- А сейчас я предлагаю вам попробовать свои силы в следующих отделах нашей химической лаборатории: экспериментаторском, расчетном, теоретическом и практическом. Посещать все отделы не обязательно. Начните с самых трудных для себя. (слайд №5).
Итак, в экспериментаторском отделе вы вспомните, как решить задачи на определение веществ по качественным реакциям. Здесь консультантом будет наш лаборант.
В теоретическом – потрудиться над превращением схем окислительно-восстановительных реакций в уравнения, используя метод электронного баланса (работа по алгоритму, с карточками для самопроверки)
Практический отдел – это работа по подбору реагентов для осуществления превращений по предложенным схемам, используя опорные конспекты, которые вы создали в начале урока.
Работать можно индивидуально, в парах, или собраться в группы.
За оставшееся время необходимо попробовать выполнить задания не менее чем в двух отделах. В каждом отделе вы можете задержаться не более 5 минут. По истечении времени вы должны поменять место дислокации. При желании, вы можете вернуться в любой отдел, но не раньше, чем через 5 мин, после того, как поработаете в другом отделе.
Я готова дать вам любую консультацию.
Время работы определяется при помощи песочных часов (на 5 мин)
В полученных опорных конспектах приведены в некоторых случаях не уравнения реакций, а схемы. Вспомните расстановку коэффициентов методом электронного баланса, используя алгоритм. Замените знаки вопроса на соответствующие коэффициенты.
Выполните несколько заданий из ЦТ прошлых лет. (Приложение 7)
Неотъемлемой частью заданий В централизованного тестирования по химии являются задания на осуществления превращений по предложенной схеме. Составьте список реагентов для предложенных схем превращений. (Приложение 8)
Решите предложенные задачи, используя формулы для расчета скорости гомогенной химической реакции (Приложение 10)
- Время нашего занятия истекает. Я предлагаю каждому из вас подвести итог собственной деятельности на занятии и ответить на вопросы:
1) весь ли материал, которые мы определили для изучения в начале занятия, рассмотрен?
2) в каком отделе нашей лаборатории вы хотели бы еще поработать?
3) по какому вопросу вам необходима дополнительная консультация? Оцените свое эмоциональное состояние, найдя себя среди капелек (слайд№7)
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью азота.

Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма - полуметалл, висмут - металл.

- N - 2s 2 2p 3
- P - 3s 2 3p 3
- As - 4s 2 4p 3
- Sb - 5s 2 5p 3
- Bi - 6s 2 6p 3
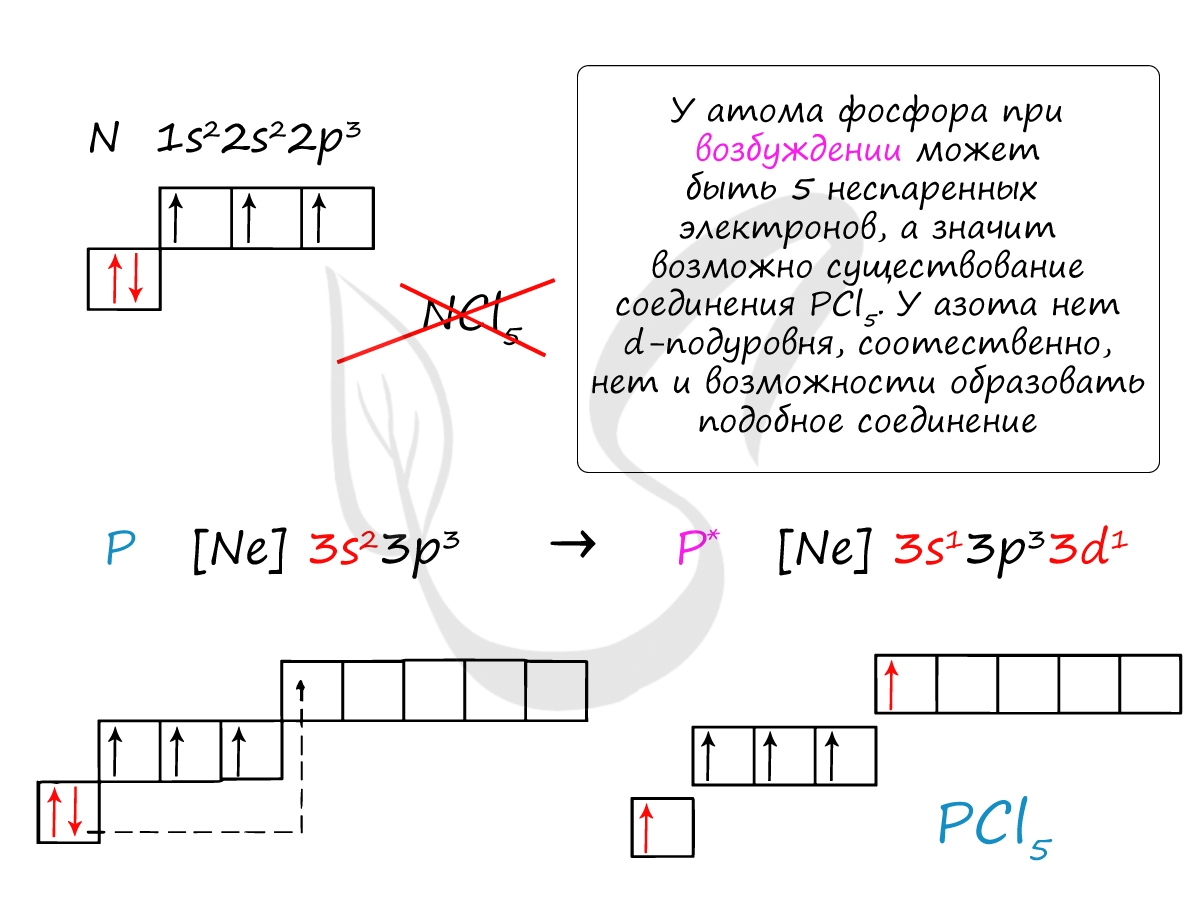
Основное и возбужденное состояние азота
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на p-подуровень. Однако с азотом ситуация иная. Поскольку азот находится во втором периоде, то 3ий уровень у него отсутствует, а значит распаривание электронов на s-подуровне невозможно - возбужденное состояние у азота отсутствует.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.
Природные соединения
- Воздух - во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 - индийская селитра, калиевая селитра
- NaNO3 - чилийская селитра, натриевая селитра
- NH4NO3 - аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако, следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.

В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения из сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.

В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
Также азот можно получить путем восстановления азотной кислоты активными металлами.

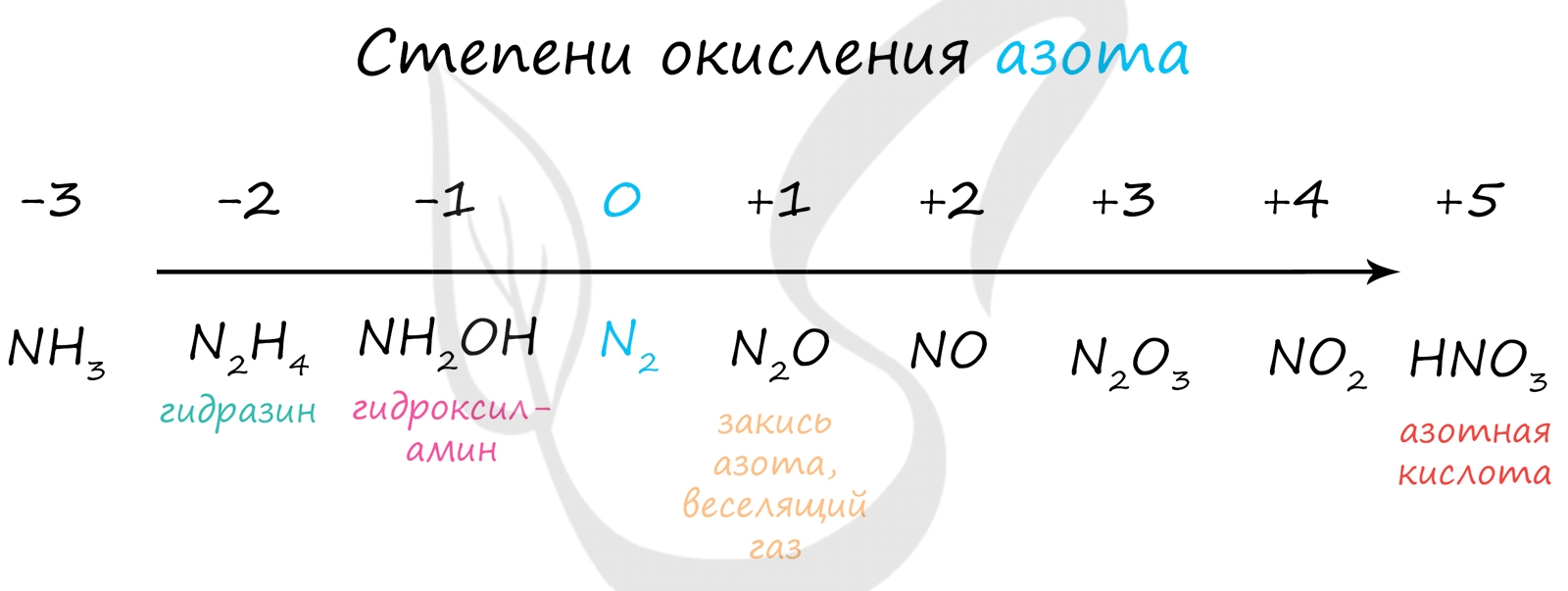
Азот восхищает - он принимает все возможные для себя степени окисления от -3 до +5.
Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.

Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях, называется нашатырным спиртом.

В промышленности аммиак получают прямым взаимодействием азота и водорода.
В лабораторных условиях сильными щелочами действуют на соли аммония.
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
-
Реакция с водой
Образует нестойкое соединение - гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)

Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные восстановительные свойства. Его используют для восстановления металлов из их оксидов.
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается выделением NO.

Соли аммония
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода - реакция идет.
-
Реакции с кислотами
В реакциях с щелочами образуется гидроксид аммония - NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.

Оксид азота I - N2O
Закись азота, веселящий газ - N2O - обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.

Получают N2O разложением нитрата аммония при нагревании:
Оксид азота I разлагается на азот и кислород:
Оксид азота II - NO
Окись азота - NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
В лабораторных условиях - в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
На воздухе быстро окисляется с образованием бурого газа - оксида азота IV - NO2.

Оксид азота III - N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.

Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой (две реакции, в которых образуется смесь оксидов азота), затем охлаждением полученной смеси газов до температуры - 36 °C.
При охлаждении газов образуется оксид азота III.
Является кислотным оксидом. соответствует азотистой кислоте - HNO2, соли которой называются нитриты (NO2 - ). Реагирует с водой, основаниями.
Оксид азота IV - NO2
Бурый газ, имеет острый запах. Ядовит.

В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при разложении нитратов.
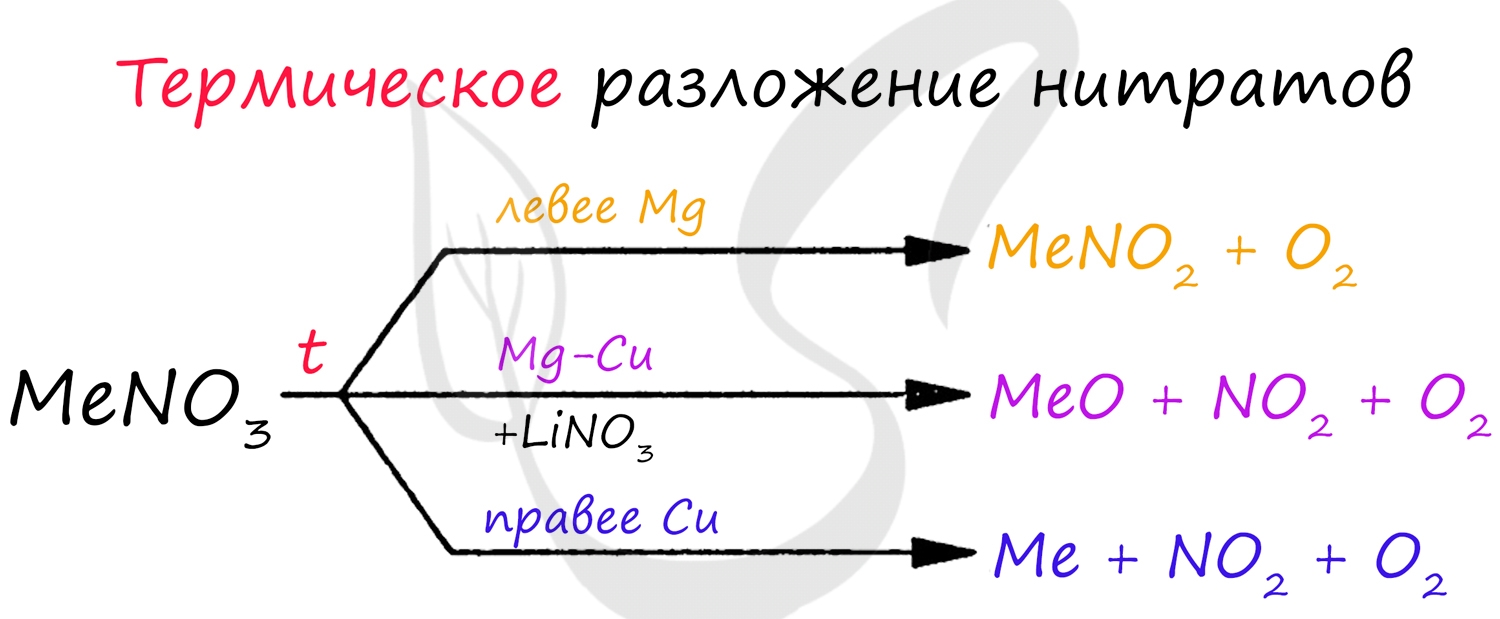
Проявляет высокую химическую активность, кислотный оксид.
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
Окисляет SO2 в SO3 - на этой реакции основана одна из стадий получения серной кислоты.
Оксид азота IV соответствует сразу двум кислотам - азотистой HNO2 и азотной HNO3. Реакции с водой и щелочами протекают по одной схеме.
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Тема3.урок№ 1(7) Общая характеристика элементов главной подгруппы V группы
Уметь давать характеристику элементов главной подгруппы, знать основную валентность и степени окисления азота. Знать физические и химические свойства азота.
Уметь объяснять изменения свойств элементов в главной подгруппе.
Уметь объяснять окислительно-восстановительные свойства азота.
Уметь предполагать свойства азота, давать обоснования своим выводам, применять знания на практике.
Задачи урока:
Образовательные:
Определить положение элементов в Периодической системе Д.И.Менделеева
Познакомить учащихся с особенностями существования элементов V группы главной подгруппы в природе
Сравнить строение атомов данных элементов
Дать характеристику физическим свойствам простых веществ
Дать характеристику химическим свойствам галогенов.
Познакомить с областями применения, их роли в работе организма человека.
Развивающие:
Продолжить формирование умений учащихся на основании положения элементов в Периодической системе, определять строение атомов.
Продолжить формирование умений учащихся на основании электронного строения атомов предполагать химические свойства элементов и оценивать возможность изменения этих свойств.
Продолжить формирование умений учащихся составлять уравнения окислительно-восстановительных реакций.
Воспитывающие:
Продолжить формирование у учащихся навыков логического мышления, умений делать выводы, обобщать и сравнивать.
Карточки с таблицами, учебник Н.Е. Кузнецовой
Периодическая система химических элементов Д.И.Менделеева,
«"Жить - значит узнавать"
Д.И. Менделеев
"Знать - значит победить!"
А.Н. Несмеянов
"Просто знать - ещё не всё,
знания надо уметь
использовать"
И. В. Гёте?
I. Организационный момент
Мы продолжаем знакомство с группами химических элементов.
Сегодня речь пойдёт об элементах, расположенных в пятой группе, главной подгруппе периодической системы. К ним относятся: азот, фосфор, мышьяк, сурьма, висмут.
II .Изучение нового материала
1. Характеристика элементов подгруппы
1.1 Учащиеся работают с учебником § 21 стр.99 – 103 , просматривают презентацию, изучают таблицы учебника № 16 и № 17 стр.101 и 102, отвечают на вопросы.
- Чему равны заряд ядра атома и количество энергетических уровней?
- число электронов на внешнем энергетическом уровне?
- записать электронную формулу внешнего энергетического уровня атомов пниктогенов ?
Этот термин происходит от греческого слова pnigein - задыхаться, удушать. Действительно, родоначальник группы газ азот не поддерживает дыхание; как было установлено еще в XVIII веке мышь в атмосфере азота быстро погибает. В соответствии с "народной этимологией" первые буквы слова PNICTO означают символы элементов фосфора и азота.
- Как изменяется сверху вниз радиус атомов?
- Как изменяется электроотрицательность данных атомов и вместе с ней окислительные свойства?
1.2 Общая характеристика
Для атомов элементов главной подгруппы V группы валентная электронная конфигурация выражается общей формулой ns 2 np 3 , что обусловливает проявление степеней окисления от -3 до +5. Однако только атом азота способен проявлять их все. В целом по подгруппе низшая степень окисления становится менее характерна: висмут не образует водородных соединений. Устойчивость высшей степени окисления растет от азота к фосфору (фосфорная кислота, в отличие от азотной, не является окислителем) и уменьшается к висмуту.
N, P, As никогда не образуют катионов в водных растворах, сурьма и висмут существуют в виде катионов Sb 3+ и Bi 3+ . В соответствии с ростом радиусов атомов, уменьшением энергии ионизации и относительной электротрицательности атомов неметаллические свойства простых веществ ослабевают. Кислотный характер высших оксидов и гидроксидов также ослабевает.
1.3 Физические свойства простых веществ, образованных элементами VA группы
Физические свойства. Азот — газ, фосфор и все остальные элементы — твердые вещества. Это объясняется тем, что начиная с третьего периода (фосфор) элементы объединяются в большие полимерные молекулы. Такое изменение молекулярной структуры при переходе от азота к фосфору и вызывает резкое изменение агрегатных состояний веществ.
1.4 Химические свойства.
С водородом элементы подгруппы азота образуют соединения типа RH 3 , с кислородом — R 2 0 3 , и R 2 0 5 . Им соответствуют кислоты HRO 2 , и HRO 3 . Все элементы, кроме азота, могут образовывать кислоты типа Н 3 R0 4 . Металлические свойства в подгруппе сверху вниз закономерно нарастают. Так, азот и фосфор — типичные неметаллы, мышьяк и сурьма имеют некоторые свойства металлов, висмут является металлом.
2.Изучение азота
Бесцветный газ без запаха и вкуса.
Людьми широко применён
Для разных дел, различных целей,
В войне и мире нужен он.
Он не поддерживает жизнь,
Так говорит о нём наука,
А без него любая жизнь
Ведь невозможна – вот так штука!
Англосаксы - nitrogen , рождающий селитру, немцы - stickstoff , удушающая смерть
Слово составлено из начальных и конечных букв алфавитов трёх языков —
2.2.Характеристика азота
Учащиеся работают с учебником § 22, стр. 106-108 и таблицей 16, 17 стр.101- 102
Как отчет о проделанной работе, заполняют таблицу.(раздаю заготовки таблиц, школьники заполняют, сдают на проверку, провереннык вклеивают в тетрадь)
3772 дн. с момента
как существует сайт


Владельцы сайта
подгруппа азота
Химия неметаллов VA группы.mp4
Характеристика элементов подгруппы азота
Азот - важнейшая составная часть атмосферы (78% ее объема). В природе встречается в белках, в залежах нитрата натрия. Природный азот состоит из двух изотопов: 14 N (99,635% массы) и 15 N (0,365% массы).
Фосфор входит в состав всех живых организмов. В природе встречается в виде минералов. Фосфор широко применяется в медицине, сельском хозяйстве, авиации, при добыче драгметаллов.
Мышьяк, сурьма и висмут распространены достаточно широко, в основном в виде сульфидных руд. Мышьяк - один из элементов жизни, способствующий росту волос. Соединения мышьяка ядовиты, но в малых дозах могут оказывать лечебное свойства. Мышьяк применяется в медицине и ветеринарии.
Строение и характеристика атомов
Элементы подгруппы на внешнем электронном слое имеют пять электронов. Они могут отдавать их, и могут притягивать к себе еще три электрона от других атомов. Поэтому степень окисления у них от - 3 до +5.
Их летучие водородные и высшие кислородные соединения имеют кислотный характер и обозначаются общими формулами: RH3 и R2O5. У элементов подгруппы неметаллические свойства, а вместе с тем и способность к притягиванию электронов меньше, чем у элементов подгрупп галогенов и кислорода.
В подгруппе азота в периодической системе при переходе элементов сверху вниз металлические свойства увеличиваются.
Азот и фосфор - неметаллы, у мышьяка и сурьмы наблюдаются свойства металлов, висмут - металл.

Обучающий дидактический материал с разнообразними заданиями для проверки качества знаний учащихся.
Ваш браузер должен поддерживать фреймы Ваш браузер должен поддерживать фреймы--> --> Ваш браузер должен поддерживать фреймы--> --> Ваш браузер должен поддерживать фреймы--> -->

-75%
Читайте также:

