Конспект по теме история создания периодической системы
Обновлено: 07.07.2024
Ключевые слова конспекта по химии для 11 класса: История развития периодического закона. Предпосылки открытия периодического закона и теории химического строения органических соединений. Роль личности в истории химии. Роль практики в становлении и развитии химической теории.
В 1869 г. Дмитрий Иванович Менделеев сформулировал периодический закон — фундаментальный закон природы. Современная формулировка периодического закона такова:
В формулировке Менделеева эта зависимость устанавливалась для атомных весов (сейчас мы их называем относительными атомными массами).
Теоретическую основу органической химии составляет теория химического строения органических соединений, сформулированная в 1861 г. Александром Михайловичем Бутлеровым.
Великие научные открытия, совершённые Д. И. Менделеевым и А. М. Бутлеровым, вносят значительный вклад в мировую химическую науку. Их идеи никогда не утратят своего значения, они только развиваются и углубляются на основе новых научных представлений.
Открытия объединяет то, что приоритет русских химиков пытались оспорить на Западе.
Как нельзя лучше слова Марковникова подтверждает присуждение Нобелевской премии в 1906 г. не Д. И. Менделееву, а французскому химику Анри Муассану за открытие фтора. Может быть, в этом решении комитета сыграл свою роль тот факт, что кандидатура Менделеева была представлена Академией наук Германии, а не России. Отношение чиновников от науки к отечественным учёным красноречиво иллюстрирует тот факт, что Менделеев так pi не был избран членом Российской академии, хотя баллотировался в неё не раз. И это тогда, когда он уже был почётным членом почти всех европейских Академий.
Сравним предпосылки периодического закона и теории химического строения органических соединений.
Как и большинству выдающихся научных открытий, периодическому закону предшествовало накопление фактического материала: науке были известны 63 химических элемента и описаны свойства их многочисленных соединений.
Количество известных органических веществ ко времени создания теории (от греч. theoria — рассмотрение, исследование) химического строения насчитывало десятки тысяч. Это многообразие веществ состояло лишь из нескольких элементов: углерода, водорода, кислорода, реже — азота, фосфора и серы.
Следующая предпосылка открытия периодического закона — обобщение работ предшественников.
Первые попытки классификации химических элементов предприняли шведский химик Йёнс Якоб Берцелиус, немец Иоганн Вольфганг Дёберейнер, француз Александр Эмиль Шанкуртуа, англичанин Джон Александр Ньюлендс.
Й. Я. Берцелиус разделил все элементы на металлы и неметаллы на основе различий свойств образованных ими простых и сложных веществ. Так, металлам соответствуют основные оксиды и основания, а неметаллам — кислотные оксиды и кислоты. Классов было только два и они включали значительно отличающиеся друг от друга элементы. Наличие амфотерных оксидов и гидроксидов у некоторых металлов вносило путаницу в предложенную Берцелиусом классификацию.
И. Дёберейнер разделил элементы по три на основе сходства образуемых ими веществ так, чтобы в триадах сходных по свойствам элементов (например, литий — натрий — калий, сера — селен — теллур, хлор — бром — иод, марганец — хром — железо) атомная масса среднего была примерно равна полусумме атомных масс двух крайних (проверьте эту закономерность для приведённых триад). Работа И. Дёберейнера послужила подтверждением мысли о наличии определённой связи между атомными массами и свойствам!! элементов. Но ему удалось составить лишь четыре триады, все известные в то время элементы он не сумел классифицировать таким образом.
Профессор Парижской горной школы А. Шанкуртуа расположил элементы в порядке увеличения атомных масс на поверхности воображаемого цилиндра по спирали. Каждый виток спирали содержал по семь элементов. Друг под другом в соседних витках оказались элементы со сходными свойствами.

Как утверждают философы, научный закон или теория выполняют следующие функции:
- систематизируют факты;
- объясняют факты;
- прогнозируют новые факты.
Так, на основе своего закона Д. И. Менделеев предсказал, описал свойства и указал пути открытия ещё неизвестных науке элементов: галлия, скандия и германия. А. М. Бутлеров получил в лаборатории соединение, совпадающее по составу с газом бутаном, но отличающееся от него физическими свойствами и назвал вещество изобутаном.
Следовательно, практика предоставила богатый фактический материал для создания этих выдающихся теоретических открытий, т. е. стала источником познания. Затем после получения предсказанных элементов и органических веществ практика подтвердила истинность периодического закона и теории строения органических соединений, т. е. послужила критерием истины.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Раздел долгосрочного плана:
7.3В Периодическая таблица химических элементов
ФИО учителя: Стакаева М.Ю.
Количество присутствующих:
отсутствующих:
История создания периодической таблицы химических элементов
Изучение новой темы
Цели обучения, которые достигаются на данном уроке (ссылка на учебную программу)
-7.2.1.1знать и сравнивать классификации химических элементов на примере работ И.В.Доберейнера,Дж.А.Ньюлендса, Д.И. Менделеева.
Все учащиеся знают:
- классификации элементов на примере работ И.ВДоберейнера, Дж. А. Ньюлендса, Д.И. Менделеева.
Большинство учащихся будут уметь:
- определять принципы и сущность классификации химических элементов;
- сравнивать классификации элементов на примере работ
И.В Доберейнера, Дж. А. Ньюлендса, Д.И. Менделеева.
Некоторые учащиеся смогут:
-анализировать классификации химических элементов на примере работ И.В.Доберейнера,Дж.А.Ньюлендса, Д.И. Менделеева.
Критерии оценивания
Называет классификации химических элементов И.В. Доберейнера , Дж. А. Ньюлендса , Д.И.Менделеева
- определяет принципы и сущнность классификаций химических элементов Доберейнера И.В., Ньюлендса Дж А, Д.И. Менделеева ;
- сравнивает и анализирует классификации химических элементов Доберейнера И.В, Ньюлендса Дж.И., Д.И. Менделеева ;
Языковые цели
Используют новые термины и фразы для диалога и беседы : триада, октава, атомная масса, периодический закон, периодическая система, порядковый номер, классификация.
Привитие ценностей
Формирование интереса учащихся к науке и самообразованию способствует становлению интеллектуального потенциала Казахстана, конкурентноспособного поколения через систему формативных заданий, использование стратегий активного обучения.
Сотрудничество, уважение
Необходимость совместного планирования деятельности при работе в группах обеспечивает терпимость и дружелюбие, уважение к мнению одноклассников.
Межпредметные связи
Математика. Физика. История
Предварительные знания
Химия 7. Химические элементы. Металлы и неметаллы. Относительная атомная масса Классификации химических элементов.

Любой, кто ходил в школу, помнит, что одним из обязательных для изучения предметов была химия. Она могла нравиться, а могла и не нравиться – это не важно. И вполне вероятно, что многие знания по этой дисциплине уже забыты и в жизни не применяются. Однако таблицу химических элементов Д. И. Менделеева наверняка помнит каждый. Для многих она так и осталась разноцветной таблицей, где в каждый квадратик вписаны определённые буквы, обозначающие названия химических элементов. Но здесь мы не будем говорить о химии как таковой, и описывать сотни химических реакций и процессов, а расскажем о том, как вообще появилась таблица Менделеева – эта история будет интересна любому творчески мыслящему человеку, да и вообще всем тем, кто охоч до интересной и полезной информации.
Небольшая предыстория
В далёком 1668 году выдающимся ирландским химиком, физиком и богословом Робертом Бойлем была опубликована книга, в которой было развенчано немало мифов об алхимии, и в которой он рассуждал о необходимости поиска неразложимых химических элементов. Учёный также привёл их список, состоящий всего из 15 элементов, но допускал мысль о том, что могут быть ещё элементы. Это стало отправной точкой не только в поиске новых элементов, но и в их систематизации.
Сто лет спустя французским химиком Антуаном Лавуазье был составлен новый перечень, в который входили уже 35 элементов. 23 из них позже были признаны неразложимыми. Но поиск новых элементов продолжался учёными по всему миру. И главную роль в этом процессе сыграл знаменитый русский химик Дмитрий Иванович Менделеев – он впервые выдвинул гипотезу о том, что между атомной массой элементов и их расположением в системе может быть взаимосвязь.
Создание периодической таблицы
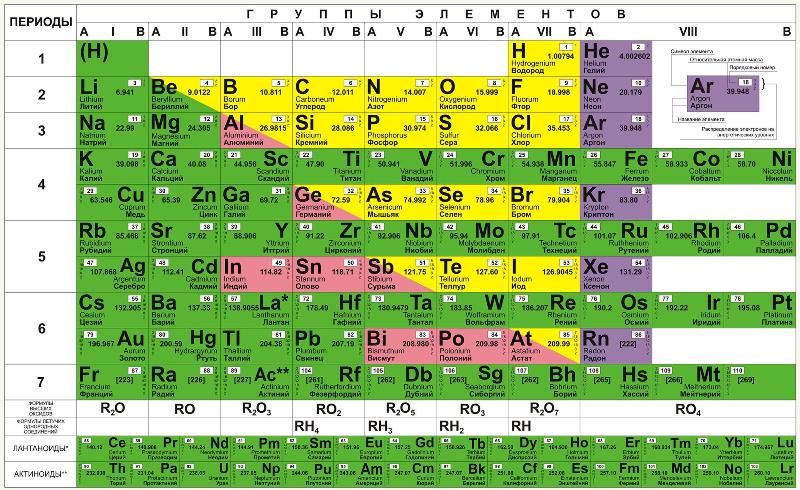
Основная идея к 1869 году уже была сформирована Менделеевым, причём за довольно короткое время, но оформить её в какую-либо упорядоченную систему, наглядно отображающую, что к чему, он долго не мог. В одном из разговоров со своим соратником А. А. Иностранцевым он даже сказал, что в голове у него уже всё сложилось, но вот привести всё к таблице он не может. После этого, согласно данным биографов Менделеева, он приступил к кропотливой работе над своей таблицей, которая продолжалась трое суток без перерывов на сон. Перебирались всевозможные способы организации элементов в таблицу, а работа была осложнена ещё и тем, что в тот период наука знала ещё не обо всех химических элементах. Но, несмотря на это, таблица всё же была создана, а элементы систематизированы.
Легенда о сне Менделеева

Дальнейшая работа
В период с 1869 по 1871 годы Менделеев развивал идеи периодичности, к которым склонялось научное сообщество. И одним из важных этапов данного процесса стало понимание того, что любой элемент в системе должно располагать, исходя из совокупности его свойств в сравнении со свойствами остальных элементов. Основываясь на этом, а также опираясь на результаты исследований в изменении стеклообразующих оксидов, химику удалось внести поправки в значения атомных масс некоторых элементов, среди которых были уран, индий, бериллий и другие.
Пустые клетки, остававшиеся в таблице, Менделеев, конечно же, хотел скорее заполнить, и в 1870 году предсказал, что в скором времени будут открыты неизвестные науке химические элементы, атомные массы и свойства которых он сумел вычислить. Первыми из них стали галлий (открыт в 1875 году), скандий (открыт в 1879 году) и германий (открыт в 1885 году). Затем прогнозы продолжили реализовываться, и были открыты ещё восемь новых элементов, среди которых: полоний (1898 год), рений (1925 год), технеций (1937 год), франций (1939 год) и астат (1942-1943 годы). Кстати, в 1900 году Д. И. Менделеев и шотландский химик Уильям Рамзай пришли к мнению, что в таблицу должны быть включены и элементы нулевой группы – до 1962 года они назывались инертными, а после – благородными газами.
Организация периодической системы
Химические элементы в таблице Д. И. Менделеева расположены по рядам, в соответствии с возрастанием их массы, а длина рядов подобрана так, чтобы находящиеся в них элементы имели схожие свойства. Например, благородные газы, такие как радон, ксенон, криптон, аргон, неон и гелий с трудом вступают в реакции с другими элементами, а также имеют низкую химическую активность, из-за чего расположены в крайнем правом столбце. А элементы левого столбца (калий, натрий, литий и т.д.) отлично реагируют с прочими элементами, а сами реакции носят взрывной характер. Говоря проще, внутри каждого столбца элементы имеют подобные свойства, варьирующиеся при переходе от одного столбца к другому. Все элементы, вплоть до №92 встречаются в природе, а с №93 начинаются искусственные элементы, которые могут быть созданы лишь в лабораторных условиях.
В своём первоначальном варианте периодическая система понималась только как отражение существующего в природе порядка, и никаких объяснений, почему всё должно обстоять именно так, не было. И лишь когда появилась квантовая механика, истинный смысл порядка элементов в таблице стал понятен.
Уроки творческого процесса
Говоря о том, какие уроки творческого процесса можно извлечь из всей истории создания периодической таблицы Д. И. Менделеева, можно привести в пример идеи английского исследователя в области творческого мышления Грэма Уоллеса и французского учёного Анри Пуанкаре. Приведём их вкратце.
Согласно исследованиям Пуанкаре (1908 год) и Грэма Уоллеса (1926 год), существует четыре основных стадии творческого мышления:
- Подготовка – этап формулирования основной задачи и первые попытки её решения;
- Инкубация – этап, во время которого происходит временное отвлечение от процесса, но работа над поиском решения задачи ведётся на подсознательном уровне;
- Озарение – этап, на котором находится интуитивное решение. Причём, найтись это решение может в абсолютно не имеющей к задаче ситуации;
- Проверка – этап испытаний и реализации решения, на котором происходит проверка этого решения и его возможное дальнейшее развитие.
Как мы видим, в процессе создания своей таблицы Менделеев интуитивно следовал именно этим четырём этапам. Насколько это эффективно, можно судить по результатам, т.е. по тому, что таблица была создана. А учитывая, что её создание стало огромным шагом вперёд не только для химической науки, но и для всего человечества, приведённые выше четыре этапа могут быть применимы как к реализации небольших проектов, так и к осуществлению глобальных замыслов. Главное помнить, что ни одно открытие, ни одно решение задачи не могут быть найдены сами по себе, как бы ни хотели мы увидеть их во сне и сколько бы ни спали. Чтобы что-то получилось, не важно, создание это таблицы химических элементов или разработка нового маркетинг-плана, нужно обладать определёнными знаниями и навыками, а также умело использовать свои потенциал и упорно работать.
Мы желаем вам успехов в ваших начинаниях и успешной реализации задуманного!

Краткосрочный план урока по теме "История создания периодической таблицы". Урок делится на три этапа: начало урока, середина и конец урока. В начале урока проводится проверка знаний учащихся по теме "классификация химических элементов". Учащиеся знают, что элементя делятся на металлы и неметаллы. Учитель делит учащихся на группы, планируют задания как групповые, так и парные и индивидуальные задания
Содержимое разработки
Раздел долгосрочного планирования:7. 3В Периодическая таблица химических элементов
ФИО учителя: Байжигитова Сауле Тулебековна
Участвовали:
Не участвовали:
История создания периодической таблицы элементов
Учебные цели, достигнутые на этом уроке (ссылка на учебный план)
7.2.1.1 знать и сравнивать классификации элементов на примере работ И. Дёберейнера, Дж. Ньюлендса, Д.И. Менделеева
Все учащиеся:
Будут знать классификации элементов И.Дёберейнера, Дж. Ньюлендса, Д.Менделеева
Большинство учащихся:
Будут сравнивать классификации элементов И.Дёберейнера, Дж. Ньюлендса и Д.Менделеева
Некоторые учащиеся:
Будут знать сущность периодического закона Д.И.Менделеева
Уровни мыслительных навыков
Навыки высокого порядка
Критерии оценивания
Описывает классификации элементов И.Дёберейнера, Дж. Ньюлендса, Д.И. Менделеева. Классифицирует элементы на металлы и неметаллы
Сравнивает преимущества и недостатки классификаций элементов И.Дёберейнера, Дж. Ньюлендса, Д.Менделеева
Описывает сущность периодического закона и периодической системы элементов Д.И.Менделеева.
Учащиеся могут :
Объяснить, металлические и неметаллические, основные и кислотные свойства и описать данные теории классификации элементов
Основные слова и термины: период, триада, октава, система, противоположность,
Сочетания, используемые для диалога и письма:
Какие элементы относятся к металлам, а какие к неметаллам?
В чем отличия металлов от неметаллов?
Как наблюдается периодичность свойств элементов в периодической системе элементов?
Противоположность металлических и неметаллических свойств наблюдается.
Сущность периодического закона.
Привитие ценностей
Совместная работа, критическое мышление, взаимное уважение в ходе групповой работы, сотрудничество, проявление активности, готовность к непрерывному самообразованию
Межпредметная связь
Предыдущие знания
7.1.2.2 -знать, что каждый химический элемент обозначается символом и является определенным видом атомов;
7.1.2.3 -классифицировать элементы на металлы и неметаллы;
Запланированные этапы урока
Виды заданий, запланированных на урок
Организационный момент.
Создание психологической атмосферы: Сконцентрировать учащихся на урок вопросом: - Перечислите элементы, которые часто встречаются в быту?
ФО: похвала
Делятся на 4 группы по цвету шарика (учитель сам раздает стикеры по уровню знаний учащихся, чтобы получились гетерогенные группы):
Задание: На слайде или карточках представлены ряды с формулами металлов, неметаллов, основных и кислотных оксидов, кислот и оснований. На каждой строчке по одной не соответствущей формуле, которое нужно вычеркнуть:
6) HCL, H2SO4, KOH
Дополнительно: 7) НNO3, H3PO4, LiOH
Различают металлы и неметаллы, основные и кислотные оксиды, основания и кислоты по их формулам
ФО: Проверив свои ответы, учащиеся проводят самооценивание, выявляют ошибки и учитель дает обратную связь.
Читайте также:

