Конспект по химии 9 класс габриелян 1 параграф характеристика химического элемента
Обновлено: 05.07.2024
- - Ковалентные и ионные связи;
- - Окислительно-восстановительные реакции;
- - Органические вещества;
- - Расчет массы металлов;
- - Металлические связи.
Справочные пособия предназначены в значительной мере упростить изучение химии школьниками, в том числе и самостоятельным образом, вне зависимости от их уровня познания в области дисциплины.
Особенности ГДЗ Габриелян Остроумов 9 класс
Издание содержит готовые решения множества задач, которые сопровождают каждый из изучаемых на уроках 41 параграфа. Примеры подробно расписаны и включают поясняющие комментарии. Дополнительно в пособии растолкованы четыре практические работы, с которыми столкнутся ученики.
- 1. В процессе проведения химических экспериментов улучшить свои интеллектуальные способности;
- 2. Развить умения произведения расчетов химических реакций;
- 3. Применять полученные теоретические и практические навыки и знания для решения повседневных задач.
Правильная работа с пособием позволяет ученикам закрепить и полноценно растолковать все полученные из учебников знания. Это возможно и при исключительно самостоятельной работе, а также при минимальной поддержке со стороны родителей.
Для кого создавался решебник

Химия 9 класс: все темы кратко
Повторение курса химии в 9 классе позволит вам систематизировать знания о веществах и химических реакциях. Внимание! Данный курс не является материалом для изучения химии с нуля. Он ориентирован на повторение пройденного материала (экспресс-обзор). Данный курс не является материалом для подготовки к ОГЭ по химии. При подготовке к ОГЭ используйте другие материалы сайта.

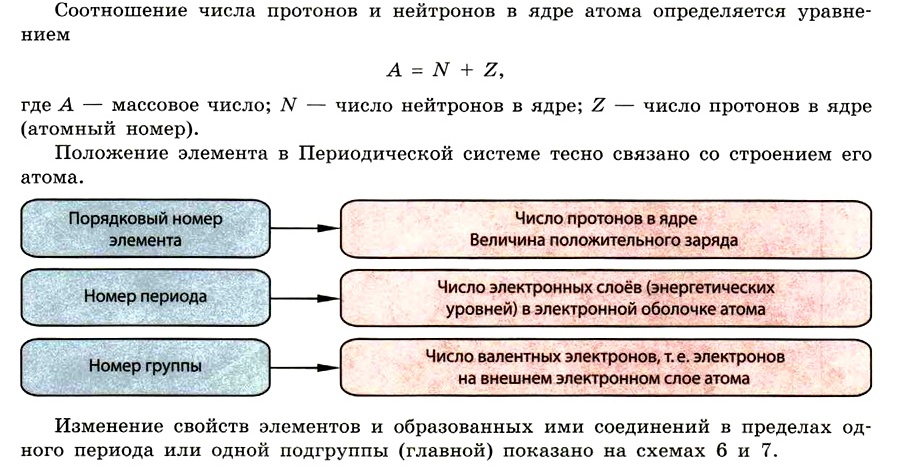
Тема: § 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева

Тема: § 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева

Тема: § 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева

Тема: § 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева

Тема: § 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева

Тема: § 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева

Тема: § 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева

Тема: § 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева

Тема: § 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева

Тема: § 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева

Тема: § 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева

Тема: § 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева

Тема: § 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева

Тема: § 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева

Тема: § 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева

Тема: § 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева

Тема: § 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева

Тема: § 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева

Тема: § 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева
5818928 5807257 5799943 4593884 4560023 4545598 4314436 4127283 3990401 3814436 3708536 3234085 3098390 2994082 2993558 2628323 2559423 2316711 2124995
Свидетельство и скидка на обучение каждому участнику
40%
Если Вы не нашли темы для своего учебника, то можете добавить оглавление учебника и получить благодарность от проекта "Инфоурок".
- Подготовка к ЕГЭ/ОГЭ и ВПР
- Для учеников 1-11 классов
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
В Россию приехали 10 тысяч детей из Луганской и Донецкой Народных республик
Время чтения: 2 минуты
Минтруд предложил упростить направление маткапитала на образование
Время чтения: 1 минута
Курские власти перевели на дистант школьников в районах на границе с Украиной
Время чтения: 1 минута
Новые курсы: функциональная грамотность, ФГОС НОО, инклюзивное обучение и другие
Время чтения: 15 минут
Отчисленные за рубежом студенты смогут бесплатно учиться в России
Время чтения: 1 минута
Каждый второй ребенок в школе подвергался психической агрессии
Время чтения: 3 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.

Цель урока: дать общую характеристику щелочных металлов в свете трех форм существования элементов: атомов, простых веществ и сложных веществ. На химии элементов этой группы повторить основные закономерности изменения свойств элементов в Периодической системе химических элементов (далее - ПСХЭ) по вертикали (в группе), металлическую связь и металлическую кристаллическую решетку, физические и химические свойства металлов.
Содержимое разработки
Конспект урока химии в 9 классе
Общая характеристика
элементов I группы главной подгруппы
Цель урока: дать общую характеристику щелочных металлов в свете трех форм существования элементов: атомов, простых веществ и сложных веществ. На химии элементов этой группы повторить основные закономерности изменения свойств элементов в Периодической системе химических элементов (далее - ПСХЭ) по вертикали (в группе), металлическую связь и металлическую кристаллическую решетку, физические и химические свойства металлов.
Задачи урока: Обучающие: научить давать характеристику элементов – щелочных металлов по их положению в ПСХЭ, уметь записывать уравнения реакций, характеризующие химические свойства щелочных металлов, углубить знания о физических свойствах этих веществ.
Развивающие: развивать внимание, память, мышление, логические операции, умение владеть химическим языком.
Воспитательные: воспитывать коллективизм, ответственность, сообразительность, творческую активность, умение выслушивать одноклассников, прививать интерес к химии.
Повторение ранее изученного материала. Разминка.
Изучение нового материала:
Строение атомов элементов I группы главной подгруппы. Степень окисления.
Простые вещества. Физические свойства.
Химические свойства щелочных металлов.
Нахождение в природе.
Получение щелочных металлов.
Применение щелочных металлов.
Открытие щелочных металлов.
ПОВТОРЕНИЕ РАНЕЕ ИЗУЧЕННОГО МАТЕРИАЛА. РАЗМИНКА:
Фронтальный опрос: учащиеся получают карточки с символами химических элементов – металлов.
Учитель дает характеристику элемента, учащиеся должны угадать о каком металле идет речь и поднять нужную карточку. Второй вопрос – дополнительный. (слайд 3)
Самый распространенный металл в земной коре (Al)?
Какой характер имеют оксид и гидроксид алюминия?
Самый твердый металл (Cr)?
Какой тип химической связи у металлов?
Химический элемент – простое вещество – самый сильный металл (Fr)?
Объясните, почему франций самый активный металл?
Самый легкий металл (Li)?
Какой тип кристаллической решетки у лития?
Самый тяжелый металл (Os)?
Охарактеризуйте положение осмия в ПСХЭ?
Один из драгоценных металлов (Au)?
Назовите еще известные Вам драгоценные металлы, в каком виде они встречаются в природе?
Какой металл является компонентом чугуна и стали (Fe)?
Какой еще элемент обязательно входит в состав чугуна и стали?
Этот металл используют для изготовления ламп накаливания (W)?
Какое физическое свойство вольфрама используют при этом?
Этот металл находится во II группе главной подгруппы и IV периоде ПСХЭ (Ca)?
Каков его порядковый номер и сколько электронов у него на внешнем слое?
На основе этого металла изготовляют сплавы: бронза, мельхиор, латунь (Cu)?
Какая (хорошая или плохая) проводимость у меди?
Этот элемент отличается от других металлов своим агрегатным состоянием (Hg)?
Будет ли ртуть реагировать с растворами кислот?
ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛА:
Учитель: Посмотрите, какие элементы расположены в I группе главной подгруппы ПСХЭ. Давайте назовем эти элементы и запишем их знаки в тетради. (слайд 4)
Ученик: Li – литий, Na – натрий, K – калий, Rb – рубидий, Cs – цезий, Fr – франций.
Учитель: начнем изучение данных элементов со строения их атомов.
1. Строение атомов элементов I группы главной подгруппы. Степень окисления:
Учитель: три ученика выйдут к доске и зарисуют схемы строения атомов Li, Na, K. Остальные зарисовывают в тетради. (слайд 5)
Учитель: что общего в строении этих атомов?
Учитель: что изменяется в строении атомов с ростом порядкового номера?
Учитель: какой вывод о свойствах этих элементов можно сделать на основании сказанного?
Учитель: какую степень окисления они проявляют в соединениях? (слайд 6,7)
Учитель: как изменяются восстановительные свойства от Li до Cs?
Учитель: атом цезия способен превращаться в положительный ион уже под действием света. Это свойство используют в фотоэлементах.
Ученик (подготовлен):
Электрон на внешнем слое
Еле держится у нас
Отдаем его спокойно
Кто захочет, в сей же час.
Учитель: далее мы поговорим о простых веществах, образованных этими элементами, т.е. о металлах: литии, калии, натрии, рубидии, цезии, франции.
2. Простые вещества. Физические свойства (слайд 8)
Учитель: простые вещества Li, K, Na, Rb, Cs, Fr – типичные металлы. Давайте вспомним, какая кристаллическая решетка характерна для них?
Учитель: какой тип химической связи характерен для металлов?
Учитель: давайте дадим определение металлической связи, укажем, какие части соединяются и за счет чего.
Учитель: металлическая кристаллическая решетка и металлическая связь определяют физические свойства металлов. Давайте назовем эти свойства.
Ученик: тепло – и электропроводность, т.к. электроны подвижны и способны переносить тепло и направленно двигаться под действием электрического напряжения.
Ученик: пластичность, т.к. электроны подвижны и поэтому при ударе слои атомов – ионов в металле смещаются, как бы скользят без разрыва связей.
Учитель: кроме этих физических свойств, для каждого металла характерна своя температура плавления, температура кипения, плотность и твердость. Щелочные металлы мягки (режутся ножом), температуры кипения и плавления уменьшаютсяот Li к Cs. Так цезий плавится на ладони руки. Плотность же возрастает от Li к Cs. (Только есть отступление от этого правила – плотность натрия больше, чем у калия). Li, Na и K легче воды.
Теперь переходим к рассмотрению химических свойств щелочных металлов.
3. Химические свойства щелочных металлов
Учитель: как мы уже выяснили, в химических реакциях щелочные металлы проявляют ярко выраженные восстановительные свойства, возрастающие от Li к Cs. (слайд 9)
Запишите в тетрадях первое химическое свойство: щелочные металлы активно взаимодействуют почти со всеми неметаллами, например, с галогенами, серой, фосфором, водородом. Давайте напишем уравнения реакций между литием и серой, натрием и фосфором, калием и хлором.
2Li + S = Li2S (сульфид лития)
2K + Cl2 = 2 KCl (хлорид калия)
3 Na + P = Na3P (фосфид натрия)
К какому типу относятся данные реакции?
Какой тип связи характерен для соединений – продуктов реакций?
Почему гидриды щелочных металлов не занесены в графу водородных соединений ПСХЭ?
Назовите продукты реакций?
Первую реакцию разбирают вместе с учителем, а аналогичные - самостоятельно, с последующей самопроверкой. (слайд 10)
Учитель: итак, в результате взаимодействия щелочных металлов с неметаллами образуются бинарные соединения – сульфиды, хлориды, фосфиды и другие. А сейчас отдельное внимание уделим взаимодействию с кислородом. (слайд 11) Литий образует нормальный основной оксид.
4 Li + O2 = 2 Li2O (оксид лития)
Остальные щелочные металлы образуют при взаимодействии с кислородом пероксиды и надпероксиды. (слайд 12)
2 Na + O2 = Na2O2 (пероксид натрия) (слайд 13)
При этом в обоих случаях атом щелочного металла отдает один электрон, т.е. степень окисления не изменяется, а кислород изменяет свою степень окисления: – 2 в оксидах и – 1 в пероксидах.
Ученик (подготовлен):
Кислород мы сильно любим
На контакт мы с ним идем,
Но от этого явленья
Потускнеем мы потом.
Учитель: Теперь перейдем к следующему, одному из самых значимых химических свойств щелочных металлов – это взаимодействие их с водой. (слайд 14) Щелочные металлы окисляются молекулами воды, при этом образуются щелочи, отсюда и произошло их название – щелочные. Причем скорость реакции будет расти от Li к Cs, т.к. растет их химическая активность. Так рубидий и цезий реагируют с водой так быстро, что происходит взрыв. Посмотрите, как реагирует с водой, например, натрий.
Демонстрация опыта.
Достаю кусочек натрия, при этом поясняю, что натрий надо беречь не только от кислорода, но и от воды. Щелочные металлы хранят очень тщательно в стеклянной банке с плотной крышкой, потом в железной. Напоминаю правила безопасности: нельзя вещества трогать руками, не приступать к выполнению опыта не зная, что и как нужно делать, работать с малыми дозами реактивов. На столе стоит кристаллизатор с водой. В воду заранее добавлен индикатор – фенолфталеин, о чем сообщаю учащимся. Отрезаю ножом кусочек натрия и бросаю в воду.
Почему индикатор изменяет свой цвет?
Какой газ выделяется в ходе реакции?
К какому типу относится данная реакция?
Учитель: какому элементу натрий отдает электроны, сколько?
Покажите это на уравнении реакции.
Первую реакцию разбирают вместе с учителем, а аналогичную - самостоятельно, с последующей самопроверкой. (слайд 15)
Учитель: Аналогично с водой реагируют и все остальные щелочные металлы.
Ученик (подготовлен):
Мы с водою в соединении
Щелочи всегда даем
С хлором, фтором, бромом, йодом
Дружненько в солях живем.
Учитель: Щелочные металлы очень легко окисляются. Им достаточно и кислорода содержащегося в воздухе, поэтому их хранят под керосином, а литий в вазелине, т.к. он очень легок и в керосине всплывает. Также щелочные металлы надо беречь не только от кислорода, но и от воды. (слайд 16)
Учитель: итак, мы рассмотрели химические свойства щелочных металлов. Скажите, почему мы не рассматриваем взаимодействие щелочных металлов с растворами солей и кислот?
Ученик: так как в растворе щелочные металлы сначала энергично прореагируют не с кислотой и с солью, а с водой.
4. Нахождение в природе. (слайд 17)
Учитель: Щелочные металлы в природе встречаются только в форме соединений. Почему?
Ученик: Так как щелочные металлы очень легко и быстро окисляются. Они вступают в реакцию с кислородом, водой.
Учитель: Натрий и калий являются постоянными составными частями многих весьма распространенных силикатов. Из отдельных минералов натрия важнейший–поваренная соль (NaCl) –входит в состав морской воды и на отдельных участках земной поверхности образует под слоем наносных пород громадные залежи так называемой каменной соли. В верхних слоях подобных залежей иногда содержатся и скопления солей калия в виде минералов сильвинита (KCl–NaCl), карналлита (KCl·MgCl2 ·6Н2 О). Для лития известен ряд минералов (например, сподумен – LiAl (SiO3 ) 2 ), но скопления их редки. Рубидий и цезий встречаются почти исключительно в виде примесей к другим щелочным металлам. Следы франция всегда содержатся в урановых рудах.
5. Получение щелочных металлов. (слайд 18)
Учитель: Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы:
2NaCl (расплав) ток — 2Na + Cl2
катод: Na + + 1e Na 0
анод: 2Cl – — 2e Cl2
6. Применение щелочных металлов. (слайд 19)
Учитель: Металлический натрий, с тех пор как его изготовление стало дешевым, находит широкое техническое применение. Его используют в качестве исходного продукта при производстве перекиси натрия и других соединений. Его используют также в больших количествах в органических синтезах (например, в красильном производстве). Металлический калий также иногда употребляют в лаборатории. Кроме того, калий и прежде всего цезий применяют в фотоэлементах. Металлический литий используют в сплавах, так как небольшие добавки этого металла существенно улучшают свойства многих сплавов. Также щелочные металлы используют в качестве катализаторов.
7. Открытие щелочных металлов. (слайд 20)
Ученик: соединения натрия и калия были известны очень давно, их соли (сода, поташ, поваренная соль) широко применялись. Однако сами металлы известны не были. В 1807 г. в Лондоне с помощью электролиза едких щелочей Гемфри Дэви получил два щелочных металла. Один из них назвали “натрий” от арабского “натрун” - сода, которую используют как моющее средство с давних времен, другой назвали “калием”, от арабского “алкали” - щелочь.
Ученик: литий был открыт в 1817 г. шведом Арфвейдсоном и назван, по предложению Берцеллиуса – литием. “Литий” - от греческого “литос” - камень, т.к. был обнаружен в твердом камне, в отличие от других щелочных металлов, которые находили только в золе.
Учитель: итак, мы рассмотрели все вопросы, запланированные нами. На следующем уроке мы поговорим подробнее о соединениях, которые образуют щелочные металлы: оксиды, щелочи, соли.
ЗАКРЕПЛЕНИЕ ИЗУЧЕННОГО (слайд 21-23)
КОММЕНТАРИИ ОЦЕНОК
ДОМАШНЕЕ ЗАДАНИЕ (слайд 24)
1. § 11
2. Выполнить цепочку химических превращений:
Na →Na 2O 2→Na 2O→Na 2 CO 3
NaOH → NaCl

-75%
Читайте также:
- Обмен веществ и превращение энергии в клетке фотосинтез 9 класс конспект урока
- Конспект свійські тварини конспект уроку
- Конспект логопедического занятия в средней группе продукты питания
- Лермонтов бородино историческая основа стихотворения конспект урока 5 класс
- Конспект занятия по художественной литературе в средней группе колосок

