Конспект по химии 8 класс габриелян 32 параграф
Обновлено: 05.07.2024
Под действием электрического тока или при температуре выше 2000° C вода разлагается на простые вещества (водород и кислород).
Вода бурно взаимодействует с активными металлами с образованием щелочи (гидроксида) и водорода.
С некоторыми менее активными металлами вода может взаимодействовать при нагревании с образованием оксида и водорода.
Некоторые оксиды металлов и неметаллов способны вступать в реакции с водой. Первые образуют гидроксиды, вторые – кислоты.
Вода может вступать в реакции с некоторыми неметаллами.
Конспекты по химии 8 класс собраны по порядку на этой странице. Они помогут вам наглядно показать учебный материал на своих уроках, а ученик с их помощью сможет самостоятельно изучить любую тему урока по видео или конспекту. Это готовые материалы для учителя химии, которые можно удобно использовать на каждом своем уроке.

21. Кислоты
Химия 8 класс

22. Соли
Химия 8 класс

23. Кристаллические решетки
Химия 8 класс

24. Чистые вещества и смеси
Химия 8 класс
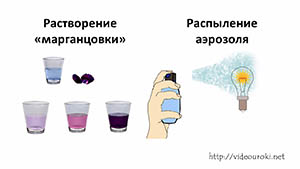
25. Физические явления
Химия 8 класс
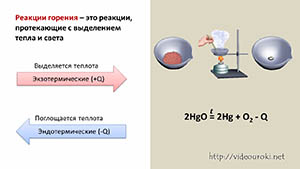
26. Химические явления. Закон сохранения массы веществ
Химия 8 класс

27. Химические уравнения
Химия 8 класс
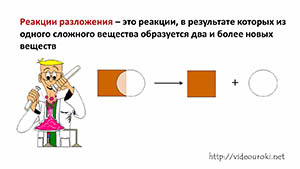
28. Реакции разложения
Химия 8 класс
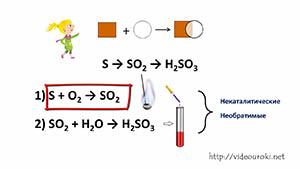
29. Реакции соединения
Химия 8 класс
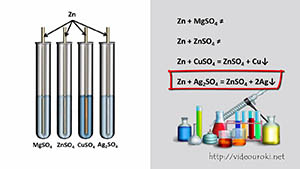
30. Реакции замещения
Химия 8 класс

Получайте новое первыми










Лицензия на право ведения образовательной деятельности №5251 от 25.08.2017 г.

Премиум

Премиум

Премиум
Химия — это довольно-таки интересная и любопытная наука. Опыты всегда притягивали каждого школьника. Этот предмет участвует во всех сферах жизнедеятельности человека. С его помощью люди смогли научиться получать различные материалы и превращать одно вещество в совершенно новое. Химия в восьмом классе раскроет перед школьником все основные химические понятия. Расскажет о трехмерных моделях молекул, научит решать химические уравнения. Чтобы лучше разобраться со всеми сложными терминами и понятиями, неплохо бы иметь всегда под рукой ГДЗ по химии 8 за класс (автор: Габриелян О. С.). Он облегчит и улучшит процесс изучения химии. Сборник полностью соответствует всем требованиям ФГОС и школьной программе по химии для общеобразовательных школ.
Учебник знакомит учащегося с начальными понятиями и законами данной дисциплины. Далее раскрываются основные сведения о строении вещества. Затем восьмиклассник изучает состояние и классификацию химических соединений. Особое время уделено изучению растворов и теории электролитической диссоциации. Учащемуся предстоит научиться наблюдать за изменениями, происходящими с веществами и уметь анализировать их свойства.
Учимся на 5+ с онлайн-решебником по химии 8 за класс Габриеляна
Использование сборника поможет восьмикласснику приобрести необходимые знания по предмету. С его помощью ученик:
- быстрее и лучше запомнит новый материал;
- качественно выполнит домашнее задание;
- сможет тренироваться в решении химических уравнений;
- подготовиться к самостоятельной работе.
Учитель-предметник сможет рассматривать пособие как некий материал для составления своей увлекательной программы, которая позволит каждому ученику в классе освоить курс и достичь высоких предметных и личностных высот в освоении непростой, но очень интересной науки.
Родители смогут с помощью решебника Габриеляна по химии для 8 класса следить за ходом выполнения домашнего задания, помогая своему ученику разобраться в непонятном для него материале. Совместная работа с ребенком принесет большую пользу в покорении этой интереснейшей дисциплины.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Конспект урока
Тема: Кислоты
(по учебнику О.С. Габриеляна)
учитель: Мирошникова Марина Алексеевна
Цель урока: познакомить учащихся с составом, классификацией кислот и названиями основных представителей этого класса.
- дидактические (образовательные): изучить состав, общие признаки классификации кислот, уметь составлять формулы кислот, рассмотреть названия основных представителей, продолжить знакомство учащихся со сложными ионами на примере кислотных остатков кислородных кислот, продолжить формирование знаний о различиях между зарядами ионов и степенью окисления элементов, об индикаторах;
- развивающие: развитие умственной и познавательной активности учащихся в решении проблемы, развитие практических умений и навыков при работе с химическими реактивами и химической посудой, умения обобщать и делать выводы при изучении материала темы;
- воспитательные: продолжить формирование у учащихся навыков: трудолюбие, усердие, дисциплинированность; прививать аккуратность при оформлении заданий в тетради и у доски, развитие химической речи, обогащение ее словарного запаса при устных ответах, и грамотное выполнение при самостоятельных заданиях.
Тип урока : урок формирования знаний.
Вид урока : урок-презентация.
Оборудование и реактивы : ПСХЭ, таблица растворимости, набор для практической работы учащихся: штатив с пробирками, кислоты – 2 образца (серная, лимонная), индикаторы (лакмус, метиловый оранжевый, фенолфталеин).
Этапы урока и их содержание.
Проверка домашнего задания, воспроизведение и коррекция опорных знаний учащихся.
Фронтальный опрос учащихся с целью актуализации имеющихся знаний:
- Какие классы неорганических соединений мы изучили?
- Что такое оксиды?
- Что такое основания?
- На какие группы делятся основания по растворимости в воде? С помощью какой таблицы мы сможем узнать о растворимости вещества?
- С помощью каких реакций распознают вещества? Какие вещества мы использовали на прошлом уроке для определения щелочей? Как изменяют окраску индикаторы в щелочной среде?
- Что такое степень окисления вещества? Чем отличается запись степеней окисления элементов от зарядов ионов?
С учащимися проводит фронтальную беседу.
Участвуют в фронтальном опросе.
Сегодня на уроке мы продолжим изучать основные классы неорганических соединений - класс кислоты, их состав, названия, классификацию и основных представителей этого класса.
Сообщает тему урока, цель урока.
Записывают в тетради тему урока.
Актуализация знаний
На сегодняшнем уроке мы должны познакомиться со следующим классом неорганических веществ – кислотами. Практически со всеми кислотами приходится сталкиваться ежедневно. Дождевая вода лишь на первый взгляд кажется чистой, не содержащей примеси. В ней растворено немало веществ, например углекислый газ из атмосферы. Поэтому дождевая вода является слабым раствором угольной кислоты. После летней грозы в ней оказывается еще и азотная кислота.
Вступительное слово учителя о значении и нахождении кислот.
Введение новых знаний, с учетом закономерностей процесса познания, осмысление связей и отношений в объекте изучения.
Почему они имеют такое название? Кислые на вкус. Достаточно вспомнить вкус аскорбиновой или лимонной кислот. Но ни одни химик и ни один грамотный человек даже и не подумает распознать таким образом кислоты – это может быть смертельно опасно, т.к. к кислотам относят и серную кислоту. Поэтому гораздо проще и безопаснее распознать кислоты, как и щелочи, с помощью индикаторов.
Мы должны определить изменение окраски индикаторов, знакомых нам по прошлому уроку, в кислой среде. Для этого мы используем растворы 2-х кислот: серной кислоты и лимонной кислоты, и растворы 3-х индикаторов: фенолфталеин, лакмус, метиловый оранжевый.
Какими правилами по технике безопасности мы должны придерживаться при проведении этой лабораторной работы:
- строго выполняем указания учителя;
- не пробуем вещества на вкус;
- наливать жидкость в пробирку осторожно, заранее проверив, не разбита ли она;
- пробирку держим на расстоянии 10- 15 см от глаз, на уровне глаз;
- не переливать вещества из пробирки в склянку;
- не загромождать рабочее место;
- производить опыты только в чистой посуде, закончив работу вымыть посуду;
- банки и склянки закрывать теми же пробками и крышками, какими они были закрыты.
Приступим к работе:
В образцы 2-х кислот, в 1-м штативе добавляем небольшое количество лакмуса, в образцы 2-го штатива – метилоранж, в образцы 3-го штатива – фенолфталеин.
Отмечаем окраску растворов.
Лакмус изменяет окраску в кислой среде с фиолетовой на красную, метиловый оранжевый с оранжевой на красно – розовую, фенолфталеин – остается бесцветным.
Что же объединяет все эти кислоты, кроме кислого вкуса? Обратимся к составу кислот. На экране формулы и названия некоторых кислот.
HCl –соляная кислота
HNO 3 –азотная кислота
H 2 CO 3 –угольная кислота
H 3 PO 4 –фосфорная кислота
Что общего в формулах этих кислот?
Давайте сформулируем определение кислот.
Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков.
Как правило, кислотные остатки образуют элементы – неметаллов, значит за счет ковалентных связей. Состав кислотных остатков различен, в одни остатки входит кислород, в других нет. Так же формулы этих кислот отличаются числом атомов H , который определяет особый признак кислот – основность.
По этим признакам кислоты классифицируют:
По числу атомов Н (по основности):
По наличию кислорода в кислотном остатке:
По растворимости в воде:
Запишите по одному примеру по каждой группе кислот.
По формулам кислот можно определить степени окисления химических элементов, образующих кислоты.
Перечислим правила написания степеней окисления:
- знаки записывают перед цифрой;
- указывается для каждого атома химического элемента;
- суммарная степень окисления атомов всех элементов в соединении равна нулю;
- значения степеней окисления записывают строго над химическим элементом.
Зная степень окисления элемента – неметалла, образующего кислотный остаток кислородсодержащей кислоты, можно определить, какой оксид ей соответствует.
HNO 3 → N 2 O 5 – оксид азота ( V ). Кислотам соответствуют оксиды металлов.
По формулам кислот можно определить и общий заряд ионов. Кислоты образуют ионы двух видов: ион водорода – H + и ион кислотного остатка, который будет иметь отрицательный заряд, равный основности кислот.
Повторим правила записи зарядов ионов:
- заряд иона записывают справа от химического элемента;
Самостоятельное определение для фосфорной кислоты: зарядов ионов; с.о. элементов; соответствующий оксид.
А теперь поподробнее познакомимся с некоторыми кислотами, потому, что они играют большое значение в нашей жизни.
Читайте также:

