Конспект и презентация соли аммония
Обновлено: 07.07.2024
Цель урока: рассмотреть физические и химические свойства солей аммония. Применение солей аммония.
1. Обеспечить в ходе урока усвоение следующих понятий:
- соли аммония
- качественные реакции на ион аммония
- химические свойства солей аммония
2. Формирование следующих специальных умений и навыков:
- умение составлять химические уравнения реакций
- умение пользоваться химической символикой и химическим языком
- умение работать с химическим оборудованием и химическими реактивами
- выполнять требования техники безопасности
3. Воспитание самостоятельности при выполнении лабораторных работ, упражнений, бережного отношения к окружающей среде, соблюдение правил техники безопасности
4. Развитие творчества, интереса к предмету, развитие интеллекта, эмоциональной мотивации в развитии личности, работа с учебником.
Задачи: к следующему уроку учащиеся должны:
- качественные реакции на ион аммония
- способы получения солей аммония на примере хлорида аммония
- составлять соответствующие уравнения реакций, отражающие свойства солей аммония
- проводить эксперимент, отражающий свойства солей аммония.
Оборудование: мультимедиа, пробирки, спиртовки, держатели, стаканы химические, стеклянная палочка, асбестовый картон, спички.
Реактивы: соляная кислота, раствор аммиака, раствор щёлочи натрия, раствор солей: хлорид аммония, карбонат аммония, нитрат серебра, кристаллический хлорид аммония, бихромат аммония, нитрат калия, бихромат калия, сахарная пудра, этиловый спирт.
1. Организационный момент (1–2 мин). Класс поделён на 4 группы.
Ребята! Сегодня у нас с вами урок обычный. Все ли к нему готовы? Проверьте ваше снаряжение – у всех ли есть учебники, авторучки, чистые листы бумаги, вопросники? Если да, то в добрый путь!
2. Проверка Домашнего задания. На прошлом занятии мы рассматривали соединения азота со степенью окисления (-3) на примере аммиака. На данном уроке мы продолжим рассматривать соединения азота с этой степенью. Но прежде повторим пройденный материал. (На слайде тест, работает группа и оценивается работа всей группы). Группам выдаётся бланк оценивания работы каждого ученика в группе в ходе урока. (Приложение 2)
Тест на слайде. (Слайд3)
По теме “Азот. Аммиак”.
1. Степень окисления азота в соединении Na3N:
А) +1, Б) +2, В) +4 , Г) -3.
2. Молекула аммиака NH3 имеет форму: А) изогнутую Б) линейную В) плоскую Г) тетраэдрическую. (Слайд4)
3. Азот в составе аммиака является:
А) только окислителем Б) только восстановителем. В) как окислителем, так и восстановителем, Г) акцептором электронов. (Слайд 5)
4. Какая среда образуется при пропускании аммиака через воду
а) кислая;
б) щелочная;
в) нейтральная;
г) аммиак в воде не растворяется. (Слайд 6)
5. Найти соответствие: (Слайд7)
Оценивание: (Слайд 9)
За каждый правильный ответ – 1 балл.
Если правильно 9 баллов – оценка “5”, 8–6 баллов – “4”, 5–3 балла – “3”, 2 балла – “2”.
3. Актуализация темы урока. (Слайд 13)
ИГРА “Третий лишний”.
Какое необычное вещество вам встретилось?
В молекуле этой соли вместо ионов металлов находится:
1) Сложный катион (NH4) +.
2) Как называется этот катион ? (Аммоний.)
3) Как могут называться эти соли? (Соли аммония.)
4) Сформулируйте тему сегодняшнего урока.
Тема урока: “Соли аммония”.
Давайте сформулируем определение солей, солей аммония.
Соли аммония это соединения, состоящие из катиона аммония и анионов кислотных остатков.
1. Строение солей аммония. Рассказ по слайд. (Слайд 15) Чтобы рассмотреть свойства солей аммония вспомним, как образуется ион аммония. (Слайд)
Вывод: при образовании донорно-акцепторной связи– образуется ион аммония, обладающий такими же свойствами как ионы К +, Na+ при взаимодействии с ионами Cl- , SO4 2– образуются соли аммония.
2. Получение солей аммония.
Я беру два стакана и получаю белый дым. (Опыт дым без огня.)
В один чисто вымытый цилиндр наливают несколько капель концентрированной соляной кислоты, а в другой – раствор аммиака. Оба раствора закрывают крышками и ставят друг от друга на некотором расстоянии. Перед опытом показывают, что цилиндры пусты. Во время демонстрации цилиндр с соляной кислотой (на стенках) переворачивают вверх дном и ставят на крышку цилиндра с аммиаком. Крышку убирают: образуется белый дым.
Мы с вами опровергли пословицу, что дыма без огня не бывает. Но это не просто дым, это частицы твёрдого вещества в воздухе. Произошла химическая реакция.
Запись уравнения реакции. (Слайд 17)
Какими еще способами можно получить соли аммония? Из кислот и аммиака и гидроксида аммония.
Будут ли соли аммония проявлять характерные свойства класса солей?
Ответы учащихся. (Слайд 19)
Радиус иона аммония по величине близок к радиусу иона калия, поэтому соли аммония и внешне, и по свойствам похожи на соли калия: это бесцветные, хорошо растворимые кристаллические вещества, вступающие в те же реакции, что и соли щелочных металлов. Как правило, это реакции ионного обмена:
3. Физические и химические свойства солей аммония
Для того чтобы убедиться, в этом выполним лабораторную работу. Открыть технологическую карту по лабораторной работе (Приложение 3) .[2]
Записали название лабораторной работы, цель, таблицу. Вспомним правила техники безопасности. (Слайд 21) Учащиеся работают по группам. Дальше каждая группа рассказывает о своей работе с записью уравнений реакции на доске. Время выполнения 7 мин.
1-я группа. (Слайд 22) [1]
Качественная реакция на ион аммония.
Оборудование и реактивы: пробирка, спиртовка, держатель, раствор хлорида аммония, раствор гидроксида натрия, лакмусовая бумажка.
1. В пробирке налит 1 мл раствора хлорида аммония.
2. Добавьте к нему 1 мл раствора гидроксида натрия.
Нагрейте содержимое пробирки до кипения, но не кипятите.
Внесите красную лакмусовую бумагу в выделяющиеся пары.
Запишите наблюдения и дайте им объяснения.
Запишите соответствующие уравнения реакции.
Вывод: реактивом на ион аммония (NH4+) является щелочь. Выделяется аммиак, обнаруживается по запаху (это качественная реакция на ион аммония).
2-я группа. (Слайд 23) [1]
Оборудование и реактивы: спиртовка, пробирка, держатель, кристаллический хлорид аммония.
Разложение хлорида аммония.
На дне пробирки лежит несколько кристалликов хлорида аммония.
Аккуратно нагрейте пробирку, держа ее наклонно.
Когда на внутренней поверхности пробирки возле отверстия появится белый налет, прекратите нагревание.
Запишите наблюдения и дайте им объяснение.
Запишите соответствующие уравнения реакции.
Разложение при высокой температуре.
NH4Cl = NH3 + НCl (качественная реакция )
3-я группа. (Слайд 24)
Оборудование и реактивы: пробирка, раствор хлорида аммония, раствор нитрата серебра.
Взаимодействие с солями.
В пробирке налит 1 мл раствора хлорида аммония.
Добавьте к нему 1 мл раствора нитрата серебра.
Запишите наблюдения и дайте им объяснения.
Запишите соответствующие уравнения реакции.
4-я группа. (Слайд 25)
Взаимодействие с кислотами.
Оборудование и реактивы: пробирка, карбонат аммония, соляная кислота.
1.В пробирке налит 1 мл раствора карбоната аммония.
2. добавьте к нему 1 мл соляной кислоты.
3. запишите наблюдения и дайте им объяснения.
4запишите соответствующее уравнение реакции.
Для каждой группы учитель задаются вопросы:
1. Будут ли соли аммония проявлять свойства класса солей?
2. Каким образом можно определить ион аммония?
Качественной реакцией на ион аммония является реактив Несслера. (К\ф.) (Слайд 26)
Качественными реакциями на ион аммония являются:
– взаимодействие со щелочами
– разложение солей аммония с выделением аммиака, соли аммония обладают всеми свойствами солей.
Реактив Несслера. (К\ф.)
Особые свойства солей аммония. (Слайд 27)
Демонстрация опыта “Вулкан”. (Слайд 28)[5]
В фарфоровой ступке тщательно растирают 50 г оранжево-красных кристаллов бихромата аммония. Порошок (NH4)2Cr2O7 высыпают на большую металлическую пластинку или лист асбестового картона, придавая ему форму горки. На вершине “вулкана” гвоздем или палочкой делают лунку и вливают в нее 1–2 мл этилового спирта. Спирт поджигают спичкой, и свет в комнате гасят.
От тепла горения спирта начинает бурно разлагаться бихромат аммония. При этом из “кратера” выбрасывается сноп ярких искр и “вулканический пепел” – грязно-зеленый оксид хрома (III), объем которого во много раз превышает объем взятого бихромата аммония.
Демонстрация опыта “Фараонова змея”. (Заготовка на опыт.) (Слайд 29) [3], [6] В ступке до порошкообразного состояния необходимо истереть:
5 г. нитрата калия,
10 г. бихромата калия,
10 г. сахарной пудры.
В полученный порошок по каплям добавляют чередуя этиловый спирт и воду, регулярно перемешивая порошок каждый раз после очередного добавления спирта или воды. Доводят смесь до консистенции “творога” – так чтоб можно было скатать шарики.
Полученные шарики высушить при комнатной температуре в течение 4–5 дней.
При разложении дихромата аммония образуются азот N2, водяной пар и зеленый оксид хрома(III) Сr2O3. Реакция протекает с выделение теплоты. В реакции термического разложения нитрата аммония выделяется бесцветный газ – оксид диазота N2O (закись азота), который уже при слабом нагревании разлагается на кислород O2 и азот N2. А горение сахара дает еще один газ – диоксид углерода СО2, вдобавок происходит обугливание – выделение углерода. Много газов плюс твердые продукты окисления – вот причина “змеиного” поведения горящей смеси.
Кристаллический карбонат аммония разлагается даже без нагревания, поэтому неплотно закрытая банка с ним через несколько дней опустеет:
У солей аммония есть и свои, специфические свойства – они разлагаются при нагревании.
5. Закрепление. (Слайд 30)
2) “Да” или “нет”. (Слайд 31)
1) Ион аммония имеет заряд -1 -
2) Соли аммония белые кристаллические вещества +
3) Все соли аммония хорошо растворимы в воде +
4) Дыма без огня не бывает -
5) Соли аммония обладают всеми свойствами солей +
6) Ион аммония имеет форму пирамиды +
7) Степень окисления азота в ионе аммония -4 -
8) Соли аммония можно определить действием щёлочи +
9) Аммиак не имеет характерного запаха _
10) Соли аммония – минеральные удобрения +
11) Нашатырный спирт – это раствор аммиака в воде +
Рефлексия. (Слайд 32)
Достигли ли вы поставленной цели?
Что для вас было новым?
О чём вы бы хотели поговорить ещё раз?
6. Домашнее задание. П. 26. (Слайд 33)
Вопрос 4, 5, кто на “4” или “5”. Реакции в конспекте расписать как окислительно-восстановительные.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам

Описание презентации по отдельным слайдам:

СОЛИ АММОНИЯ Урок по неорганической химии в 9 классе. Автор: Гвоздева Т.Л., учитель химии МБОУ СОШ №6 г. Озеры Московской области

Цели урока: сформировать знания о составе и характерных свойствах солей аммония, ознакомить с представителями этих солей и их применением, развивать умения выделять главное, классифицировать, представлять результаты работы.

Задачи урока: Образовательные: Систематизировать знания учащихся о солях, изучить свойства, присущие солям аммония, научиться распознавать эти соли, дать представление о применении солей аммония. Совершенствовать умения составлять уравнения химических реакций Развивающие: Способствовать продолжению развития устойчивого интереса к химической науке и практике. Совершенствовать навыки химического эксперимента. Способствовать развитию исследовательских навыков Совершенствовать умения обобщать и делать выводы. Воспитательные: Выработать у учащихся аккуратность при работе с химическими реактивами. Способствовать у учащихся воспитанию умения работать в коллективе.


II. Повторение и контроль.

Решите альтернативный тест – выбор правильного ответа из множества. I вариант выбирает правильные ответы для азота, II вариант - для аммиака:

1. Газообразный при обычных условиях. 2.Не имеет запаха. 3.Бесцветный. 4.Степень окисления азота -3 5. Взаимодействует с кислотами с образованием солей 6. В молекуле между атомами ковалентная полярная связь 7. Взаимодействует с водородом в присутствии катализатора 8. Он является важнейшим биогенным элементом. 9. Он проявляет только восстановительные свойства 10. В атмосфере этого газа хранят рукописи 11. Жидкий … прекрасное азотное удобрение. 12. Легче воздуха. 13. Используют в медицине. 14. Хорошо растворим в воде. 15. Инертный газ.

Взаимопроверка азотаммиак 1,2,3,7,8,10,12,13,15 1,3,4,5,6,9,11,12,13,14

III. Изучение нового материала.


Первая мировая война. Морское сражение немцев с англичанами.

1787 год - комиссия по химической номенклатуре дала этому газу имя ammoniaque (аммониак). 1801 год - русский химик Я. Д. Захаров исключил из него две буквы. Так получился аммиак.

* H Строение N H H •• Есть возможность образовать донорно – акцепторную связь Молекула образована ковалентной полярной связью N H H H •• + H+ N H H H •• H + АКЦЕПТОР ДОНОР Состав


Физические свойства солей аммония. а) твёрдые вещества; б) имеют кристаллическое строение (ионные кристаллические решётки); в) хорошо растворимые в воде.

Химические свойства солей аммония Вспомните правила Т/Б!

Химические свойства солей аммония. Взаимодействие с солями. хлорид аммония + нитрат серебра NH4Cl + AgNO3 NH4NO3 + AgCl NH4+ + Cl- + Ag+ + NO3- NH4+ + NO3- + AgCl Cl- + Ag+ AgCl

Сульфат аммония + хлорид бария (NH4)2SO4 + BaCl2 2NH4Cl + BaSO4 2NH4 ++SO42- + Ba2+ +2Cl - 2NH4 + +2Cl - + BaSO4 Ba2+ + SO42- BaSO4

2. Взаимодействие с кислотами. Карбонат аммония + соляная кислота (NH4 )2СО3 + 2HCl 2NH4Cl + CO2 + H2O 2NH4 + + СО32- + 2H ++2Cl- 2NH4 + + 2Cl- + CO2 + H2O СО32- + 2H + CO2 + H2O


Для разминки из-за парт Поднимаемся. На старт! Бег на месте. Веселей И быстрей, быстрей, быстрей! Делаем вперёд наклоны – Раз – два – три – четыре – пять. Мельницу руками крутим, Чтобы плечики размять. Начинаем приседать - Раз – два – три – четыре – пять. А потом прыжки на месте, Выше прыгаем все вместе. Руки к солнышку потянем. Руки в стороны растянем. А теперь пора учиться. Да прилежно, не лениться

3. Взаимодействие с щелочами. NH4Cl+ NaOH NH3 + H2O + NaCl Взаимодействие с щелочами – это качественная реакция на соли аммония (признак реакции: выделение газа с характерным запахом, окрашивающий влажную лакмусовую бумажку в синий цвет)

* Получение аммиака в лаборатории NH4Cl Ca(OH)2 NH3

4. Термическое разложение. Все аммонийные соли при нагревании разлагаются. (NH4)2CO3 = 2NH3 + H2O + CO2 NH4NO2 = 2H2O + N2 NH4Cl NH3 + HCl (NH4)2Cr2O7 = Cr2O3 + 4H2O + N2 соли летучих кислот соли кислот окислителей

Получение солей аммония Получают их при взаимодействии NH3 или NH4 OH с кислотами: NH3 + HCl = NH4 Сl NH3+HNO3→NH4 NO3 2NH4 OH+H2 SO4→(NH4)2 SO4+2Н2O

Применение солей аммония.

Русский химик Д.Н Прянишников Соли аммония Азотные удобрения

Аммиачная селитра (нитрат аммония) - прекрасное азотное удобрение. NH4NO3

Аммиачная селитра (нитрат аммония) – взрывчатое вещество.

Смесь нитрата аммония с алюминием и углем - аммонал (взрывные работы, в пиротехнике)

Нашатырь (хлорид аммония) Паяние, лужение металлов Изготовление гальванических элементов Хлорид аммония NH4Cl используют при паянии, так как он очищает поверхность металла от оксидной плёнки и к ней хорошо пристаёт припой.

Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3 применяют в кондитерском деле, так как они легко разлагаются при нагревании и образуют газы, разрыхляющие тесто и делающие его пышным, например: NH4HCO3 = NH3↑ + Н2O↑ + CO2↑

Роль азотистых соединений в природе и жизни человека

Задания на развитие творческого мышления Предложите способ очистки поваренной соли от содержащейся в ней примеси хлорида аммония. Объясните, можно ли смешивать аммиачную селитру (нитрат аммония) с известью?


Повторим: 1.Выбрать и назвать соли аммония 2. Перечислите химические свойства солей аммония. 3. Назовите физические свойства солей аммония. NaNO3 H2SO4 NH4HSO4 K2CО3 (NH4)2CО3 H3PО4 NaCL AgNO3 Ca(OH)2 NH4Cl HNO3 NH4H2PО4 CaCl2 (NH4)2SO4 H2S NH4NO3 H2SiO3 (NH4)2S

V. Домашнее задание. Выучить параграф 18. Составить уравнения реакций, с помощью которых можно осуществить превращения: N2 NH3 (NH4)3РO4 NH4Cl NH4NO3 Составьте полное и краткое ионные уравнения для превращений 3 и 4. Для превращения 1 (окислительно–восстановительная реакция) расставьте коэффициенты методом электронного баланса.


РЕФЛЕКСИЯ 1) Больше всего мне понравилось. 2) Самым интересным сегодня на уроке было. 3) Сегодня на уроке я почувствовал… 4) Сегодня я понял. 5) Сегодня я научился. 6) Сегодня я задумался. 7) Я не узнал сегодня ничего нового 8) Мне сегодня было скучно на уроке

СПАСИБО ВСЕМ ЗА УРОК!
Краткое описание документа:
Урок по неорганической химии.
Тема : Соли аммония.
Цель : сформировать знания о составе и характерных свойствах солей аммония, ознакомить с представителями этих солей и их применением, развивать умения выделять главное, классифицировать, представлять результаты работы.
1. Систематизировать знания учащихся о солях, изучить свойства, присущие солям аммония, научиться распознавать эти соли, дать представление о применении солей аммония.
2. Совершенствовать умения составлять уравнения химических реакций
1. Способствовать продолжению развития устойчивого интереса к химической науке и практике.
2. Совершенствовать навыки химического эксперимента.
3. Способствовать развитию исследовательских навыков
4. Совершенствовать умения обобщать и делать выводы.
1. Выработать у учащихся аккуратность при работе с химическими реактивами.

данная разработка позволяет дать полное представление о свойствах и применении аммиака и солей аммония.
Класс: 9 , предмет химия, 10.01.2018, Орден А.Ю.
Тема: Соли аммония.
Цель: сформировать знания о составе и характерных свойствах солей аммония, ознакомить с представителями этих солей и их применением, развивать умения выделять главное, классифицировать, представлять результаты работы.
Задачи: Образовательные:
Систематизировать знания учащихся о солях, изучить свойства, присущие солям аммония, научиться распознавать эти соли, дать представление о применении солей аммония.
Совершенствовать умения составлять уравнения химических реакций
Способствовать продолжению развития устойчивого интереса к химической науке и практике.
Совершенствовать навыки химического эксперимента.
Способствовать развитию исследовательских навыков
Совершенствовать умения обобщать и делать выводы.
1. Выработать у учащихся аккуратность при работе с химическими реактивами.
2. Способствовать у учащихся воспитанию умения работать в коллективе.
Тип урока: комбинированный.
Методы и методические приемы: словесные (рассказ, беседа), практические (демонстрация опытов, ученический эксперимент), методы самостоятельной работы (написание уравнений химических реакций), методы контроля и самоконтроля (устный опрос, решение тестов).
Межпредметные связи: биология, история.
Основные понятия: Соли аммония, термическое разложение солей аммония, качественная реакция на ион аммония.
I. Организационный момент. (1 мин)
II. Повторение и контроль (5 мин)
Альтернативный тест–выбор правильного ответа из множества
Выдать листочки учащимся.
I вариант выбирает правильные ответы для азота, II вариант - для аммиака:
1. Газообразный при обычных условиях.
2.Не имеет запаха.
4.Степень окисления азота -3
5. Взаимодействует с кислотами с образованием солей
6. В молекуле между атомами ковалентная полярная связь
7. Взаимодействует с водородом в присутствии катализатора
8. Он является важнейшим биогенным элементом.
9. Он проявляет только восстановительные свойства
10. В атмосфере этого газа хранят рукописи
11. Жидкий … прекрасное азотное удобрение.
12. Легче воздуха.
13. Используют в медицине.
14. Хорошо растворим в воде.
15. Инертный газ.
Проводим взаимопроверку (учащиеся ставят оценки друг другу)
III. Изучение нового материала (30 мин)
Актуализация знаний, полученных на предыдущем уроке. Постановка целей урока.
- с элементом какой группы и какой подгруппы периодической системы химических элементов Д.И.Менделеева вы начали знакомство на предыдущих уроках? (азот, 5-я группа, главная подгруппа)
- с каким соединением азота вы уже познакомились? (аммиак)
Учитель: На прошлом уроке вы познакомились с физическими и химическими свойствами аммиака, убедились в значимости этого вещества для человека. Сегодня мы продолжим знакомиться с соединениями азота. Я познакомлю вас с удивительными веществами, которые могут быть получены из аммиака и которые, на мой взгляд, имеют необыкновенные свойства.
Девизом сегодняшнего урока я предлагаю взять известные высказывания О.М. Нефедова и И.В.Гете:
Учитель: Эта история произошла во время I мировой войны. Английский крейсер вел преследование поврежденного в бою немецкого эсминца. Цель была почти достигнута, как вдруг между кораблями появилось плотное белое облако дыма. Экипаж крейсера почувствовал удушливый запах, раздражающий горло и легкие. Крейсер был вынужден дать задний ход и выйти из дымового облака. Уже после обнаружили, что пострадали не только люди, но и металлические части корабля.
Вещество, о котором пойдет речь, имеет древнюю историю. А представьте, как были взволнованы алхимики, когда имели дело с этим веществом!
Фронтальная беседа.
Почему мы уделяем отдельное внимание этим солям, чем они отличаются от других солей? Вспомним с вами:
- какие вещества называются солями? (Соли - это сложные вещества, в состав которых входят атомы металла и кислотный остаток).
- Что такое электролиты? Что такое соли с точки зрения теории электролитической диссоциации? Какие ионы образуются при диссоциации солей в водных растворах?(при растворении солей образуются катионы металлов и анионы кислотных остатков).
Так вот, ребята, в солях аммония отсутствует катион металла, вместо него мы пишем катион аммония. Давайте выполним задание 1: запишите определение солей аммония.
Соли аммония – сложные вещества, состоящие из катионов аммония и анионов кислотного остатка.
- Какие вы можете назвать соли аммония?
Хлорид аммония, нитрат аммония, сульфат аммония, карбонат аммония и др.
Странное название - аммоний. Этимология - происхождение названия. Откуда оно пошло?
- Чем отличаются эти соли от других солей?
При диссоциации эти соли в растворах дают сложный катион аммония с зарядом 1+ (NH4 + ).
Уникальность существования ионного типа веществ, образованных только неметаллами; соли аммония похожи на соли калия, так как радиусы ионов калия и аммония близки по размерам!
Физические свойства солей аммония.
Соли аммония по внешнему виду очень похожи на соли щелочных металлов - это белые кристаллические вещества, поэтому все соли аммония должны хорошо растворяться в воде.
Соли аммония хорошо растворяются в воде.
Физические свойства:
а) твёрдые вещества;
б) имеют кристаллическое строение (ионные кристаллические решётки);
в) хорошо растворимые в воде.
Химические свойства.
Перечислите известные вам химические свойства солей.
(В водных растворах соли вступают в реакции обмена между собой (если при этом выпадает осадок), соли реагируют с кислотами и щелочами (если в результате реакции выпадает осадок или выделяется газ), одни металлы могут вытесняться из солей другими металлами. Также многие соли подвергаются термическому разложению).
Это общие свойства солей. Изучим, имеют ли перечисленные свойства соли аммония
1. Взаимодействие с солями.
Хлорид аммония можно распознать так же, как и все соли соляной кислоты - действием раствора нитрата серебра.
Запишите уравнение этой реакции на доске в молекулярном, полном и сокращенном ионном виде. (Вызванный ученик на доске, а остальные учащиеся в тетрадях - записывают уравнение реакции):

NH4Cl + AgNO3 NH4NO3 + AgCl

NH4 + + Cl - + Ag + + NO3 - NH4 + + NO3 - + AgCl

Cl - + Ag + AgCl
Нужно взять хлорид бария, тогда образовавшийся сульфат бария выпадает в осадок, и реакция пойдёт до конца.
учащиеся записывают уравнение реакции в тетрадях).


Вывод: Соли аммония взаимодействуют с другими солями в водных растворах, если в результате реакции выпадает осадок.
2. Взаимодействие с кислотами.
Налейте в пробирку раствор карбоната аммония и добавьте к нему раствор соляной кислоты.
Что наблюдаете? (выделение газа)
Запишите уравнение этой реакции на доске в молекулярном, полном и сокращенном ионном виде. (Вызванный ученик на доске, а остальные учащиеся в тетрадях - записывают уравнение реакции):

(NH4 )2СО3 + 2HCl 2NH4Cl + CO2 + H2O
2NH4 + + СО3 2- + 2H + +2Cl - 2NH4 + + 2Cl - + CO2 + H2O
Вывод: Соли аммония взаимодействуют с кислотами в водных растворах, если в результате реакции выпадает осадок или выделяется газ.
ФИЗКУЛЬТМИНУТКА. (Цели: сохранение зрения, снятие усталости с глаз во время работы на уроке. Продолжительность выполнения – до 2минут. Необходимо помнить, что головные боли, раздражительность, апатия и даже депрессия у учащихся могут быть вызваны обычной усталостью глаз. А от состояния глаз зависит работоспособность детей, умение воспринимать и запоминать информацию. Поэтому физминутки снимают усталость, повышают настроение, работоспособность).
3. Взаимодействие со щелочами.
Учитель: Нальем в пробирку раствор любой соли аммония и прильем щёлочи. Подогреем пробирку. Запах какого знакомого вещества вы ощущаете?
Запах такой же как от нашатырного спирта. Это запах аммиака.
Запишите уравнение реакции в тетрадь.

А как ещё можно обнаружить аммиак?
(Аммиак обнаруживается по посинению лакмусовой бумажки. Фенолфталеин в присутствии аммиака приобретает малиновую окраску).
Вывод: Соли аммония взаимодействуют с щелочами в водных растворах, если в результате реакции выделяется газ. Более того, взаимодействие с щелочами – это качественная реакция на соли аммония (признак реакции: выделение газа с характерным запахом, окрашивающий влажную лакмусовую бумажку в синий цвет).
4. Термическое разложение.
Но соли аммония имеют и особенные, отличающие их от других солей, свойства. Насыпаем немного в пробирку хлорида аммония. Осторожно нагреваем и наблюдаем, что происходит? Запишите уравнение в тетрадь.
Соль исчезла, верхняя часть пробирки покрылась белым налётом - очевидно, хлорид аммония разлагается на аммиак и хлороводород (В этой реакции образуется также газообразный хлороводород, который улетучивается вместе с аммиаком, а при охлаждении снова соединяется с ним, образуя соль. Это возгонка).Эта реакция разложения протекает без изменения степени окисления элементов.
Таким образом, еще одной качественной реакцией на соли аммония является разложение сухих солей при нагревании с выделением газообразного аммиака.
Но соли аммония могут разлагаться и по-другому:
Эта реакция разложения протекает с изменением степени окисления элементов и является окислительно –восстановительной.
Применение солей аммония (учащиеся пытаются объяснить, на каких свойствах солей аммония основаны области их применения).
в пиротехнике, при взрывных работах (разложение при нагревании);
в хлебопечении и кондитерской промышленности (разрыхлители теста – карбонат и гидрокарбонат аммония);
в сельском хозяйстве - удобрения (питательные вещества)
при паянии металлов (нашатырь - хлорид аммония)
электролит в сухих элементах (хлорид аммония).
Выделившийся азот создает в мяче повышенное давление.
Задания на развитие творческого мышления.
Предложите способ очистки поваренной соли от содержащейся в ней примеси хлорида аммония (предполагаемый ответ – нагреть)
Объясните, можно ли смешивать аммиачную селитру (нитрат аммония) с известью? (нельзя, так как между ними происходит химическая реакция).
Роль азотистых соединений в жизни человека и общества очень велика, а применении разнообразно. Азот – основа жизни на Земле. На Земле постоянно происходят процессы превращения веществ живой и неживой природы. В результате этих превращений неорганические вещества неживой природы – соли аммония могут превращаться в сложные органические вещества – белки. А белки – это основа всего живого. В белках содержится 18 % азота. Без азота нет белка, без белка нет жизни!

•углубить и расширить знания учащихся о солях, образованных сложным катионом аммония; •познакомить с общими и специфическими свойствами солей аммония; •развивать умения, наблюдать, делать выводы, обобщать при проведении лабораторных опытов, продолжать развивать умения в записи уравнений реакций в ионном виде; •применять теоретические знания для составления прогнозов; •воспитывать умения общаться в коллективе, прививать трудолюбие, умение слушать и слышать, корректировать ответы, брать на себя ответственность за работу каждого члена группы.
Подготовила:
учитель химии
Манякина Лариса Павловна

- углубить и расширить знания учащихся о солях, образованных сложным катионом аммония;
- познакомить с общими и специфическими свойствами солей аммония;
- развивать умения, наблюдать, делать выводы, обобщать при проведении лабораторных опытов, продолжать развивать умения в записи уравнений реакций в ионном виде;
- применять теоретические знания для составления прогнозов;
- воспитывать умения общаться в коллективе, прививать трудолюбие, умение слушать и слышать, корректировать ответы, брать на себя ответственность за работу каждого члена группы.
Оборудование: твердые соли аммония: хлорид, сульфат, нитрат и их растворы; растворы нитрата серебра, хлориды бария, гидроксид натрия, серной кислоты; лакмусовая бумага. Посуда для проведения опытов.
Девиз урока
М.В. Ломоносов

I. Организационный этап.
II. Проверка домашнего задания.
III. Изучение нового материала
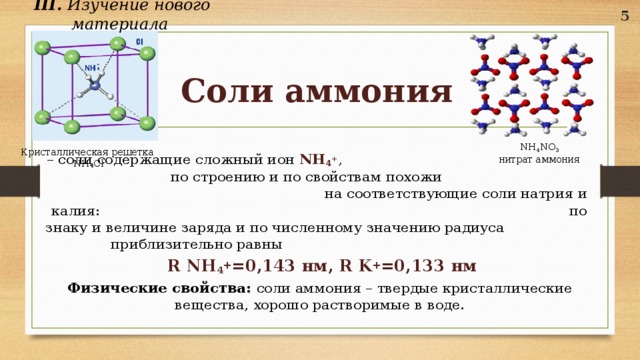
III. Изучение нового материала
Соли аммония
– соли содержащие сложный ион NH 4 + , по строению и по свойствам похожи на соответствующие соли натрия и калия: по знаку и величине заряда и по численному значению радиуса приблизительно равны
R NH 4 + =0,143 нм, R K + =0,133 нм
Физические свойства: соли аммония – твердые кристаллические вещества, хорошо растворимые в воде.
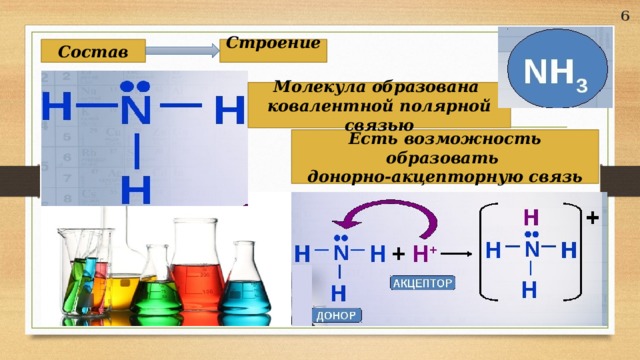
Состав
Строение
Молекула образована
ковалентной полярной связью
Есть возможность образовать
донорно-акцепторную связь

СОЛИ АММОНИЯ
NH 4 NO 3
(NH 4 ) 2 CO 3
NH 4 Cl
( NH 4 ) 2 HPO 4
(NH 4 ) 2 SO 4
NH 4 HCO 3
Каждая группа из 4 (по 6-7 чел.) используя таблицу растворимости солей и проводя аналогию с соответствующими солями калия выполняет задание (находятся на столах) отвечают на вопросы по образцам выданных соли:
1. агрегатное состояние;
3. отношение к воде.

Вспомните о химических свойствах солей металлов!
Химические свойства солей аммония
Вспомните правила Т/Б!
Задание № 2: практическим путем, соблюдая при этом правила техники безопасности, подтвердить химические свойства солей аммония.
По окончанию опыта учащиеся каждой группы записывают уравнения реакций в тетрадях и на доске и делают выводы.

Задание № 3. Записать уравнение электролитической диссоциации для солей аммония:
- а) хлорида аммония;
- б) нитрата аммония;
- в) карбонат аммония;
- г) сульфат аммония.
а) NH 4 Cl↔ NH 4 + + Cl - ;
б) NH 4 NO 3 ↔ NH 4 + + NO 3 - ;
в)(NH 4 ) 2 CO 3 ↔ 2NH 4 + + CO 3 2 ; -
г) (NH 4 ) 2 SO 4 ↔ 2NH 4 + + SO 4 2-

Демонстрацию данного опыта проводит учитель!
Качественная реакция на ион аммония
Ион аммония обусловливает общее для всех солей аммония свойство: его соли реагируют с щелочами при нагревании с выделением аммиака например:
или в ионном виде:
NH 4 + + OH - ↔ H 2 O + NH 3 ↑
Данные уравнения учащиеся записывают самостоятельно с дальнейшим обсуждением.

Все аммонийные соли при нагревании разлагаются
2. Карбонат аммония разлагается даже без нагревания
1. Реакция разложения хлорида аммония при высокой температур е
(NH 4 ) 2 CO 3 → NH 3 ↑+CO 2 ↑+H 2 O
NH 4 Cl→NH 3 ↑+HCl
Возгонка хлорида аммония

Демонстрацию данного опыта проводит учитель с сопровождением материала презентации и комментариями!
Разложение дихромата аммония
NH 4 Cr 2 O 7 → Cr 2 O 3 + N 2 ↑+4H 2 O
Демонстрацию данного опыта проводит учитель с комментариями!
Аммиак взаимодействует с кислотами, образуя соли аммония.
Опыт: стеклянную палочку или стакан, смоченные раствором аммиака, поднести к другой палочке или стакану, смоченным соляной кислотой, — появится густой белый дым

Учащиеся самостоятельно подготовили материал по способу получения солей, работая с дополнительными источниками.
Задание № 4. Способы получения солей.
Соли аммония получают взаимодействием аммиака или его водного раствора с кислотами.
1. Нитрофосфатный метод поучения нитрата аммония ( способ Одда ):
Ca(NO 3 ) 2 + 4H 3 PO 4 + 8NH 3 CaHPO 4 + 2NH 4 NO 3 + 3(NH 4 ) 2 HPO 4
2. По способу Габера из азота и водорода синтезируется аммиак, в результате чего образуется нитрат аммония:
С данным материалом можно ознакомить учащихся на уроке при наличии учебного времени или на самостоятельное изучение.
Применение аммиака и солей аммония:
С данным материалом можно ознакомить учащихся на уроке при наличии учебного времени или на самостоятельное изучение.
1) Гидрокарбонат аммония NH 4 HCO 3 и карбонат аммония (NH 4 ) 2 CO 3 Будущим хозяйкам на заметку!
2) Аммиачная селитра (нитрат аммония) – прекрасное азотное удобрение.
Любителям получать высокие урожаи на огороде!
NH 4 NО 3
Применяют в кондитерском деле, так как они легко разлагаются при нагревании и образуют газы, разрыхляющие тесто и делающие его пышным, например:
NH 4 HCO 3 NH 3 ↑ + H 2 O + CO 2 ↑
3) Аммиачная селитра (нитрат аммония) – взрывчатое вещество!
В смеси с порошками алюминия и угля используют в качестве взрывчатого вещества — аммонала , который широко применяют при разработке горных пород.
Осторожно взрывоопасно!

IV. Закрепления
Из предложенных формул веществ составить цепочку превращений:
NH 3 , NH 4 OH, N 2 , NH 4 Cl, (NH 4 ) 2 SO 4 , NH 4 NO 3 .
Читайте также:

