Конспект ацетилен и его свойства
Обновлено: 07.07.2024
Загрузить презентацию (304 кБ)
Цели урока:
- Образовательная:закрепить понятие непредельные углеводороды; изучить свойства и применение ацетилена;
- Развивающая:научить пользоваться приемами сравнения, обобщения, делать выводы, расширять познавательные интересы.
- Воспитывающая: воспитывать интерес к предмету химия.
Тип урока: комбинированный.
Форма занятия: урок изучения нового материала с использованием ИКТ.
I. Организационный момент
II. Изложение нового материала
Загадка
– Горит с образованием углекислого газа и воды, но не алкан;
– Обесцвечивает бромную воду, но не алкан;
– Подчиняется общей формуле СnH2n–2 , но не алкадиен.
Подсказка – содержит 2 атома углерода.(Слайд 2)
1. Алкины – это алифатические (ациклические), непредельные (ненасыщенные) углеводороды, с одной тройной углерод-углеродной связью
С ≡ С в цепи и общей формулой СnH2n–2
2. Строение
Ацетилен – первый член гомологического ряда ацетиленовых углеводородов, или алкинов.
Молекулярная формула ацетилена C2H2
Структурная формула ацетилена H–C≡C–H
Электронная формула H : С : : : С : Н
Углеродные атомы ацетилена, связанные тройной связью, находятся в состоянии sp-гибридизации. При образовании молекулы ацетилена у каждого атома С гибридизуются по одной s- и p-орбитали. В результате этого каждый атом С приобретает по две гибридных орбитали, а две p-орбитали остаются негибридными. Две гибридных орбитали взаимно перекрываются, и между атомами С образуется σ-связь. Остальные две гибридных орбитали перекрываются с s-орбиталями атомов H, и между ними и атомами С тоже образуются σ-связи. Четыре негибридных p-орбитали размещены взаимно перпендикулярно и перпендикулярно направлениям σ-связей. В этих плоскостях p-орбитали взаимно перекрываются, и образуются две π-связи, которые относительно непрочные и в химических реакциях легко разрываются.
Таким образом, в молекуле ацетилена имеются три σ-связи (одна связь C–C и две связи C–H) и две π-связи между двумя С атомами. Тройная связь в алкинах – не утроенная простая, а комбинированная, состоящая из трех связей: одной σ- и двух π-связей.
Молекула ацетилена имеет линейное строение. Появление третьей связи вызывает дальнейшее сближение атомов С: расстояние между их центрами составляет 0,120 нм.

sp-гибридные орбитали двух атомов углерода в состоянии,
предшествующем образованию тройной связи и связей C–H

Схематическое изображение строения молекулы ацетилена (ядра атомов углерода и водорода на одной прямой, две p-связи между атомами углерода находятся в двух взаимно перпендикулярных плоскостях) (Слайды 4,5)
3. Физические свойства
С2Н2 – Ацетилен – бесцветный газ, легче воздуха, мало растворим в воде, в чистом виде почти без запаха.
Свойства гомологов изменяются аналогично алкенам. По физическим свойствам алкины напоминают алкены и алканы. Температуры их плавления и кипения увеличиваются с ростом молекулярной массы. В обычных условиях алкины С2–С3 – газы, С4–С16 – жидкости, высшие алкины – твердые вещества. Наличие тройной связи в цепи приводит к повышению температуры кипения, плотности и растворимости их в воде по сравнению с олефинами и парафинами. (Слайд 6)
4. Химические свойства алкинов
1. Реакции присоединения
1) Галогенирование – стадийно, до производных алканов:
(как и алкены обесцвечивают бромную воду!)
2) Гидратация – (реакция М.Г. Кучерова)
протекает в присутствии солей ртути(II) – HgSO4, Hg(NO3)2 – с образованием уксусного альдегида:
3) Полимеризация
В определенных условиях ацетилен способен полимеризоваться в бензол и винилацетилен.
При пропускании ацетилена над активированным углем при 450–500 °С происходит тримеризация ацетилена с образованием бензола (Н.Д.Зелинский, 1927 г.):
2. Реакции окисления и восстановления
1) Горение – пламя сильно коптящее
Ацетилениды металлов – взрывчатые вещества!
3. Применение ацетилена (Слайд 7)
III. Закрепление материала: (Слайд 9)
– К каким углеводородам относятся алкины?
– Какая особенность в строении алкинов?
– Как получить газ ацетилен?
– Где применяют ацетилен?
IV. Подведение итогов. Выставление оценок.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
познакомиться с гомологическим рядом, номенклатурой, и изомерией непредельных углеводородов ряда ацетилена;
выяснить области применения представителей данного класса органических веществ;
закрепить полученные знания.
Задачи урока:
Формирование представлений о химических свойствах ацетилена и его гомологов на основе строения.
Формирование информационно-коммуникативных компетенций учащихся при поиске информации, при работе с разными источниками информации.
Совершенствование умений и навыков учащихся в написании изомеров непредельных углеводородов, в составлении уравнений химических реакций для ацетилена и его гомологов.
Тип урока: комбинированный
Оборудование:
Шаростержневая модель молекулы ацетилена
I . Организационный момент: объявление темы, целей и задач урока. II. Изучение темы урока по плану :
Состав: общая формула, простейшие представители данного класса, номенклатура соединений.
Особенности строения: наличие тройной (кратной) связи, тип гибридизации.
Изомерия молекул и ее виды.
Свойства веществ: физические и химические.
Подведение итогов урока, выставление оценок.
II. Изучение новой темы.
1. Алкины – это непредельные (ненасыщенные) углеводороды, с одной тройной углерод - углеродной связью С ≡ С в цепи и общей формулой С n H 2 n -2
2. Строение. Состав алкинов.
На доске записаны формулы углеводородов. Чем они отличаются? Числом атомов водорода.
Первая формула принадлежит этану (предельному углеводороду), вторая этилену (непредельному углеводороду), а третья принадлежит еще более ненасыщенному соединению – ацетилену. Давайте составим структурные формулы этих углеводородов.
Ацетилен еще более ненасыщенный угеводород, чем этан и этилен..
Ацетилен – первый член гомологического ряда ацетиленовых углеводородов, или алкинов.
Молекулярная формула ацетилена C 2 H 2
Структурная формула ацетилена H–C≡C–H
Электронная формула H : С : : : С : Н
Углеродные атомы ацетилена, связанные тройной связью, находятся в состоянии sp -гибридизации. При образовании молекулы ацетилена у каждого атома С гибридизуются по одной s - и p -орбитали. В результате этого каждый атом С приобретает по две гибридных орбитали, а две p -орбитали остаются негибридными. Две гибридных орбитали взаимно перекрываются, и между атомами С образуется σ-связь. Остальные две гибридных орбитали перекрываются с s -орбиталями атомов H, и между ними и атомами С тоже образуются σ -связи.
Таким образом, в молекуле ацетилена имеются три σ -связи (одна связь C–C и две связи C–H) и две π -связи между двумя С атомами. Тройная связь в алкинах – не утроенная простая, а комбинированная, состоящая из трех связей: одной σ - и двух π -связей.
Молекула ацетилена имеет линейное строение. Появление третьей связи вызывает дальнейшее сближение атомов С: расстояние между их центрами составляет 0,120 нм.
Четыре негибридных p -орбитали размещены взаимно перпендикулярно и перпендикулярно направлениям σ-связей. В этих плоскостях p -орбитали взаимно перекрываются, и образуются две π -связи, которые относительно непрочные и в химических реакциях легко разрываются.
Таким образом, в молекуле ацетилена имеются три σ -связи (одна связь C–C и две связи C–H) и две π -связи между двумя С атомами. Тройная связь в алкинах – не утроенная простая, а комбинированная, состоящая из трех связей: одной σ - и двух π -связей.
Молекула ацетилена имеет линейное строение. Появление третьей связи вызывает дальнейшее сближение атомов С: расстояние между их центрами составляет 0,120 нм.
Запомните!
1. Длина связи 0,12 нм
3. Линейная молекула
4. Связи – σ и 2π
5. Sp - гибридизация
3. Физические свойства
С 2 Н 2 – Ацетилен – бесцветный газ, легче воздуха, с резким запахом, малорастворим в воде,
4. Изомерия и номенклатура
Структурная изомерия
1. Изомерия положения тройной связи (начиная с С 4 Н 6 ):
2. Составить все возможные изомеры гексина.
3. Построить следующие структурные формулы алкенов:
а) 3метил пентин-1, б) 4,4диметил пентин-2, в) 2,5диэтилгексин-3
5.Химические свойства алкинов
1). Горение. Ацетилен горит светящимся пламенем и образует много копоти. Чем больше в горящем веществе углерода и чем меньше водорода, тем больше коптящего пламени получается. Часть углерода просто не успевает перевариться в углекислый газ и дает частицы сажи от которых пламя становиться светящимся.
2 С 2 Н 2 + 5 О 2 = 4СО 2 + 2 Н 2 О
Реакции присоединения
2). Галогенирование
С H ≡ CH + Br 2 → CHBr = CHBr (1,2-дибромэтен)
CHBr = CHBr + Br 2 → CHBr 2- CHBr 2 (1,1,2,2-тетрабромэтан)
3). Гидрогалогенирование
* CH 3 - C ≡ CH + HBr AlBr 3 → CH 3 - CBr = CH 2
* - используется пр. Морковникова
4). Полимеризация
В определенных условиях ацетилен способен полимеризоваться в бензол. При пропускании ацетилена над активированным углем при 450–500 °С происходит тримеризация ацетилена с образованием бензола (Н.Д.Зелинский, 1927 г.):

Получение ацетилена.
Ацетилен химически активен, поэтому в природе не встречается. Его получают:
1. Из метана, тo есть основного компонента природного газа: 2СН4 → С2Н2+ 3H2
2.Ацетилен в лаборатории получают карбидным способом. В карбид кальция наливают дистиллированную воду и опускают газоотводную трубку в перманганат калия. Раствор обесцвечивается. CaC2 + 2H2O → Ca(OH)2 + C2H2↑
Применение ацетилене.
Для сварки и резки металлов.
Из ацетилена поучают полихлорвинил из которого изготавливают новогодние искусственные елочки, искусственные кожи , клеенки, линолиум.
Ацетилен дешевое химическое сырье, из которого получают пластмассы, каучуки, резину, химические волокна.
Переработав ацетилен можно получить этиловый спирт, уксусную кислоту, растворители, ароматические углеводороды.
Обобщение и закрепление знаний: Закончите следующие фразы:
2. Общая формула алкинов…
3 Простейший алкин…
4. Связь в молекуле ацетилена между углеродными атомами…
5. Физические свойства ацетилена…
6. Характерные химические реакции алкинов…
7. Ацетилен применяется для…
Метан → Ацетилен → Этилен → Этан → Хлорэтан
Ацетилен (этин) – газ без цвета и запаха, обладает слабым наркотическим действием (строение молекулы показано на рис. 1).
Мало растворим в воде и очень хорошо в ацетоне. В виде ацетонового раствора его хранят в стальных баллонах, заполненных каким-нибудь инертным пористым материалом. Смеси ацетилена с воздухом взрывоопасны.

Рис. 1. Строение молекулы ацетилена.
Таблица 1. Физические свойства ацетилена.
Молярная масса, г/моль
Температура плавления, o С
Температура кипения, o С
Получение ацетилена
Выделяют промышленные и лабораторные способы получения ацетилена. Так, в промышленности ацетилен получают путем высокотемпературного крекинга метана:
В лаборатории ацетилен получают гидролизом карбида кальция:
Кроме вышеперечисленных реакций, для получения ацетилена используют реакции дегидрирования алканов и алкенов:
Химические свойства ацетилена
Ацетилен вступает в реакции присоединения, протекающие по нуклеофильному механизму, такие как:
Кроме этого ацетилен способен образовывать соли при взаимодействии с активными металлами (1) и оксидом серебра (2):
2СH≡CH +2Na→2 СH≡C-Na + H2 (1);
Он способен тримеризоваться:
Применение ацетилена
Ацетилен является исходным продуктом для многих важнейших химических производств. Например, из ацетилена получают различные галогенпроизводные, такие как тетрахлорэтан и трихлорэтилен, являющиеся хорошими растворителями, а также винилхлорид, служащий мономером для получения поливинилхлорида. Кроме этого ацетилен используется для получения синтетических каучуков.
Примеры решения задач
| Задание | Эквимолекулярная смесь ацетилена и формальдегида полностью реагирует с 69,6 г Ag2O, растворенного в аммиаке. Определите состав исходной смеси. |
| Решение | Запишем уравнения реакций, указанных в условии задачи: |
Рассчитаем количество вещества оксида серебра (I):
n(Ag2O) = 69,6 / 232 = 0,3 моль.
По уравнению (2) количество вещества формальдегида будет равно 0,1 моль. По условию задачи смесь эквимолекулярна, следовательно, ацетилена тоже будет 0,1 моль.
Найдем массы веществ, составляющих смесь:
M(HC≡CH) = 26 г/моль;
M(H-C(O)H) = 30 г/моль;
m(HC≡CH) = 0,1 × 26 = 2,6 г;
m(H-C(O)H) = 0,1 × 30 = 3 г.
| Задание | При пропускании смеси пропана и ацетилена через склянку с бромной водой масса склянки увеличилась на 1,3 г. При полном сгорании такого же количества исходной смеси углеводородов выделилось 14 л (н.у.) оксида углерода (IV). Определите массовую долю пропана в исходной смеси. |
| Решение | При пропускании смеси пропана и ацетилена через склянку с бромной водой происходит поглощение ацетилена. Запишем уравнение химической реакции, соответствующее этому процессу: |
Таким образом, значение, на которое увеличилась масса склянки (1,3 г) представляет собой массу ацетилена. Найдем количество вещества ацетилена (молярная масса – 26 г/моль):
Запишем уравнение реакции сгоранияацетилена:
Согласно уравнению реакции, в неё вступило 2 моль ацетилена, однако, известно, что 0,05 моль из этого количества поглотилось бромной водой. Т.е. выделилось:
Найдем общее количество оксида углерода (IV):
Запишем уравнение реакции сгорания пропана:
Учитывая, что в реакции сгорания ацетилена выделилось 0,1 моль оксида углерода (IV), количество вещества оксида углерода (IV), выделившееся в ходе сгорания пропана равно:
0,625 — 0,1 = 0,525 моль СО2.
Найдем количество вещества пропана, вступившего в реакцию горения. Согласно уравнению реакции n(CO2) : n(С3Н8) = 3 : 1, т.е.


В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Ацетилен"
Впервые ацетилен получил в 1836 году Дэви, действуя на карбид кальция водой. Дал название ацетилену французский химик – П.Э. Бертло в 1860 году.


Ацетилен, или этин является первым представителем ненасыщенных углеводородов с тройной связью. Его молекулярная формула С2Н2. Начиная с ацетилена, можно построить гомологический ряд, в котором каждый последующий углеводород отличается от предыдущего на одну группу СН2.
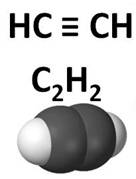
С3Н4 – это пропин, С4Н6 – бутин. Поэтому общая формула гомологического ряда ненасыщенных углеводородов с одной тройной связью СnНn-2. Общее название этого класса – алкины.
Названия ацетилена и его гомологов образуют изменением суффикса – ан на суффикс –ин.
В отличие от этилена, имеющего плоскостное строение, ацетилен имеет линейное строение: все четыре атома молекулы ацетилена лежат на одной прямой с углами связей, равными 180 0 . Каждый атом углерода образует три связи с атомами углерода и одну – с атомами водорода.

Ацетилен при обычных условиях представляет собой бесцветный газ, смесь которого с воздухом взрывается от искры. Ацетилен плохо растворяется в воде, хорошо растворяется в ацетоне: в одном объёме ацетона при обычных условиях растворяется двадцать пять объёмов ацетилена.
Так как ацетилен содержит кратные связи, то для него характерны реакции присоединения. Например, при присоединении водорода количеством один моль к ацетилену количеством один моль в присутствии катализатора образуется этилен.
В данной реакции происходит разрыв только одной ковалентной связи в молекуле ацетилена.
Этилен, в свою очередь, также может взаимодействовать с водородом в присутствии катализатора с образованием этана. Поэтому можно написать суммарное уравнение присоединения водорода количеством два моль к ацетилену количеством один моль с разрывом двух ковалентных связей и образованием этана.
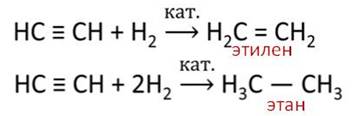
Ацетилен вступает и в реакции присоединения галогенов.
Например, при присоединении хлора количеством 1 моль к ацетилену количеством один моль, разрывается одна ковалентная связь и образуется 1,2–дихлорэтен, если к ацетилену присоединить сразу два моль хлора, то разрывается две ковалентные связи и образуется соединение 1,1,2,2–тэтрахлорэтан.
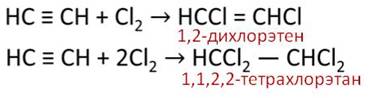
Кроме галогенов, ацетилен вступает в реакции присоединения галогеноводородов. Например, при присоединении хлороводорода количеством один моль к ацетилену количеством один моль, то разрывается только одна ковалентная связь и образуется хлорэтен. Если к ацетилену количеством один моль добавить два моль хлороводорода, то разрываются две связи и образуется 1,1–дихлорэтан.
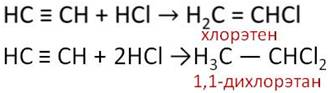
При горении ацетилена образуется углекислый газ и вода.


В лаборатории ацетилен получают действием воды на карбид кальция СаС2. В результате этого взаимодействия образуется ацетилен и гидроксид кальция.
Например, если на карбид кальция подействовать водой, а затем поджечь выделяющийся газ, то он горит коптящим пламенем. Это горит ацетилен.

В смеси с кислородом ацетилен широко используется для резки и сварки металлов. Ацетилен используют при получении растворителей, уксусной кислоты, клея ПВА, поливинилхлорида, а также его используют как горючее.

Решим задачу. Вычислите, какой объём ацетилена при нормальных условиях, образуется в результате взаимодействия с водой 100 г технического карбида кальция, содержащего 4% примесей.
По условию задачи нам дана масса карбида кальция 100 г и массовая доля примесей в этом техническом карбиде кальция 4%. Найти нужно объём ацетилена. Согласно уравнению, в результате этой реакции образуется газ ацетилен и гидроксид кальция. Найдём массовую долю чистого карбида кальция, для этого от 100 вычитаем 4 и получаем 96%, поэтому масса чистого карбида кальция равна произведению массы технического карбида кальция на массовую долю чистого карбида кальция. Получается нужно 100 умножить на 0,96%, получаем 96 г. Нам необходимо найти количество вещества карбида кальция, для этого необходимо его массу разделить на молярную массу. Чтобы найти молярную массу карбида кальция нужно атомную массу кальция умножить на один и сложить с произведением атомной массы углерода, умноженной на два, получается 64 г/моль. Находим количество вещества карбида кальция, для этого разделим массу на молярную массу, подставим значения: 96 г делим на 64 г/моль, получаем 1,5 моль. Найдём по уравнению реакции количество вещества ацетилена, для этого 1,5 умножим на 1 и разделим на 1, будет 1,5 моль. Теперь можно найти и объём ацетилена, для этого необходимо количество вещество умножить на молярный объём. Получается 1,5 моль умножим на 22,4 л/моль, будет 33,6 л. Поэтому, в результате данной реакции образуется 33,6 л ацетилена.

Таким образом, ненасыщенные углеводороды с одной тройной связью (алкины) образуют гомологический ряд общей формулой СnНn-2. Названия ацетилена и его гомологов образуют изменением суффикса –ан на суффикс –ин. Ацэтилен имеет линейное строение и образует угол связи равный 180 0 . Характерными свойствами ацетилена являются реакции присоединения.
Читайте также:

