Классификация неорганических веществ 11 класс конспект
Обновлено: 07.07.2024
Цели урока: обобщить и закрепить знания о классификации неорганических веществ; научить на основании состава молекулы вещества правильно называть вещества; рассмотреть взаимосвязь и взаимообусловленность состава, строения и свойства вещества; дать представление о значении неорганических веществ в повседневной жизни; дать понятие комплексного соединения.
Основные понятия: вещества простые — металлы, неметаллы; сложные — оксиды, кислоты, соли; гидроксиды — основания, гидроксиды — кислоты, амфотерность; двойные и комплексные соли; ион-комплексообразователь, лигатун, внутренняя сфера, внешняя сфера, координационное число.
I. Организационный момент
Учитель анализирует результат выполнения контрольной работы № 3, акцентирует внимание учащихся на ошибках, допущенных в работе, объясняет правильное выполнение некоторых заданий. Предлагает учащимся сделать работу над ошибками и с целью повышения балла предлагает индивидуальные задания.
II. Изучение нового материала
Материал знаком, однако изучался он в 8 и 9 классах. Многое забыто. Необходимо, работая с текстом учебника, § 17, вспомнить состав, классификацию, номенклатуру неорганических веществ.
1. Определение простых и сложных веществ.
2. Классификация простых веществ: металлы и неметаллы. Строение атомов, виды химической связи, типы кристаллических решеток, особенность свойств (составление таблицы).
3. Классификация сложных веществ; оксиды, гидроксиды: кислоты, основания; соли.
4. Характеристика сложного вещества по плану: определение, классификация, номенклатура, строение (химическая связь, кристаллическая решетка), физические свойства, значение в повседневной жизни.
На основании состава все вещества делятся на простые и сложные.
Вспомним определение простых и сложных веществ.
Простые вещества — молекулы состоят из атомов одного вида.
Пример: кислород, сера, азот.
Сложные вещества — молекулы состоят из атомов разного вида.
Пример: вода, оксид углерода (N2), серная кислота и т. д.
Все простые вещества на основании строения атомов, вида химической связи, типа кристаллических решеток, физических и химических свойств делятся на металлы и неметаллы.
Учащиеся в тетрадях составляют таблицу:
Вид химической связи
Строение простых веществ, тип кристаллической решетки
Малое количество электронов на внешнем энергетическом уровне (меньше, чем 3)
Большое количество электронов на внешнем энергетическом уровне (больше, чем 4)
Внешний энергетический уровень завершен (октет электронов или 2 у Не)
Ковалентная полярная связь
Нет связей между атомами
Металлическая кристаллическая решетка
Молекулярная или атомная кристаллические решетки
Молекулярная кристаллическая решетка
Учащиеся рассматривают коллекцию металлов и некоторые неметаллы, которые имеются в кабинете. Вспоминают типы кристаллических решеток, рассматривая их модели и по таблице (атомная, молекулярная, металлическая).
Какова же классификация сложных веществ?
а) оксиды; б) основания; в) кислоты; г) соли.
Обобщающая и более полная классификация неорганических веществ представлена в учебнике § 17 стр. 179, схема 7.
В тетрадях следует, согласно этой классификации сделать записи но следующему плану:
1. Определение класса, общая формула.
2. Классификации; название.
3. Признаки (химическая связь) строения вещества, физические свойства.
4. Значение веществ в повседневной жизни.
Оксиды — сложные вещества, образованные двумя элементами, один из которых — кислород: ЭmОn.
По составу оксиды могут быть образованы металлами: СаО; РbО и неметаллами: СO2; NO2.
По свойствам оксиды бывают солеобразующие и несолеобразующие (также называют безразличными). Солеобразующие делятся на основные, кислотные и амфотерные. Основные оксиды образованы металлами, им соответствуют основания; кислотные оксиды, как правило, образованы неметаллами и металлами в максимальной С.О. Им соответствуют кислоты. Амфотерные оксиды образованы переходными элементами.
Пример: оксид бария — ВаО, основной оксид, т. к. Ва — типичный металл. Оксид серы(IV) — SO2, кислотный оксид, т. к. S — типичный неметалл. Оксид марганиа(VII) Мn2O7 — кислотный оксид, т. к. Мn — металлический элемент в максимальной С.О., оксид алюминия — Аl2O3 — амфотерный оксид, т. к. Al — переходный элемент.
В названии оксида обязательно указывается С.О., если образующий элемент имеет несколько С.О.
Пример: — оксид серы (IV); — оксид серы (VI).
Несолеобразующих оксидов не так и много, их следует запомнить:
СО — оксид углерода(II);
NO — оксид азота(II);
Оксиды, образованные металлами, имеют ионную связь, переходными металлами — ковалентную полярную связь. Кристаллические решетки могут быть ионными и атомными:
оксид бария — ионная кристаллическая решетка;
оксид алюминия — атомная кристаллическая решетка;
минералы: корунд, сапфир, рубин.
Учитель демонстрирует учащимся коллекцию минералов и горных пород, в состав которых входят оксиды: кварц (SiO2), корунд (Аl2O3), асбест (CaO · 3MgO · 4SiO2), тальк (3MgO · 4SiO2 ·H2O); глина: белая, красная: в состав входят оксиды: Аl2O3 · nН2O — белая; боксит Fe2O3 входит в состав красной глины. Руды железа: Fe2O3 — красный железняк, Fe3O4 — магнитный железняк.
В состав воздуха входят: оксид углерода (IV) — СO2, вода — Н2O, вредные примеси, СО — угарный газ, который образуется при неполном сгорании топлива.
Н2O — вода; важнейший минерал Земли; участвует в круговороте веществ;
SiO2 — оксид кремния; входит в состав большинства минералов, встречающихся в природе: кремнезем, тальк, асбест, яшма, горный хрусталь, полевой шпат;
Fe2O3, Fe3O4 — руды для производства чугуна и стали;
СO2 — углекислый газ; круговорот веществ в природе; фотосинтез;
СО — угарный газ, яд; образуется при неполном сгорании топлива.
Всем оксидам соответствуют гидроксиды — соединения, состоящие из трех элементов, два из которых водород и кислород.
В зависимости от характера оксида, образуемый им гидроксид может быть основанием или кислотой. Основным оксидам соответствуют гидроксиды — основания. Пример, ВаО — Ва(ОН)2.
Основания — сложные вещества, состоящие из атомов металла и одной или несколько гидроксогрупп (—ОН):
По растворимости в воде основания бывают хорошо растворимые в воде — щелочи (КОН, NaOH), малорастворимые в воде (Са(ОН)2), нерастворимые в воде (Сu(ОН)2).
Основания имеют ионную связь между металлом и гидроксогруппой, в гидроксогруппе — ковалентная полярная связь. Кристаллическая решетка — ионная, твердая.
Особую группу оснований составляют нерастворимые в воде, которым соответствуют амфотерные оксиды С.О. +2, +3, +4. Такие основания также называются амфотерными. Они проявляют кислотно-основные свойства.
Для них возможны ковалентные полярные связи и молекулярные кристаллические решетки.
Область применения оснований:
Ca(ОН)2 — гидроксид кальция, каменная известь; в смеси с песком известковый раствор, побелка; производство сахарозы;
NН3 · H2О — гидрат аммиака, нашатырный спирт — медицина, аммиачная вода — жидкое азотное удобрение;
Al(ОН)3 — оксид алюминия; медицина — алмагель, препарат, обладающий обволакивающим адсорбирующим действием.
— получение в лаборантки;
Fе(ОН)3 — гидроксид железа (III) — компонент желтого пигмента для красок и эмалей, поглотительная масса для очистки природного газа; катализатор в органическом синтезе.
Кислотным оксидам соответствуют гидроксиды — кислоты.
— общая формула кислот.
— кислотный остаток (acid (англ.) — кислота).
По наличию кислорода в молекуле кислоты бывают кислородосодержащие (H2SО4, HNО3), бескислородные (HCl, H2S); по количеству атомов водорода в молекуле кислоты бывают одноосновные — HCl, HNO3; двухосновные — Н2СO3, H2S; трехосновные — Н3РO4.
Химическая связь между атомами в кислотах ковалентная полярная. Строение веществ — молекулярное.
H2SО4 — серная кислота; производство минеральных удобрений, тлей бескислородных кислот; очистка нефтепродуктов, поверхностей металлов; органический синтез: производство волокон, краски, лаков, лекарственных препаратов; взрывотехника; заливка аккумуляторов;
HNО3 — азотная кислота; производство азотных удобрений, лекарственных препаратов; органический синтез; окислитель ракетного топлива;
Н3РО4 — фосфорная кислота; производство фосфорных удобрений;
НСl — соляная кислота; травление металлов, производство соней, пищевая промышленность, медицина, органический синтез.
Многочисленный класс сложных веществ — это соли.
Соли — сложные вещества, состоящие из катионов металла и анионов кислотного остатка (это общее определение).
Соли бывают: а) средние; б) кислые; в) основные; г) двойные; д) комплексные.
Средние соли образуются при полном замещении атомов водорода в молекуле кислоты на атомы металла или полном замещении гидроксогрупп в молекулах оснований на кислотные остатки:
Кислые соли образуются при неполном замещении атомов водорода в молекулах кислот на атомы металла:
Основные соли образуются при неполном замещении гидроксогрупп в основаниях на кислотные остатки:
Двойные соли и комплексные соли отличаются друг от друга характером диссоциации в водных растворах. Двойные соли диссоциируют в одну ступень на катионы металлов и анионы кислотных остатков.
Комплексные соли при диссоциации образуют сложные комплексные ионы, которые устойчивы в водных растворах. Примера [Cu(NH3)4]SO4 — комплексная соль.
Для классов, имеющих повышенный уровень усвоения учебного материала, следует более подробно рассказать о комплексных соединениях.
Теория строения комплексных соединений разработана А. Вернером (швейцарский химик). Согласно теории А. Вернера, в центре комплексного соединения находится ион-комплексообразователь. Им может быть металл (в основном d-элементы — имеющие свободные орбитали), а также элемент, имеющий неподеленные пары электронов.
Вокруг иона-комплексообразователя находятся противоположно заряженные ионы или нейтральные молекулы, которые называются лигандами (аддендами). Ион-комплексообразователь и лиганды составляют внутреннюю сферу комплексного соединения, которую записывают в квадратные скобки. Число лиганд соответствует координационному числу иона-комплексообразователя. Наиболее характерны:

Заряд внутренней сферы равен сумме зарядов иона-комплексообразователя и лиганд.
Ионы, не вошедшие во внутреннюю сферу, образуют внешнюю сферу.
Классификация комплексных соединений но заряду внутренней сферы:
а) катионные комплексы:
[Cu(NH3)4] 2+ + SO4 2- название составляется, начиная с аниона молекулы; ион-комплексообразователя назван по-русски в родительном падеже:
Сульфат-тетрааммин меди (II)
Na 2+ [Zn(OH)4] -2 — тетрагидроксоцинкат натрия;
в) нейтральные комплексы. Ион-комплексообразователь называем по-русски в именительном падеже: [Fe(CO)5] пента-карбонил-железо.
K +3 [Fe +3 (CN - )6] -3 — анионный комплекс гекса-ционо-феррат (III) калия.
Рассмотреть строение комплексных соединений (как закрепление знании о комплексных соединениях).
Ag + — ион — комплексообразователь;
Сl - — внешняя сфера;
Хлорид диаммин серебра (I).
Значение комплексных соединений в природе огромное. Хлорофилл, гемоглобин — это комплексные соединения живой клетки.
Хлорофилл — комплексное соединение, ионом-комплексообразователем является магний; хлорофилл отвечает за фотосинтез. Гемоглобин — комплексное соединение, ионом-комплексообразователем является железо. Гемоглобин отвечает за газообмен в клетке: снабжает клетку кислородом и удаляет углекислый газ. Витамин В-12 — это комплексное соединение кобальта. Таким образом, от комплексных соединений в живых организмах зависит обмен веществ.
В солях присутствует ионная связь, ковалентная полярная снизь, а в комплексных соединениях между ионом-комплексообразователем и лигандами — связь по донорно-акцепторному механизму.
В повседневной жизни соли имеют огромное значение (демонстрация некоторых солей). В быту NaHCО3 — гидрокарбонат натрия, пищевая сода; СаСО3 — карбонат кальция, мел, известняк, мрамор; стеарат Na, К — твердое и жидкое мыло; КМnO4 — дезинфицирующее средство: минеральные удобрения: азотные NH4NO3 — нитрат аммония, калийные KCl — хлорид калия, фосфорные (NH4)2HPO4 — гидрофосфат аммония.
В промышленности: соли катализаторы АlСl3; FeBr3; биологическое значение: соли NaCl, KCl; Na2HPO4; NaHCO3; CaF2; Са3(РO4)2; малахит (CuOH)2CO3 — минерал.
В конце урока в качестве итога можно предложить самостоятельно без учебника составить схему классификации неорганических веществ.

III. Домашнее задание
§ 17, с. 176—178. Дать названия, распределить согласно классификации:
1. История открытия элемента. Почему так назван? Нахождение в природе, получение.
2. Особенности строения атома. Степени окисления.
3. Особенности физических свойств простых веществ. Химическая связь, кристаллическая решетка.
4. Особенности химических свойств.
5. Важнейшие области применения в чистом виде и в виде соединений.
Библиотека образовательных материалов для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы из сети Интернет, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.

Видеоурок позволяет обобщить знания об основных классах неорганических соединений. Урок содержит примеры веществ различных классов, где указана тривиальная и международная номенклатура.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Классификация неорганических веществ"
Каждый класс веществ образован веществами со сходными свойствами. Эти вещества имеют схожее строение и состав.
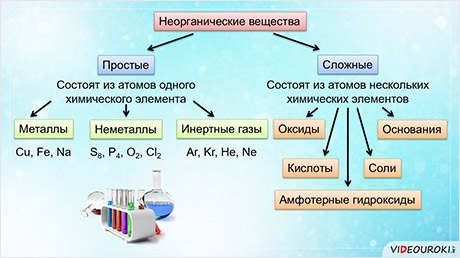
Все неорганические вещества делят на простые и сложные. Простые вещества состоят из атомов одного химического элемента. К простым веществам относятся металлы: медь, железо, натрий и другие; неметаллы: сера, фосфор, кислород, хлор; инэртные, или благородные газы: аргон, криптон, гелий, неон.
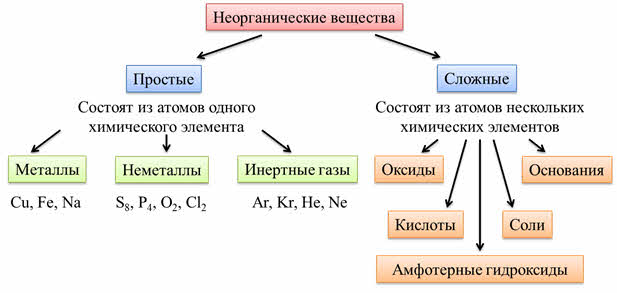
Сложные вещества состоят из атомов нескольких химических элементов. К сложным веществам относятся оксиды, основания, амфотэрные гидроксиды, кислоты и соли.
Оксиды – это сложные вещества, которые состоят из двух химических элементов, один из которых кислород. Общая формула оксидов: э-эм-о-эн, где эм и эн – индэксы. Степень окисления кислорода в оксидах равна минус двум.

Оксиды делят на две группы: солеобразующие и несолеобразующие (индифферентные).
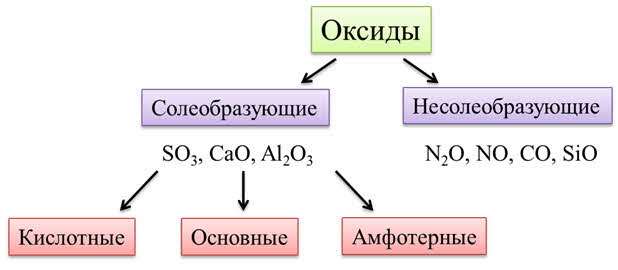
Солеобразующие оксиды образуют гидроксиды и соответствующие соли. Например, к солеобразующим оксидам относятся оксид серы шесть, оксид кальция, оксид алюминия.
Несолеобразующие оксиды не образуют гидроксидов и солей. К таким оксидам относятся: оксид азота один, оксид азота два, оксид углерода два, оксид кремния два.
Оксиды бывают кислотные, амфотэрные и основные. Кислотным оксидам соответствуют кислотные гидроксиды, основным оксидам соответствуют основные гидроксиды.
Например: оксиду натрия соответствует основный гидроксид – гидроксид натрия, в реакции этого гидроксида с соляной кислотой образуется соль – хлорид натрия.
Оксиду алюминия соответствует амфотэрный гидроксид – гидроксид алюминия, этот гидроксид с азотной кислотой образует соль – нитрат алюминия.
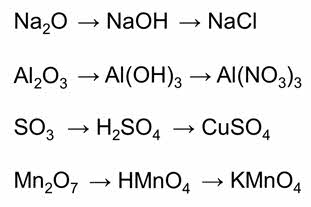
Оксиду серы шесть соответствует кислотный гидроксид – серная кислота, эта кислота с гидроксидом меди два образует соль – сульфат меди два.
Оксиду марганца семь соответствует кислотный гидроксид – марганцовая кислота, которая в реакции с гидроксидом калия образует соль – перманганат калия.
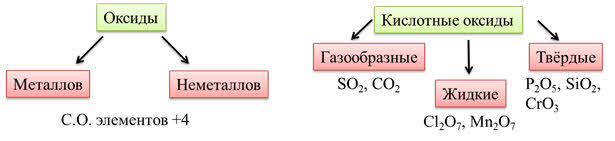
Кислотные оксиды образованы элементами металлами и неметаллами со степенью окисления больше, чем плюс четыре.
Кислотным оксидам соответствуют кислоты: оксиду углерода четыре соответствует угольная кислота, оксиду серы шесть соответствует серная кислота, оксиду фосфора пять соответствует фосфорная кислота.

Для этих оксидов характерен ковалентный характер связи между элементами. В основном у кислотных оксидов молекулярная кристаллическая решётка. Они могут быть газообразными, жидкими и твёрдыми. Например: оксид серы четыре, оксид углерода четыре – газы, оксид хлора семь, оксид марганца семь – жидкости, оксид фосфора пять, оксид кремния четыре, оксид хрома шесть – твёрдые.
Основные оксиды – это оксиды, гидраты которых являются основаниями. Все основные оксиды являются оксидами металлов. Например: оксиду натрия соответствует гидроксид натрия, оксиду кальция соответствует гидроксид кальция, оксиду железа два соответствует гидроксид железа два.

Амфотэрные оксиды – это оксиды, которым соответствуют амфотэрные гидроксиды. Все амфотэрные оксиды являются оксидами металлов. Например: оксид алюминия, оксид хрома три, оксид железа три, оксид свинца четыре, оксид олова четыре. Так оксиду цинка соответствует амфотэрный гидроксид – гидроксид цинка, оксиду алюминия соответствует амфотэрный гидроксид – гидроксид алюминия.

Оксиды широко распространены в природе. Так, большая часть Земли покрыта Мировым океаном, который образован оксидом водорода, в атмосфере содержится оксид углерода четыре; оксид кремния четыре является основой многих минералов и горных пород, таких как кварц, аметист, яшма; оксид алюминия – корунд, известные и его разновидности – рубин и сапфир.

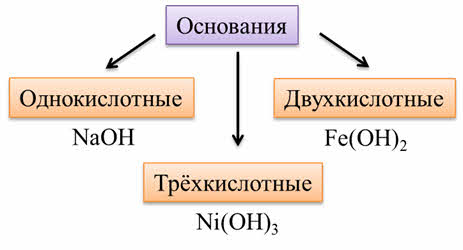
Основания – это сложные вещества, состоящие из катионов металлов и гидроксогруппы. Общая формула оснований – металл –о-аш.

К основаниям относятся: гидроксид натрия, гидроксид кальция, гидроксид железа три, гидроксид калия и другие. Для оснований характерен ионный тип связи, а значит, и ионная кристаллическая решётка, поэтому основания – это твёрдые вещества.
По числу гидроксогрупп различают однокислотные основания (как гидроксид натрия), двухкислотные (как гидроксид железа два), трёхкислотные (как гидроксид никеля три).
По растворимости в воде различают растворимые в воде основания – щёлочи, которые являются сильными основаниями. К ним относятся: гидроксид натрия, гидроксид бария и другие. Нерастворимые в воде основания – это слабые основания. К ним относятся: гидроксид меди два, гидроксид железа два.
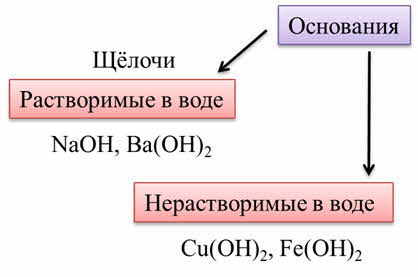
Щёлочи являются твёрдыми веществами.
В реакции сульфата меди два с гидроксидом натрия образуется нерастворимое основание – гидроксид меди два и соль – сульфат натрия.
При добавлении гидроксида натрия к сульфату железа два образуется также нерастворимое основание – гидроксид железа два и соль – хлорид натрия.

Есть основания, где в составе не ионы металла, а катион аммония. Раствор аммиака используют как нашатырный спирт, основания используют для штукатурки стен.

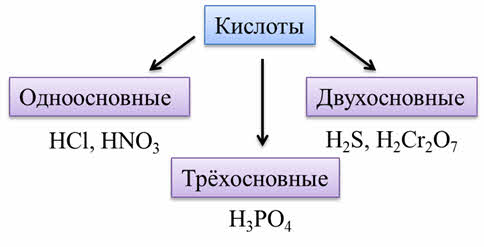
Кислоты – это сложные вещества, которые состоят из атомов металла и кислотных остатков.

Кислоты могут быть образованы не только атомами неметаллов, как соляная кислота, сернистая, азотная кислоты, но и атомами металлов в высшей степени окисления: как например марганцовая кислота.
По количеству атомов водорода (основности) различают одноосновные кислоты (такие как соляная кислота, азотная), двухосновные (такие как сероводородная, дихромовая кислоты), трёхосновные (как фосфорная кислота).
По содержанию атомов кислорода различают кислородсодержащие кислоты (или оксокислоты), как азотная кислота, хромовая кислота, так и бескислородные, как сероводородная, соляная.
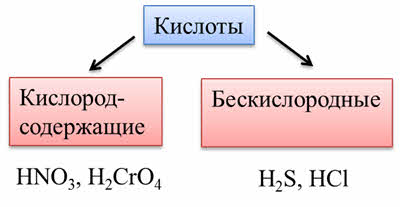
По летучести кислоты бывают летучие, которые легко испаряются или выветриваются из раствора: это такие кислоты, как соляная, бромоводородная, азотная, сероводородная; к нелетучим кислотам относятся серная, фосфорная кислота и другие.
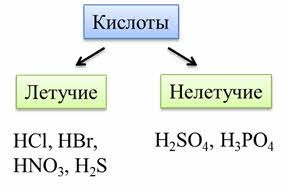
Кислоты бывают сильные и слабые. Сильные кислоты практически полностью диссоциируют на ионы. К таким кислотам относятся: азотная, серная, соляная, хлорная. Слабые кислоты диссоциируют незначительно, к таким кислотам относятся: сернистая, сероводородная, фосфорная кислоты.

К кислотам-окислителям относятся: азотная кислота, серная, то есть в этих кислотах есть элемент-окислитель. К кислотам-неокислителям относится большинство кислот, в которых окислителем является ион водорода.

Для кислот характерен ковалентный тип связи и молекулярная кристаллическая решётка.
При обычных условиях кислоты могут быть в газообразном состоянии: как соляная и сероводородная, в жидком состоянии, как азотная, серная кислоты. Кислоты могут быть и в твёрдом состоянии, как кремниевая кислота.

Амфотэрные гидроксиды – это сложные вещества, имеющие свойства кислот и оснований, поэтому формулы амфотэрных гидроксидов можно записать в форме оснований и в форме кислот.

Их образуют элементы, проявляющие переходные свойства металлов и неметаллов. Эти соединения образуют большинство дэ-элементов со степенью окисления плюс три, плюс четыре, иногда плюс два; эти соединения могут образовывать и пэ-элементы: бериллий, алюминий, олово, свинец.
К амфотэрным гидроксидам относятся гидроксид цинка, гидроксид алюминия, гидроксид железа три, гидроксид бериллия.

Амфотэрные гидроксиды практически нерастворимы в воде. Например, при растворении хлорида железа три с гидроксидом натрия образуется бурый осадок – гидроксид железа три.

При растворении сульфата алюминия с гидроксидом натрия образуется белый осадок – гидроксид алюминия. Полученные гидроксиды являются амфотэрными гидроксидами.

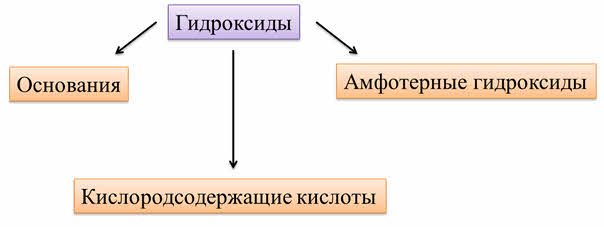
Таким образом, к гидроксидам относятся основания, амфотэрные гидроксиды и кислородсодержащие кислоты.
Соли – это сложные вещества, которые состоят из катионов металла или аммония и кислотных остатков.

Соли бывают средними, кислыми, основными.
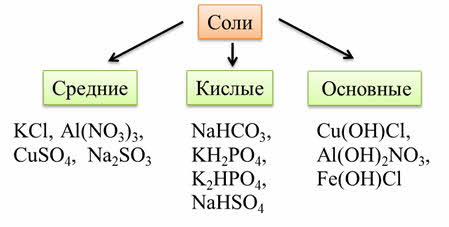
Средние соли – это продукты полного замещения атомов водорода в кислоте атомами металлов: например, хлорид калия, нитрат алюминия, сульфат меди два, сульфит натрия.
Кислые соли – это продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла. Например: гидрокарбонат натрия, дигидрофосфат калия, гидрофосфат калия, гидросульфат натрия.
Основные соли – это продукты неполного замещения гидроксидных групп в молекулах многокислотных оснований кислотными остатками. Например: гидроксохлорид меди два, дигидроксонитрат алюминия, гидроксохлорид железа два.
Для солей характерен ионный характер связи и ионная кристаллическая решётка, поэтому это твёрдые вещества.
Соли применяются в быту: например, перманганат калия используют как дезинфицирующее средство, широко используют алебастр и побелку, при приготовлении пищи используют поваренную соль.

Таким образом, вещества делят на простые и сложные. К простым веществам относятся металлы, неметаллы, инэртные газы. К сложным веществам относятся оксиды, основания, амфотэрные гидроксиды, кислоты и соли.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
План конспект урока
Учителя химии и биологии
МБОУСОШ п. Пионерский
Копыловой Марины Михайловны
Цели урока: Обобщить и систематизировать знания о классах неорганических веществ по их составу строению и свойствам. Рассмотреть взаимосвязь и взаимообусловленность веществ. Показать значение неорганических веществ в повседневной жизни.
Задачи урока:
Развивающие: способствовать развитию навыков составления электронных схем образования химических связей, соединений с ионным типом связи и определения количества электронов в ионах; развитию умений определять типы связи на основании анализа состава химического соединения, развитию интеллектуальных умений и навыков, диалектического мышления, памяти.
Воспитательные: воспитывать положительное отношение к учению, способствовать осознанию роли знаний в развитии личности, воспитании характера, преодолении трудностей
Тип урока: комбинированный ( урок получения новых знаний и актуализации ранее изученного материала)
Формы работы учащихся: фронтальная, индивидуальная, групповая.
Методы: объяснительно-иллюстрированные (рассказ с элементами беседы, демонстрация наглядных пособий), проблемно-поисковый.
Хронометрическая карта урока:
1. Организационный момент (3 мин.)
2. Актуализация и изучение новой темы (15 мин.)
3. Закрепление изученного материала (15 мин.)
4. Рефлексия и подведение итогов (5 мин.)
5. Домашнее задание (2 мин.)
Формулирование темы урока, путем нахождения общего с картинкой.


- Что такое классификация?
- По каким признакам можно классифицировать вещества?
- На какие группы классифицируются вещества по их составу?

- Какие вещества называют простыми, а какие сложные?
-Что относим к простым веществам?

Задание по группам: по плану дайте характеристику простым веществам.

На какие группы делятся сложные вещества?

-Работа в группах: По плану дайте характеристику сложным веществам?

После окончания работы заслушиваем ответы представителей от каждой группы.
Ищут общее между темой урока и картинкой.
Неорганическая химия - раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:

Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO - соответствует основанию Cu(OH)2
- Li2O - соответствует основанию LiOH
- FeO - соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 - соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 - соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
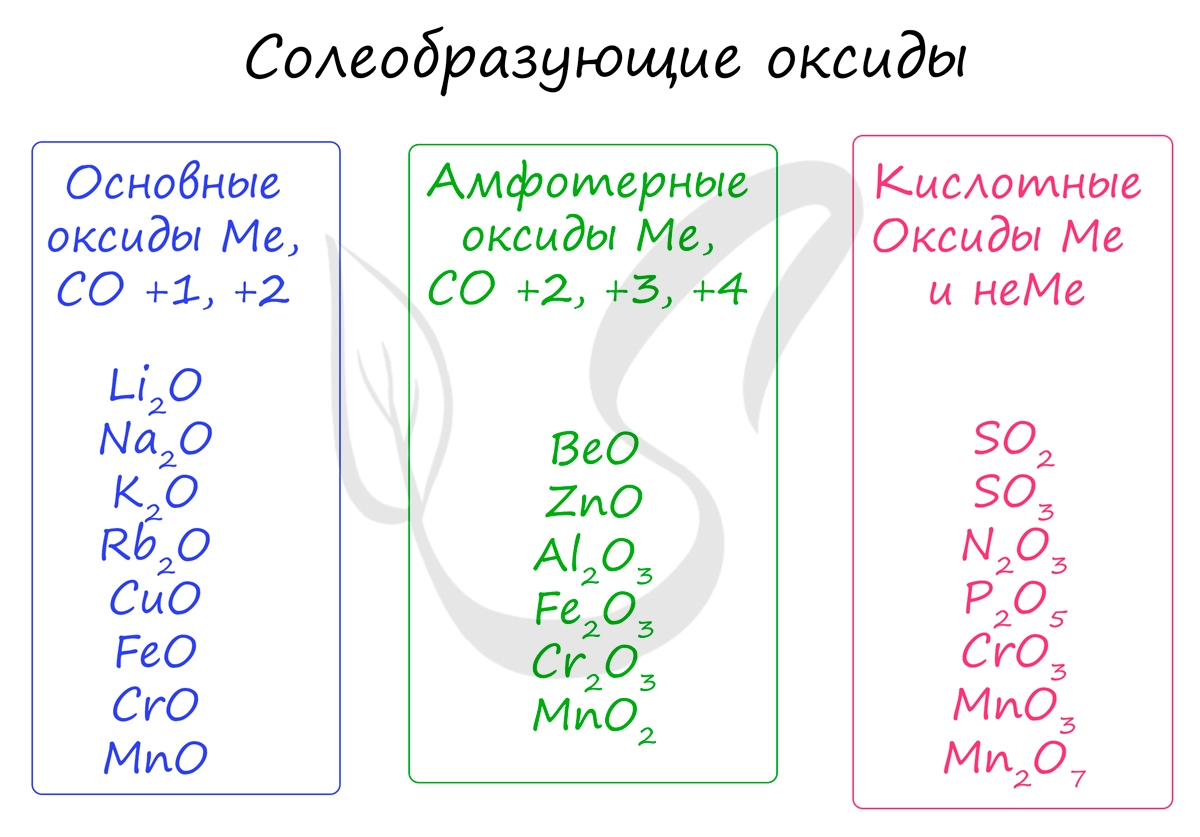
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)

Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
- SO2 - H2SO3
- SO3 - H2SO4
- P2O5 - H3PO4
- N2O5 - HNO3
- NO2 - HNO2, HNO3
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 - не реагирует с водой, так как продукт реакции - H2SiO3 является нерастворимой кислотой.

- CO
- N2O
- NO
- SiO
- S2O
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)

Основания
Основания - химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов. Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр - NaOH, едкое кали - KOH.

Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.

Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода - реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.

Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами - с образованием соли и воды, так и с основаниями - с образованием комплексных солей.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода - при высоких температурах вода испаряется, и комплексная соль образоваться не может)

Кислоты
Кислота - химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации кислоты подразделяются на одно-, двух- и трехосновные.
Основность кислоты определяется числом атомов водорода, которое способна отдать молекула кислоты, реагируя с основанием. Определять основность кислоты по числу атомов водорода в ней - часто верный способ, но не всегда: например, борная кислота H3BO3 является слабой одноосновной кислотой, фосфористая кислота H3PO3 - двухосновной кислотой.

Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода - реакция нейтрализации)
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Записать эти кислоты в растворе в виде "H2CO3 или H2SO3" - будет считаться ошибкой. Пишите угольную и сернистую кислоты в разложившемся виде - виде газа и воды.

Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной - серную кислоту. Природу не обманешь :)
K2S + HCl → H2S + KCl (из сильной - соляной кислоты - получили более слабую - сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной - серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными гидроксидами, например серная кислота - H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
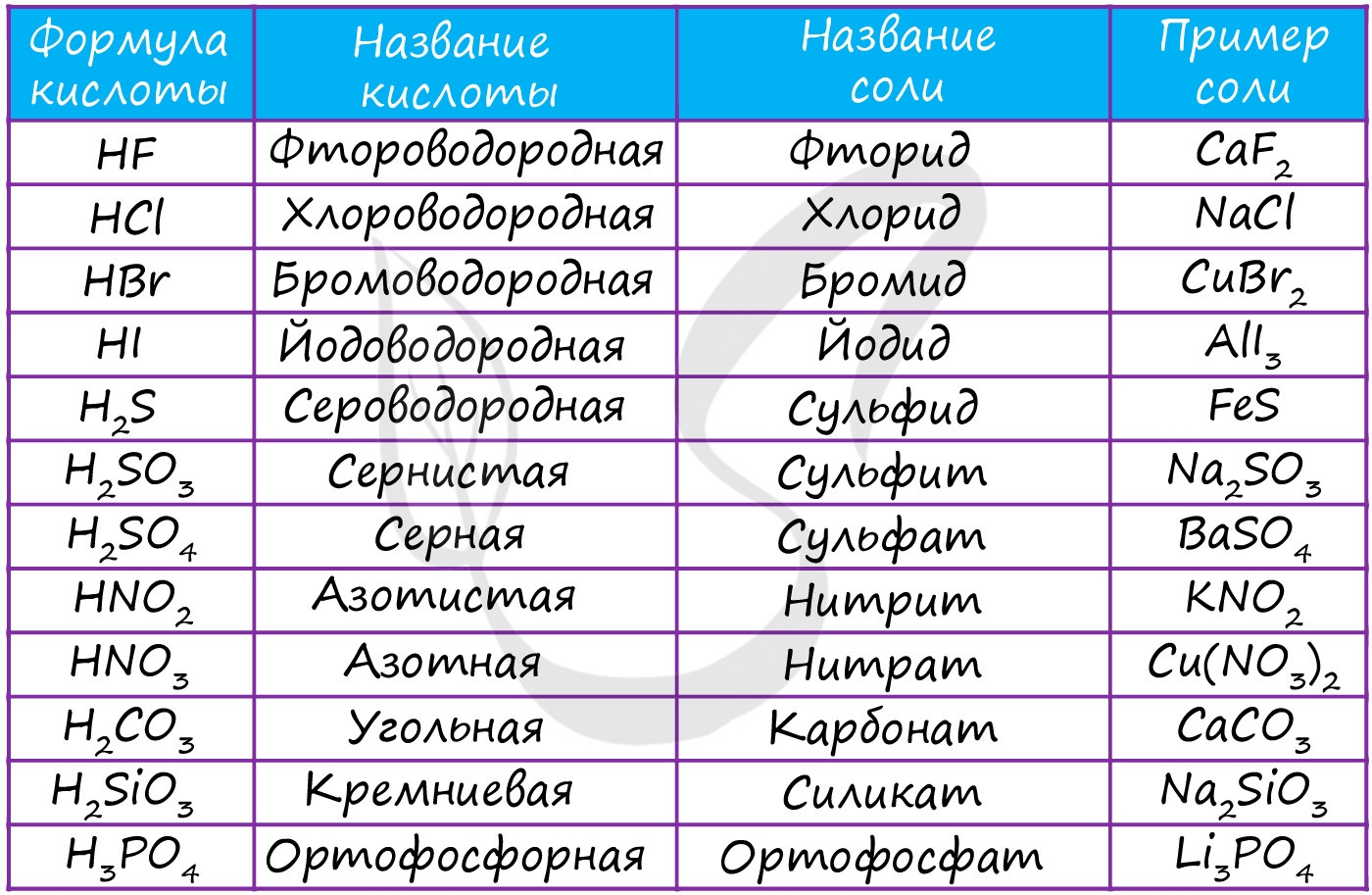
Соль - ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль - NaCl.
- Средние - продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые - продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат лития, дигидрофосфат и гидрофосфат натрия)
- Основные - продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные - содержат два разных металла и один кислотный остаток (NaCr(SO4)2
Читайте также:

