Кислородсодержащие кислоты конспект урока
Обновлено: 05.07.2024
Кислоты – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид катионов – катионы водорода Н + (точнее – катионы гидроксония H3O + ):
НCl = Н + + Cl – (НCl + H2O = H3O + + Cl – )
HNO3 = Н + + NO3 – (HNO3 + H2O = H3O + + NO3 – )
Кислоты – вещества молекулярного строения. Атомы в молекулах кислот связаны ковалентными полярными химическими связями. Чем более поляризована связь между атомом водорода, способным отщепляться в виде катиона водорода, и атомом какого–либо другого элемента, тем легче происходит её распад с образованием ионов, тем сильнее кислота.
Классифицировать кислоты можно по разным признакам.
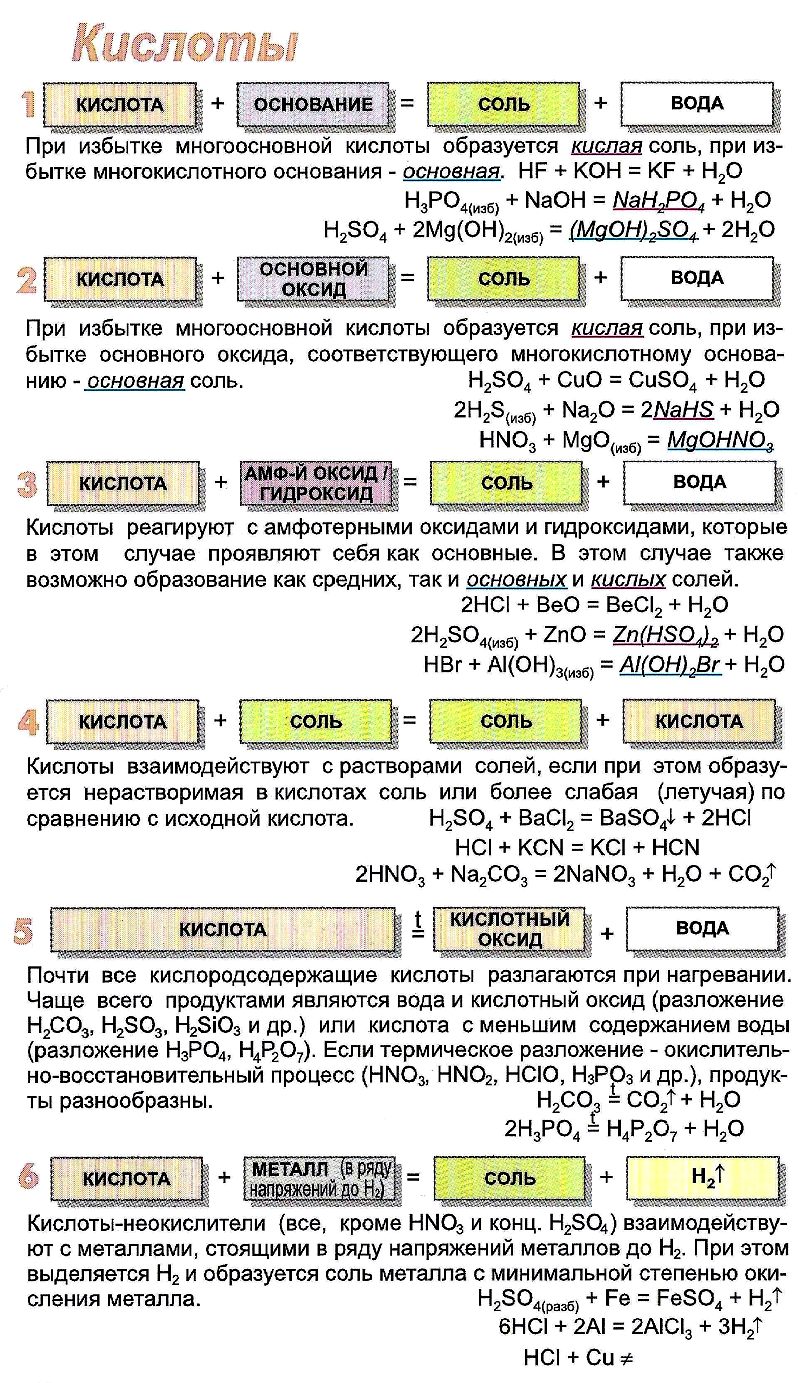
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
- Кислоты реагируют с металлами. Металлы, расположенные в электрохимическом ряду напряжений металлов до водорода H2, вытесняют водород из растворов кислот. Происходит реакция замещения, образуется соль и водород:
Металлы, расположенные в ряду напряжений после водорода, с кислотами не реагируют.
Важное примечание: с серной концентрированной кислотой и с азотной кислотой любой концентрации реакции идут за счёт аниона кислотного остатка, водород в этих случаях не выделяется:
Cu+ 4HNO3 (конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
Cu+ 2H2SO4 (конц.) = CuSO4 + SO2↑ + 2H2O
- Киcлоты реагируют с основными и амфотерными оксидами с образованием соли и воды:
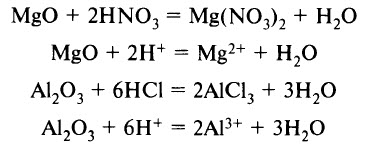
- Кислoты реагируют с основаниями и с амфотерными гидроксидами с образованием соли и воды:

(Взаимодействие сильных кислот с сильными основаниями – реакция нейтрализации.)
Al(ОН)3 + 3НCl = AlCl3 + 3H2O
Al(ОН)3 + 3Н + = Al 3+ + 3H2O
(Реакция амфотерного гидроксида с сильной кислотой.)
- Сильные кислоты реагируют с солями слабых кислот. Слабые кислоты при этом могут быть вытеснены из солей. Например, сильная соляная кислота НCl вытесняет слабую сероводородную кислоту H2S:
FeS + 2НCl = FeCl2 + H2S↑
FeS + 2Н + = H2S↑ + Fe 2+

Нелетучие кислоты могут вытеснить летучую из её соли. Например, нелетучая серная кислота H2SO4 вытесняет более летучую азотную HNO3. Обе кислоты – сильные. В растворе такая реакция не происходит. Она осуществима, если соль находится в кристаллическом виде (не в растворе), а серная кислота концентрированная:
Аналогично можно получить газообразный хлороводород, раствор которого – соляная кислота.
- Кислoты можно обнаружить индикаторами. Индикаторы реагируют на наличие в растворе ионов Н + (H3O + ). Лакмус в кислой среде приобретает красный цвет, метиловый оранжевый – красный, фенолфталеин – бесцветный. Для обнаружения кислот удобно использовать лакмус.
ПОЛУЧЕНИЕ КИСЛОТ

Бескислородные кислоты, состоящие из двух элементов, могут быть получены синтезом простых веществ:
Кислородсодержащие кислоты могут быть получены в результате взаимодействия с водой соответствующих кислотных оксидов:
Р2O5 + 3H2O = 2H3РO4
SO3 + H2O = H2SO4
Слабые или летучие киcлoты могут быть вытеснены из солей более сильными или менее летучими кислотами. Например, сильная соляная кислота НCl вытесняет слабую уксусную кислоту СH3СООН:
CH3COONa + НCl = СH3СООН + NaCl
СH3СОО – + Н + = СH3СООН

Летучие киcлoты могут быть вытеснены из солей менее летучими кислотами. Например, нелетучая серная кислота H2SO4 может вытеснить более летучую соляную НCl. Но в растворе такая реакция не пойдёт (обе киcлoты сильные). Она осуществима, если соль в кристаллическом состоянии (не в растворе) обработать серной концентрированной кислотой:
В результате этой реакции образуется газообразный хлороводород, при растворении которого в воде образуется соляная кислота.
Для получения слабых нелетучих кислот (например, ортофосфорной киcлоты или сернистой кислoты) лучше воспользоваться концентрированной серной кислотой, причём образующаяся сернистая кислота H2SO3 разлагается на сернистый газ SO2 и воду:
Са3(РO4)2 (тв.) + 3H2SO4 (конц.) = 3CaSO4 + 2H3РO4
Na2SO3 (тв.) + H2SO4 (конц.) = Na2SO4 + SO2↑ + H2O
Дополнительные материалы (схемы, таблицы)


Урок в 11 классе по теме "Оксилы и кислородсодержащие кислоты неметаллов". Представлена презентация и конспект урока. В разработку входит свойства, и получение кислотных оксидов и кислот.
| Вложение | Размер |
|---|---|
| конспект урока в 11 классе оксиды неметаллов и кислородсодержащие кислоты | 23.18 КБ |
| презентация | 1.29 МБ |
Предварительный просмотр:
22.03.2018 11 класс
Тема: Оксиды неметаллов и кислородсодержащие кислоты.
Образовательные- углубить, систематизировать, обобщить знания учащихся об оксидах неметаллов и соответствующих им кислородсодержащих кислотах.
Развивающие - развивать логическое мышление учащихся, умение анализировать, обобщать, делать выводы, правильно и последовательно излагать свои мысли.
Воспитывающие - содействовать повышению уровня мотивации на уроках через средства обучения;
Тип урока: урок обобщение и систематизация знаний
I . Организационный момент.
Я желаю вам настроиться на плодотворную, успешную работу сегодня на уроке.
II. Актуализация опорных знаний
Их получают путем горения,
Или разложением сложных веществ
В них два элемента, один-кислород,
Я отнесу к ним и известь и лед
Что такое оксиды? К какой группе относятся оксиды неметаллов?
Дайте определения кислотным, основным и амфотерным оксидам, подтвердите схему примерами формул соответствующих оксидов. Для этого запишите правильно формулы оксидов: оксид серы6, оксид азота4, оксид магния, оксид натрия, оксид фосфора5,оксид кремния, оксид углерода4, оксид хрома6, оксид цинк.
III .Изучение новой темы.
Общая характеристика оксидов неметаллов.
Задание: Даны формулы кислотных оксидов:
А) N 2 O 5 CO 2 Cl 2 O 7 SO 3
Б)P 2 O 5 As 2 O 5 N 2 O 5 Sb 2 O 5
Расположите эти формулы в порядке усиления кислотных свойств оксидов. Объясните, какие закономерности наблюдаются в изменении кислотных свойств оксидов в периодах и группах.
3.2.Окислительные свойства серной и азотной кислоты.
Работа с текстом учебника, схемами (стр132):
Сравните химические свойства серной и азотной кислот. Допишите схемы реакций, объясните их в свете представлений об ОВР.
Ме + HNO 3 конц. → соль + NO 2 ↑ + H 2 O
Ме + HNO 3 разб. → соль + NO↑ + H 2 O
А) Hq + H 2 SO 4 конц . → Б) Hq + HNO 3 конц.→ В) Hq + HNO 3 разб.→
IV. Первичный контроль
Выполните тестовые задания ( с взаимопроверкой по ключу)
Часть 1 ( с выбором одного ответа, по 1 б. за каждый правильный ответ)
1. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1) вода и соляная кислота
2) кислород и оксид магния
3) вода и медь
4) оксид кальция и гидроксид натрия
2. Способны взаимодействовать между собой
1) SiO 2 и Н 2 О 2) СО 2 и H 2 SO 4 3) CO 2 и Са(ОН) 2 4) Na 2 O и Са(ОН) 2
3. Ни с водой, ни с раствором гидроксида натрия не реагирует
1) SiО 2 2) SO 3 3) ВаО 4) NО
4. Реагирует с гидроксидом натрия и оксидом бария, а с водой нет
1) CO 2 2) SO 3 3) SiО 2 4) SO 2
5. Верны ли следующие суждения?
А). В А-группах сверху вниз кислотные свойства высших оксидов неметаллов усиливаются.
Б). В периодах слева направо свойства высших оксидов постепенно изменяются от основных к кислотным.
1) верно только А 3) верны оба суждения
2) верно только Б 4) оба суждения неверны
6. Сумма коэффициентов в уравнении реакции между серебром и разбавленной азотной кислотой :
1) 6 2) 10 3) 13 4) 18
Часть 2 ( за правильный ответ -3 б., если есть одна ошибка – 1 б., 2 и более ошибки – 0 б.)
7. Установите соответствие между реагентами и продуктами реакций
1) Zn + HNO3 конц.→ А) Zn (NO3)2 + NO2↑ + H 2 O
2) Zn + HNO3 разб.→ Б) ) Zn (NO3)2 + H 2 ↑
3) ZnO + HNO3 → В) Zn (NO3)2 + NO↑ + H 2 O
4) Zn(NO 3 ) 2 → Г) ZnO + NO2↑ + H 2 O
Д) Zn (NO3)2 + H 2 O
Ключ к взаимопроверке:
1 – А; 2 – В; 3 – Д; 4 - Г
Система перевода первичного балла в отметку:
V. Домашнее задание:
1) проработать §38, 39; используя электронное приложение к учебнику, выполните тесты к §38
2) Для тех, кто сдаёт ЕГЭ: выполните 1-2 задания на выбор: упр. 3 стр. 183; задачи № 5,6 стр. 179;
3) Творческие задания:
Я могу… Я умею… Я пока затрудняюсь… Мне ещё необходимо…
Всем спасибо за урок!
Предварительный просмотр:
Подписи к слайдам:
Р Е Б У С Ы Й О Д К Р Е М Н И Й
А З О Т У Г Л Е Р О Д
Их получают путем горения, Или разложением сложных веществ В них два элемента, один-кислород, Я отнесу к ним и известь и лед Отгадайте загадку
Тема урока: Оксиды и кислородсодержащие кислоты неметаллов Урок в 11 классе у читель химии Сат А.А.
SO CrO CO MgO NO ZnO SiO PO Оксиды неметаллов IV IV II V IV IV III II Составить формулы оксидов. Определить класс оксидов. NaO I
Закономерности изменения свойств оксидов по периоду Na Mg Al Si P S Cl С войства высших оксидов постепенно изменяются от основных к кислотным. Na 2 O MgO Al 2 O 3 SiO 2 P 2 O 5 SO 3 Cl 2 O 7 Na OH Mg(OH) 2 Al ( OH) 3 H 2 SiO 3 H 3 PO 4 H 2 SO 4 HClO 4
Закономерности изменения свойств оксидов по группе N- неМе N 2 O 5 HNO 3 P - неМе P 2 O 5 H 3 PO 4 As - Ме As 2 O 5 H 3 AsO 4 Sb - Ме Sb 2 O 5 H[ Sb (OH) 6 ] Bi - МЕ Bi 2 O 5 HBiO 5 По группе сверху вниз кислотные свойства высших оксидов постепенно ослабевают
А ) N 2 O 5 CO 2 Cl 2 O 7 SO 3 Б )P 2 O 5 As 2 O 5 N 2 O 5 Sb 2 O 5 Расположите эти формулы в порядке усиления кислотных свойств оксидов А) CO 2 N 2 O 5 SO 3 Cl 2 O 7 Б ) Sb 2 O 5 As 2 O 5 P 2 O 5 N 2 O 5
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ Реагируют с основаниями Реагируют с основными оксидами С водой С некоторыми солями Заполните пустые места: СО 2 +…..= СаСО 3 +Н 2 О CaO + …. = CaSiO 3 3. …. + SO 2 =H 2 SO 3 4. СаСО 3 + …. = CaSiO 3 + СО 2
СО 2 +Са(ОН) 2 =СаСО 3 +Н 2 О CaO+SiO 2 =CaSiO 3 3. H 2 O+SO 2 =H 2 SO 3 4. СаСО 3 + SiO 2 =CaSiO 3 + СО 2
Свойства кислородсодержащих кислот рассмотрим на примере с ерной и азотной кислот. H 2 SO 4 HNO 3 Конц . Разб . Конц . Разб . Восс-ся металлами (стоящими после Н) до SO 2 , с активными металлами до S и Н2 S с металлами стоящими до Н, выделяется Н 2 Независимо от активности металла выделяется NO 2 Взаимодействует с металлами по-разному в зависимости от разбавления 3Zn+4H 2 SO 4 = 3ZnSO 4 +S+4H 2 o Zn+H 2 SO 4 = ZnSO 4 +H 2 Mg+4HNO 3 =Mg(NO 3 ) 2 + 2NO 2 + H 2 O 3Mg+8HNO 3 =3Mg(NO 3 ) 2 + 2NO +4 H 2 O
1 2 3 4 5 6 7 4 3 4 3 2 3 1 – А; 2 – В; 3 – Д; 4 – Г;
Х И М И Я О С Н О В А Н И Я Х Л О Р С О Л И О К С И Д Ы Ц И Н К К И С Л О Т Ы 1 2 3 4 5 6 7
Домашнее задание: 1) Проработать с §38, 39; выполните тесты к § 38 стр.138 2) Для тех, кто сдаёт ЕГЭ: выполните 1-2 задания на выбор: упр. 13 стр. 138; задача № 1 стр. 138;
По теме: методические разработки, презентации и конспекты

Кислородные соединения неметаллов (кислоты) 10 класс
Презентация к уроку "Кислородные соединения неметаллов (кислоты)" 10 класс учебник И.И.Новошинского.

Кислородсодержащие углеводороды. Альдегиды и карбоновые кислоты.
В презентации рассмотрены основные теоретические вопросы по темам Альдегиды, Карбоновые кислоты. Для закрепления материала ученикам предлагаются задания, ссылки на видеофрагменты химических опытов, пр.

Взаимодействие неметаллов со щелочами и кислотами-окислителями
Представляю Вашему вниманию сводную таблицу, помогающую при подготовке к ЕГЭ-ОГЭ.
Тест по теме «Кислородсодержащие вещества: спирты, альдегиды, карбоновые кислоты, эфиры.
Тест составлен в соответствии с контрольно-измерительными материалами ЕГЭ.
Методическая разработка теоретического занятия "Водородные соединения неметаллов. Оксиды. Кислоты органические и неорганические"
Предлагаемая методическая разработка предназначене для учащихся 11 - класса, а также для студентов I курса медицинских колледжей.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Тема: Общая характеристика оксидов неметаллов и кислородсодержащих кислот.
Демонстрации. Образцы оксидов неметаллов и кислородсодержащих кислот
Лабораторные опыты № 5,6,7. Распознавание хлоридов, сульфатов, карбонатов.
Цель: углубить, систематизировать, обобщить знания учащихся об оксидах неметаллов и соответствующих им кислородсодержащих кислотах.
Развивать логическое мышление учащихся, умение анализировать, обобщать, делать выводы, правильно и последовательно излагать свои мысли.
I. Организационный момент.
Притча о сверчке
Как-то раз я шел со своим другом по людной улице Москвы, и он внезапно воскликнул:
– “ Я слышу сверчка”.
– “ Да ты с ума сошел”, – ответил я, окинув взором переполненную в час пик центральную улицу города. Повсюду сновали автомобили, работали строители, над головой летали самолеты.
– “ Но, я правда слышу сверчка”, – настаивал он, двигаясь к цветочной клумбе, разбитой перед причудливым зданием какого-то учреждения. Потом нагнулся, раздвинул листья растений и показал мне сверчка, беспечно стрекочущего и радующегося жизни.
– “ Удивительно”, – отозвался я. – “У тебя, должно быть, фантастический слух”.
– “ Да, нет. Все зависит от того, на что ты настроен”, сказал он.
Я желаю вам настроиться на плодотворную, успешную работу сегодня на уроке.
II . Актуализация опорных знаний
Что такое оксиды? К какой группе относятся оксиды неметаллов?
Дайте определения кислотным, основным и амфотерным оксидам, подтвердите схему примерами формул соответствующих оксидов.

III .Изучение новой темы.
3.1. Общая характеристика оксидов неметаллов.
Демонстрации. Образцы оксидов неметаллов и кислородсодержащих кислот
Работа в группах:
Задание 1 группе:
Даны формулы кислотных оксидов:
Расположите эти формулы в порядке усиления кислотных свойств оксидов. Объясните, какие закономерности наблюдаются в изменении кислотных свойств оксидов в периодах и группах?
Задание 2 группе:
Как доказать, что нерастворимый в воде оксид кремния ( IV ), принадлежит к числу кислотных оксидов? Составьте соответствующие уравнения реакций.
3.2.Окислительные свойства серной и азотной кислоты.
Работа с текстом учебника, схемами (Работа в парах):
Сравните химические свойства серной и азотной кислот. Допишите схемы реакций, объясните их в свете представлений об ОВР.
Ме + HNO 3 конц. → соль + NO 2 ↑ + H 2 O
Ме + HNO 3 разб. → соль + NO ↑ + H 2 O
А) Hq + H 2 SO 4 конц . → Б) Hq + HNO 3 конц.→ В) Hq + HNO 3 разб.→
IV . Первичный контроль
Выполните тестовые задания ( с взаимопроверкой по ключу)
Часть 1 ( с выбором одного ответа, по 1 б. за каждый правильный ответ)
1. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1) вода и соляная кислота
2) кислород и оксид магния
3) вода и медь
4) оксид кальция и гидроксид натрия
2. Способны взаимодействовать между собой
3. Ни с водой, ни с раствором гидроксида натрия не реагирует
1) SiО 2 2) SO 3 3) ВаО 4) NО
4. Реагирует с гидроксидом натрия и оксидом бария, а с водой нет
5. Верны ли следующие суждения?
А). В А-группах сверху вниз кислотные свойства высших оксидов неметаллов усиливаются.
Б). В периодах слева направо свойства высших оксидов постепенно изменяются от основных к кислотным.
1) верно только А 3) верны оба суждения
2) верно только Б 4) оба суждения неверны
6. Сумма коэффициентов в уравнении реакции между серебром и разбавленной азотной кислотой :
1) 6 2) 10 3) 13 4) 18
Часть 2 ( за правильный ответ -3 б., если есть одна ошибка – 1 б., 2 и более ошибки – 0 б.)
7. Установите соответствие между реагентами и продуктами реакций
1) Zn + HNO3 конц .→ А ) Zn (NO3)2 + NO2↑ + H 2 O
2) Zn + HNO3 разб .→ Б ) ) Zn (NO3)2 + H 2 ↑
3) ZnO + HNO3 → В ) Zn (NO3)2 + NO↑ + H 2 O
4) Zn(NO 3 ) 2 → Г ) ZnO + NO2↑ + H 2 O






Учитель: Значит, сегодня речь пойдёт? (о кислотах).
Мы сказали, что будем говорить о кислотах.
Почему же на доске написаны эти соединения? Что это за вещества?
Какое отношение они имеют к кислотам?
Ученик: Потому что при добавлении воды к оксидам неметаллов (кислотным) образуются кислоты) (H2CO3 HNO3 H2SO4 H2SO3 H3PO4)
Учитель: Что общего между ними? (наличие в кислотном остатке кислорода – кислородсодержащие кислоты)
Итак, тема урока: Кислородосодержащие кислоты
Учитель: Какую группу кислот мы должны добавить для полного рассмотрения этой темы? (карбоновые кислоты - муравьиная кислота, уксусная кислота, дописать формулы на доске)
Учитель. Какова цель урока?
Ученик: Обобщить знания о кислородосодержащих кислотах
Для этого вспомнить определение кислот
Кислоты – это сложные вещества, имеющие в своем составе водород, способный замещаться на металл.
- с точки зрения ТЭД
^ Кислоты – электролиты, которые при диссоциации образуют катионы только одного типа – гидратированные ионы водорода.
Задание : составить диссоциацию кислот, написанных на доске
Учитель: Как доказать это экспериментальным путём?
( помощью индикаторов + универсальный индикатор) Какая рН среды в кислотах?)
Учитель: Рассмотрите таблицы по классификации кислот у вас на столах. По каким признакам можно классифицировать все кислоты? (ответы учащихся)
Классифицировать кислоты по всем предложенным признакам
Тренажёр классификация кислот
3) Изменение свойств кислот
Учитель: Почему сила кислот отличается? С чем это связано? Что должны сравнить в этих двух кислотах? (степени окисления)
Степени окисления увеличиваются, =>кислотный характер возрастает
Как изменяются свойства кислот в периоде?
Степень окисления увеличивается => радиус иона уменьшается, => кислотные свойства увеличиваются
Как изменяются свойства кислот в группах?
Степень окисления не изменяется, радиус иона возрастает, => кислотные свойства уменьшаются
4).Вспомните физические свойства кислот (неорганических и органических) Какое свойство кислот положено в основу их названия?
Обращаем внимание на запахи кислот: неприятные, действуют на организм человека неблагоприятно, вызывают повышение давления. Приятные запахи. наоборот понижают давление, тонизируют нервную систему, повышают концентрацию внимания, снимают головную боль и усталость.
5) Химические свойства
Учитель: С чем могут взаимодействовать кислоты (с металлами, основными оксидами, щелочами, солями более слабых кислот)
Вариант 2 Лабораторная работа «Химические свойства уксусной кислоты
Сделайте выводы об общих химических свойствах кислот
Мы рассмотрели общие свойства неорганических и органических кислот. Наряду с этим отдельные представители минеральных и органических кислот имеют особые свойства.
на компьютерах выполнение тестирования
Уравнения реакций, характеризующие химические свойства кислот
Общие химические свойства кислот
или индивидуальная работа учащихся по карточкам. Укажите, с каким из перечисленных веществ взаимодействует раствор соляной кислоты HCI Ag, AgNO3 CaO, Cu, CuO, F, H2SO4, Na2CO3, SO3 Zn, Zn(OH)2,
Укажите, с какими из перечисленных веществ реагирует раствор уксусной кислоты CH3COOH
Ag CI2 CO2 C5H5OH Fe2O3 CHI KOH. Допишите уравнения, характеризующие свойства кислот, расставьте недостающие коэффициенты.
Читайте также:

