Изотермы реального газа конспект
Обновлено: 05.07.2024
Для исследования поведения реального газа рассмотрим изотермы Ван-дер-Ваальса – кривые зависимости от при заданных температурах Т, определяемые уравнением Ван-дер-Ваальса для 1 моля газа (рис. 9.2). Эти кривые рассматриваются для четырёх различных температур. При высоких температурах изотерма реального газа отличается от изотермы идеального газа только некоторым искажением её формы, оставаясь монотонно спадающей кривой. При некоторой температуре на изотерме имеется точка перегиба К. Эта изотерма называется критической, соответствующая ей температура – критической температурой, а точка К – критической точкой. Состояние с критическими параметрами называется критическим состоянием.
При температурах изотермы имеют волнообразный участок. У реальных изотерм такого завитка нет, вместо него у них имеется прямолинейный горизонтальный участок (на рис. 9.2 обозначены пунктиром). Если через крайние точки горизонтальных участков семейства изотерм провести линию, то получится колоколообразная кривая, ограничивающая область двухфазных состояний вещества. Эта кривая и критическая изотерма делят диаграмму P, V под изотермой на три области: под колоколообразной кривой располагается область двухфазных состояний (жидкость и насыщенный пар Ж+П), слева от неё находится область жидкого состояния (Ж), а справа – область пара (П). Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает процесс сжижения. Газ же при температуре выше критической не может быть превращён в жидкость ни при каком давлении.
2. Метастабильные состояния (греч. meta – после, за, в данном случае за стабильным состоянием, неустойчивые состояния).
Рассмотрим часть изотермы рис. 9.3. Состояния на участке 2-3 не реализуются, т.к. на нём , т.е. увеличение объёма газа сопровождалось бы не уменьшением, а ростом давления – совершенно противоестественное свойство. На участках 1-2 и 3-4 , это нормально, но оказывается, что эти состояния не вполне устойчивы. Достаточно в состоянии А попадание в пар пылинки, чтобы вещество распалось на две фазы и перешло в состояние В. (Напомним, что фазой называется однородная, одинаковая по свойствам часть системы. Например, в закрытом сосуде вода и смесь воздуха и паров воды. Пар, находящийся вравновесии со своей жидкостью называетсянасыщенным.
| Давление, при котором наблюдается равновесие, называется давлением насыщенного пара ). Состояния, подобные состоянию А (неустойчивые) называются метастабильными. Состояние 1-2, где давление меньше при данной температуре называется перегретой жидкостью, а 3-4 |
| Рис. 9.3 |
Рассмотрим перегретую жидкость. Если жидкость тщательно очистить от твёрдых включений, то путём нагревания или понижения давления до её можно перевести в состояние перегрева. Прохождение заряженной частицы приводит к образованию вдоль следа частицы зародышевых центров кипения. Пузырьки фотографируют.
Критическое состояние
Рассмотрим подробнее состояние в т. К (рис. 9.2.). В этой точке различие в плотностях жидкости и насыщенного пара полностью исчезает. Одновременно исчезает всякое различие между жидкостью и паром. Границы раздела между жидкостью и паром также нет. Первая и вторая производные давления по объёму равны нулю.
3. Внутренняя энергия реального газа. Кроме кинетической энергии включает потенциальную энергию взаимодействия молекул газа. Работа, совершаемая при расширении газа против сил взаимного притяжения молекул друг к другу, равна приращению энергии взаимодействия . Ван-дер-Ваальса поправка к давлению . Тогда работа , отсюда потенциальная энергия
При реальный газ стремится к идеальному и тогда :
Ранее для кинетической энергии хаотического теплового движения молекул было получено: .
Внутренняя энергия реального газа, учитывающая и кинетическую и потенциальную энергии:
То есть внутренняя энергия моля Ван-дер-Ваальского газа есть функция состояния газа.
4. Эффект Джоуля-Томсона
 | перемещении поршня (П) образуется постоянный перепад давлений ( ). Различают а) положительный эффект для Т, когда температура реального газа понижается и б) отрицательный эффект, когда (для идеального газа T=const). Практический интерес представляет положительный эффект. Положительный эффект наблюдается в области давлений, где преобладают силыпритяжения |
| Рис. 9.4 |
между молекулами. При расширении молекулы газа совершают работу против сил притяжения и температура уменьшается. При этом кинетическая энергия теплового движения газа расходуется на работу против сил молекулярного притяжения.
Изменение температуры может быть значительным. Например, воздух, расширяясь при комнатной температуре от давления 200 атм до давления 1 атм охлаждается примерно на 40 .
Процесс используется в технике для сжижения газов. На эффекте Джоуля – Томсона основана работа так называемой машины Линде.
Сжижение газов и получение низких температур
Газ может быть превращён в жидкое состояние, если его температура ниже критической и ниже температуры кипения при данном давлении.
Машина Линде (немецкий учёный) (Рис. 9.5)
Атмосферный воздух сжимается компрессором (К) до давления 220 атм. Сжатый воздух проходит по трубопроводу и охлаждается проточной водой до 10 15 . Далее воздух поступает во внутренний канал
 | змеевика откуда в резервуар (Р), где давление 20 атм. При этом воздух охлаждается на 50 .(Расширение происходит в области положительного эффекта Джоуля – Томсона). Охлаждённый воздух по наружному каналу змеевика отводится к компрессору, охлаждая следующие порции воздуха, идущие по внутреннему каналу и т.д. При температуре 180 и давлением 20 атм. начинается конденсация воздуха. Жидкий воздух стекает в резервуар. |
| Турбодетандер Капицы (русский учёный, лауреат Нобелевской премии, 1894 – 1984). Газ, сжатый компрессором (К) до давления 6-7 атм, поступает в турбину (Т), расширяется до давления 1,3 атм., совершает работу, охлаждается, далее охлаждает газ, поступающий в компрессор, циркулирует и т.д., и, наконец, конденсируется. Таким методом можно получить жидкие азот, кислород, водород, гелий. (Отметим, что температура кипения жидкого кислорода 90К, азота 78К, водорода 20К, гелия 4,2К). Применяются жидкие газы в металлургии, медицине, авиации. | |
| Рис. 9.5 | |
 | |
| Рис. 9.6 |
Вопросы для самоконтроля.
1. При каких термодинамических условиях газ не подчиняется уравнению состояния идеального газа? Что такое реальный газ?
2. Запишите уравнение Ван-дер-Ваальса. Какой смысл имеют константы Ван-дер-Ваальса, входящие в это уравнение?
3. Какое состояние называется метастабильным? Критическим? Критической температурой?
4. Что такое пересыщенный пар? Перегретая жидкость? Как используются эти состояния?

Это интересно… Слой тумана толщиной 10 м, висящий над полем площадью 5 км 2 , имеет объем 5×10 7 м 3 . При плотности тумана 0,1 г/м 3 в нем содержится 5×10 3 л воды. Этого достаточно для орошения рассматриваемого поля.
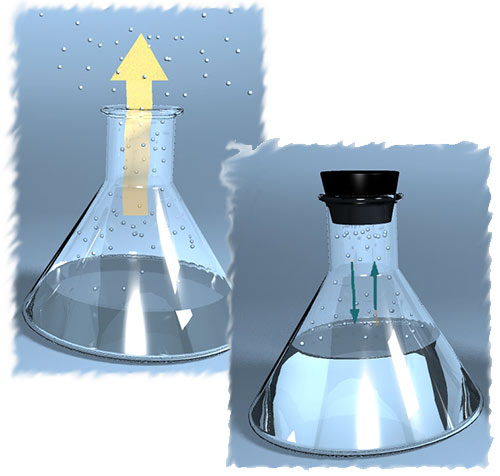
Если рассматривать жидкость в открытом сосуде, то с течением времени объем жидкости будет уменьшаться вследствие ее испарения.
Парообразование, происходящее при любых температурах с открытой поверхности жидкости, называется испарением .
Если же сосуд с жидкостью плотно закрыть, то уменьшение объема жидкости вскоре прекратится. Процесс испарения жидкости будет уравновешен процессом конденсации пара.
Процесс превращения пара в жидкость называется конденсацией.
В результате в закрытом сосуде при постоянной температуре устанавливается динамическое равновесие между жидкостью и паром.
В этом случае пар, находящийся над жидкостью, становится насыщенным .
Водяной пар является примером реального газа.
Это интересно… Догадку об отсутствии принципиального различия между парами и газами высказал в конце XVII в. А. Лавуазье. Он считал, что при достаточно низкой температуре в жидкость превратится и атмосферный воздух.
Насыщенный пар и его свойства
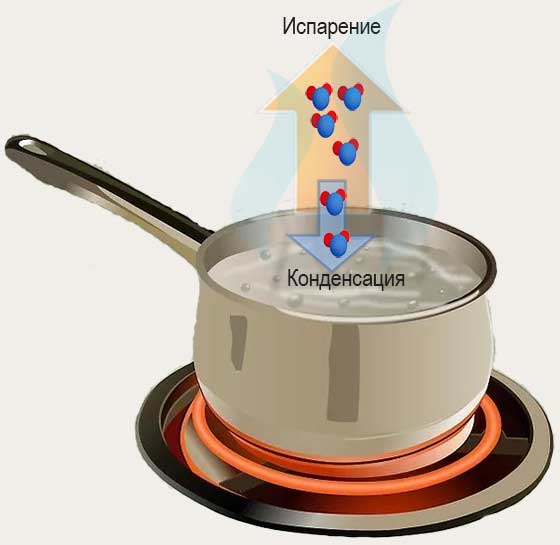
При испарении жидкость покидают молекулы, обладающие наибольшей кинетической энергией. В этом случае внутренняя энергия жидкости уменьшается, и температура жидкости понижается.
Некоторые молекулы, приближаясь к поверхности жидкости, притягиваются молекулами поверхностного слоя и возвращаются обратно в жидкость. Таким образом, при конденсации пара внутренняя энергия жидкости увеличивается, и температура жидкости повышается.
В отличие от идеального газа, молекулы реальных газов имеют конечные размеры и взаимодействуют друг с другом на расстоянии.
При установлении динамического равновесия между паром и жидкостью количество молекул, покинувших жидкость, равно количеству молекул, вернувшихся обратно из пара в жидкость.
Насыщенный пар не подчиняется газовым законам. Состояние насыщенного пара приближенно описывается уравнениями:
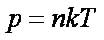
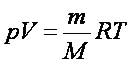
Свойства насыщенного пара
1 – Давление насыщенного пара не зависит от объема над испаряющейся жидкостью.
Если медленно сжимать газ при постоянной температуре (T=const), то в начале опыта давление газа изменяется в соответствии с законом Бойля-Мариотта (пар ненасыщенный).
С появлением капелек жидкости дальнейшее уменьшение объема не приводит к увеличению давления, т.к. концентрация молекул газа остается постоянной. Газ и жидкость находятся при одинаковой температуре и давлении. При этом пар становится насыщенным.
Как только весь газ превратится в жидкость, дальнейшее уменьшение объема приводит к резкому увеличению давления.
Давление насыщенного пара не зависит от занимаемого паром объема. Поэтому закон Бойля-Мариотта в данном случае не работает.
2 – Зависимость давления насыщенного пара от температуры.
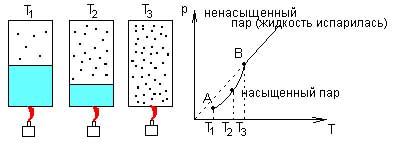
В замкнутом объеме (V=const)с ростом температуры насыщенного пара растет и концентрация молекул. Поэтому давление пара растет нелинейно. Как только жидкость превратится в пар, то давление начнет расти пропорционально температуре, как давление идеального газа.
Давление насыщенного пара не зависит линейно от объема . Закон Шарля не выполняется
Процесс испарения жидкости происходит и при кипении жидкости. При этом парообразование одновременно идет с поверхности и по всему объему жидкости. Внутри жидкости при нагревании образуются пузырьки, наполненные растворенными в жидкости газами. Пар, находящийся внутри пузырьков, является насыщенным. По мере увеличения температуры объем пузырьков растет, и под действием архимедовой силы они поднимаются к поверхности жидкости. Так как верхние слои жидкости прогреты недостаточно, то давление насыщенного пара в пузырьках уменьшается, и они схлопываются с характерным шумом.
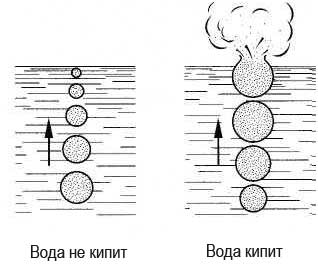
По мере нагревания жидкости образуется большое количество пузырьков, наполненных насыщенным паром. Достигая поверхности жидкости, они лопаются, выбрасывая пар в атмосферу. Начинается интенсивное кипение жидкости. При этом давление насыщенного пара внутри пузырьков равно или больше атмосферного. Если атмосферное давление не изменяется, то температура кипения жидкости остается постоянной.
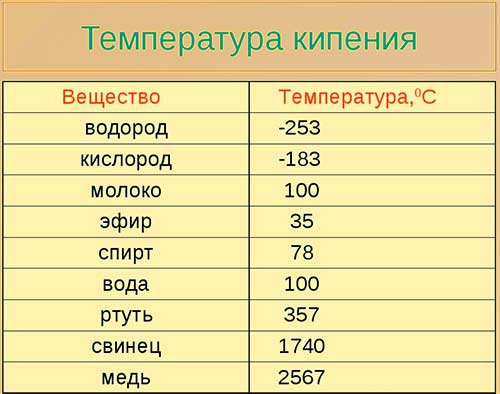
Температура кипения зависит от рода жидкости, от внешнего давления и наличия в ней примеси.
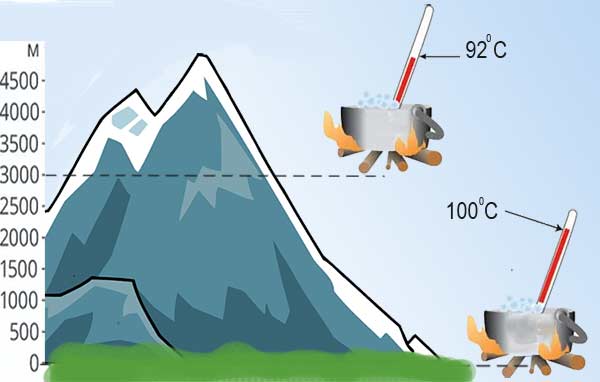
С понижением давления уменьшается температура кипение жидкости, а с повышением – увеличивается.
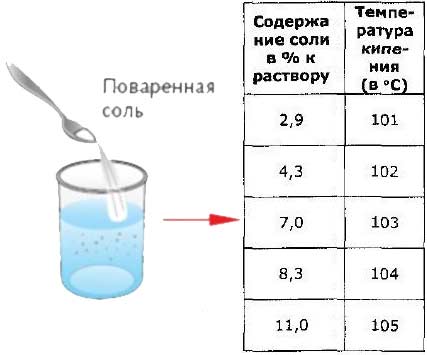
Наличие примесей в жидкости увеличивает температуру кипения.
Свойства насыщенного пара учитываются при проектировании и эксплуатации автоклавов и котлов высокого давления, получении сжиженного газа, определении характеристик водяного пара в атмосфере Земли.
Влажность воздуха
Поскольку 2/3 земной поверхности занимает вода, то в воздухе всегда содержится водяной пар. За год на Земле испаряется 4,25*10 14 т воды. По отношению ко всем газам, содержащимся в атмосфере Земли, водяной пар занимает всего около 1%.
Для описания состояния водяного пара в атмосфере Земли используют уравнение состояния идеального газа.
Физическая величина, характеризующая содержание в воздухе водяного пара, называется влажностью воздуха.
Относительная влажность воздуха определяется как отношение парциального давления p водяного пара, содержащегося в воздухе при данной температуре, к давлению насыщенного пара p0 при той же температуре:
Относительная влажность воздуха показывает, насколько водяной пар в данных условиях далек от насыщения. Именно от этого зависит интенсивность испарения воды и потери влаги живыми организмами. Для человека наиболее благоприятна относительная влажность, равная 40-60%.
В метеорологии важно знать абсолютную влажность воздуха , т.е. массу водяного пара, содержащегося в единице объема воздуха (плотность водяного пара в воздухе). На практике измеряется в г/м 3 .
С уменьшением температуры воздуха водяной пар переходит в насыщенное состояние. Точка росы характеризует температуру, при которой пар становится насыщенным.
Измерение влажности воздуха
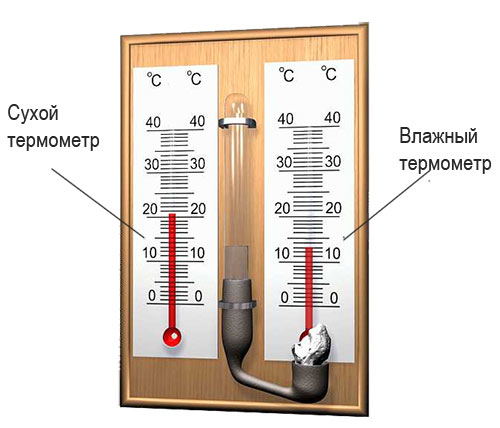
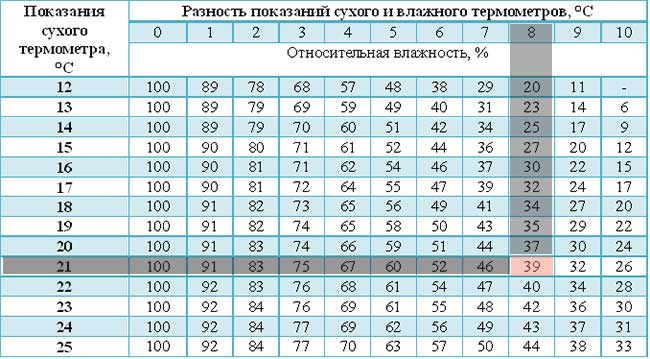
С помощью психрометра фиксируют разницу температур двух термометров – сухого и влажного. По этой разнице и температуре сухого термометра устанавливают влажность воздуха по психрометрической таблице:
Действие волосного гигрометра основано на способности обезжиренного человеческого волоса изменять свою длину в зависимости от влажности воздуха.
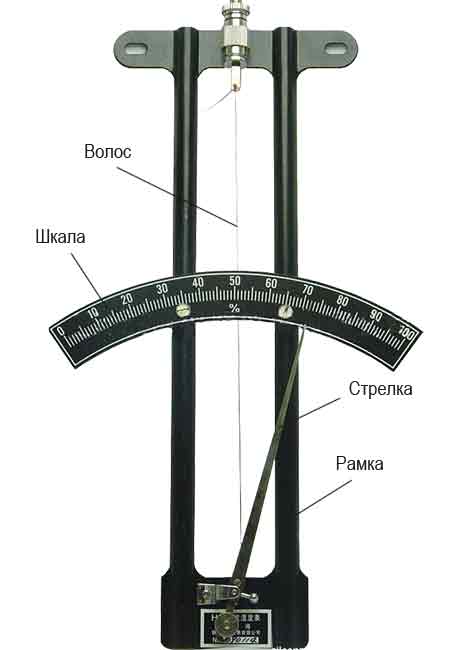
Волос соединяется со стрелкой прибора, шкала которого градуируется в процентах относительной влажности.
С помощью конденсационного гигрометра измеряют точку росы – температуру, до которой необходимо охладить воздух, чтобы содержащийся в нем водяной пар, остывая, стал насыщенным.

Начиная с этой температуры, охлаждение воздуха сопровождается появлением капелек росы на зеркальном сосуде, температуру которого понижают, прокачивая грушей воздух через легкокипящую жидкость.
В настоящее время нашли широкое применение как стрелочные, так и электронные цифровые гигрометры с жидкокристаллическим экраном.

Определенную влажность воздуха нужно поддерживать в библиотеках, музеях для лучшего сохранения книг, картин и других экспонатов. Для уменьшения электризации нитей в ткацких цехах создают высокую влажность. Строгий контроль влажности ведется в кондитерских цехах.
Изотерма реального газа представляет собой зависимость молярного объема газа от давления при постоянной температуре.
При высоких температурах изотерма реального газа отличается от изотермы идеального газа только некоторым искажением формы.
При некоторой температуре - критической температуре – на изотерме появляется точка перегиба К – критическая точка. Соответствующие, этой точке объеми давлениеназываются критическими. Изотерма приназывается критической изотермой.


Приуравнение Ван-дер-Ваальса соответствует кривая 1-2-3-4-5-6-7. Однако, на участке 5-3 сжатие вещества сопровождается уменьшением давления, следовательно в этой области вещество распадается на две фазы – жидкость и пар.
Фаза – совокупность всех частей системы, обладающих одинаковым химическим составом и находящихся в одинаковом термодинамическом состоянии.
Истинные до критические изотермы реального газа имеют вид 1-2-6-7 и являются кривыми непрерывного перехода вещества из газообразного состояния (участок 6-7) в жидкое (участок 2-1). Участок 6-2 соответствует равновесному сосуществованию жидкости и газа.

Вещество в газообразном состоянии при температуре ниже критической называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным (Ж+П). Пар при изотермическом сжатии претерпевает процесс сжижения. Газ, при температурах не может быть превращен в жидкость ни при каком давлении.
При некоторых условиях могут быть реализованы метастабильные состояния 5-6 и 2-3. Участок 2-3 изображает перегретую жидкость, 5-6 – пересыщенный пар.
§ 48. Свойства жидкостей. Поверхностное натяжение
Жидкость является агрегатным состоянием вещества, промежуточным между, газообразным и твердым. В газах нет закономерности во взаимном расположении молекул (хаотическое расположение). В твердых телах наблюдается дальний порядок – молекулы образуют кристаллическую решетку. В жидкостях дальний порядок отсутствует, а имеет место ближний порядок в расположении молекул – их упорядоченное расположение повторяется на расстояниях, сравнимых с межатомными. Тепловое движение молекулы в жидкости это ее колебание около определенного положения равновесия в течение некоторого времени, после чего молекула скачком переходит в новое положение, отстоящее от исходного на расстояние порядка межатомного.


Радиус r молекулярного действия – расстояние (порядка м), при котором можно пренебречь силами притяжения между молекулами жидкости. Сфера радиусомr называется сферой молекулярного действия.
Силы, действующие на молекулуА внутри объема жидкости со стороны окружающих молекул, в среднем скомпенсированы. Для молекулыВ, расположенной на поверхности, равнодействующая сил R направлена внутрь жидкости. Результирующие силы всех молекул поверхностного слоя оказывает на жидкость молекулярного (внутреннее) давление.
Молекулы поверхностного слоя жидкости обладают большей потенциальной энергией, чем молекулы внутри жидкости. Эта дополнительная энергия, называемая поверхностной энергией, пропорциональна площади поверхности: , где- поверхностное натяжение.
Так как равновесное состояние характеризуется минимумом потенциальной энергии, то жидкость при отсутствии внешних сил будет принимать такую форму, чтобы при заданном объеме она имела минимальную поверхность, т.е. форму шара.
Поверхностный слой жидкости аналогичен растянутой упругой пленке, в которой действует силы натяжения.

Пусть под действием сил поверхностного натяжения поверхность жидкости стянулась, (рис.48.2) при этом силы, действующие на элемент контура, совершают работу, где- сила поверхностного натяжения, действующая на единицу длины контура поверхности жидкости. Поскольку эта работа совершается за счет уменьшения поверхностной энергии, то, т.е. поверхностное натяжениеравно силе поверхности натяжения приходящейся на единицу длины контура, ограничивающего поверхность.
Единица поверхностного натяжения –ньютон на метр (Н/м) или джоуль на квадратный метр (Дж/м 2 ).
Изотерма реального газа представляет собой зависимость молярного объема газа от давления при постоянной температуре.
При высоких температурах изотерма реального газа отличается от изотермы идеального газа только некоторым искажением формы.
При некоторой температуре - критической температуре – на изотерме появляется точка перегиба К – критическая точка. Соответствующие, этой точке объеми давлениеназываются критическими. Изотерма приназывается критической изотермой.


Приуравнение Ван-дер-Ваальса соответствует кривая 1-2-3-4-5-6-7. Однако, на участке 5-3 сжатие вещества сопровождается уменьшением давления, следовательно в этой области вещество распадается на две фазы – жидкость и пар.
Фаза – совокупность всех частей системы, обладающих одинаковым химическим составом и находящихся в одинаковом термодинамическом состоянии.
Истинные до критические изотермы реального газа имеют вид 1-2-6-7 и являются кривыми непрерывного перехода вещества из газообразного состояния (участок 6-7) в жидкое (участок 2-1). Участок 6-2 соответствует равновесному сосуществованию жидкости и газа.

Вещество в газообразном состоянии при температуре ниже критической называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным (Ж+П). Пар при изотермическом сжатии претерпевает процесс сжижения. Газ, при температурах не может быть превращен в жидкость ни при каком давлении.
При некоторых условиях могут быть реализованы метастабильные состояния 5-6 и 2-3. Участок 2-3 изображает перегретую жидкость, 5-6 – пересыщенный пар.
§ 48. Свойства жидкостей. Поверхностное натяжение
Жидкость является агрегатным состоянием вещества, промежуточным между, газообразным и твердым. В газах нет закономерности во взаимном расположении молекул (хаотическое расположение). В твердых телах наблюдается дальний порядок – молекулы образуют кристаллическую решетку. В жидкостях дальний порядок отсутствует, а имеет место ближний порядок в расположении молекул – их упорядоченное расположение повторяется на расстояниях, сравнимых с межатомными. Тепловое движение молекулы в жидкости это ее колебание около определенного положения равновесия в течение некоторого времени, после чего молекула скачком переходит в новое положение, отстоящее от исходного на расстояние порядка межатомного.


Радиус r молекулярного действия – расстояние (порядка м), при котором можно пренебречь силами притяжения между молекулами жидкости. Сфера радиусомr называется сферой молекулярного действия.
Силы, действующие на молекулуА внутри объема жидкости со стороны окружающих молекул, в среднем скомпенсированы. Для молекулыВ, расположенной на поверхности, равнодействующая сил R направлена внутрь жидкости. Результирующие силы всех молекул поверхностного слоя оказывает на жидкость молекулярного (внутреннее) давление.
Молекулы поверхностного слоя жидкости обладают большей потенциальной энергией, чем молекулы внутри жидкости. Эта дополнительная энергия, называемая поверхностной энергией, пропорциональна площади поверхности: , где- поверхностное натяжение.
Так как равновесное состояние характеризуется минимумом потенциальной энергии, то жидкость при отсутствии внешних сил будет принимать такую форму, чтобы при заданном объеме она имела минимальную поверхность, т.е. форму шара.
Поверхностный слой жидкости аналогичен растянутой упругой пленке, в которой действует силы натяжения.

Пусть под действием сил поверхностного натяжения поверхность жидкости стянулась, (рис.48.2) при этом силы, действующие на элемент контура, совершают работу, где- сила поверхностного натяжения, действующая на единицу длины контура поверхности жидкости. Поскольку эта работа совершается за счет уменьшения поверхностной энергии, то, т.е. поверхностное натяжениеравно силе поверхности натяжения приходящейся на единицу длины контура, ограничивающего поверхность.
Единица поверхностного натяжения –ньютон на метр (Н/м) или джоуль на квадратный метр (Дж/м 2 ).
Читайте также:

