Изотермический изобарный и изохорный процессы изменения состояния идеального газа план конспект
Обновлено: 06.07.2024
Цель урока: выяснение условий выполнения изопроцессов; выяснение теоретической зависимости трех макроскопических параметров; практическое доказательство этих параметров.
- Диагностика знаний учащихся по темам:
“Основы молекулярно-кинетической теории”,
“Основное уравнение молекулярно-кинетической теории”
“Уравнение состояния идеального газа”. - Коррекция теоретических знаний по данным темам.
- Виртуальное и экспериментальное подтверждение законов “Бойля-Мариотта”, “Гей-Люссака”, “Шарля”.
- Теоретическое обобщение и подтверждение зависимости макроскопических параметров
- Разработка алгоритма решения графических задач и перепостроения графиков в различные системы координат.
- Тестирование.
- Беседа.
- Лекция.
- Презентация.
- Виртуальная и практическая лабораторная работы.
- Решение графических задач.
- Методическая система интенсивного обучения (В.Ф.Шаталов)
- Теория развития познавательного интереса (Г.И.Щукина)
- Теория оптимизации обучения (Ю.К.Бабанский, М.П.Поташник)
- Концепция поэтапного формирования умственных знаний (П.Я.Гольперин)
Тип урока - изучение нового материала.
Ход урока
1. Организация урока - 2мин.
2. Постановка цели и задач урока - 3 мин.
3. Презентация - 12 мин.
4. Мотивация мысленной деятельности учащихся (работа по тестам и 2 учащихся у доски с аналогичными заданиями по пройденному материалу) - 12 мин.
5. Объяснение нового материала -15 мин.
А) изотермический процесс (закон Бойля-Мариотта)
Б) изобарный процесс (закон Гей-Люссака)
В) изохорный процесс (закон Шарля).
1. Организация урока - 2 мин.
2. Постановка цели и задач урока - 3-5 мин.
3. Выполнение виртуальной лабораторной работы - 30 мин.
4. Обобщение полученных результатов - 3-5 мин.
1. Организация урока - 2 мин.
2. Постановка цели и задач урока - 3 мин
3. Выполнение практической работы -10-2 мин.
4. Обобщение полученных результатов - 3-5 мин.
5. Алгоритмизация графических задач -15 мин.
6. Приемственность материала, подведение итогов, постановка задач на новый урок.
1. Повторение и закрепление основных понятий и уравнений молекулярно-кинетической теории.
(Презентация раздела физики “Молекулярно-кинетическая теория”, выявление способностей учащихся практически и теоретически компоновать пройденный материал).
2. Диагностика знаний учащихся по данной теме (Варианты тестов см. Приложение3). Двое учащихся отвечают у доски, при этом проводят самооценку своих знаний. Каждый ученик после окончания тестирования сам оценивает свою работу на листке.
3. Объяснение нового материала:
Изопроцессы - процессы изменения состояния газов так, что один из трех макроскопических параметров (объем, давление, температура) остается постоянным, а два других параметра при этом изменяются.
а) Изотермический процесс- процесс изменения состояния определенной массы газа при постоянной температуре (m=const, T=const). Из уравнения Менделеева-Клайперона следует закон Бойля-Мариотта PV=CONST=m/V* RT. Это означает, что произведение начального давления Р1 на его первоначальный объем равно произведению этих параметров P2*V2 в произвольной момент времени P1*V1=P2*V2или P1/P2=V2/V1 следовательно Р - 1/V график- гипербола, название - изотерма.
б) Изобарный процесс - процесс изменения состояния определенной массы газа при постоянном давлении (m=const, P=const).Из уравнения Менделеева - Клайперона следует закон Гей-Люссака. V/T=const=mR/MP-это означает, что отношение первоначального объема газа к его температуре Т1 равно отношению этих параметров V2/T2 в произвольный момент времени. V1/T1=V2/T2 или V1*T2=V2*T1 следует V~T.
График - прямая, название - изобара.
в) Изохорный процесс - процесс изменения состояния определенной массы при постоянном объеме(m=CONST, V= CONST). Из уравнения Менделеева - Клайперона следует закон Шарля Р/ Т=const=mR/MV - это означает, что отношение первоначального давления газа Р1 к его температуре равно отношению этих параметров Р2, Т2- в произвольный момент времени Р1/Т1=Р2/Т2 или Р1*Т2=Р2*Т1 следует Р пропорционально Т. График - прямая, название- изохора.
1. Виртуальная лабораторная работа (выявление расположения графиков и положение аналогичных линий, при наблюдении изопроцессов).
2. Обобщение полученных данных, заполнение таблицы №1, №2
3. Выполнение дополнительных задач.
ЭТАПЫ III УРОКА
1. Проведение практической работы.
Внимание, соблюдение техники безопасности (инструктаж).
а) Выслушай учителя, затем делай работу.
б) ОСТОРОЖНО. - работа с огнем и со стеклом.
в) Вывод и анализ работы.
2. На доске построение графиков.
3. Алгоритм перепостроения графиков
в) Закон (формула) -
г) Изменение параметров
д) Название линии
4. Сборник задач по физике (Степанова Г.Н.) № 626(5)
Использованная литература:
1. Касьянов В.А. Учебник физики: 10 класс. - Дрофа, 2002.
2. Пинский А.А. Учебник физики: 10 класс. - Просвещение, 2002.
4. Куперштейн Ю.С., Марон А.Е. Физика: 10-11 классы. Опорные конспекты и дифференцированные задачи. - Л., 1991.
5. Программы для общеобразовательных учреждений. Физика. Астрономия. - Дрофа, 2001.
6. Гин А.А. Приемы педагогической техники. - М., 1999.
7. Волковский Р.Ю., Тёмкина Д.А. Организация дифференцированной работы учащихся при обучении физике. - М., 1993.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Конспект урока физики в 10 классе
Цель занятия: изучение и первичное закрепление полученных знаний о газовых законах (их значение в природе и технике, закономерности).
Задачи занятия:
Развивающие: закрепить знание уравнений состояния идеального газа и их применение при решении задач, развивать умение сравнивать, выявлять закономерности, обобщать, логически мыслить; научить применять полученные знания в нестандартных ситуациях для решения графических и аналитических задач, раскрыть взаимосвязь между изученным теоретическим материалом и явлениями в жизни;
Воспитательные: воспитывать самостоятельность, трудолюбие, точность и четкость при ответе, сознательное отношение к процессу обучения, формировать практические навыки в применении и закреплении полученных знаний, познавательный интерес к предмету, развивать умение видеть физику вокруг себя, творческий подход к решению задач
Сегодня, ребята, мы попытаемся, используя уже накопленные нами знания, пройти сложный путь первооткрывателей и сформулировать пусть уже открытые законы. Но мы пока учимся, а дальше, может быть, вам откроется то, о чем сегодня ученые даже не думают. Повторим то, что изучали ранее.
Фронтальный опрос
Что является объектом изучения молекулярно-кинетической теории? ( Идеальный газ )
Что в молекулярно-кинетической теории называется идеальным газом? ( Идеальный газ – это модель, в которой взаимодействием между молекулами и размерами молекул можно пренебречь )
Каковы нормальные условия для идеального газа? ( давление 101 325 Па, температура 273,13 К, объем 1 моля газа – 22,4 дм 3 )
Для того чтобы описать состояние идеального газа, используют три термодинамических параметра. Какие? ( Давление, объем и температура )
Какие макроскопические параметры связываются уравнением Клапейрона – Менделеева? ( Давление, объем, температура )
Письменная проверка домашнего задания
А) Тест (слайд 3)
1. Как изменится давление идеального одноатомного газа при изменении его объема в 4 раза и увеличении температуры в 2 раза?
А. Увеличится в 8 раз
Б. Уменьшится в 4 раза
В. Увеличится в 2 раза
2. Вычислите давление кислорода массой 0,032 кг в сосуде объемом
8,3 м 3 при температуре 100 0 С.
3. Как изменится масса воздуха в помещении, если температура увеличится?
4. Чему равен объем одного моля идеального газа при нормальных условиях?
Вариант 1: Какова температура 1,6·10 -2 кг кислорода, находящегося под давлением 10 6 Па и занимающего объем 1,6·10 -3 м 3 ? Молярная масса кислорода 32·10 -3 кг/моль.
Вариант 2: Определите давление воздуха в сосуде объемом 2·10 -3 м 3 , если его масса 1,2 ·10 -2 кг, температура 27 0 С, а молярная масса 29·10 -3 кг/моль.
Изучение нового материала
Мы знаем, что состояние данной массы газа полностью определено, если известны его давление , температура и объем - параметры состояния газа.
Изопроцесс. Газовый закон
Особый интерес представляют процессы, в которых один из параметров (p, V или T) остается неизменным. Такие процессы называются изопроцессами. Запишите определение
Изопроцесс – это переход газа из одного состояния в другое, при котором масса газа и один из его термодинамических параметров остаются неизменными. ( слайд 8)
Газовый закон – количественная зависимость между двумя термодинамическими параметрами газа при фиксированном значении третьего. (слайд 9)
Газовых закона, как и изопроцесса – три. Используя уравнение состояния идеального газа, можно вывести все три закона за 10 минут. Но в истории физики сначала экспериментально были получены газовые законы, и только потом они были обобщены в уравнение состояния. Этот путь занял почти 200 лет: первый газовый закон был получен в 1662 году физиками Бойлем и Мариоттом, уравнение состояния – в 1834 году Клапейроном, а более общая форма уравнения – в 1874 году Д.И. Менделеевым.
4 .1 Изотермический процесс
Изотермический процесс – процесс изменения состояния определенной массы газа при постоянной температуре (Т= const ) (слайд 10)
Для идеального газа изотермический процесс описывается законом Бойля-Мариотта. Закон установлен экспериментально до создания молекулярно-кинетической теории газов английским физиком Робертом Бойлем в 1662 году и французским аббатом Эдмоном Мариоттом, который описал независимо от Бойля аналогичные опыты в 1676 году
Формулировка: Для газа данной массы при постоянной температуре произведение давления на объем постоянно:
Закон Бойля-Мариотта справедлив для любых газов, а так же и для их смесей, например, для воздуха. Лишь при давлениях, в несколько сотен раз больших атмосферного, отклонения от этого закона становятся существенными. Изотермическим можно приближенно считать процесс медленного сжатия воздуха или расширения газа под поршнем насоса при откачке его из сосуда. Правда, температура газа при этом меняется, но в первом приближении этим изменением можно пренебречь.
При изотермическом расширении происходит уменьшение средней кинетической энергии молекул газа, т. е газ охлаждается . Поэтому для поддержания постоянной температуры газа к нему нужно подводить тепло.
Графически этот закон можно изобразить в виде изотермы , которую вы видите в осях ( p , V ) ( V , T ) ( p , T ) (слайд 12)

Решим задачу: (слайд 13) Сосуд объемом 12 л, содержащий газ при давлении 4·10 5 Па, соединяют с другим сосудом объемом 3 л, из которого полностью откачан воздух. Найти конечное значение давления. Процесс изотермический.
4.2 Изобарный процесс
Изобарный процесс – процесс изменения состояния определенной массы газа, протекающий при постоянном давлении (Р= const ) (слайд 14).
Для идеального газа изобарный процесс описывается законом Гей-Люссака. Закон установлен в 1802 году французским физиком Жозефом Луи Гей-Люссаком, который определял объем газа при различных значениях температур в пределах от точки кипения воды. Газ содержали в баллончике, а в трубке находилась капля ртути, запирающая газ, расположенная горизонтально
Формулировка: для газа данной массы при постоянном давлении отношение объема газа к его термодинамической температуре постоянно:
Графически этот закон изображается с помощью изобары . Вы видите изобары в осях ( p , V ) ( p , T ) ( V , T ) (слайд 16)

Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем. Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю поверхность поршня.
При изобарном расширении температура газа и соответственно средняя квадратичная скорость молекул возрастают за счет тепла, подводимого к газу.
Решим задачу: (слайд 17) Газ при температуре 300 К занимает объем 250 см 3 . Какой объем займет та же масса газа, если температура повысится до 324 К? Давление считать постоянным.
4.3 Изохорный процесс
Изохорный процесс – процесс изменения состояния определенной массы газа, протекающий при постоянном объеме ( V = const ). (слайд 18)
Для идеального газа изохорный процесс описывается законом Шарля. В 1787 году французский ученый Жак Александр Цезар Шарль измерял давление различных газов при нагревании при постоянном объеме и установил линейную зависимость давления от температуры, но не опубликовал исследования. Через 15 лет к таким же результатам пришел и Гей-Люссак и, будучи на редкость благородным, настоял, чтобы закон назывался в честь Шарля (слайд 19)
Формулировка: Для газа данной массы при постоянном объеме отношение давления к температуре постоянно:
Что происходит с давлением при нагревании? При охлаждении? Почему? Графически этот закон изображается с помощью изохоры: (слайд 20) эта зависимость показана в координатах ( V , T ) ( p , T ) и (р, V )

Изохорным можно считать увеличение давления газа в любой емкости или в электрической лампочке при нагревании.
При изохорном нагревании газа за счет подводимого к нему тепла средняя квадратичная скорость молекул и соответственно температура и давление газа возрастают.
Решим задачу. (слайд 21) Газ находится в баллоне при температуре 288 К и давлении 18 атм. При какой температуре давление газа станет равным 15,6 атм? Объем газа считать неизменным.
Закрепление и систематизация полученных знаний
А теперь проверим, насколько хорошо вы разобрались в газовых законах. Необходимо самостоятельно выполнить задания (слайд 22)
Задание 6. Даны графики процессов в различных системах координат:

Найти во всех трех системах координат:
Подведение итогов и рефлексия
Сегодня мы с вами хорошо поработали. Результаты следующие (выставить и прокомментировать оценки). А еще ответьте на вопросы:
1. Сегодняшний урок мне (понравился или не понравился)
2. Мне понравилось …(назвать, что именно)
3. Что нового узнали? Чему научились?
Домашнее задание :
§ 54 ( учебник Физика – 10, Касьянов В.А)
№ 500, 509, 511, 515 (Сборник задач по физике – А.П. Рымкевич, П.А. Рымкевич)
Решить задачу: При температуре 27 о С давление газа в закрытом сосуде было 75кПа. Каким будет давление этого газа при температуре – 13 о С?

Цель урока: изучить связь между тремя макроскопическими параметрами газа, а конкретнее – их взаимосвязь в газовых процессах, протекающих при постоянном значении одного из этих трёх параметров, или изопроцессах: изотермических, изохорных и изобарных.
Задачи урока:
Образовательные:
- Ввести понятие об изопроцессе;
- Изучить изопроцессы (история открытия, модель установки для изучения зависимостей между термодинамическими параметрами, графики изопроцесса, математическая запись закона, объяснение с точки зрения МКТ);
- Сформировать умения выделять и описывать изопроцессы.
-Научить учащихся решать аналитические и графические задачи, используя уравнение состояния и газовые законы.
Развивающие:
- Вырабатывать умения объяснять газовые законы на основе положений МКТ;
- Научить описывать состояние и изопроцессы идеального газа, в том числе определять микро - и макропараметры; давать и объяснять графическое изображение процессов.
- Сформировать умение самостоятельно добывать знания, применять полученные знания в нестандартных ситуациях для решения графических и аналитических задач;
Воспитательные:
-Продолжить формирование познавательного интереса учащихся;
-Продолжить формирование стремления к глубокому усвоению теоретических знаний через решение задач.
- Формирование взаимопомощи, доброжелательного отношения друг к другу, развивать культуру общения и культуру ответа на вопросы.
Планируемые результаты:
• сформировать понятия о изопроцесс, изотермический, изобарный, изохорный, закон Бойля-Мариотта, Гей-Люссака, Шарля, изотерма, изохора, изобара;
• выработать умения выделять и описывать изопроцессы;
отработать навык решения аналитические и графические задачи, используя уравнение состояния и газовые законы решать аналитические и графические задачи, используя уравнение состояния и газовые законы
Метапредметные:
• Регулятивные: фиксировать индивидуальное затруднение в проблемном действии; самостоятельно решать задачи, используя имеющиеся знания; контролировать свою деятельность по ходу выполнения задания;
• Познавательные работать с разными видами информации и ориентироваться в ней; выполнять действия по образцу; использовать знаково-символичные средства при сворачивании и разворачивании информации; задавать проблемные вопросы в ходе исследовательской деятельности и отвечать на них; развивать умение анализировать, сравнивать, сопоставлять и обобщать;
• Коммуникативные: развивать умение сотрудничества со сверстниками при работе в группе; развивать умение принимать коллективное решение.
Личностные УУД:
- Осознание необходимости учения и бережного отношение к своему здоровью;
- Осознать роль газовых законов в жизни человека;
- Работать над самооценкой и адекватным пониманием причин успеха/неуспеха в учебной деятельности;
- Учиться проявлять самостоятельность в разных видах деятельности (выдвигать гипотезу, проверять ее опытным путем, делать выводы);
- Работать над осознанием ответственности за общее дело; учиться выражать свое мнение.
Место урока в разделе "Основы МКТ": урок проводился в 10 классе после изучения основ молекулярно-кинетической теории газов и понятия температура.
Организационный этап (1минута).
Постановка темы, цели и задачи урока (5 минут).
Этап изучения нового материала (3 минут).
Работа в группах (5 минут).
Валеологическая пауза (1мин)
Этап изучения нового материала (10 минут).
Применение газовых законов (4 минут)
Рефлексия, подведение итогов (1 минут).
Ход занятия
Обеспечить нормальную внешнюю обстановку для работы на уроке.
Психологически подготовить учащихся к общению.
Содержание этапа урока
Проверка подготовленности школьников к уроку.
Организация внимания школьников.
Раскрытие общих целей урока и плана его проведения.
Здравствуйте, гости дорогие! Добрый день, учащиеся! Я рада вас видеть. Сегодня мы с вами совершим увлекательное виртуальное историческое путешествие, и, надеюсь, вы откроете для себя что-то новое. Для нормальной работы нам потребуются хорошие знания законов физики, поэтому сейчас мы с вами их повторим.
2. ПОСТАНОВКА ТЕМЫ, ЦЕЛИ И ЗАДАЧ УРОКА
Образовательные задачи
Установить правильность, полноту и осознанность выполнения домашнего задания всеми учащимися.
Выявить пробелы в знаниях и способах деятельности учащихся.
Содержание этапа урока
Определение типичных недостатков в знаниях и способах деятельности учащихся и причин их появления.
По традиции опять
Начинаем как обычно
Это ведь для нас привычно.
Вы хорошо поработали над предыдущей темой (мотив достижений).
Но не усвоили ещё одну важную сторону этой темы (мотив относительной неудовлетворенности).

Итак, мы знаем уравнение, которое характеризует состояние идеального газа. . Мы видим, что если масса постоянна, то между оставшимися параметрами есть определённое соотношение.
Надо сказать, что изопроцессами называются такие процессы, которые протекают при неизменно одном из параметров газа. Другими словами изопроцесс это процесс, который протекает при постоянном давлении, или процесс который протекает при постоянном объеме, или процесс который протекает при постоянной температуре. Уравнение описывающий изопроцесс, его закономерности - газовым законом. Цель нашего урока: познакомится с законами изопроцессов иначе газовыми законами.
Получить уравнение состояния, используя те знания, что у вас уже есть достаточно просто, и вы сможете в этом убедиться. А зная это уравнение, можно вывести все три газовых закона всего за 10 минут.
Но в истории физики эти открытия были сделаны в обратном порядке: сначала экспериментально были получены газовые законы, и только потом они были обобщены в уравнение состояния. Этот путь занял почти 200 лет: около 420 г. до н.э.- Атомная теория строения вещества, 1662 - 1802гг – экспериментально установлены газовые законы, 1811 - Закон Авогадро, 1827 - Броуновское движение, 1834 - Уравнение состояния идеального газа, 1849 - Молекулярно-кинетическая теория, а более общая форма уравнения состояния идеального газа – в 1874 году Д.И.Менделеевым.
Ваша задача на уроке: повторить путь известных физиков и получить формулировки газовых законов. По сравнения с 17-18 в., для вас эта задача значительно упрощена. Но, выступая в роли исследователей, вам придется анализировать увиденное, делать выводы, объяснять результаты. Ведь как говорил Майкл Фарадей “Искусство экспериментатора состоит в том, чтобы уметь задавать природе вопросы и понимать ее ответы”.
По ходу урока вы будете весь новый материал систематизировать и заносить в таблицу:

Формирование понятий изотермического, изобарного и изохорного процессов; понимания законов Бойля — Мариотта, Гей-Люссака, Шарля; научить применять полученные знания в нестандартных ситуациях для решения задач;
продолжить формирование познавательного интереса учащихся; в целях интернационального воспитания обратить внимание учащихся, что физика развивается благодаря работам ученых различных стран и исторических времен; продолжить формирование стремления к глубокому усвоения теоретических знаний через решение задач
Обучающиеся:
Все: Проявляют знание и понимание основных понятий: газовые законы; умеют объяснять законы с молекулярной точки зрения; изображать графики процессов.
Большинство: Умеют применять полученные знания в нестандартных ситуациях для решения графических и аналитических задач.
Некоторые: При решении задач свободно владеют изученным материалом.
Языковые цели
Предметная лексика и терминология:
Серия полезных фраз для диалога/письма
Изопроцесс – процесс, при котором масса газа и один из его термодинамических параметров остаются неизменными.
Газовый закон – количественная зависимость между двумя термодинамическими параметрами газа при фиксированном значении третьего.
Воспитание ценностей
воспитание ответственности, настойчивости и познавательной активности обучение на протяжении всей жизни. Уважение и сотрудничество прививаются на занятии через умение работать в группе.
Межпредметная связь
Самопознание - вопросы из области самопознания.
Математика- выполнение математических преобразований и расчётов при решении задач.
Предыдущие знания
Основная задача МКТ. Основные положения МКТ. Опытные подтверждения МКТ. Идеальный газ. Уравнение состояния идеального газа
Демкович В.П., Демкович Л.П. Сборник задач по физике. 10-11 классы –
Время / этапы урока
Деятельность учителя
Деятельность учащихся
(метод/ прием/ техника/ стратегия)
Способы дифференциации
Начало урока
Организационный момент.
Организационный момент.
П риветствие на трех языках:
Здравствуйте, Сәлематсіз бе, Good morning.
Установка на учебную деятельность. Знакомство с содержанием модуля, литературой. Единые требования: отсутствующие, внешний вид.
Объявление темы и цели занятия. Актуальность темы дня.
Мы рассмотрели идеальный газ с позиций молекулярно-кинетической
теории. Выяснили зависимость давления идеального газа от концентрации его молекул и температуры. Рассмотрели как связаны между собой давление идеального газа, его масса, объём и температура.
На этом уроке мы продолжим изучать связь между тремя макроскопическими параметрами газа, а конкретнее – их взаимосвязь в газовых процессах, протекающих при постоянном значении одного из этих трёх параметров, или изопроцессах: изотермических, изохорных и изобарных.
Включаются в деловой ритм урока
Деление на группы
Проверка домашнего задания
Примерный перечень вопросов:
1. Что является объектом изучения МКТ?
2. Что в МКТ называется идеальным газом?
3. Для того чтобы описать состояние идеального газа, используют три термодинамических параметра. Какие?
4. Какое уравнение связывает между собой все три термодинамических параметра?
5. Задача. Какова плотность сжатого воздуха при 0 градусов С в камере шины легкового автомобиля? Давление 0,17 МПа.
6 . Молярная масса газа 4∙10 -3 кг/моль. 5кг этого газа при температуре 500 К занимает объем 34,6 м 3 . Давление газа равно .
7 . Оцените массу воздуха объемом 1 м 3 при давлении 10 5 Па и температуре 300 К (молярная масса воздуха 29∙10 -3 кг/моль).
1. Что является объектом изучения МКТ? (Идеальный газ.)
2. Что в МКТ называется идеальным газом? (Идеальный газ – это газ, в котором взаимодействием между молекулами можно пренебречь.)
3. Для того чтобы описать состояние идеального газа, используют три термодинамических параметра. Какие? (Давление, объем и температура.)
4. Какое уравнение связывает между собой все три термодинамических параметра? (Уравнение состояния идеального газа).
5. Задача. Какова плотность сжатого воздуха при 0 градусов С в камере шины легкового автомобиля? Давление 0,17 МПа.(Ответ:2,17 кг/м куб.)
6 . Молярная масса газа 4∙10 -3 кг/моль. 5кг этого газа при температуре 500 К занимает объем 34,6 м 3 . Давление газа равно .
7 . Оцените массу воздуха объемом 1 м 3 при давлении 10 5 Па и температуре 300 К (молярная масса воздуха 29∙10 -3 кг/моль).
(ФО) Учитель наблюдает за процессом опроса и даёт обратную связь.
(ФО) Самооценивание по листу самооценки
Ребята отвечают на вопросы по желанию.
В группе могут выбрать вопрос, на который хотят ответить.
Основная часть
Изучение нового материала
При подготовке тем обучающийся использовали интернет ресурсы:
Во время работы обучающихся в группе наблюдает за работой и оценивает их.
Работа в группе.
Изучение нового материала .
Определение изо процесса .
История открытия закона .
Математическое выражение газового закона, формулировка закона .
Критерий для оценивания выступления от группы.
Ни один термодинамический параметр нельзя изменить, не затронув один, а то и два других параметра. Бывает так, что газ данной массы переходит из одного состояния в другое, изменяя только два параметра, оставляя третий неизменным. Такой переход называется изопроцессом, а уравнение его закономерности - газовым законом.
Изопроцесс – процесс, при котором масса газа и один из его термодинамических параметров остаются неизменными.
Газовый закон – количественная зависимость между двумя термодинамическими параметрами газа при фиксированном значении третьего.
Газовых закона, как и изопроцесса – три. Используя уравнение состояния идеального газа, можно вывести все три закона за 10 минут. Но в истории физики эти открытия были сделаны в обратном порядке: сначала экспериментально были получены газовые законы, и только потом они были обобщены в уравнение состояния. Этот путь занял почти 200 лет: первый газовый закон был получен в 1662 году физиками Бойлем и Мариоттом, уравнение состояния – в 1834 году Клапейроном, а более общая форма уравнения – в 1874 году Д.И.Менделеевым.
Деление на группы.
Выступление 1-й группы:
1. Изотермический процесс – процесс изменения состояния термодинамической системы при постоянной температуре.
Для идеального газа изотермический процесс описывается законом Бойля-Мариотта.
Закон установлен экспериментально до создания молекулярно-кинетической теории газов английским физиком Робертом Бойлем в 1662 году и французским аббатом Эдмоном Мариоттом, который описал независимо от Бойля аналогичные опыты в 1676 году.

Закон Бойля-Мариотта (изотермический процесс, T = const )
где - параметры газа в разные моменты времени.
Для газа данной массы при постоянной температуре произведение давления на объем постоянно.
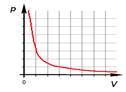
(математически это гипербола)
Закон Бойля-Мариотта справедлив для любых газов, а так же и для их смесей, например, для воздуха. Лишь при давлениях, в несколько сотен раз больших атмосферного, отклонения от этого закона становятся существенными.
Изотермическим можно приближенно считать процесс медленного сжатия воздуха или расширения газа под поршнем насоса при откачке его из сосуда. Правда температура газа при этом меняется, но в первом приближении этим изменением можно пренебречь.
Однако газовые законы активно работают не только в технике, но и в живой природе, широко применяются в медицине.
Выдох происходит аналогично: вследствие уменьшения объема легких давление воздуха в них становится больше, чем внешнее атмосферное, и за счет обратного перепада давлений он переходит наружу.
Выступление 2-й группы:
2. Изобарный процесс – процесс изменения состояния термодинамической системы, протекающий при постоянном давлении.
Для идеального газа изобарный процесс описывается законом Гей-Люссака.

Жозеф Луи Гей-Люссак
Закон установлен в 1802 году французским физиком Гей-Люссаком, который определял объем газа при различных значениях температур в пределах от точки кипения воды. Газ содержали в баллончике, а в трубке находилась капля ртути, запирающая газ, расположенная горизонтально.
Закон Гей-Люссака (изобарный процесс p = const )
параметры газа в разные моменты времени.
Для газа данной массы при постоянном давлении отношение объема к температуре постоянно.
Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем. Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю поверхность поршня.
Выступление 3-й группы:
3. Изохорный процесс – процесс изменения состояния термодинамической системы, протекающий при постоянном объеме.
Для идеального газа изохорный процесс описывается законом Шарля.

Портрет Ж. Шарля
В 1787 году французский ученый Жак Шарль измерял давление различных газов при нагревании при постоянном объеме и установил линейную зависимость давления от температуры, но не опубликовал исследования. Через 15 лет к таким же результатам пришел и Гей-Люссак и, будучи на редкость благородным, настоял, чтобы закон назывался в честь Шарля.
Закон Шарля (изохорный процесс, V = const )
где - параметры газа в разные моменты времени
Для газа данной массы при постоянном объеме отношение давления к температуре постоянно.
Изохорным можно считать увеличение давления газа в любой емкости или в электрической лампочке при нагревании.
Читайте также:

