Галогены конспект урока 9 класс
Обновлено: 06.07.2024
Тип урока: изучение и первичное закрепление новых знаний.
Вид урока: проблемная лекция с элементами беседы.
Цели и задачи урока.
- Обучающий аспект: познакомить учащихся с элементами подгруппы галогенов; показать практическую роль галогенов и их соединений в природе и жизни человека.
- Воспитательный аспект: продолжить формирование научного мировоззрения, воспитание положительного отношения к знаниям.
- Развивающий аспект: продолжить развитие умений выделять главное, устанавливать причинно-следственные связи, вести конспект, проводить эксперимент, делать выводы, применять полученные знания на практике.
Методы и методические приемы.
- Словесные: диалогический метод изложения знаний с элементами исследования (при формировании теоретических и фактических знаний);
- наглядные: (для развития наблюдательности, повышения внимания);
- проблемно-поисковые: выполнение лабораторных опытов и демонстрационного эксперимента (для развития самостоятельности мышления, исследовательских умений, творческого подхода к процессу обучения);
- методы контроля и самоконтроля: текущий контроль знаний с помощью графического диктанта.
Структура урока.
Оборудование и реактивы.
Для лабораторных опытов (на каждую парту): штатив для пробирок, растворы хлорида натрия, бромида натрия, иодида натрия, нитрата серебра, чистые пробирки (3 штуки).
Для демонстрационного эксперимента: раствор карбоната натрия, раствор соляной кислоты, штатив для пробирок.
Эпиграф.
Оформление доски.
Дата, тема урока, домашнее задание, девиз (эпиграф – слова М.Фарадея). (Приложение 1. Слайд 3).
Ход урока.
I. Вступление.
Ознакомление с темой урока, целями и задачами урока. (Приложение 1. Слайд 2).
II. Основная часть.
1. Подготовка к восприятию нового материала. Мы с вами приступаем к изучению химических элементов подгруппы галогенов. Но для начала давайте вспомним, как взаимосвязаны положение химических элементов в ПСХЭ и строение их атомов.
2. Соединения галогенов. К важнейшим соединениям галогенов относятся галогеноводороды и их производные. Получить эти вещества можно взаимодействием соответствующих галогенов с водородом. Давайте рассмотрим этот процесс на примере хлороводорода (выполнить задание 2стр.89 в рабочей тетради). Один ученик пишет уравнения на доске, остальные работают в тетрадях. Проверяем задание. (Приложение 1. Слайд 5).
Н2 + Cl 2 = 2 HCl (получение в промышленности),
H 2 SO 4 (конц) + 2 NaCl = 2 HCl ↑+ Na 2 SO 4 (в лаборатории, реакция Глаубера).
Раствор хлороводорода в воде – это соляная (или хлороводородная кислота). Кислота сильная, поэтому ей свойственны все свойства сильных кислот. Давайте вспомним, какие свойства сильных кислот мы знаем (выполняем упр 4 (стр.90 в рабочей тетради). Два ученика пишут уравнения у доски (Приложение 1. Слайд 6).
Химические свойства соляной кислоты.
1) Диссоциация: HCl → H + + Cl - (кислая среда)
2) С металлами, стоящими в ЭРНМ левее водорода: Zn + 2 HCl = ZnCl 2 + H 2 ↑
3) С основными и амфотерными оксидами и гидроксидами:
CaO + 2 HCl = CaCl 2 + H 2 O
ZnO + HCl = ZnCl 2 + H 2 O
Ca ( OH )2 + 2 HCl = CaCl 2 + 2 H 2 O
Zn ( OH )2 + 2 HCl = ZnCl 2 + 2 H 2 O
4) С солями слабых кислот: Na 2 CO 3 + 2 HCl = 2 NaCl + CO 2 ↑ + H 2 O или в ионном виде:
Также сильными кислотами являются бромоводородная и иодоводородная кислоты, а вот фтороводородная (плавиковая) – слабая, ее диссоциация идет необратимо: HF ↔ H + + F -
Проводим физкультминутку (Приложение 1. Слайд 7).
Качественная реакция на галогенид-ионы. Чтобы обнаружить в растворах или в солях галогенид-ионы, проще всего воспользоваться раствором нитрата серебра AgNO3. Нитрат серебра реагирует с солями – галогенидами с образованием творожистого осадка. Ученики выполняют парную лабораторную работу (упр.11 стр.92 в рабочей тетради), пишут уравнения реакций в молекулярном и ионном виде, четверо работают у доски:
Ag + + Cl - = AgCl ↓ (белый осадок)
Ag + + Br - = AgBr ↓ (светло-желтый осадок)
Ag + + I - = AgI ↓ (желтый осадок)
По окончании работы обсуждаем результаты эксперимента, делаем вывод: качественной реакцией на галогенид-ионы является взаимодействие с катионом серебра. (Приложение 1. Слайд 9).
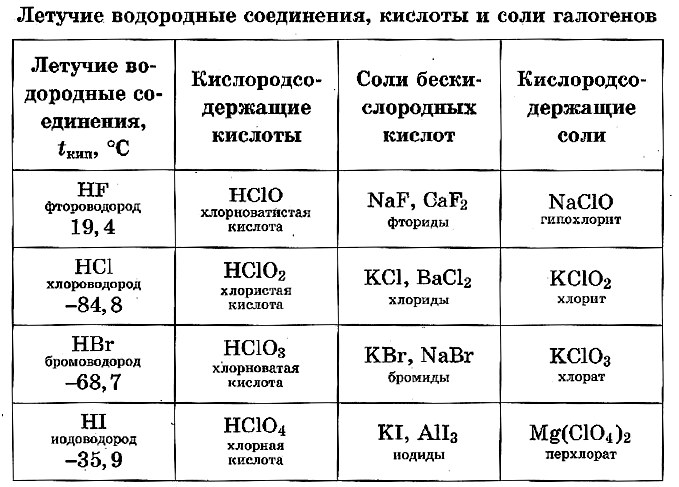
Кислородные соединения галогенов. Разберем их на примере кислородных соединений хлора. Существуют оксиды хлора Cl2O, ClO2 и Cl2O7 . Получить эти оксиды можно только из кислородных кислот хлора или солей хлора. Кроме оксидов, есть кислородные кислоты. (Учитель показывает карточки с формулами кислот, ученики пишут их в тетрадь, определяют степень окисления хлора в каждой кислоте). Проверяем выполненное задание. (Приложение 1. Слайд 10).
Все оксиды хлора по характеру кислотные, при растворении в воде образуют кислоты.
1) Cl 2 O + H 2 O = 2 HClO
2) ClO 2 + H 2 O = HClO 2 + HClO 3 (составить электронный баланс)
3) Cl 2 O 7 + H 2 O = 2 HClO 4. (Приложение 1. Слайд 11 ).
III. Заключительная часть.
Итак, мы сегодня изучали галогены и их важнейшие соединения. А теперь давайте проверим, что вы усвоили на сегодняшнем уроке. Для этого мы напишем небольшой химический диктант. Нужно вписать в предложения недостающие слова. (Приложение 1. Слайд 12).
Проверяем правильные ответы, выставляем оценки. (Приложение 1. Слайд 13).
А перед тем, как записать домашнее задание, давайте немного почитаем стихи (Приложение 1. Слайд 14).
Домашнее задание: § 19,упр3,4 (с115) по учебнику, 9,10(ГИА) по рабочей тетради; закончить уравнения электронного баланса. (Приложение 1. Слайд 15).

Задачи урока: • Воспитывающие: формировать умения работать в группе с выполнением различных социальных ролей; воспитывать толерантные отношения в группе; учить приемам рефлексии, развивать адекватную самооценку. • Развивающие: развивать познавательный интерес к предмету; формировать ключевые компетенции: умение проводить поиск, обработку, анализ, систематизацию информации; преобразовывать информацию из одной знаковой системы в другую; развивать практические навыки работы с лабораторным оборудованием, опорными конспектами; развивать умение логически излагать свою точку зрения в монологе и диалоге. • Обучающие: через систему познавательных задач сформировать представление о галогенах как типичных неметаллах; установить взаимосвязь между строением, свойствами и биологическим применением галогенов;
Содержимое разработки
Тип урока: изучение нового материала
Вид урока: проблемно-развивающий.
Задачи урока:
Воспитывающие: формировать умения работать в группе с выполнением различных социальных ролей; воспитывать толерантные отношения в группе; учить приемам рефлексии, развивать адекватную самооценку.
Развивающие: развивать познавательный интерес к предмету; формировать ключевые компетенции: умение проводить поиск, обработку, анализ, систематизацию информации; преобразовывать информацию из одной знаковой системы в другую; развивать практические навыки работы с лабораторным оборудованием, опорными конспектами; развивать умение логически излагать свою точку зрения в монологе и диалоге.
Обучающие: через систему познавательных задач сформировать представление о галогенах как типичных неметаллах; установить взаимосвязь между строением, свойствами и биологическим применением галогенов;
На столе преподавателя: пробирка с йодом, закрытая пробкой; спиртовка, спички, держатель для пробирок
На столах учащихся: тексты для изучения физических свойств галогенов; карты независимого расследования; алгоритм ОВР, раствор йода (бледно желтый), раствор крахмала, кусочек хлеба, майонез, кетчуп.
1. Ориентировочно-мотивационный этап.
Сегодня на уроке мы с вами работаем в группах (5 групп учащихся по количеству рассматриваемых веществ). Все проблемы решаем вместе.
Изучение неметаллов мы начинаем со знакомства с самыми активными неметаллами – галогенами (солеродами). Почему данное семейство получило такое название? (Ответ на поставленный вопрос учащимся предстоит дать в ходе урока)
2. Операционально-исполнительский.

Изучить галогены как представители неметаллов, при этом рассмотреть строение атома, физические и химические свойства.
Российская Федерация
Краснодарский край г. Сочи, Лазаревский район
Управление по образованию и науке администрации города Сочи
Муниципальное общеобразовательное бюджетное учреждение
гимназия № 76 имени Кононцевой Г.В. г. Сочи

354207 г. Сочи, Л-207, ул. Гайдара, 11, тел. 252-29-91, факс (862) 252-29-92
Разработка урока по химии в 9 классе по теме:
Общая характеристика галогенов, их физические химические свойства
Разработала учитель химии: Егиазарова В.В.
Сценарий урока
1этап . Организационный момент -1мин
Учитель: Доброе утро, я приветствую вас на уроке химии. Садитесь. Готовьтесь к уроку (наличие учебных принадлежностей).
Работа с дежурным класса( отсутствующие).
2 этап. Мотивация -3 мин
Учитель: Прежде чем назвать тему сегодняшнего урока, давайте внимательно посмотрим видеоролик, в котором говорится о тех химических элементах, которые мы будем сегодня изучать.( просмотр видеоролика о химических веществах хлоре, фторе, йоде)
Учитель: Итак, о каких же химических элементах говорилось в видеофрагментах?
Учащиеся: О хлоре, фтор и йоде.
Учитель: давайте вместе сформулируем цель урока.
3 этап. Целепологание-1 мин
Цель урока: изучить галогены как представители неметаллов, при этом рассмотреть строение атома, физические и химические свойства.
Для этого необходимо решить следующие:
задачи:
- рассмотреть местоположение галогенов в ПСЭ, а также их особенности на атомном и молекулярном уровне;
- изучить физические и химические свойства галогенов;
- показать роль галогенов в жизни человека.
Тип урока: урок – изучение нового материала с сочетанием фронтального и индивидуального вида работы учащихся.
Оборудование: интерактивная доска, проектор, мультимедийная презентация, Цоры.
4 этап. Основная часть-25 мин
Все началось с поваренной соли. Одна из дорог, ведущих из Рима к местам соледобычи, так и называлась – Соляная дорога. Это древнее название сохранилось и по сей день.
Какую среду имеют соли и чему численно равно РН соли?
Сейчас мы определим с вами РН раствора соли и посмотрим, действительно ли галогены образуют соли (лабораторный опыт с датчиком РН).
Где еще в быту мы сталкиваемся с названиями галогенов?
Учащиеся: Например, в водопроводной воде ощущается слабый запах хлора, которым чаще всего обеззараживают воду. Слабый запах хлора чувствуем также при стирке белья, добавляя в воду отбеливатель.
Учитель: С другим галогеном – бромом - вы не сталкивались. Но его соединения могут быть вам знакомы. Например, бромид серебра(1). Это соединение желтоватого цвета содержится на фотопленке и фотобумаге.
Учитель: встречали ли вы в быту йод?
Учащиеся: Третий представитель галогенов – йод – встречался, конечно, каждому из нас, так как он имеется в домашней аптечке в виде йодной настойки. Также йод входит в состав гормонов щитовидной железы. В пищу, мы употребляем йодированную соль.
Учитель: С четвертым галогеном – фтором вы не встречались. А соединения фтора, называемые фреонами, входят в состав хладагентов домашних холодильников. Помимо этого, фторид олова(II) входит в состав зубных паст.
Астат. С ним никогда вы точно не встречались. Этот галоген – короткоживущий радиоактивный элемент.
Атомарный уровень организации галогенов. ( Строение атома)
Учитель: Мы сейчас рассмотрим положение галогенов в ПСХЭ Менделеева и строение атома.
Перед вами Задание 1.(зашифрованное письмо) В 7-этажном доме на улице имени Д.И. Менделеева в 7 подъезде жили химические элементы – галогены. Расселились они по этажам, соблюдая строгую субординацию и в зависимости от своего богатства и прихотей. Те, которые очень любят полетать – повыше, которым это удается с трудом, расположились на нижних этажах. Но вместе их объединило одно обстоятельство.
Задание: Обсудите информацию, зашифрованную в этом тексте. Перескажите этот текст, используя химические термины и понятия. Дайте характеристику по положению в ПСХЭ.
Учащиеся: Галогены расположены в периодической системе Д. И.Менделеева в 7 группе ,главной подгруппе. Окислительные свойства галогенов возрастают в ряду от астата к фтору. Фтор самый сильный окислитель, астат самый слабый окислитель. Общее у них на внешнем энергетическом уровне по 7 электронов – они все могут проявлять с. о. -1, т. е принимать один электрон.
У доски один учащийся выполняет задание.
ФИЗИЧЕСКАЯ МИНУТКА
Учитель: Перед вами Задание 2. Физические свойства ( работа с учебником, интерактивное задание)
Галогены не любят показывать свое лицо, обычно они прячутся за спинами других. Иногда, в экстремальных обстоятельствах, они появляются на свет и тогда все любуются их красивыми нарядами, но при этом страдают от крайне неприятного запаха.
Задание: Обсудите информацию, зашифрованную в этом тексте. Перескажите этот текст, используя химические термины и понятия.
Учащиеся: В этом задании речь идет о физических и химических свойствах галогенов .
Учитель: Все верно, давайте рассмотрим физические свойства галогенов у доски и используя таблицу №7 на стр. 105 учебника.
Один ученик работает у доски, ему помогает класс.
Вывод: с увеличением молекулярной массы галогена повышается их температура плавления и кипения , возрастает плотность фтор и хлор –газы, бром-жидкость, йод-твердое вещество. Это связано с тем, что с увеличением размеров атомов и молекул галогенов возрастают и силы межмолекулярного взаимодействия между ними.
Учитель: Химическая активность галогенов от фтора к йоду ослабевает.
Переходим к химическим свойствам , более подробно рассмотрим свойства фтора и хлора.
Хлор хвалился: «Нет мне равных!
Галоген я - самый главный.
Зря болтать я не люблю:
Йод красой своей гордился,
Твердым был, но испарился.
Фиолетовый как ночь,
Далеко умчался прочь.
Бром разлился океаном,
Хоть зловонным. Но румяным.
Бил себя он грозно в грудь:
Фтор молчал и думал:
Каждый галоген является самым сильным окислителем в своем периоде, Окислительные свойства отчетливо проявляются при взаимодействии с металлами , при этом, как вы уже знаете, образуются соли. Так, фтор при обычных условиях реагирует с большинством металлов , при нагревании и с золотом, серебром, платиной, известными своей химической пассивностью.
Уравнения реакции приведены в презентации к уроку (слайд 13-17)
Нагретый порошок железа загорается при взаимодействии с хлором
( виртуальный опыт, слайд 17)
5 этап. Закрепление-5мин
Учитель: Задание: соотнести начало и конец уравнений реакций

Решение задачи на интерактивной доске
Вычислите объем хлора (н.у.), который потребуется для вытеснения всего иода из 300г 15% раствора иодида калия. Вычислите количество вещества новой соли, которое при этом образуется.
6 этап. Рефлексия-3 мин
Учитель: Подведем итог урока.
И нтересные факты
Т ермины
О ценка
Г лавный вывод
7 этап. Творческие задания на дом -2мин
Решите задачу:
Определите объем хлора (н.у), который образуется при действии на 5,8 г перманганата калия раствора соляной кислоты массой 100 г, с массовой долей кислоты 36%.
Габриелян О.С. Химия, Учебник для общеобразовательных учреждений 9 класс, М. Дрофа, 20014;
Габриелян О.С., Остроумов И.Г. Настольная книга учителя, 9 класс, М.Дрофа, 2009;
Гузей Л.С., Сорокин В.В., Суровцева Р.П. Учебник для общеобразовательный учреждений Химия 8 класс, М., Дрофа, 2008

Галогены. Элементы VIIA-группы. Хлор, фтор
Ключевые слова: галогены, VIIA-группа, хлор, фтор, бром, йод, характеристика элемента, строение галогенов, получение хлора.
Раздел ОГЭ: 3.1.2. Химические свойства простых веществ-неметаллов: водорода, кислорода, галогенов, серы, азота, фосфора, углерода, кремния
ХАРАКТЕРИСТИКА ЭЛЕМЕНТА ХЛОР
Высший оксид хлора – оксид хлора (VII) Cl2О7 – кислотный оксид, высшим гидроксидом хлора является хлорная кислота НСlO4 (сильная кислота).
Водородное соединение хлора – хлороводород НCl (газ при обычных условиях), его водный раствор – соляная кислота, сильный электролит.
ХАРАКТЕРИСТИКА ЭЛЕМЕНТА ФТОР
В атоме фтора нет вакантных орбиталей на втором энергетическом уровне для перехода атома в возбуждённое состояние. Переход на вакантные орбитали третьего энергетического уровня потребовал бы слишком больших затрат энергии, следовательно, фтор может быть только одновалентен.
Электроотрицательность фтора среди других элементов максимальна (∼4,0 по шкале Полинга). Следовательно, для фтора невозможны положительные степени окисления. Возможные степени окисления фтора: 0 (F2) и –1 (HF, KF и т. д.).
СТРОЕНИЕ ГАЛОГЕНОВ – ПРОСТЫХ ВЕЩЕСТВ
Галогенам не присуща аллотропия, каждому элементу – галогену (Hal) соответствует одно простое вещество Наl2. Галогены – вещества молекулярного строения.
При обычных условиях фтор F2 – зеленовато–жёлтый газ; хлор Cl2 – жёлто–зелёный газ; бром Вг2 – красно–бурая жидкость, примерно в 3 раза тяжелее воды; йод I2 – фиолетово–чёрные кристаллы с металлическим блеском. Все галогены обладают характерным запахом.
Хлор, бром, йод умеренно растворимы в воде, их растворы называются соответственно хлорной, бромной и йодной водой (фтор с водой реагирует).

ПОЛУЧЕНИЕ ХЛОРА
В промышленности хлор получают электролизом расплава поваренной соли.
Лабораторные способы получения хлора основаны на окислении хлора в соляной кислоте с помощью таких окислителей, как перманганат калия, дихромат калия или диоксид марганца. Приведём примеры этих реакций:
Конспект урока по химии «Галогены. Элементы VIIA-группы. Хлор, фтор «. Выберите дальнейшее действие:
Читайте также:

