Электронные конфигурации атомов химических элементов 11 класс конспект урока
Обновлено: 06.07.2024
Ключевые слова конспекта: строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева, завершенный электронный слой, валентный слой, энергетические уровни, правило октета, орбиталь,
Электронная оболочка атома — это все электроны атома. Электроны в электронной оболочке атома расположены слоями. Электроны в разных слоях различаются энергией взаимодействия с ядром атома. Чем дальше от ядра находится электрон, тем меньше энергия его взаимодействия с ядром.
Вместимость электронных слоев различная. В слое № 1, или в первом слое, у всех элементов, кроме водорода, находится 2 электрона. (В атоме водорода всего 1. электрон, и он — в первом слое.) Во втором слое может находиться не больше восьми электронов. В третьем слое максимально может расположиться 18 электронов. В четвертом слое максимально бывает 32 электрона.
Если N — максимальное число электронов на электронном слое с номером n, то для определения числа N можно воспользоваться формулой N = 2n 2 .
Завершенный электронный слой — это слой в атоме, содержащий максимально возможное для него число электронов.
Электронные слои заполняются так: сначала первый, потом второй и последующие — по мере уменьшения энергии их взаимодействия с ядром. Расположение по слоям электронов в атомах водорода, кислорода и магния:
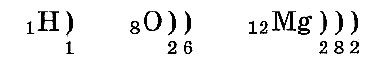
Число электронных слоев атома равно номеру периода химического элемента в таблице Менделеева. Поэтому у атома водорода один электронный слой, у кислорода — два слоя, а у магния — три слоя.

Зная максимальное число электронов в каждом электронном слое атома, можно составить схему расположения электронов по слоям в заданном элементе. Электронные слои атомов называют энергетическими уровнями.
Химические свойства атомов определяются свойствами их электронов. Движение электронов в атоме описывают с привлечением понятия орбитали. Каждый электрон в атоме находится на своей орбитали.

Орбиталь — это часть электронного облака, создаваемого электронами при движении в атоме. Орбиталь — это пространство около ядра, где чаще всего находится электрон.
Электроны первых 30 химических элементов от водорода до цинка размещены на орбиталях трех видов — s , р и d . Вместимость любой орбитали — два электрона. На 1-м энергетическом уровне одна s-орбиталь.
Таблица. Строение электронных оболочек атомов
первых 20 элементов Периодической системы Д.И. Менделеева

Приведем некоторые сведения, которые следуют из электронной формулы атома на примере атома фтора: F 1s 2 2s 2 2р 5 .
Фтор — элемент 2-го периода, т.к. в его электронной формуле два электронных слоя. Сумма всех надстрочных индексов — 9 (общее число электронов), это и атомный номер фтора. Элементы, у которых очередные электроны помещаются на s- и р-орбиталях, относятся к главным подгруппам таблицы Менделеева. Сумма электронов 2-го внешнего слоя дает номер группы — VII.

С помощью этого видеофрагмента учащиеся смогут вспомнить электронную классификацию элементов s-, p-, d-, f-семейства. На конкретных примерах увидят электронно-графические формулы атомов химических элементов.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Электронные конфигурации атомов"
Общее число электронов равно заряду ядра атома, числу протонов в нем и соответственно атомному номеру элемента.

Например, у водорода атомный номер один, значит заряд ядра атома тоже плюс один, а протонов и электронов по одному.

Распределение электронов происходит в зависимости от энергии по энергетическим уровням, письменное выражение которых называется электронной формулой или электронной конфигурацией атома.
Например, у лития, элемента с атомным номером три, электронная конфигурация один эс два два эс один.

В этой конфигурации цифрой слева записывается номер энергетического уровня, затем следует буква, обозначающая подуровень, и, наконец, цифра вверху справа указывает число электронов на этом подуровне.
Схематически электронное строение атома изображается с помощью электронно-графической схемы. Электронно-графическая схема атома лития:
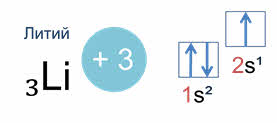
Орбитали обозначаются клеточками, а электроны стрелочками. На первом энергетическом уровне на эс орбитали находятся два спаренных электрона, а на втором уровне на эс орбитали только один неспаренный электрон.
По принципу минимальной энергии, электрон занимает тот энергетический уровень, тот подуровень или ту атомную орбиталь, которым соответствует минимальный запас энергии. Это значит, что вначале заполняются те уровни, подуровни и орбитали, которые находятся ближе к ядру.
Например, у атома азота вначале заполняется одна эс орбиталь первого энергетического уровня двумя электронами, а затем второго энергетического уровня два эс орбиталь – двумя электронами и два пэ орбиталь того же уровня – тремя электронами.
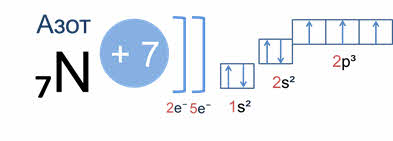
Орбитали в атомах элементов первых трех периодов заполняются электронами в порядке увеличения их энергии.
В атоме не может быть двух электронов, у которых все четыре квантовых числа охарактеризованы одинаковыми значениями, так гласит принцип австрийского ученого Вольфганга Эрнста Паули.

Хотя бы одним значением квантового числа электроны должны отличаться. Из этого принципа следует следствие: на каждой орбитали максимально может находиться не более двух электронов, причём с противоположными спинами.
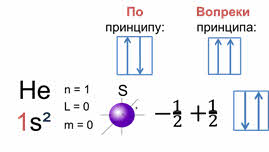
В качестве примера рассмотрим электронную формулу атома гелия – один эс два. Главное квантовое число, которого равняется одному, значит, побочное квантовое число будет равняться нулю, и соответственно всего один подуровень эс и одна орбиталь в форме сферы. Магнитное орбитальное квантовое число также равно нулю, так как оно равно сумме значений положительного отношения один к двум и отрицательного отношения один к двум. А эс подуровень атома гелия заполняется всего двумя электронами. Поскольку на первом электронном слое могут находиться максимально только два электрона, то этот слой в атоме гелия является завершённым и, следовательно, очень устойчив.

У атомов элементов второго периода начинает заполняться второй энергетический уровень, на котором может находиться максимально восемь электронов.
Так у атомов лития и бериллия электронами заполняется только два эс орбиталь.
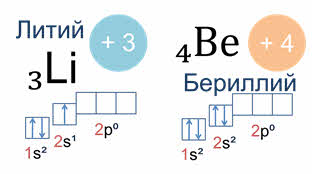
А у атома бора пятый электрон уже занимает одну из трёх два пэ орбиталей. Вот так выглядят электронная и электронно-графическая формулы атома бора.
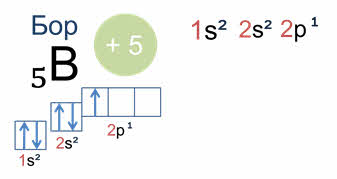
Подуровень два пэ изображён вплотную к подуровню два эс, но несколько выше. Тем самым подчёркивается его принадлежность к одному и тому же уровню и одновременно больший запас энергии.
По правилу немецкого учёного Генриха Хунда в пределах определённого подуровня электроны располагаются таким образом, чтобы суммарный спин был максимальным.

Электроны сначала заполняют все пустые орбитали одного подуровня по одному, а если число электронов больше, чем число орбиталей, то по два. Однако в атоме имеются атомные орбитали с одинаковым запасом энергии, но расположенные на различных энергетических уровнях.
В таком случае применяем правило русского ученого Всеволода Маврикиевича Клечковского: энергия электронов в атоме определяется суммой значений главного и побочного квантовых чисел, поэтому, сначала заполняются электронами те энергетические уровни и подуровни, для которых сумма значений главного и побочных квантовых чисел минимальна.
Рассмотрим первый элемент четвертого периода – калий.
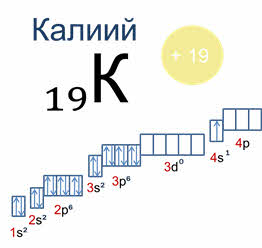
У него появляется четвёртый электронный слой, открывающийся эс подуровнем. Однако в третьем периоде был только завершен подуровень пэ у аргона.
Возникает вопрос: вначале будет заполняться три дэ или четыре эс подуровень? На три дэ подуровне сумма главного и побочного чисел равна пяти. А сумма главного и квантового чисел четыре эс подуровня равна четырем. Приходим к выводу, что четыре меньше пяти.
Значит энергия подуровня четыре эс несколько меньше, чем подуровня три дэ.

Заполняется первым четыре пэ подуровень или три дэ подуровень, если значения сумм главного и побочного квантовых чисел на двух подуровнях равны пяти? Вспомним принцип минимальной энергии: энергия на три дэ подуровне меньше, чем на четыре пэ, следовательно, вначале будет заполняться три дэ подуровень.

Поэтому в этом случае только после того как заполнился четыре эс подуровень, начинает заполняться электронами дэ подуровень третьего, теперь уже предвнешнего, энергетического уровня.
В атоме каждый электрон располагается так, чтобы его энергия была минимальной, что отвечает наибольшей связи его с ядром. А энергетические уровни и подуровни выражаются общей формулой распределения, но необходимо не забывать при заполнении все правила и принципы электронной конфигурации атомов.
Рассмотрим, как происходит заполнение электронами атомов элементов второго и третьего периодов.
У элементов второго периода согласно принципу минимальной энергии, вначале заполнится первый энергетический уровень, а затем будет заполняться по принципу Паули, правилу Хунда – второй энергетический уровень.
На втором энергетическом уровне максимально может находиться только восемь электронов, поэтому электронный слой атома неона является завершенным и очень устойчивым.

В атомах элементов третьего периода начинает формироваться третий электронный слой. Сначала заполняется электронами эс подуровень у натрия и магния, а затем пэ подуровень у алюминия, кремния, хлора и аргона. В атоме аргона на внешнем электронном слое находится восемь электронов.
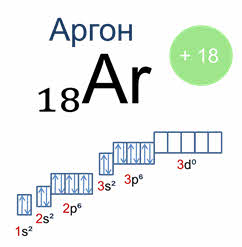
Следовательно, он завершён, так как в атоме любого элемента на внешнем энергетическом уровне максимально может находиться не более восьми электронов. Застраивание третьего электронного слоя этим не исчерпывается. В соответствии с формулой число электронов на уровне равно произведению два на эн в квадрате максимально на нём может находиться 18 электронов: восемь на эс и пэ-подуровнях и десять на дэ подуровне.

В зависимости от того, на какой атомной орбитали находится последний электрон, химические элементы можно разделить на следующие семейства: эс, пэ, дэ, эф.
Принадлежность химического элемента к тому или иному электронному семейству можно определить по электронной конфигурации, которая показывает расположение электронов на энергетических уровнях и орбиталях атомов. Записать такую формулу можно с помощью периодической системы Дмитрия Ивановича Менделеева. Для элементов малых периодов, состоящих только из главных подгрупп, это совсем не сложно. Например, сера, элемент номер 16 расположенный в третьем периоде, главной подгруппе шестой группы. Следовательно, ядро ее атома имеет заряд плюс 16, на электронной оболочке, которой располагается 16 электронов. На первом уровне 2 электрона на один эс орбитали, на втором уровне два электрона на два эс орбитали и 6 электронов на два пэ орбитали. На третьем уровне два электрона на три эс орбитали, четыре электрона на три пэ орбитали. Значит сера — это элемент, относящийся к пэ семейству, потому что последний ее электрон располагается на три пэ орбитали.
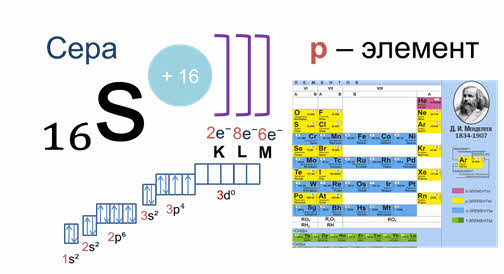
Для элементов побочных подгрупп следует учитывать тот факт, что у атомов этих элементов строится не внешний уровень. На нем, как правило, будут находиться не два эс электрона, а дэ орбитали предвнешнего уровня. На них может поместиться не более десяти электронов.
Например, строение электронной оболочки элемента номер 22 титана, который расположен в четвертом периоде побочной подгруппы IV группы Периодической системы Дмитрия Ивановича Менделеева.

Следовательно, ядро его атома имеет заряд плюс 22 и на электронной оболочке находятся 22 электрона: на первом уровне два электрона на один эс орбитали, на втором уровне восемь электронов, на два эс орбитали два электрона и шесть электронов на два пэ орбитали. На внешнем, четвертом – два эс электрона как у элемента побочной подгруппы, и остальные 10 электронов – на третьем уровне (два на три эс орбитали, шесть на три пэ орбиталях и оставшиеся два на три дэ орбиталях). Значит титан это дэ элемент, так как последний электрон в его атоме располагается на незавершенной – три дэ орбитали.
Распределение электронов в атоме по энергетическим уровням, подуровням и орбиталям отображают с помощью электронных конфигураций и электронно-графических схем. Для правильного заполнения атомных орбиталей электронами необходимо применять принцип минимальной энергии, принцип Паули, правило Хунда и правило Клечковского.
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Тема: Электронные конфигурации атомов хим. элементов.
1 . Изучить основные закономерности заполнения энергетических подуровней электронами. Научить учащихся составлять электронные формулы атомов. Представить электронную конфигурацию атомов хим.эл-тов. Электронно-графические формулы атомов хим.эл-тов. Провал ē.
2. Развивать внимание, память, речь, аналитическое мышление, способность делать выводы.
3. Воспитывать любовь к предмету.
Тип урока: комбинированный
Метод: рассказ с элементами беседы
Что такое электронное облако ?
Чем отличается 1 s -орбиталь от 2 s -орбитали?
Что такое главное квантовое число? Как оно соотносится с номером периода?
Что такое подуровень и как это понятие соотносится с номером периода?
III . Изучение нового материала:
Раньше учёные полагали, что ē движется вокруг ядра атома и удерживается на определённом расстоянии от него. Но это не так. ē при движении может находиться на различных расстояниях от ядра. Расположение атомной орбитали относительно ядра, её форма и размеры определяются запасом энергии, которым обладают находящиеся на ней ē. Чем меньше запас энергии ē, тем сильнее притягивается он к ядру и тем меньше по размерам его орбиталь.
А) ē, который при движении образует облако шаровой (сферической) формы, называют s -электронами , а орбиталь – s -орбиталь. Для каждого значения n существует одна s -орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере ↑ значения n .
Б) электронное облако может иметь форму гантели. Гантелевидные облака с одинаковым запасом энергии расположены в пространстве по взаимоперпендикулярным осям координат x , y , z , проведённых через ядро атома. Это р-облака. Каждое из них вмещает р-электроны . С ↑ значения n электроны занимают р-орбитали, расположенные на больших расстояниях от ядра и направленные по осям x , y , z .
Помимо s - и р-облаков, существуют d - и f -облака. Они более сложные по строению. (рис.4стр.11 )
Обычно ē стремятся занять наиболее близкое к ядру положение, соответствующее меньшему запасу энергии: сначала заполняются s -орбиталь, потом р-орбиталь. ē занимают d - и f -орбитали лишь тогда, когда s - и р-орбитали уже заполнены.
1s 1 =4f 14 10 1 = 5f 14 10
У элементов 4-го и 5-го периодов первые 2 ē занимают соотв. 4 s - и 5 s -орбитали. Начиная с 3-го эл-та каждого большого периода , последующие 10 ē поступят на предыдущие 3 d - и 4 d -орбитали соответственно ( у эл-тов побочных подгрупп).
У эл-тов 6го и 7-го периодов первые 2 ē поступят на внешний s -подуровень, следующий 1 ē ( у La и Ac ) на предыдущий d -подуровень. Затем 14 ē поступят на третий снаружи энерг. уровень на 4 f - и 5 f -орбитали соотв. у лантаноидов и актиноидов. Затем снова начнёт застраиваться второй снаружи энерг. уровень ( d -подуровень): у элементов побочных подгрупп, и, наконец, только после заполнения десятью электронами d -подуровня будет снова заполняться внешний р-подуровень.
Электронная конфигурация атома –
показывает распределение ē по энерг. уровням и подуровням.
+1 Н 1 s 1 ← число ē с данной формой облака
↑↖ форма электронного облака
Графические электронные формулы (изображения электронной структуры атома) –
показывает распределение ē по энерг. уровням, подуровням и орбиталям.
I период: +1 Н
Где ↑ - ē, ↑↓ - ē с антипараллельными спинами, орбиталь.
(Работа с электронными и графическими электронными формулами).
Напр ., H +1 1s 1 ; He +2 1s 2 ; Li +3 1s 2 2s 1 ; Na +11 1s 2 2s 2 2p 6 3s 1 ; Ar +18 1s 2 2s 2 2p 6 3s 2 3p 6 ;
I период: водород и гелий – s -элементы , у них заполняется электронами s -орбиталь.
II период: Li и Be – s -элементы
B , С, N , O , F , Ne – р-элементы
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы делят на 4 электронных семейства или блока:
1) s -элементы – у них заполняется ē-ми s -подуровень внешнего слоя атома; к ним относятся водород, гелий и эл-ты гл.п/гр. I и II групп.
2) р-элементы – у них заполняется электронами р-подуровень внешнего уровня атома; к ним относят элементы гл.п/гр. III - VIII групп.
3) d -элементы – у них заполняется электронами d -подуровень предвнешнего уровня атома; к ним относятся эл-ты побоч.п/гр. . I - VIII групп,т.е. эл-ты вставных декад больших периодов, распложенные между s - и р-элементами, их также называют переходными элементами.
4) f -элементы - у них заполняется электронами f -подуровень третьего снаружи уровня атома; к ним относятся лантаноиды ( 4 f -элементы) и актиноиды (5 f -элементы).
29 Cu 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 1 3 d 10
24 Cr 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 1 3 d 5
IV . Закрепление: 1. № 3, 4, 7 стр.23 (письм.).
3.Как определяется принадлежность элемента к тому или иному электронному семейству?
Конспект урока по химии ""Строение электронных оболочек атомов". Урок составлен по сингапурской метдике.
| Вложение | Размер |
|---|---|
| stroenie_elektronnyh_obolochek_atomov._singapur.ur_.himiya_11_kl.docx | 19.01 КБ |
Предварительный просмотр:
Конспект урок по химии на тему:
Строение электронных оболочек атомов.
Цель урока: Сформировать представление о строении электронной оболочки атомов.
Образовательная задача: продолжить формирование умения извлекать информацию из ПСХЭ;
Развивающая задача: продолжить развитие умений объяснять при выполнении заданий, делать выводы и анализировать;
Воспитательная задача: продолжить формирование мировоззрений, представление о единичном и целом, развитие элементов эстетического восприятия
комбинированный с элементами обучающих структур ( LEARNING STRUCTURES ).
Оборудование: карточки с заданиями, аудиопроигрыватель, ноутбук, доска со слайдами.
Прослушивание аудиозаписи о планетарной модели строения атома . Выполняется структура ЭЙ АР ГАЙД
Перед прослушиванием ученики определяют, считают ли они утверждения верными или неверными. После прослушивания ученики снова отвечают на те же вопросы.
Ученики обсуждают, где они столкнулись с информацией, которая изменила их мнение.
Электронная оболочка атома - совокупность всех электронов атома.
Количество электронов данного атома определяется порядковым номером (атом в целом нейтрален, число электронов вокруг ядра равно числу протонов в ядре). Электроны расположены в атоме не хаотично, а послойно. Положительно заряженное ядро притягивает электроны. Чем ближе электроны к ядру, тем сильнее притяжение и тем меньше энергии необходимо электронам, чтобы удержаться на своей орбите.
Энергетический уровень (электронный слой) – совокупность электронов с близким значением энергии.
Электроны внешнего (наружного) энергетического уровня обладают наибольшим запасом энергии и наименьшей связью с ядром.
Число энергетических уровней определяется номером периода ХЭ в ПСХЭ.
Максимальное число электронов на данном энергетическом уровне определяется по формуле:
N – максимальное число е- на уровне
n – номер уровня
С помощью структуры СИНГЛ РАУНД РОБИН ученики определяют максимальное число электронов на энергетическом уровне, записывают свои ответы.
Проверяются ответы (по слайду)
С помощью структуры МИКС-ФРИЗ-ГРУП сделаем следующее действие:
У каждого есть по одной карточке. Участники, у которых карточки с количеством электронов на энергетическом уровне, найдите свой химический элемент.
На внешнем Е уровне не может находиться более 8 электронов (для элементов 1 периода – не более 2-х).
Число электронов на внешнем Е уровне соответствует номеру группы ПСХЭ, в которой находится ХЭ.
Завершенный Е уровень – уровень, содержащий максимально возможное число электронов.
Незавершенный е уровень – уровень, содержащий меньше максимального количества электронов.
Электронные схемы атомов.
Каждый новый электрон поступает на внешний Е уровень атома, а если он завершается – начинается заполнение нового Е уровня.
С помощью структуры ФО БОКС СИНЕКТИКС ученики пишут химические элементы и с помощью структуры КОНТИНИУС РАУНД РОБИН записывают электронные схемы атомов.
Общее число электронов вокруг ядра равно заряду ядра (соответствует порядковому номеру ХЭ в ПСХЭ).
Электроны расположены на Е уровнях, число которых определяется номером периода в ПСХЭ, в котором находится ХЭ.
Число электронов на внешнем Е уровне соответствует номеру группы ПСХЭ, в которой находится ХЭ.
На внешнем Е уровне не может находиться более 8 электронов.
Повторить периодический закон и структуру периодической системы.
По теме: методические разработки, презентации и конспекты

Тест "Строение атома. Строение электронных оболочек атомов"
Ученикам: Выберите один правильный ответ. Обратите внимание вы должны уметь расписывать электронное строение атомов 20 первых элементов расположенных в ПСХЭ Д.И.Менделеева. Удачи! Тест для 9 класса. .
план-конспект урока Тема урок: Строение электронных оболочек атомов химических элементов №1-20
Тема: Строение электронных оболочек атомов химических элементов №1-20Цель: сформировать у учащихся представления об электронной оболочке атома и энергетических уровнях;рассмотреть электронное строение.

Проверочная работа по теме "Строение атома. Электронные оболочки атомов", 8 класс

Тест "Строение атома. Электронная оболочка атома"
Тестовая работа включает 10 вопросов, 4 варианта. Задания на выбор одного верного ответа из четырех предложенных, задания на соответствие.

Примеры заданий по теме: Строение атома. Строение электронных оболочек атомов
Разработка представляет собой подборку заданий по теме: "Строение атома. Строение электронных оболочек атома"(задание 1). Задания могут быть использованы.
Учебное занятие по изучению и первичному закреплению новых знаний и способов деятельности сформировать у учащихся представления об электронной оболочке атома и энергетических уровнях;рассмотреть .
Читайте также:

