Электронное и пространственное строение алканов 10 класс конспект
Обновлено: 06.07.2024
Технология обучения: информационно-коммуникационная.
Тип учебного занятия: урок-практикум.
Формы организации познавательной деятельности: индивидуальная.
Тема урока “Пространственное строение молекул предельных углеводородов”.
Считай несчастным тот день или тот час, в который ты не усвоил ничего нового и ничего не прибавил к своему образованию. (Я.А. Коменский)
Эти слова замечательного педагога, который 300 лет назад стал основателем урочной системы обучения.
Наша с вами задача с делать нас сегодня “счастливыми”. Немного прибавить новых знаний и стать более грамотными.
2. Этап подготовки учащихся к активному и сознательному усвоению нового материала; актуализация знаний.
В 1861 г. нашим соотечественником А.М.Бутлеровым были сформулированы основные положения теории химического строения. Ее основная идея заключается в том, что свойства веществ обусловлены не только качественным и количественным составом молекул, но и их строением. Говоря о “химическом строении”, Бутлеров понимал последовательность соединения атомов в молекулы в соответствии с валентностью этих атомов.
Молекулы каждого вещества имеют вполне определенное строение, которое может быть установлено экспериментально и передано структурной формулой.
Теория строения дала в руки химиков мощный инструмент познания, который обеспечил возможность понимания свойств известных веществ и прогнозирования свойств еще не известных соединений. Ее создание явилось одним из величайших научных открытий и на многие годы определило прогресс химической науки.
Однако для дальнейшего продвижения вперед требовалось более глубокое проникновение в закономерности строения молекул. Это хорошо понимал и А.М.Бутлеров.
Он предвидел, что развитие теории пойдет по двум основным направлениям:
1) изучение реального пространственного строения молекул;
2) выяснение природы химической связи.
Время подтвердило правильность этих прогнозов. Оказалось, что носителями химической связи являются электроны, появились и методы изучения и описания пространственной структуры молекул. Поэтому сейчас, говоря о строении молекул, мы имеем в виду три его стороны: химическое, электронное и пространственное строение.
Когда мы задумываемся над значением органических соединений, поражает не столько широта их распространения, сколько неисчислимое богатство видов органических молекул.
Вопрос: Что же лежит в основе их многообразия?
Ответ: Способность атома углерода образовывать цепи различной длины.
Другим источником необычайного многообразия органических соединений является существование изомеров –веществ, молекулы которых имеют одинаковый качественный и количественный состав, но разное химическое строение
Изомеры можно сравнить с аллотропными модификациями в неорганической химии- состав так же одинаковый, а строение и свойства разные, например, алмаз и графит.
На предыдущем уроке мы с вами начали знакомство с классом предельных угдеводородов- алканы. Давайте вспомним основные характеристики данного класса:
Почему класс так назван?
Какие вещества мы называем изомерами?
От чего зависит изомерия предельных углеводородов?
Из предложенных формул веществ выберите изомеры:

Постройте изомеры состава С5Н12 - пентан. Эти изомеры нам пригодятся для дальнейшего этапа урока. (Cпросить у доски).
Современные представления о строении вещества не сводятся только к установлению порядка соединений атомов, но также включают рассмотрение пространственного строения молекул и электронной природы химических связей.
Существуют разные способы записи формул органических веществ. Предлагается написать молекулярную, электронную, структурную формулы метана, выяснить, что они показывают.
СН4 – молекулярная формула (качественный, количественный состав);
– электронная формула (ковалентная полярная связь);
– структурная формула (порядок соединения атомов в молекуле).
Но данные формулы не отражают истинного строения молекул метана. Молекула метана не имеет плоского строения, как можно представить на основании структурной формулы.
Но как же эти вещества выглядят в пространстве?
Молекулы алканов имеют пространственное тетраэдрическое строение, углы между связями 109, 280, поэтому атомы углерода соединяются между собой зигзагообразно:



Эти молекулы могут и вращаться, образуя конформации. Конформация (поворотные изомеры) - различные геометрические формы молекул, переходящие друг в друга путем вращения вокруг С-С связей. При обычных температурах конформации легко переходят друг в друга.

Конформации молекул пентана.
4. Этап закрепления знаний.
Как же это всё увидеть? В этом нам поможет работа в программе Chem Sketch.
5. Этап подведения итогов урока, домашнее задание.
Д.з. - на страничке Дневник.ру.
6. Оценочно-рефлексивный. Оцените своё состояние на уроке, оставив картинку на компьютере.
Образовате льная: по нять пространст венное строение метана и его гомологов.
Развивающая: развитие простра нственног о воображения учащихся,
совершенствов ание у мения у станавливать л огические связи между изу ченным и
Воспитательная - воспитание сотрудн ичества при работе на у роке.
А. Вспомним строение атома у глерода (на доске у ченик). ( слайд № 2)
Б. Просмотр на компьютере форм элект ронных орбиталей и перех од основ ного
состояния атом а углерода в в озбуждё нное, образова ние σ – связи, понятие
Г. Сегодня на уроке мы до лжн ы понять простран ственное строение метана и его
Мо делирование м олекул предельных углев одородо в .
В ходе работ ы заполняем та блицу . Лабораторную работу проводим парам и.
1. Соберите ша ростержневу ю модель мол екулы мет ана. На шарике,
имитиру ющем атом углерода, нам етьте четыре равноу далённые д руг от
друга точки и вст авьте стержни, к которым присоеди нены водо родные
шарики. Полу чили модель молекул ы метана. Сделайте пят ь одинаков ых
2. Отнимите от к аждой из дву х молеку л по 1 атому водорода и соед ините
остатки (радик алы) вместе. П олучили модель молеку лы этана. Сделайте 2 -
3. Если отнять от эта на молеку лу в одорода, то полу чим радикал – этил. К
этилу присоедин им радикал метил и по лучим пропа н.
4. При соеди нении между собой двух э тилов образуется моле кул а бутан а.
5. Отнимем от м олекулы бу тана один во дород, и на е го место присоед иним
радикал метил. П олу чили ещё один гом олог – пент ан . ( сла йд №1 3 ,1 4)
Метан, этан, п ропан, бутан, пентан и т. д. – гомол оги. ( слайд №1 5)
Гомологи – веществ а, сходные по строе нию и свойствам, н о отличающ иеся дру г
от друга по с оставу на одну или несколь ко групп – СН
Изомеры – это веще ства, имеющ ие одинаков ый качествен ный и кол ичественны й
1. Выбрать в молеку ле саму ю длинную цепочку угл еродных атомов.
2. Прону меровать цепочку с того конца, к которому ближе раз ветвление
3. Основа назван ия – название у глеводорода с тем же числ ом у глеродных
4. Перечислить пер ед основ ой названия вс е заместители о сновно й цепи с
указанием номе ров у глеродных атомов, при которых они стоят. Если
одинаковых замест ителей не сколько, п еред их назва ниями ставят
5. Отделить зап ятыми все цифры дру г от друга, буквы от цифр – дефисом.
Если при одном у глеродном ат оме имее тся не один, а два за местителя, его
Углеводороды но рмального строе ния обозначают бу квой н, например:
Заключение И так, мы изу чили простра нственное ст роение пре дельных
углеводородов, у знали, что так ое гомологи, изомеры, нау чились их называть.
Дан ряд форму л веществ. Вы берите из них гомологи и изомер ы.
Для скачивания поделитесь материалом в соцсетях
После того как вы поделитесь материалом внизу появится ссылка для скачивания.
Урок в 10 классе "Электронное и пространственное строение алканов" предназначен для изучения химии по программе Новошинской.
| Вложение | Размер |
|---|---|
| alkanow.rar | 2.48 МБ |
Подписи к слайдам:
Тема урока:Электронное и пространственное строение алканов
Ковалентная связь
σ-связь (перекрытие происходит вдоль оси, соединяющей ядра атомов)перекрываются:s-s-облака, s-p-облака, p-p-облака.Всегда одинарная
π-связь(перекрытие происходит по обе стороны от оси,соединяющей ядра атомов)перекрываютсяр-р-облака, d-d-облака.
Атом углерода в нормальном состоянии.
Атом углерода в возбужденном состоянии.
C* s px py pz C* 1s22s12p3
Гибридизация - это
процесс усреднения (выравнивания) электронных облаков по форме и энергии.
Молекула метана
SР3 – гибридизацияВалентный угол -109о28Тетраэдр Длина углерод – водородной связи: 0,109 нм
0,154 нм
Молекула этана
Характеристики связей
В молекуле этана два атома углерода находятся в состоянии sp3-гибридизации.Образуется семь ковалентных σ-связей, из них одна С-С, а шесть других – это связи С-Н.Как и в молекуле метана валентный угол равен 109°28ґ, длина связи С-С – 0,154нм.Связь С-С – неполярная, связь С-Н – слабополярная.
Модель молекулы пентана
Алканы с большим числом атомов углерода имеют зигзагообразное строение
Число гибридных орбиталей равно числу исходных.Гибридные обитали образуют только σ-связи.Гибридизации подвергаются электронные орбитали с близкими значениями энергии.Гибридизация характерна для элементов 2 периода Ι - VΙ групп.
Домашнее задание:
конспект, § 5, у. 4
По теме: методические разработки, презентации и конспекты
Электронное и пространственное строение молекулы метана
Дать представление о гибридизации электронных облаков, электронном и пространственном строении молекул предельных углеводородов на примере молекулы метана.
Электронное и пространственное строение молекулы метана
Дать представление о гибридизации электронных облаков, электронном и пространственном строении молекул предельных углеводородов на примере молекулы метана.
Электронное и пространственное строение молекулы метана
Дать представление о гибридизации электронных облаков, электронном и пространственном строении молекул предельных углеводородов на примере молекулы метана.


Пространственное строение молекул углеводородов
Организовать исследовательскую деятельность, направленную на усвоение знаний по изомерии и гомологии органических веществ. Научить составлять структурные формулы и шаростержневые модели на примере алк.

Пространственное строение молекул углеводородов
Материал представляет собой презентацию для учащихся 10 класса, изучающих курс органической химии. В презентации рассматривается строение молекул углеводородов: метана, этилена, ацетилена в свете учен.
Технологическая карта по химии к уроку по теме "Электронное и пространственное строение алканов. Гомологи и изомеры алканов" 10 класс
Технологическая карта по химии к уроку по теме "Электронное и пространственное строение алканов. Гомологи и изомеры алканов" 10 класс Рудзитис, Фельдман.
I. Видеоурок: “Алканы”
II. Гомологический ряд алканов
Алканы (предельные углеводороды) – это алифатические (ациклические), насыщенные углеводороды, в которых все валентности атомов углерода, не затраченные на образование простых С – С связей, насыщены атомами водорода.
Общая формула алканов – СnH2n+2
В таблице представлены некоторые представители ряда алканов и их радикалы.
Формула
Название
Название радикала
Из таблицы видно, что эти углеводороды отличаются друг от друга количеством групп - СН2 -.Такой ряд сходных по строению, обладающих близкими химическими свойствами и отличающихся друг от друга числом данных групп называется гомологическим рядом. А вещества, составляющие его называются гомологами.
Гомологи – вещества сходные по строению и свойствам, но отличающиеся по составу на одну или несколько гомологических разностей (- СН2 -).

III. Строение алканов
Основные характеристики:
- пространственное строение – тетраэдрическое
- sp 3 – гибридизация,
- ‹ HCH = 109 ° 28
- Углеродная цепь - зигзаг (если n ≥ 3)
- σ – связи (свободное вращение вокруг связей)
- длина (-С-С-) 0,154 нм
- энергия связи (-С-С-) 348 кДж/моль
Все атомы углерода в молекулах алканов находятся в состоянии sр 3 -гибридизации

Угол между связями С-C составляет 109°28', поэтому молекулы нормальных алканов с большим числом атомов углерода имеют зигзагообразное строение (зигзаг). Длина связи С-С в предельных углеводородах равна 0,154 нм (1нм=1*10 -9 м).
а) электронная и структурная формулы
б) пространственное строение

Строение молекулы этана С2Н6
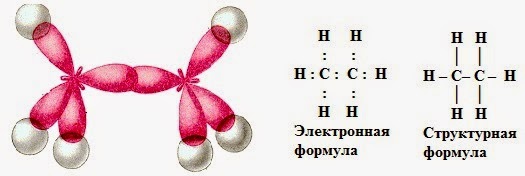
Строение молекулы пропана С3Н8 – цепь зигзагообразная

IV. Изомерия алканов
Характерна СТРУКТУРНАЯ изомерия цепи с С4
Один из этих изомеров (н-бутан) содержит неразветвленную углеродную цепь, а другой — изобутан — разветвленную (изостроение).
Атомы углерода в разветвленной цепи различаются типом соединения с другими углеродными атомами. Так, атом углерода, связанный только с одном другим углеродным атомом, называется первичным, с двумя другими атомами углерода – вторичным, с тремя – третичным, с четырьмя – четвертичным.
С увеличением числа атомов углерода в составе молекул увеличиваются возможности для разветвления цепи, т.е. количество изомеров растет с ростом числа углеродных атомов.
Сравнительная характеристика гомологов и изомеров

V. Номенклатура алканов
Свою номенклатуру имеют радикалы (углеводородные радикалы)
Алкан
- ан
СnH2n+2
Радикал (R)
- ил
СnH2n+1
Число одинаковых заместителей указывают при помощи множительных приставок:
Для названия предельных углеводородов применяют в основном систематическую (международная номенклатура IUPAC) и рациональную номенклатуры.
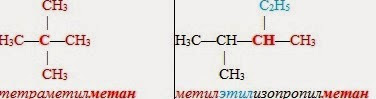
1. Рациональная номенклатура
По рациональной номенклатуре алканы рассматривают как производные простейшего углеводорода — метана, в молекуле которого один или несколько водородных атомов замещены на радикалы. Эти заместители (радикалы) называют по старшинству (от менее сложных к более сложным). Если эти заместители одинаковые, то указывают их количество. В основу названия включают слово "метан":
2. Систематическая номенклатура
Правила систематической номенклатуры:
1. В формуле молекулы алкана выбираем главную цепь — самую длинную.

2. Затем эту цепь нумеруем с того конца, к которому ближе расположен заместитель (радикал). (Если заместителей несколько, то поступают так, чтобы цифры, указывающие их положение, были наименьшими) Заместители перечисляем по алфавиту.

3. Называем углеводород: вначале указываем (цифрой) место расположения заместителя, затем называем этот заместитель (радикал), а в конце добавляем название главной (самой длинной) цепи.
Таким образом, углеводород может быть назван: 2 - метил - 4 - этилгептан (но не 6-метил-4-этилгептан).
Читайте также:

