Электролитическая диссоциация 9 класс конспект
Обновлено: 08.07.2024
На уроке планируется организовать деятельность учащихся по восприятию, осмыслению, первичному запоминанию таких понятий как: кислоты – электролиты, щелочи -электролиты, соли-электролиты. Отработать умения самостоятельно составлять уравнения элетролитической диссоциации кислот, щелочей и солей; познакомить их со строением иона гидроксония. умение работать индивидуально и в парах. Развивать умения выделить главное, существенное в изучаемом материале. Продолжить воспитание желания вести здоровый образ жизни через эмоциональные разрядки, игровые моменты, смену видов деятельности,
Обучение на уроке строилось по принципам: систематичность и последовательность формирования знаний, умений и навыков, самостоятельность.
Предполагается, что к окончанию урока учащиеся смогут дать определение кислотам, щелочам и растворимым солям как электролитам, будут знать их основные свойств; будут владеть умениями определять кислоты, основания в растворах электролитов; - усовершенствуют умения составлять уравнения электролитической диссоциации кислот, щелочей и солей.
| Вложение | Размер |
|---|---|
| elektroliticheskaya_dissotsiatsiya.docx | 746.71 КБ |
Предварительный просмотр:
Тема: Электролитическая диссоциация
- Организовать деятельность учащихся по восприятию, осмыслению, первичному запоминанию таких понятий как: кислоты – электролиты, щелочи -электролиты, соли-электролиты.
- Отработать умения самостоятельно составлять уравнения элетролитической диссоциации кислот, щелочей и солей; познакомить их со строением иона гидроксония. умение работать индивидуально и в парах.
- Развивать умения выделить главное, существенное в изучаемом материале.
- Продолжить воспитание желания вести здоровый образ жизни через эмоциональные разрядки, игровые моменты, смену видов деятельности,
Принципы обучения: систематичность и последовательность формирования знаний, умений и навыков, самостоятельность.
Когнитивные цели урока:
предполагается, что к окончанию урока учащиеся
- смогут дать определение кислотам, щелочам и растворимым солям как электролитам, будут знать их основные свойства ;
- - будут владеть умениями определять кислоты, основания в растворах электролитов ; - усовершенствуют умения составлять уравнения электролитической диссоциации кислот, щелочей и солей.
Цели личностного развития:
создавать ситуации для
- развития познавательных умений учащихся, умений производить учебно-логические действия (проведение лабораторного опыта,, наблюдение, анализ, выделение главного, вывод);
- формирования положительного отношения к химии как важнейшему компоненту общечеловеческой культуры.
На столах учащихся: 2 пробирки с водными растворами кислот (соляной и серной), 2 пробирки с водными растворами щелочей (гидроксидов натрия и калия), ф-ф, лакмус, метилоранж. 2 пробирки с водными растворами солей (хлорида натрия и сульфата калия)
1.Оргмомент . Слайд 2
Китайский мудрец и философ Конфуций когда-то говорил:
Три пути ведут к знанию:
путь размышления – самый благородный,
путь подражания – самый легкий,
и путь опыта – это самый горький .
Я желаю вам идти к достижению цели трудными, но благородными путями.
I. Повторение и закрепление ранее изученного материала.

1. Ребята, в начале нашего урока, я предлагаю вам составить химический кластер из терминов, изученных нами ранее. Они напечатаны на карточках. Вы даете определение понятию и помещаете карточку на стенд.
Электролиты Слайд 3 , кислоты,
Неэлектролиты Слайд 4 , основания,
катионы, соли, диссоциация,
С.Аррениус Слайд 5 , анод,
анионы, сильные электролиты,
катод, слабые электролиты,
Чем можно объединить все эти определения и понятия? Все они входят в понятие Теории электролитической диссоциации.
2. Мы продолжим повторение изученных терминов, для этого немного поиграем. Для этого нам понадобятся карточки с цифрами от 1 до 7, лежащие у вас на столе.
Я читаю вопрос, вы даете ответ карточкой с номером, под которым, по вашему мнению, содержится ответ.
- Анионы.
- Электролитическая диссоциация.
- Катионы.
- Углекислый газ.
- Электролиты.
- Щелочь.
- Неэлектролиты.
- Положительно заряженные ионы – это… (3)
- Вещества, водные растворы или расплавы которых не проводят электрический ток, называются… (7)
- Распад веществ на ионы называется… (2)
- Отрицательно заряженные ионы – это… ( 1)
- К электролитам относится … (6)
- С позиции представлений об электролитической диссоциации вещества можно разделить на две группы: …(5 и 7).
- К неэлектролитам относится … (4).
2. Актуализация знаний
Создает условия для восприятия учебного материала через актуализацию знаний:
Учитель ставит перед учащимися вопросы, ответы на которые будут использованы в процессе изучения нового материала:
1) Какие основные классы неорганических соединений Вам известны?
(оксиды, кислоты, основания, соли)
2) Распределите вещества по классам неорганических соединений:
H 2 SО 4 , CuSO 4 , FeCl 3 , KOH, Ba(OH) 2 , K 3 PO 4 , Al 2 (SO4) 3 , HNO 3 , Ca(OH) 2 , H 3 PO 4 , Mg(NO 3 ) 2 , H 2 СО 3 , LiOH.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
тема: Теория электролитической диссоциации.
Цель определяют учащиеся : узнать… . определить ….
Основные положения теории электролитической диссоциации. Кислоты, основания и соли с точки зрения ТЭД.
Писать уравнения диссоциации кислот, оснований и солей.
План – конспект урока
2. Мотивация урока.
Растворы широко применяются в различных сферах деятельности человека. Они имеют большое значение для живых организмов Сложные физико-химические процессы в организмах человека, животных и растений протекают в растворах. В различных производственных и биологических процессах большую роль играют растворы электролитов. Свойства этих растворов объясняет теория электролитической диссоциации. Знание ТЭД является основой для изучения свойств неорганических и органических соединений, для глубокого понимания механизмов химических реакций в растворах электролитов.
3. Объяснение нового материала
1. Основные положения теории электролитической диссоциации
2. Кислоты, основания и соли с точки зрения ТЭД
1. Основные положения теории электролитической диссоциации
В первой половине 19 в. М. Фарадей ввел понятие об электролитах и неэлектролитах.
Электролиты – вещества, водные растворы или расплавы которых проводят электрических ток.
Неэлектролиты – вещества, водные растворы или расплавы которых не проводят электрический ток
К электролитам относятся соли, кислоты, основания. В молекулах этих веществ имеются ионные или ковалентные сильно полярные химические связи.
К неэлектролитам относятся вещества, в молекулах которых имеются ковалентные неполярные или малополярные связи. Например, кислород, водород, многие органические вещества – глюкоза, сахароза, бензол, эфиры и др.
Для объяснения электропроводности растворов и расплавов солей, кислот, оснований шведский ученый С. Аррениус создал теорию электролитической диссоциации (1887 г.). Представления о диссоциации электролитов получили развитие в работах русских химиков И.А.Каблукова и В.А. Кистяковского. Они применили к объяснению процесса электролитической диссоциации химическую теорию растворов Д.И. Менделеева.
Основные положения ТЭД: (учебник)
1. Молекулы электролитов при растворении в воде или расплавлении распадаются на ионы. Процесс распада молекул электролитов на ионы в растворе или расплаве называется электролитической диссоциацией (или ионизацией)
Ионы – это атомы или группы атомов, имеющие положительный или отрицательный заряд ( Na + , S 2- , NO 3 - и др.)
Положительно заряженные ионы – катионы, отрицательно заряженные ионы – анионы.
К катионам относятся ион водорода Н + , ион аммония NH 4 + , ионы металлов – Na + , Cu 2+ , Al 3+ и др.
К анионам относятся гидроксид – ион ОН - , ионы кислотных остатков – Cl - SO 4 2- , PO 4 3- и др.
2. Диссоциация – процесс обратимый. Это значит, что одновременно идут два противоположных процесса: распад молекул на ионы (диссоциация, ионизация) и соединение ионов в молекулы (ассоциация, моляризация).
Диссоциацию молекул электролитов выражают уравнениями, в которых вместо знака равенства ставят знак обратимости (↔).
Каждая молекула нитрата магния диссоциирует на ион магния и два нитрат – иона. Следовательно, в результате диссоциации одной молекулы Mg ( NO 3)2 образуется три иона.
Общая сумма зарядов катионов и зарядов анионов равна нулю, т.к. молекула электролита нейтральна.
3. Ионы и атомы одних и тех же элементов отличаются друг от друга по строению и свойствам.
4. Ионы вступают во взаимодействие друг с другом – реакции ионного обмена.
Механизм электролитической диссоциации
Причины и механизм диссоциации электролитов объясняются теорией растворов Д.И. Менделеева и природой химической связи. Как известно, электролитами являются вещества с ионной или ковалентной сильно полярной связями.
При растворении в воде ионных соединений, например хлорида натрия NaCl , дипольные молекулы воды ориентируются вокруг ионов натрия и хлорид-ионов. При этом положительные полюсы молекул воды притягиваются к хлорид-ионам Cl - , отрицательные полюсы - к положительным ионам натрия Na + .
В результате этого взаимодействия между молекулами растворителя и ионами электролита притяжение между ионами в кристаллической решетке вещества ослабевает. Кристаллическая решетка разрушается, и ионы переходят в раствор. Эти ионы в водном растворе находятся не в свободном состоянии, а связаны с молекулами воды, т.е. являются гидратированными ионами.
При растворении в воде веществ с полярной ковалентной связью происходит взаимодействие дипольных молекул воды с дипольными молекулами электролитов. Например, при растворении в воде хлороводорода, изменяется характер связи в молекуле HCl : сначала связь становится более полярной, а затем переходит в ионную. Результатом процесса является диссоциация электролита и образование в растворе гидратированных ионов.
Таким образом, главной причиной диссоциации в водных растворах является гидратация ионов. В водных растворах все ионы находятся в гидратированном состоянии. Для простоты в химических уравнениях ионы изображают без молекул воды: H + , Mg 2+ , NO 3 - и т.д.
2. Кислоты, основания и соли с точки зрения ТЭД
Кислоты – электролиты, которые при диссоциации образуют только один вид катионов – катионы водорода Н +
Составим уравнение электролитической диссоциации сильных кислот:
Слабые многоосновные кислоты диссоциируют ступенчато. Число ступеней зависит от основности слабой кислоты H x ( Ac ), где х – основность кислоты. Например,
Растворы кислот имеют некоторые общие свойства, которые, согласно ТЭД, объясняются присутствием в их растворах гидратированых ионов водорода Н + (Н3О + ).
Основания - электролиты, которые при диссоциации образуют только один вид анионов - гидроксид-ионы ОН - .
Составим уравнение диссоциации сильных оснований (щелочей)
Слабые многокислотные основания диссоциируют ступенчато. Число ступеней диссоциации определяется кислотностью слабого основания Ме(ОН)у , где у- кислотность основания.
Fe ( OH )2 ↔ FeOH + + OH -
FeOH + ↔ Fe 2+ + OH -
Основания имеют некоторые общие свойства. Общие свойства оснований обусловлены присутствием гидроксид-ионов ОН - .
Средние (нормальные) соли – сильные электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка.
Кислые соли – сильные электролиты, диссоциирующие на катион металла и сложный анион, в состав которого входят атомы водорода и кислотный остаток.
NaHCO 3 ↔ Na + + HCO 3 - (α = 1)
Сложный анион (гидрокарбонат-анион) частично диссоциирует:
5. Закрепление изученного материала
Выберите один правильный вариант ответа.
1. Неэлектролитами являются оба вещества в паре
1) гидроксид бария (р-р) и азотная кислота
2) серная кислота и сульфат натрия (р-р)
3) этиленгликоль (р-р) и метанол
4) этанол и хлорид кальция (р-р)
2. Составить уравнение диссоциации гидроксида кальция и гидрокарбоната натрия.
Выберите один правильный вариант ответа.
1. Лампочка прибора для испытания веществ на электрическую проводимость загорится при погружении электродов в водный раствор:
2) хлорида натрия
2. Напишите уравнение диссоциации хлорида бария и серной кислоты.
Рефлексия по целеполаганию.
Я узнал(а), что ….
Я понял(а), что ….
д\з п.1-2 р\т по разделу.
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. Лампочка прибора для испытания на электрическую проводимость загорится при погружении электродов в оба вещества:
1) ацетон и глюкозу (р-р)
2) гидроксид калия (расплав) и гексан
3) серную кислоту (р-р) и карбонат кальция
4) хлорид натрия (р-р) и ацетат калия (р-р)
2. Напишите полное и сокращенное ионные уравнения реакций между растворами гидроксида бария и хлорида меди ( II )
а) полное ионное уравнение ____________________
б) сокращенное ионное уравнение ______________
3. Сокращенное ионное уравнение реакции: Al 3+ + 3 OH - → Al ( OH )3↓ соответствует взаимодействию
1) хлорида алюминия с водой
2) алюминия с водой
3) хлорида алюминия со щелочью
4) алюминия со щелочью
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. Лампочка прибора для испытания веществ на электрическую проводимость загорится при погружении электродов в
1) водные растворы сахарозы и глицерина
2) водные растворы хлорида натрия и уксусной кислоты
3) ацетон и крахмальный клейстер
4) глицерин и NaOH (р-р)
2. Сумма всех коэффициентов в полном ионном уравнении реакции между растворами хлорида железа ( III ) и нитрата серебра равна ______________.
3. Сокращенное ионное уравнение реакции: Ba 2+ + SO 4 2- → BaSO 4↓ соответствует взаимодействию веществ
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. К электролитам относятся все вещества группы:
1) растворы гидроксида натрия, хлорида натрия, соляная кислота
2) гидроксид железа ( III ), уксусная кислота, метанол
3) хлорид бария (р-р), крахмал, серная кислота
4) растворы глюкозы, мыла, карбонат кальция
2. Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между гидроксидом натрия и сульфатом магния равны
3. Сокращенное ионное уравнение реакции: 2Н + + СО3 2- → Н2О + СО2↑ соответствует взаимодействию:
1) азотной кислоты с карбонатом кальция
2) сероводородной кислоты с карбонатом калия
3) соляной кислоты с карбонатом кальция
4) серной кислоты с оксидом углерода ( IV )
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. В уравнении реакции оксида алюминия с серной кислотой сумма коэффициентов перед формулами сильных электролитов равна
2. Сумма всех коэффициентов в полном и сокращенном ионных уравнениях реакции между хлоридом бария и сульфатом меди ( II ) равны
3. Сокращенное ионное уравнение реакции: SiO 3 2- + 2 H + → H 2 SiO 3↓ соответствует взаимодействию
1) оксида кремния ( IV ) с водой
2) оксида кремния ( IV ) с серной кислотой
3) силиката натрия с серной кислотой
4) силиката кальция с серной кислотой
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. Лампочка прибора для испытания веществ на электрическую проводимость не загорится при погружении электродов в
1) водный раствор сахарозы
2) водный раствор хлорида натрия
3) муравьиную кислоту (р-р)
4) расплав гидроксида натрия
2. Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между азотной кислотой и гидроксидом бария равны
1) 10 и 3
3. Сокращенное ионное уравнение реакции: Zn 2+ + 2 OH - → Zn ( OH )2↓ соответствует взаимодействию веществ:
2) ZnCl 2 и NaOH
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. Слабым электролитом является:
1) гидроксид бария
2) хлорид кальция
3) соляная кислота
4) угольная кислота
2. Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между пропионовой кислотой и гидроксидом калия равны
1) 10 и 3
3. Сокращенное ионное уравнение реакции: 2Н + + СО3 2- → Н2О + СО2↑ соответствует взаимодействию
1) соляной кислоты с карбонатом магния
2) сероводородной кислоты с карбонатом калия
3) серной кислоты с карбонатом калия
4) азотной кислоты с оксидом углерода ( IV )
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. Неэлектролитами являются все вещества группы
1) этанол, хлорид калия (р-р), сульфат бария
2) растительное масло, гидроксид калия (расплав), ацетат натрия
3) раствор сахарозы, глицерин, оксид серы ( IV )
4) растворы сульфата натрия, глюкозы, уксусная кислота
2. Суммы всех коэффициентов в полном и сокращенном ионных
уравнениях реакции между уксусной кислотой и гидроксидом лития равны
1) 10 и 3
3. Сокращенное ионное уравнение реакции: Ba 2+ + SO 4 2- → BaSO 4↓ соответствует взаимодействию:
1) оксида бария с серной кислотой
2) гидроксида бария с серной кислотой
3) гидроксида бария с сульфатом меди ( II )
4) нитрата бария с сульфатом натрия
Выберите один правильный вариант ответа или дополните предложение.
Ответы во всех тестовых заданиях следует объяснить на основании теоретических знаний или написанием соответствующих уравнений.
1. Лампочка прибора для испытания веществ на электрическую проводимость не загорится при погружении электродов в
1) расплав гидроксида калия
2) водный раствор сульфата натрия
3) муравьиную кислоту (р-р)
4) водный раствор этанола
2. Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между уксусной кислотой гидроксидом бария равны
3. Сокращенное ионное уравнение реакции: Ca 2+ + CO 3 2- → CaCO 3↓ соответствует взаимодействию:
развивать умения сравнивать, анализировать и делать выводы, навыки само– и взаимоконтроля, интеллектуальные способности;
воспитывать компетентную личность с практической направленностью.
Реактивы: Н2О дист., NaCl кр., NaOH кр., ледяная уксусная кислота CH3COOH, С12Н22О11 кр.; р-р Н2SO4, на каждую парту: растворы индикаторов метилоранжа, фенолфталеина, р-ры HCl, NaОН, Na2SO4.
I. Организационный момент
(Запись в тетрадь темы урока)
Учитель: Речь пойдет о самом удивительном веществе нашей планеты, без которого нет жизни – это воде, её роли при растворении веществ.
Прежде чем начать изучение новой темы, я хочу проверить ваше настроение. Зарисуйте свое настроение в индивидуальном сопроводительном листе, который находится у Вас на парте. (Приложение 1)
III. Изучение нового материала
1 этап. Электролиты, неэлектролиты.
Учитель: Обратимся к истории 1837 года. В этот период в Лондоне в лаборатории Королевского института работали два учёных: Гемфри Деви и Майкл Фарадей. Они начали исследования в области электричества и ввели понятия, которыми мы пользуемся до сих пор. Деви и Фарадей проводили опыты по определению электропроводности растворов, используя специальный прибор, модель которого представлена у Вас на рис. 126 с.193 (О.С.Габриелян, Химия 8). Он состоит из 2-х электродов, лампочки и розетки. При опускании электродов в исследуемое вещество, если оно проводит ток, то лампочка загорается, если не проводит – не загорается.
Давайте и мы проведем исследования (Демонстрация электрической проводимости различных веществ с помощью специального прибора).
Беседа с классом:
– Предварительно вспомним, на какие 2 группы делят все химические соединения по типу химической связи?
Результаты эксперимента отмечаем в таблице сопроводительного листа. (Приложение 1)
Проверка электропроводности воды прибором
– Как Вы думаете, проводит вода электрический ток?
– Какой тип химической связи у воды? (Ковалентная слабо полярная)
– К какому классу химических соединений она относится?
– Проверим электропроводность прибором. (Не проводит ток).
(Отмечаем в таблице.)
Проверка электропроводности у поваренной соли NaCl кристаллической.
– Какой тип химической связи у этого соединения?
– К какому классу оно относится?
– Как вы думаете, проводит NaClкр. электрический ток?
– Проверим прибором (Нет).
– А теперь добавим воду в соль и проверим электропроводность этого раствора.
– Как Вы думаете, будет раствор поваренной соли проводить электрический ток? (Этот опыт может проделать ученик)
– Как Вы думаете почему? На этот вопрос мы дадим ответ немного позже. А сейчас продолжим исследование. И так далее….
– Какой вывод мы можем сделать на основе проведенных исследований?
(Вывод: Одни вещества проводят ток, а другие нет)
Учитель: Вещества, растворы которых проводят электрический ток назвали электролитами, а вещества, которые не проводят ток – неэлектролитами
– А какие вещества проводят электрический ток? (Растворы кислот, щелочей, солей.)
– С каким видом химической связи растворы веществ проводят электрический ток? (Ионной, ковалентной сильно полярной)
– Какие вещества не проводят электрический ток? (Все кристаллические вещества, оксиды, газы)
– С каким видом химической связи вещества не проводят электрический ток? (С ковалентной неполярной и слабо полярной)
Закрепление этапа 1: Задание 1. Блиц-опрос:
– Сформулируйте определения электролитов и неэлектролитов. (Запись в тетрадь)
– Какой тип химической связи характерен электролитам и неэлектролитам?
– Классы каких веществ относятся к электролитам и неэлектролитам?
– Где Вы в жизни встречались с электролитами? (Аккумуляторы в автомобилях)
Задание 2. Выберите из перечня веществ электролиты и неэлектролиты, определив вид химической связи. Ответ поясните.
2 этап: Механизм электролитической диссоциации.
– Какие частицы могут создавать электрический ток в растворе? (Движущие заряженные частицы)
– Почему и при каких условиях вещества проводят электрический ток?
(Они распадаются на ионы при растворении или расплавлении, являются проводниками второго рода. Прохождение тока происходит за счёт переноса ионов, а не электронов. Металлы – проводники первого рода (ток создается за счет свободных электронов).
– А какие заряженные частицы могут быть в растворах, например, у веществ с ионной связью – растворе NaCl? (Свободные ионы)
Внимание: В кристаллах ионы не свободные, а находятся в узлах кристаллической решетки.
– Что же происходит с кристаллом при растворении его в воде?
– Какова роль воды в этом процессе?
(Вода взаимодействует с электролитом и он под действием воды распадается на ионы).
Рассмотрим механизм этого процесса.
Сначала рассмотрим строение молекулы воды
Вода (диполь) 0
Механизм электролитической диссоциации с ионной связью на примере NaCl
Рассмотрите схему процесса (рис.127, с.195, Химия, 9, О.С.Габриелян).
– Что происходит с диполями воды?
1. Диполи ориентируются отрицательными концами вокруг положительных ионов, а положительными вокруг отрицательных.
Этот процесс называется ориентация. ( Запись в тетрадь)
– Что происходит дальше?
2. Между ионами электролита и диполями происходит взаимодействие. Этот процесс называется гидратация. (Запись в тетрадь)
Происходит распад – диссоциация.
Ионы, окруженные водной оболочкой, называют гидратированными.
Процесс диссоциации упрощенно можно записать: NaCl = Na + + Cl -
– Как называют распавшиеся ионы? (Катионы, анионы)
– Они простые или сложные? (Простые)
– Итак, какие 3 процесса происходят при растворении веществ с ионной связью в воде?
1. ориентация
2. гидратация
3. диссоциация. Демонстрация процесса диссоциации. (Анимация)
Задание для учащихся
С помощью модели-аппликации покажите на магнитной доске механизм диссоциации электролита с ионной связью и прокомментируйте это
Механизм электролитической диссоциации веществ с ковалентной полярной связью на примере НCl
– А каков механизм диссоциации электролита с ковалентной полярной связью?
– Рассмотрите схему процесса (рис.128, с.196, в учебнике).
– Что происходит с диполями воды?
1. Диполи ориентируются отрицательными концами вокруг положительных ионов, а положительными вокруг отрицательных.
Этот процесс называется ориентация. (Запись в тетрадь)
– Что происходит дальше?
2. Между ионами электролита и диполями происходит взаимодействие. Этот процесс называется гидратация. (Запись в тетрадь)
3.Под действием диполей воды происходит превращение ковалентной полярной связи в ионную, то есть происходит ионизация молекул электролита.
4. Происходит распад – диссоциация.
Процесс диссоциации упрощенно можно записать: НCl = Н + + Cl -
– Как называют распавшиеся ионы?
– Они простые или сложные?
– Итак, какие процессы происходят при растворении веществ с ковалентной полярной связью в воде?
1. ориентация
2. гидратация
3. ионизация
4. диссоциация
Демонстрация процесса диссоциации. (Анимация)
Задание для учащихся
С помощью модели-аппликации покажите на магнитной доске механизм диссоциации электролита с ковалентной полярной связью и прокомментируйте это
Вывод: при растворении в воде вещества взаимодействуют с диполями, распадаются на свободные гидратированные ионы и проводят электрический ток. Гидратация ионов является основной причиной диссоциации электролита.
К такому выводу пришел шведский ученый Сванте Аррениус в 1887 году.
Вернемся к истории.
Учитель: Так как диссоциация происходит у электролитов, поэтому ее называют электролитической.
Оказывается электролитами являются не только растворы кислот, солей и щелочей, но и их расплавы.
Давайте сформулируем определение ЭД.
По лесенке поднимемся к вершине горы, теме сегодняшнего урока.
– Какие ключевые слова мы применяли при исследованиях, выводах?
Процесс обратный диссоциации называется ассоциацией.
– Какие бывают ионы? Заполните схему:
И выполните задание.
– Отличаются ли ионы от атомов или молекул? Если да, то чем?
| Сравнение ионов и атомов/молекул | |
| Атом/молекула | Ион |
| Сu, тв.металл красноватого цвета | Cu 2+ белый в безводных солях (CuSO4) и имеет голубой цвет, когда гидратирован (Сu 2+ •nH2O) |
| Na, металл серебристо-белого цвета, активно реагирует с водой, образуя щелочи | Na + , входит а состав поваренной соли, мы его употребляем в пищу |
| Cl2, ядовитый газ желто-зеленого цвета | Cl - , входит а состав поваренной соли, мы его употребляем в пищу, не ядовит |
3 этап: Степень диссоциации. Сильные и слабые электролиты.
Учитель: Все ли электролиты в одинаковой степени проводят электрический ток? (Нет)
– Продолжим исследование с уксусной кислотой.
Учитель: Проверим электропроводность концентрированной уксусной кислоты.
Беседа с классом:
– Что вы наблюдаете? (Лампочка горит очень слабо)
Вывод: не все электролиты в одинаковой степени проводят электрический ток. Бывают сильные и слабые электролиты.
Характеристикой силы электролита является степень диссоциации и обозначается α. α можно вычислить по формуле.
Для слабых электролитов процесс диссоциации обратим. HNO2↔ H + + NO2 -
Подробная информационная карта у вас на столах в сопроводительном листе.
– От чего зависит α?
Продолжим исследования (Демонстрация опыта)
Беседа с классом:
1. Нагреем уксусную кислоту.
– Что Вы наблюдаете? От чего же зависит α?
2. Разбавим кислоту водой, то есть уменьшим её концентрацию.
– Что наблюдаете? От чего еще зависит α?
Вывод: α зависит от t, C. Если температуру увеличить α тоже увеличивается, если концентрацию увеличить α уменьшается.
4 этап: Кислоты, основания соли с точки зрения ЭД.
Учитель: Рассмотрим наглядно диссоциацию кислот, оснований и солей и составим уравнения их диссоциации на примере модельных схем ЭД кислот, щелочей и солей
Работа и беседа учителя с классом:
– Составьте алгоритм написания данных уравнений (по образцу).
– На какие ионы диссоциируют кислоты?
– Сформулируйте определение кислот с точки зрения ЭД. -Каким ионом будут определяться их свойства?
– Докажите экспериментально, что у вас в пробирке №1 кислота.(Обучающиеся выполняют лабораторный опыт)
– На какие ионы диссоциируют основания?
– Сформулируйте определение оснований с точки зрения ЭД.
– Каким ионом будут определяться их свойства?
– Докажите экспериментально, что у вас в пробирке №2 щелочь.
(Обучающиеся выполняют лабораторный опыт)
– На какие ионы диссоциируют соли?
– Сформулируйте определение солей с точки зрения ЭД.
– Каким ионом будут определяться их свойства? (Разными)
5 этап: Физкультминутка для глаз
А теперь все отдохнем
Глазки крепенько сожмем
Поморгаем раз пяток
И продолжим наш урок
Крепко глазки зажмурим
Вспомним всё и повторим:
Раз, да, три, четыре, пять
Вернемся к диссоциации опять.
Истина всегда проста:
Щелочь, соль и кислота
Пропускают ток всегда,
Если их раствор – вода.Почему же кислород,
Спирт, глюкоза и азот,
Растворенные в воде,
Не пропустят ток нигде?
Потому что вещества –
Неживые существа,
И зависят свойства их,
Сложных и совсем простых,
От строения частиц,
Микромира без границ.
А раствор, где ток бурлит,
Назван был электролит
Укрепляя мышцы глаз,
Взгляд меняем 8 раз
То поближе, то подальше
Посмотреть прошу я Вас.
От усталости спасет
Вас глазной круговорот.
Круга 3 вращайте влево,
А потом наоборот!
6 этап. Это интересно. (Приложение 2)
1. Задания в игровой форме, проблемно-поисковые задания на слайдах.
2. Самостоятельная работа на 10 мин (Слайд)
V. Обобщающие выводы
Учитель: Все сегодняшние полученные знания можно обобщить в одной теории, которая называется теорией электролитической диссоциации (ТЭД)
Основные положения сформулированы в опорном конспекте (Приложение 4).
Работа с опорным конспектом
- Все вещества делятся на электролиты и неэлектролиты. ТЭД изучает электролиты.
- При растворении в воде эл-ты диссоциируют на ионы.
- Причина диссоциации – гидратация, то есть взаимодействие электролита с молекулами воды и разрыв химической связи в нем.
- Под действием эл. тока + ионы(катионы) движутся к катоду, а отрицательные (анионы) к аноду.
- ЭД обратима для слабых электролитов.
- Не все электролиты в одинаковой степени диссоциируют на ионы. Поэтому они делятся на сильные и слабые и характеризуются степенью диссоциации, которая зависит от разных причин.
- Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
- По характеру образующихся ионов различают 3 типа электролитов.
VI. Подведение итога урока. Домашнее задание
§35,36; упр. № 4,5 с.203,
Индивидуальные доп.зад. в раб. тетр. №18, с.124, №20 с.126
Учитель: Прежде чем закончить урок, я хочу проверить ваше настроение в конце урока. Зарисуйте свое настроение в индивидуальном сопроводительном листе, который находится у Вас на парте. (Приложение 1)
Ты – молодчина! И в это поверь.
Открыта тобой в мир химии дверь.
Надеемся все мы, что лет через пять,
Прекрасным ученым сможешь ты стать.
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A - (анион)
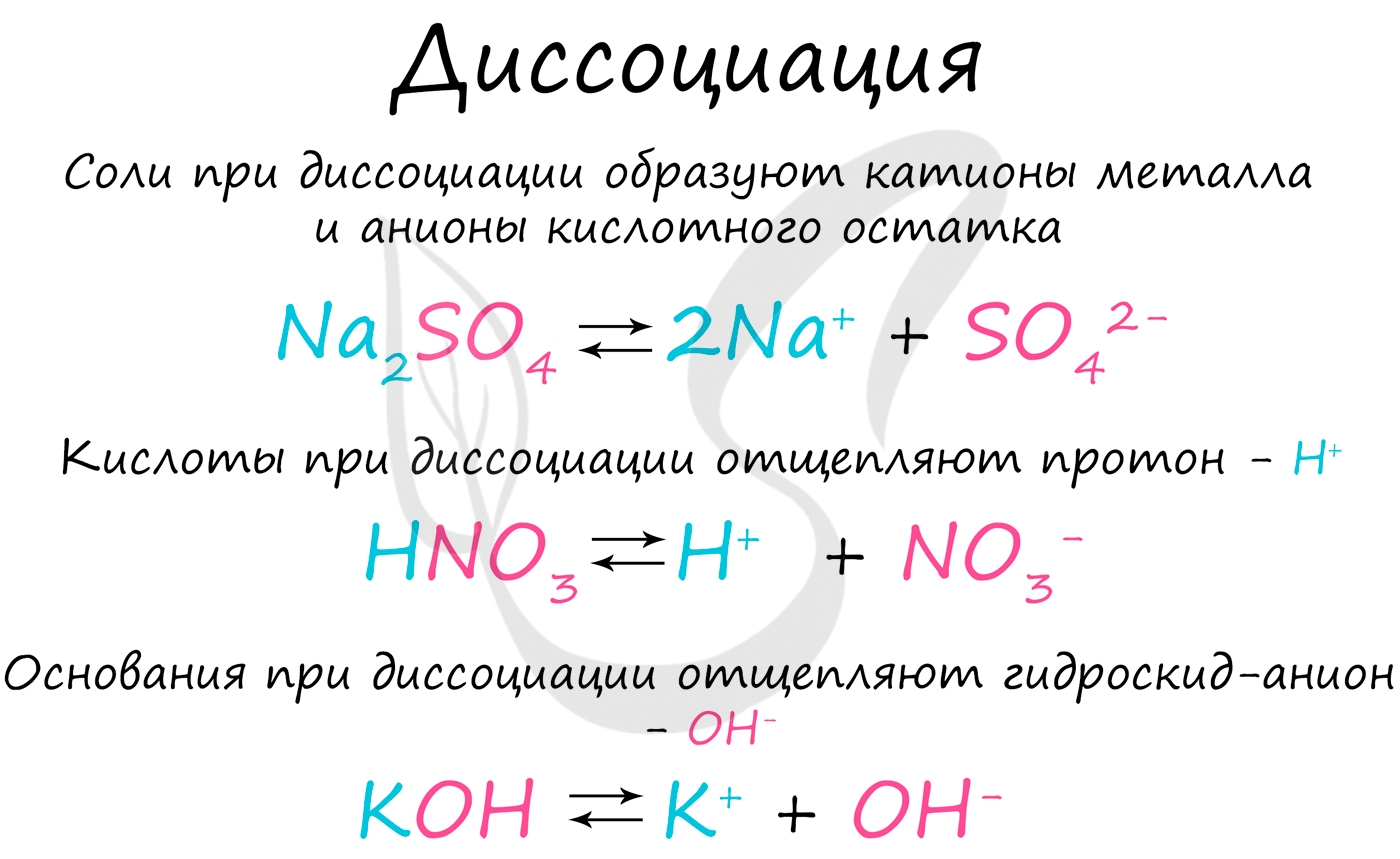
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
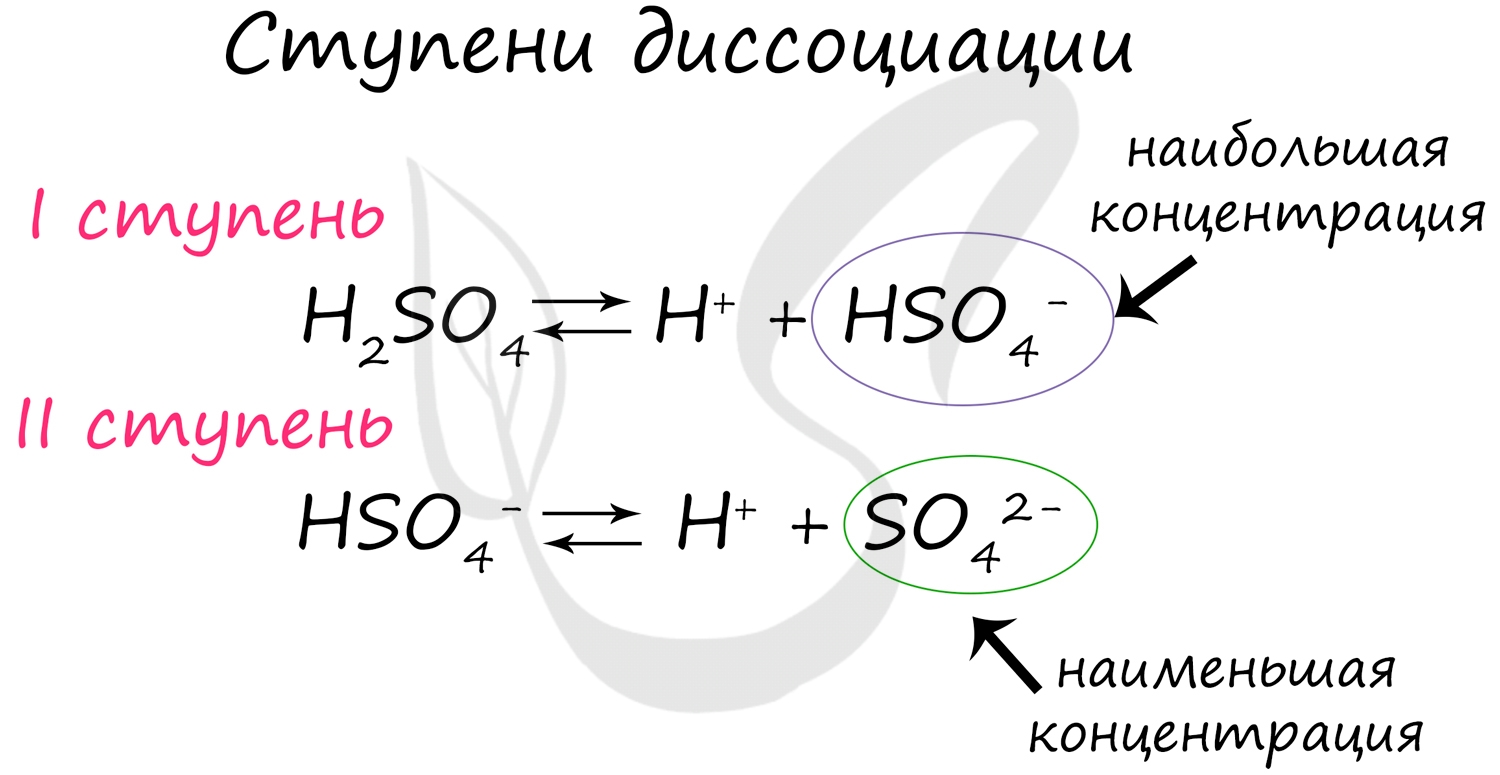
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
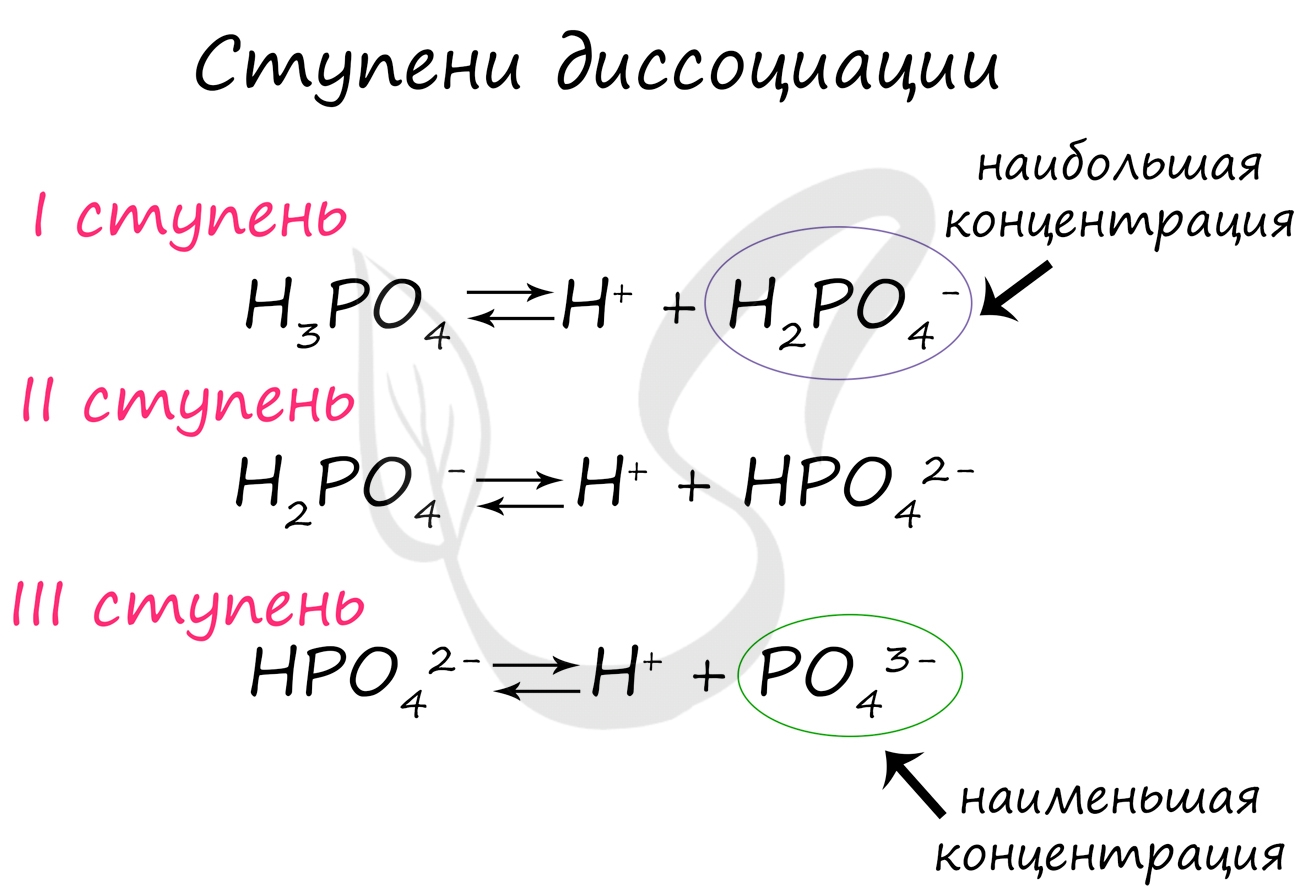
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.

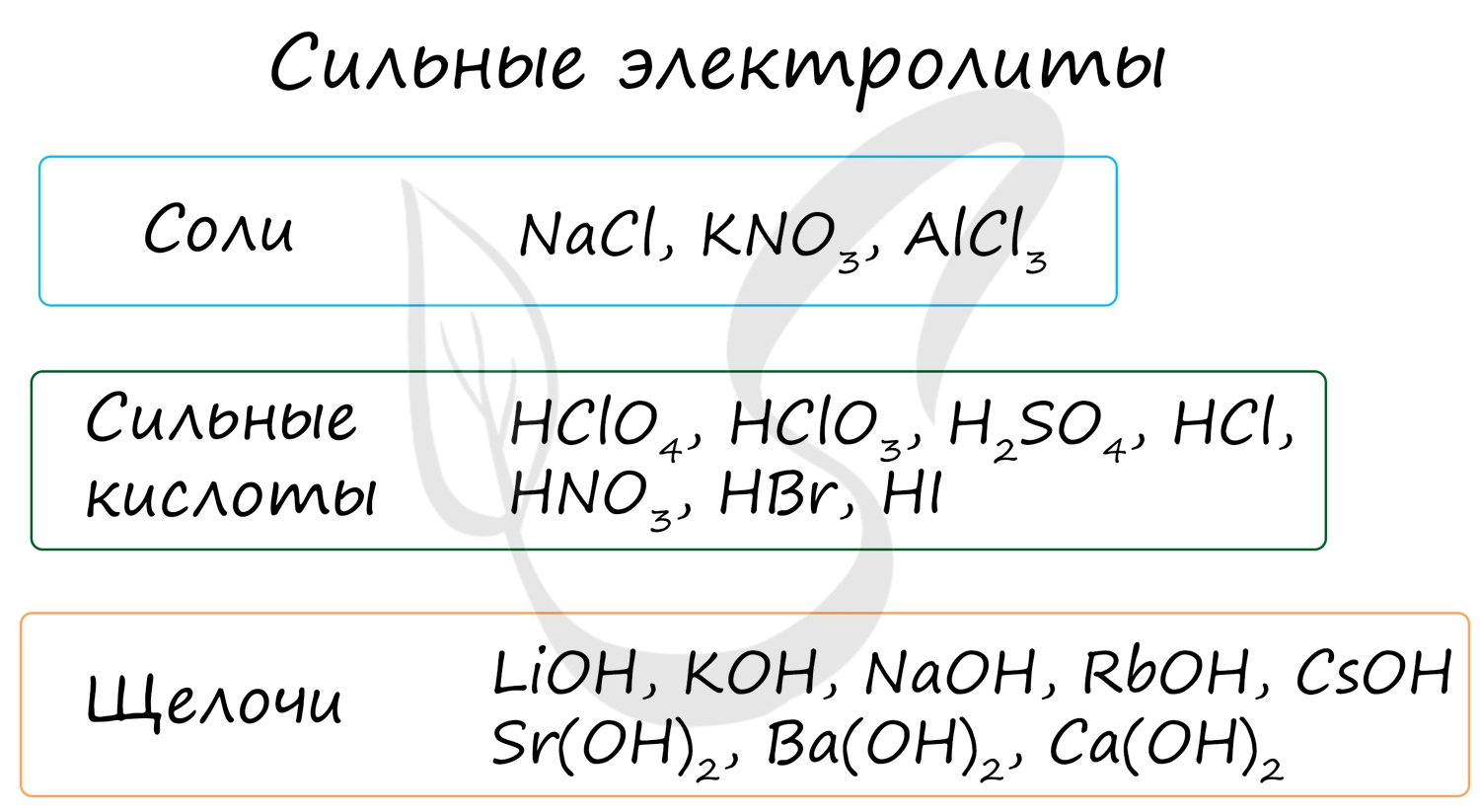
Электролиты - жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты - вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
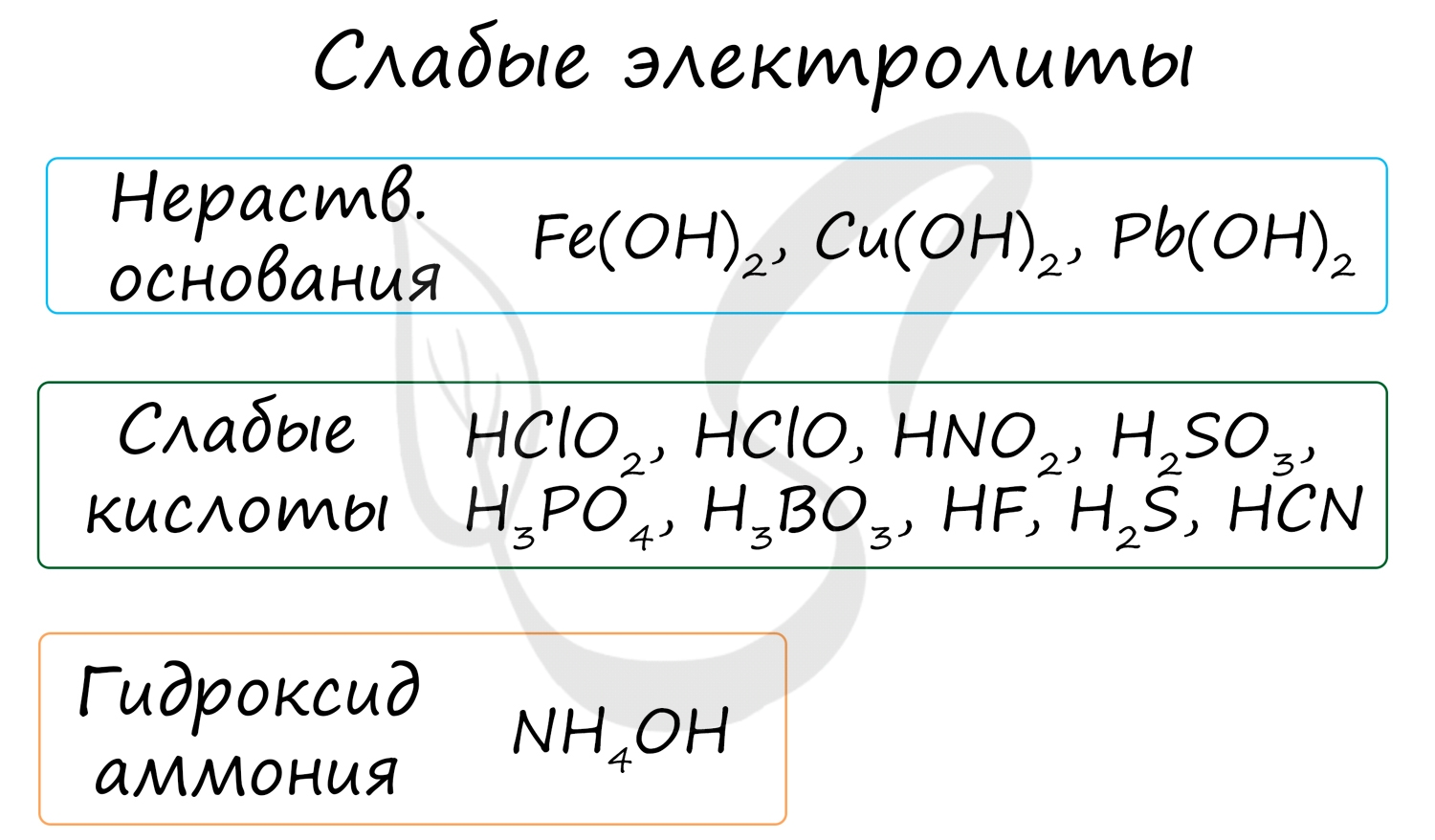
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
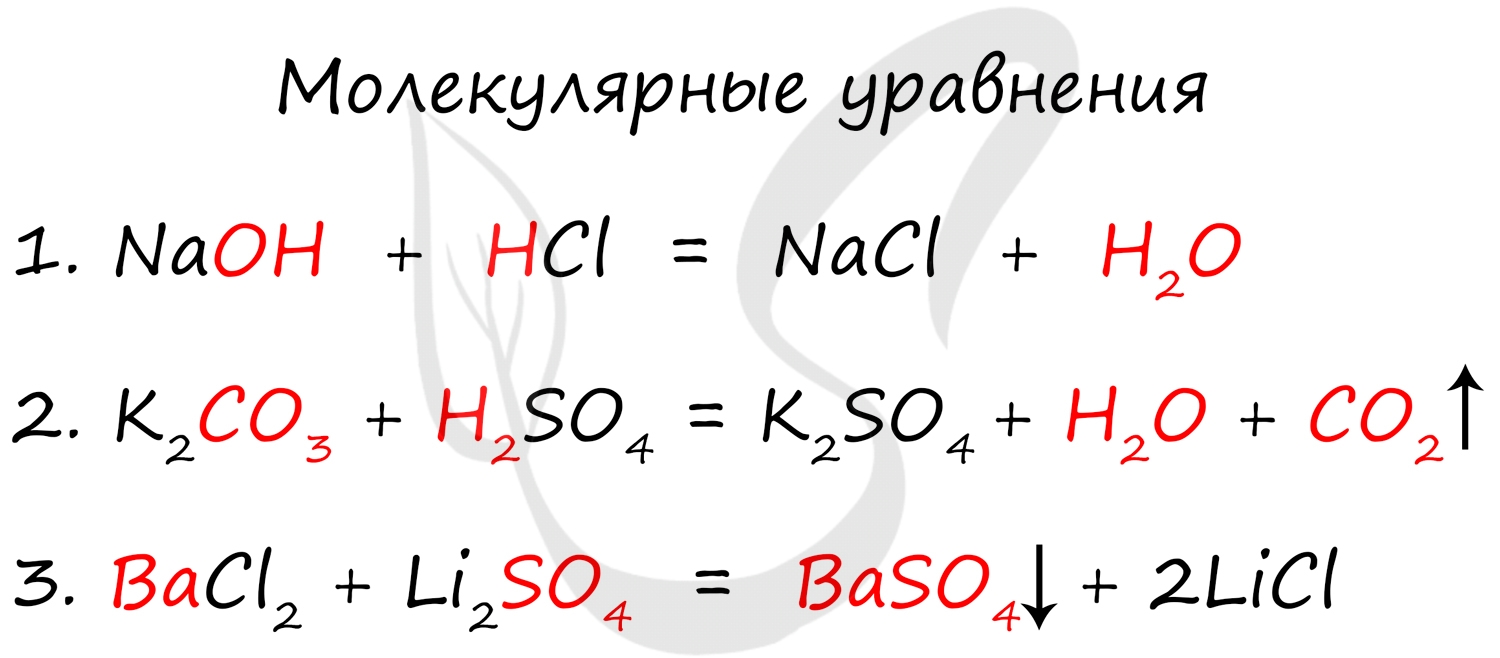
- Слабые электролиты (в их числе вода)
- Осадки
- Газы

Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике - остается только то, что сократить нельзя.
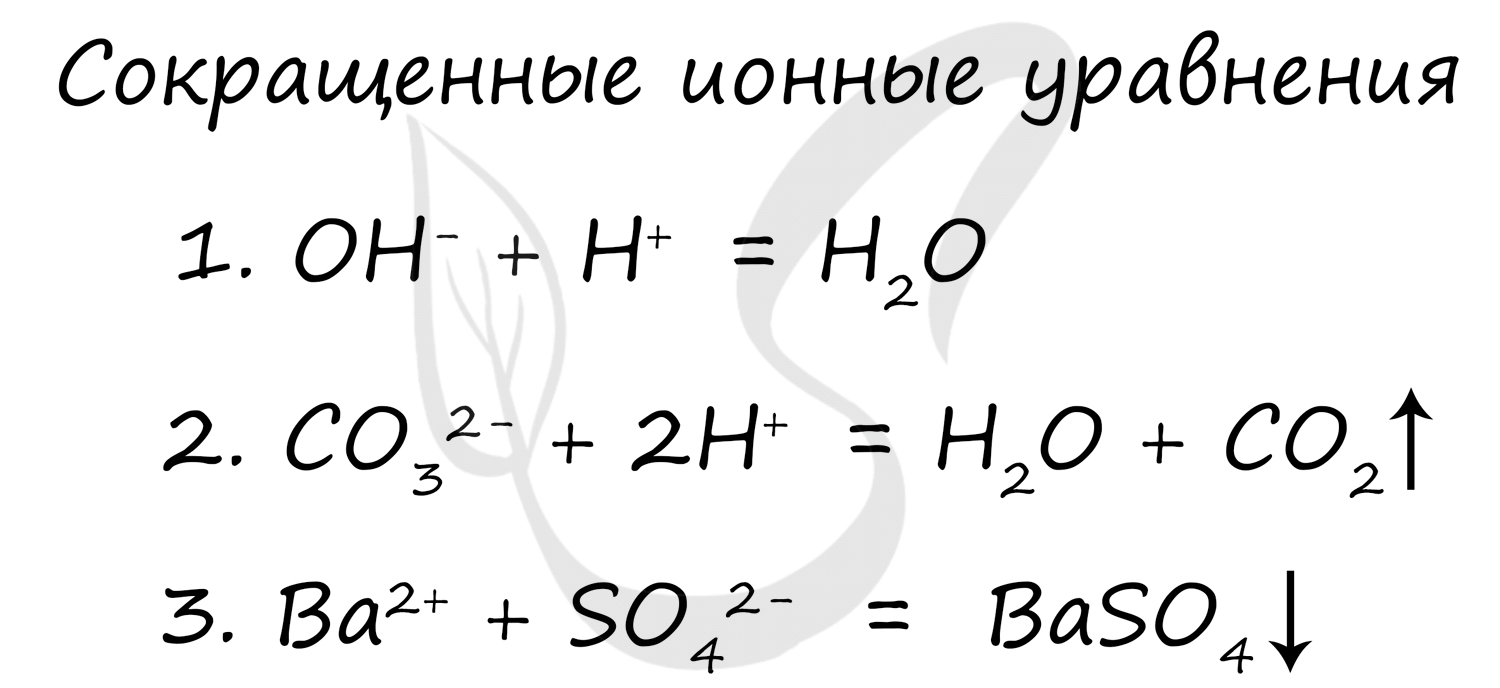
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:

