Диссоциация кислот оснований и солей конспект
Обновлено: 07.07.2024
Сформулировать определения кислот, оснований и солей с точки зрения теории электролитической диссоциации. Закрепить умение составлять уравнения диссоциации кислот, оснований и солей.
Кислоты, основания, соли (с точки зрения теории электролитической диссоциации), ступенчатая диссоциация кислот, ион гидроксония (для сильных учащихся).
Развить интеллектуальные и практические умения и навыки, память, аналитические способности, такие как умение анализировать, сравнивать, обобщать и делать выводы.
Тип и форма учебного занятия
урок – изучение нового материала, лабораторная работа.
Планируемые результаты обучения
Уметь самостоятельно определять цели своего обучения, ставить и формулировать для себя новые задачи в учёбе и познавательной деятельности, соотносить свои действия с планируемыми результатами, осуществлять контроль своей деятельности в процессе достижения результата.
Формировать ответственное отношение к учению, готовность и способность к саморазвитию и самообразованию.
Технологии обучения или элементы технологий
Технология развития критического мышления, игровые технологии, проблемно- развивающее обучение, здоровьесберегающие технологии, ИКТ
Средства обучения, дидактическое обеспечение урока
Проектор, презентация, интерактивная доска, учебник, рабочая тетрадь, ПСХЭ
Организационная структура урока
I. Организационный момент
Приветствие учеников. Выявление отсутствующих. цели и задач урока, этапов урока и времени каждого этапа.
Настраивание на восприятие материала урока.
II. Актуализация знаний
Ответ: кислоты состоят из атома водорода и кислотного остатка;
Основания состоят из металла и гидроксид ионов;
Соли состоят из металла и кислотного остатка.
Ответ: химическая связь образованная перекрытием пары валентных электронных облаков.
Работа на местах
III. Постановка проблемы урока
(мотивация и целеполагание)
Я думаю, вы догадались, что и дальше мы будем говорить о положительных и отрицательных ионах. Совершенно точно , что все эти понятия должны быть объединены в одну тему. Поэтому, исходя из рассуждений, предположите, как должна звучать наша сегодняшняя тема?
Дети выдвигают предположения и формулируют тему.
Отвечают на вопросы учителя.
Ученический демонстрационный эксперимент — определение индикаторами наличия ионов водорода и гидроксид-ионов в растворах .
Затем проводится ученический демонстрационный эксперимент: один из учащихся испытывает растворы щелочей индикаторами и доказывает наличие гидроксид-ионов, другой — растворы кислот и доказывает наличие ионов водорода, третий — растворы солей и доказывает, что общих ионов в их растворах нет.
Проводить наблюдения в ходе демонстрационного эксперимента, исследовать свойства растворов электролитов, обсуждать результаты опытов, делать выводы.
V. Изучение нового материала
Возможно несколько вариантов изучения нового материала
1 вариант : Изучение нового материала осуществляется в форме самостоятельной работы с учебником и последующего обсуждения результатов этой работы.
Сильные учащиеся самостоятельно рассматривают ступенчатую диссоциацию кислот и образование иона гидроксония.
2 вариант: обсуждение темы с учителем.
HNO 3 = H + + NO 3 -
H 2 SO 4 = H + + SO 4 2-
Сильные кислоты диссоциируют полностью по одной ступени. У всех кислот в качестве катиона выступает ион Н. при диссоциации сильных кислот ставится знак равенства. А при диссоц. Слабых кислот, вместо = ставится знак обратимости.
HNO 2 ↔ H + + NO 2 -
Многоосновные слабые кислоты дссоц. Ступенчато.
- H 3 PO 4 = H + + H 2 PO 4 -
- H 2 PO 4 - = H + + HPO 4 2-
- HPO 4 2- = H + + PO 4 3-
Лакмус и метилоранж становятся красными из – за иона Н + .
Учащиеся рассматриваю схему на с. 26 донорно – акцепторный механизм получения гидроксония.
Сильные электролиты щелочи диссоц. Полностью по первой ступени:
Многоосновные слабые основания диссоц. Ступенчато и вместо = ставится ↔ .
Cu(OH) 2 ↔ CuOH + + OH -
CuOH + ↔ Cu 2+ + OH -
Свойство оснований: мыльность на ощупь, изменение окраски: лакмус – синий, метилоранж – желтый, фенолфталени – малиновым.
Соли диссоц. По одной ступени:
AL 2 (SO 4 ) 3 = 2AL 3+ + 3SO 4 2-
Работают на местах с учебниками.
Работают на местах с тетрадями и у доски.
Ⅵ. Закрепление изученного материала
Для закрепления нового материала можно предложить учащимся качественную задачу: в трёх пробирках без этикеток находятся растворы следующих веществ: хлорида натрия, соляной кислоты, гидроксида натрия. Как можно распознать эти вещества?
Возможен другой вариант — проведение самостоятельной работы.
1. На какие ионы при растворении в воде распадаются вещества, формулы которых приведены ниже? Составьте уравнения реакций диссоциации этих веществ.
KNO 3 , Ba(OH) 2 , Al 2 (SO 4 ) 3 , H 2 SO 4 , KHSO 4
2. При растворении каких веществ могут образовываться перечисленные ионы? Катионы Na + , Ba 2+ , H + и анионы Cl – , HSO 4 – CO 3 2–
1. На какие ионы при растворении в воде распадаются вещества, формулы которых приведены ниже? Составьте уравнения реакций диссоциации этих веществ.
FeCl 3 , H 2 SO 4 , Mg(NO 3 ) 2 , NaOH, NaHSO 4 .
2. При растворении каких веществ могут образовываться перечисленные ионы? Катионы H + , Cu 2+ , K + и анионы NO 3 – , SO 4 2– , OH – .
Работа у доски и на местах с тетрадями и учебником
Попробуем подвести итоги. Основные выводы:
- Что такое кислоты?
- Что такое основания?
- Что такое соли?
Итак, ребята. Над какой темой мы сегодня работали? Поделитесь своими впечатлениями об уроке. Что вы нового узнали? Что хотели бы узнать? Что вызвало затруднения?
Участвуют в эвристической беседе
VIIІ. Итоги урока
Выставление оценок. Домашнее задание: п. 7, с. 26-28, с. 29 упр. 1-3, Тестовые Задания
Тему сформировали учащиеся правильно. Была поставлена цель и задачи . Цель и задачи были достигнуты.
Планируемые результаты: Предметные – закрепили. Метапредментные – осуществили. Личностные - сформированы.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
9 Г класс Дата: 29.09.20г.
Тема урока: Диссоциация кислот, оснований, солей.
Цели урока: рассмотреть свойства кислот, щелочей и солей в свете теории электролитической диссоциации.
Задачи урока:
Образовательные: изучить свойства кислот, щелочей и солей с позиции теории электролитической диссоциации ;
Развивающие: развивать мышление, память; умение решать уравнения и работать по таблице;
Воспитательные: воспитывать интерес к предмету.
Формировать УУД:
Познавательные УУД : умение осуществлять поиск нужной информации, выделять главное в тексте, структурировать учебный материал, грамотно формулировать вопросы,
Личностные УУД : умение применять полученные знания в своей практической деятельности.
Регулятивные УУД: умение планировать свою работу при выполнении заданий учителя, делать выводы по результатам работы.
Коммуникативные УУД: умение работать в составе творческих групп, высказывать свое мнение.
Оборудование: презентация.
Организационный момент урока.
Китайский мудрец и философ Конфуций когда-то говорил:
Три пути ведут к знанию:
путь размышления – самый благородный,
путь подражания – самый легкий,
и путь опыта – это самый горький.
Я желаю вам идти к достижению цели трудными, но благородными путями .
Актуализация знаний.
Фронтальный опрос. Учитель ставит перед учащимися вопросы, ответы на которые будут использованы в процессе изучения нового материала:
1) Какие основные классы неорганических соединений Вам известны?
(оксиды, кислоты, основания, соли)
2) Распределите вещества по классам неорганических соединений:
H 2 S О 4 , CuSO 4 , FeCl 3 , KOH, Ba(OH) 2 , K 3 PO 4 , Al 2 (SO4) 3 , HNO 3 , Ca(OH) 2 , H 3 PO 4 , Mg(NO 3 ) 2 , H 2 СО 3 , LiOH.
3) Какие вещества относятся к классу кислот?
4) Какие вещества относятся к классу оснований и как их классифицируют по растворимости в воде?
5)Какие вещества называются солями?
Решение задания. Разложить вещество на катионы и анионы.
4. Изучение нового материала.
Диссоциация кислот, оснований и солей в водных растворах
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H + ).
Многоосновные кислоты диссоциируют ступенчато :
Н3РО4 ↔ Н + + Н2РО - 4 (первая ступень) – дигидроортофосфат ион
Н2РО - 4 ↔ Н + + НРO 2- 4 (вторая ступень) – гидроортофосфат ион
НРО 2- 4 ↔ Н + + PО З- 4 (третья ступень) – ортофосфат ион
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени - по третьей.
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (OH - ) .
Щёлочи – это основания, растворимые в воде.
Это основания щелочных и щелочноземельных металлов:
LiOH, NaОН, КОН, Rb ОН, С s ОН, Fr ОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, R а(ОН)2, а также N Н4ОН
Амфолиты - это электролиты, которые при диссоциации одновременно образуют катионы водорода (H + ) и гидроксид-ионы ( OH - ).
Примеры уравнений диссоциации щелочей
Многокислотные основания диссоциируют ступенчато:
Ba(ОН)2 -> Bа(ОН) + + OH - (первая ступень)
Ba(OH) + ↔ Ba 2+ +OH - (вторая ступень)
Примеры уравнений диссоциации амфолитов
Диссоциацию амфотерного гидроксида цинка Zn(ОН)2 можно выразить уравнением:
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония (NH + 4 ) и анионы кислотных остатков.
Например, диссоциация средних солей :
Кислые же и основные соли диссоциируют ступенчато:
У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода.
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы.
Mg( OH )Cl -> Mg( OH ) + + Cl -
Mg ( OH ) + ↔ Mg 2+ + OH -
5.Закрепление изученного материала.
Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ:
Ключевые слова конспекта: электролитическая диссоциация, теория, электролиты, неэлектролиты, определения основаниям, кислотам и солям как электролитам, степень диссоциации, степень электролитической диссоциации.
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Электрический ток – это направленное движение заряженных частиц. В металлах такое направленное движение осуществляется за счёт относительно свободных электронов. Но проводить электрический ток могут не только металлы.
Вещества, растворы или расплавы которых проводят электрический ток, называются электролитами. Вещества, растворы или расплавы которых не проводят электрический ток, называются неэлектролитами.
Почему же электролиты проводят электрический ток?
В 1887 г. шведский учёный Сванте Аррениус сформулировал положения теории электролитической диссоциации. Основная идея этой теории заключается в том, что электролиты под действием растворителя самопроизвольно распадаются на ионы. Электропроводность электролитов обусловлена именно наличием в растворе свободных ионов, которые и являются носителями зарядов.
В дальнейшем теория электролитической диссоциации совершенствовалась. Современная теория водных растворов электролитов, кроме теории С. Аррениуса, включает в себя представления о гидратации ионов (И. А. Каблуков, В. А. Кистяковский) и теорию сильных электролитов (П. Й. Дебай, Э. А. Хюккель, 1923 г.).
Основными положениями теории электролитической диссоциации являются следующие:
- Электролиты в растворах под действием растворителя самопроизвольно распадаются на ионы. Такой процесс называется электролитической диссоциацией. Диссоциация также может происходить при плавлении твёрдых электролитов (термическая диссоциация электролитов).
- Ионы отличаются от атомов по составу и по свойствам. В водных растворах ионы находятся в гидратированном состоянии. Ионы в гидратированном состоянии отличаются по свойствам от ионов в газообразном состоянии вещества.
- В растворах или расплавах электролитов ионы движутся хаотично, но при пропускании через раствор или расплав электролита электрического тока ионы движутся направленно: катионы – к катоду, анионы – к аноду.
ОПРЕДЕЛЕНИЯ ОСНОВАНИЙ, КИСЛОТ И СОЛЕЙ
В свете теории электролитической диссоциации можно дать определения основаниям, кислотам и солям как электролитам.
Основания – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид анионов – гидроксид-анионы OH – :
КОН = К + + OH –
Са(ОН)2 = Са 2+ + 2 OH –
Кислоты – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид катионов – катионы водорода Н + (точнее – катионы гидроксония H3O + ).
Катион гидроксония образуется при взаимодействии Н + с молекулой H2O. В результате образуется ещё одна ковалентная связь кислорода с водородом по донорно-акцепторному механизму:
Примеры диссоциации кислот:
НCl = Н + + Cl – или НCl + H2O = H3O + + Cl –
НСlO4 = Н + + СlO4 – или НСlO4 + H2O = H3O + + СlO4 –
Соли – это электролиты, диссоциирующие в водном растворе на катионы металлов и анионы кислотного остатка.

Средние соли диссоциируют с образованием только катионов металла и анионов кислотного остатка. Например:
Соли аммония вместо катиона металла содержат катион аммония. Например:
NH4Cl = NH4 + + Cl –
Основные соли диссоциируют с образованием катионов металла, анионов ОН– и анионов кислотного остатка:

Суммарное уравнение: AlOНCl2 = Al 3+ + ОН – + 2Cl –
Кислые соли диссоциируют с образованием катионов металла, катионов водорода (гидроксония) и анионов кислотного остатка. Например:

Суммарное уравнение: Са(НСO3)2 + 2H2O = Са 2+ + 2H3O + + 2СО3 2–
Двойные соли – соли, в результате диссоциации которых образуются катионы нескольких металлов (или аммония и какого–либо металла) и анионы одного кислотного остатка. Например, сульфат калия–хрома (хромокалиевые квасцы):
Смешанные соли – соли, в результате диссоциации которых образуются катионы какого-либо металла и анионы нескольких кислотных остатков. Например, хлорид-гипохлорит кальция (хлорная известь):
СаСlOCl = Са 2+ + Cl – + СlO –
При растворении одних электролитов диссоциация происходит практически полностью. Такие электролиты называют сильными. При растворении других электролитов диссоциация происходит в незначительной мере, их называют слабыми.
СТЕПЕНЬ ДИССОЦИАЦИИ
Для количественной оценки силы электролита введено понятие степени электролитической диссоциации.

Степень электролитической диссоциации (α) – отношение количества вещества электролита, распавшегося на ионы (nрасп.), к количеству вещества электролита, поступившего в раствор (nобщ.):
Степень диссоциации также выражают в процентах, тогда 0%

В данном видеофрагменте учащиеся знакомятся с уравнениями диссоциации электролитов: оснований, кислот и солей. Все приведенные уравнения диссоциации объясняются и акцентируется внимание на наиболее сложных моментах, подчеркивается общность свойств электролитов. Это поможет сконцентрировать внимание учащихся по этой теме.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Диссоциация оснований, кислот, солей"
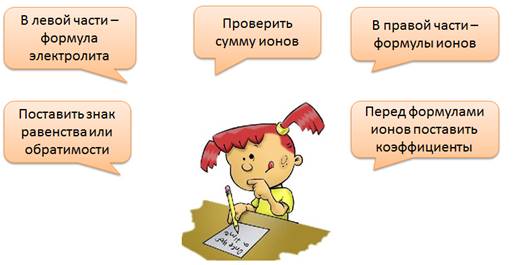
При составлении уравнений электролитической диссоциации следует поступать следующим образом: в левой части уравнения записать формулу электролита, затем поставить знак равенства или обратимости в зависимости от силы электролита. В правой части записать формулы образующихся положительно и отрицательно заряженных ионов, указав значения и знаки их зарядов. Перед формулами ионов поставить коэффициенты, затем проверить сумму положительных и отрицательных ионов, она должна быть равна нулю.
Кислоты – это электролиты, при диссоциации которых образуются катионы водорода и анионы кислотного остатка.
Сильные кислоты диссоциируют полностью по одной ступени:
HCl = H + + Cl -
H2SO4 = 2H + + SO4 2-
При диссоциации сильных кислот ставится знак равенства, а при диссоциации слабых кислот вместо знака равенства ставится знак обратимости.
HNO2 ⇆ H + + NO2 -
Многоосновные слабые кислоты диссоциируют ступенчато. На каждой стадии отщепляется ион водорода. Например, диссоциация фосфорной кислоты идет в 3 ступени:
1) H3PO4 ⇆ H + + H2PO4 -
2) H2PO4 - ⇆ H + + HPO4 2-
3) HPO4 2- ⇆ H + + PO4 3-
Следует учитывать, что диссоциация, в данном случае, по второй ступени протекает намного слабее, чем по первой, а диссоциация по третьей ступени при обычных условиях почти не происходит.
Как видно, все кислоты при диссоциации образуют катионы водорода, поэтому они имеют кислый вкус и изменяют окраску индикаторов: лакмус и метилоранж становятся красными.
Основания – это электролиты, при диссоциации которых образуются катионы металла и в качестве анионов гидроксид-ионы.
Сильные электролиты – щёлочи – диссоциируют полностью по первой ступени.
NaOH = Na + + OH -
Ca(OH)2 = Ca 2+ + 2OH -
Многоосновные слабые основания диссоциируют ступенчато и вместо знака равенства ставится знак обратимости. Например, гидроксид меди (II) диссоциирует по двум ступеням:
1) Cu(OH)2 ⇆ CuOH + + OH -
2) CuOH + ⇆ Cu 2+ + OH -
Т.к. при диссоциации оснований образуются гидроксид-ионы, то они будут иметь схожие свойства, такие как мыльность на ощупь, изменение окраски индикаторов: лакмус становится синим, метилоранж – жёлтым, фенолфталеин – малиновым.
Соли – это электролиты, при диссоциации которых образуются катионы металлов (или аммония) и анионы кислотного остатка.
Соли диссоциируют по одной ступени, в отличие от кислот и оснований.
NaCl = Na + + Cl -
Al2(SO4)3 = 2Al 3+ + 3SO4 2-
Свойства солей определяются как катионами металла, так и анионами кислотного остатка. Например, соли аммония имеют общие свойства, обусловленные наличием иона аммония (NH4 + ), так и различные, обусловленные анионами кислотного остатка. Общие свойства сульфатов – солей серной кислоты – обусловлены наличием сульфат-ионов, а специфические свойства обусловлены различными катионами.
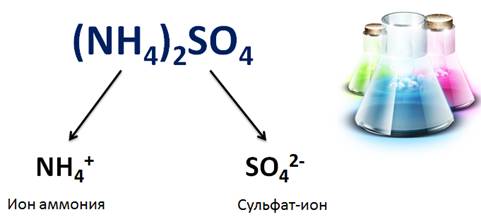
Кислые соли, в отличие от средних, диссоциируют ступенчато: первая ступень сопровождается диссоциацией катиона металла и аниона кислотного остатка, содержащего ион водорода, вторая ступень – это отщепление иона водорода и кислотного остатка.
Читайте также:
- Сложение и вычитание в пределах 7 конспект урока
- Конспект урока по технологии в 5 классе на тему металлы и сплавы пластмассы
- Способности общие и специальные способности к практическим видам деятельности конспект урока
- Камень загадка жумбактас 4 класс конспект урока
- Конспект урока сравнение чисел в пределах 5

