Аминокислоты конспект по биологии
Обновлено: 05.07.2024
Аминокислоты — это органические вещества, в молекулах которых содержатся две функциональные группы: карбоксильная − COOH и аминогруппа − N H 2 .
Аминокислоты — это производные карбоновых кислот, в молекулах которых вместо атома водорода содержится аминогруппа.
Аминокислоты могут содержать в радикале разные группы атомов. Так, в молекуле фенилаланина содержится бензольное кольцо . Его структурная формула:
В состав аминокислот могут также входить атомы некоторых элементов. Например, в молекуле цистеина содержится атом серы . Формула цистеина может быть представлена следующим образом:
Аминокислоты — кристаллические вещества , хорошо растворимые в воде. Они могут быть сладкие, безвкусные и даже горькие. Температуры плавления всех аминокислот выше \(22\) °С.
Функциональные группы определяют химические свойства аминокислот: карбоксильная — кислотные, а аминогруппа — основные. Основность аминогруппы связана со способностью атома азота присоединять к себе протоны водорода за счёт свободной электронной пары:
Аминокислоты — амфотерные органические соединения, имеющие одновременно кислотные и основные свойства.
Благодаря наличию двух функциональных групп аминокислоты способны взаимодействовать друг с другом и соединяться в более сложные вещества — пептиды :
Реакция образования полимера, сопровождающаяся выделением низкомолекулярного вещества, называется реакцией поликонденсации .
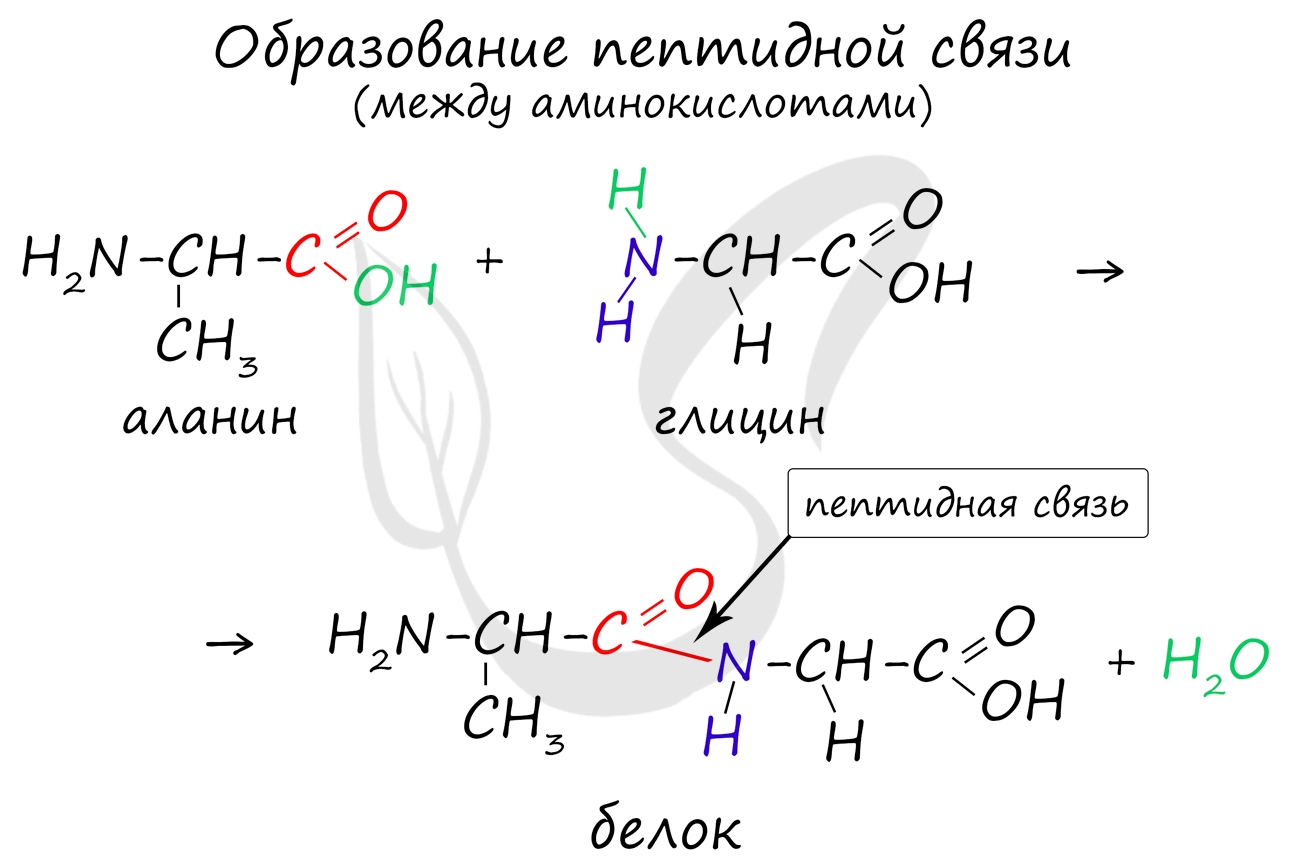
При взаимодействии молекул аминокислот между их остатками возникает связь, которая называется пептидной связью.
Пептидная связь — связь, возникающая между остатком аминогруппы одной молекулы аминокислоты и остатком карбоксильной группы другой молекулы аминокислоты − NH − CO − в полипептидах.
Аминокислоты используются как лекарства . В сельском хозяйстве их применяют для подкормки животных. Некоторые аминокислоты служат исходными веществами для синтеза полимеров (например, капрона).
Природные аминокислоты можно разделить на следующие основные группы:

- Для природных α-аминокислот R-CH(NH2)COOH применяются тривиальные названия: глицин, аланин, серин и т. д.
- По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе:
| α-Аминомасляная кислота | β-Аминомасляная кислота |
 |  |
Аминокислоты – твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы хорошо проводят электрический ток.
- Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:

- Восстановление нитрозамещенных карбоновых кислот (применяется для получения ароматических аминокислот):

| При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион: |

1. Кислотно-основные свойства аминокислот
| Аминокислоты — это амфотерные соединения. |
Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами.
| Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. |
Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин — щелочной (одна группа -СООН, две -NH2).
1.1. Взаимодействие с металлами и щелочами
Как кислоты (по карбоксильной группе), аминокислоты могут реагировать с металлами, щелочами, образуя соли:

1.2. Взаимодействие с кислотами
По аминогруппе аминокислоты реагируют с кислотами:

2. Взаимодействие с азотистой кислотой
Аминокислоты способны реагировать с азотистой кислотой.
| Например, глицин взаимодействует с азотистой кислотой: |

3. Взаимодействие с аминами
Аминокислоты способны реагировать с аминами, образуя соли или амиды.
4. Этерификация
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир:
| Например, глицин взаимодействует с этиловым спиртом: |

5. Декарбоксилирование
Протекает при нагревании аминокислот с щелочами или при нагревании.
| Например, глицин взаимодействует с гидроксидом бария при нагревании: |
| Например, глицин разлагается при нагревании: |

6. Межмолекулярное взаимодействие аминокислот
При взаимодействии аминокислот образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
| Например, г лицин реагирует с аланином с образованием дипептида (глицилаланин): |

Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH — пептидной связью.

Аминокислоты. Белки
Ключевые слова конспекта: Аминокислоты. Глицин. Пептидная связь. Белки. Качественные реакции на белки. Денатурация белка. ДНК. Ген.
Строение аминокислот
Аминокислоты представляют собой твёрдые кристаллические вещества, многие из них хорошо растворимы в воде, некоторые имеют сладкий вкус.

Способы получения и химические свойства аминокислот

В промышленности аминокислоты получают биотехнологическим путём как продукты жизнедеятельности микроорганизмов. Кроме того, разработано несколько лабораторных способов получения аминокислот. Один из них может быть представлен следующей схемой:
Простейшую аминокислоту называют аминоуксусной кислотой или глицином, её формула H2N—СН2—СООН.


Какие же свойства проявляют аминокислоты — кислотные или основные? Оказывается, подобно амфотерным неорганическим соединениям, в зависимости от природы реагента аминокислоты могут проявлять свойства как кислоты, так и основания. Например, глицин реагирует со щелочами с образованием солей, проявляя свойства кислоты:

В реакциях с кислотами глицин проявляет свойства органических оснований — аминов:
Понятие о пептидах и белках

Важное химическое свойство аминокислот — способность взаимодействовать друг с другом с отщеплением молекулы воды, образуя пептиды:

Между двумя остатками аминокислот образуется пептидная связь:
Получившийся в результате реакции дипептид может вступать в реакции с другими молекулами аминокислот, образуя полимеры — белки. Поскольку в результате этой реакции, помимо высокомолекулярного вещества, образуется второй продукт — вода, такой процесс относят к реакциям поликонденсации.
О важности белков для живых организмов свидетельствует тот факт, что в большинстве иностранных языков соединения такого типа называют протеинами (от греч. protos — первый). На Земле не существует ни одного живого организма, включая простейшие одноклеточные и бактерии, который не состоял бы из белковых молекул.
Структура и функции белков
Молекулы белков имеют также вторичную и третичную структуру. Характеристика этих структур белковых молекул приведена в таблице.

В зависимости от того, какую функцию выполняет белок в организме, различно его отношение к воде. Большинство белков в воде не растворяется, например кератины, которые составляют основу волос, ногтей, перьев, рогов и т. д. Для некоторых белков выполнение их функций невозможно без растворения. Так, в воде растворяются многие белки, выполняющие функции природных катализаторов, — ферменты.
Химические свойства белков
Для обнаружения белка проводят качественные реакции на белки. Белки дают фиолетовое окрашивание в щелочной среде под действием свежеприготовленного осадка гидроксида меди(II). Эту пробу называют биуретовой реакцией.
Вторую качественную реакцию на белки называют ксантопротеиновой. При действии на раствор белка концентрированной азотной кислоты образуется белый осадок, который быстро приобретает жёлтую окраску, а при добавлении водного раствора аммиака становится оранжевым.
Для обнаружения в белках соединений серы используют следующий тест. При горении серосодержащих белков появляется характерный запах жжёного рога.

Одно из важнейших химических свойств белков — реакции гидролиза. В присутствии природных катализаторов (ферментов) или сильных кислот молекулы воды расщепляют полимерную белковую молекулу до аминокислот:
Белки играют ключевую роль почти во всех структурах живых организмов и происходящих в них процессах.
В каждой клетке организма синтезируется множество белков. Информация о структуре всех белков организма зашифрована в ещё одних природных биополимерах — молекулах дезоксирибонуклеиновых кислот (ДНК). Мономеры ДНК — нуклеотиды. Молекулы ДНК человека содержат примерно 3,1 млрд пар нуклеотидов. Участок молекулы ДНК, отвечающий за синтез одного белка, называют геном.


Видеофрагмент позволяет изучить состав аминокислот и белков. Здесь показан принцип образования пептидной связи, структуры белка: первичная, вторичная, третичная и четвертичная, функции белка, а также демонстрируются качественные реакций на белки: биуретовая и ксантопротеиновая.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Понятие об аминокислотах. Белки"
Понятие об аминокислотах. Белки
Аминокислоты – это органические соединения, содержащие карбоксильную группу – СООН и аминогруппу – NH2.
Поэтому состав аминокислот можно выразить формулой NH2 – CH – COOH
Аминокислоты можно рассматривать как производные карбоновых кислот, у которых атом водорода в радикале замещён на аминогруппу.
Например из уксусной кислоты получается аминоуксусная кислота NH2 – CH2 – COOH.
Карбоксильная группа и аминогруппа определяют химические свойства аминокислот. Так аминогруппа определяет основные свойства вещества, потому что может присоединять к себе катион водорода за счёт наличия свободной пары электронов у азота. А карбоксильная группа определяет кислотные свойства аминокислот.
Поэтому аминокислоты – это органические вещества, которые обладают основными и кислотными свойствами, так как содержат амино- и карбоксильную группу. То есть аминокислоты являются амфотерными соединениями.
Аминокислоты – бесцветные кристаллические вещества, хорошо растворимы в воде и малорастворимы в органических растворителях. Они могут быть сладкими, безвкусными и горькими.
Аминокислоты – это кирпичики, из которых строятся молекулы белков. Благодаря наличию кислотной и основной групп молекулы аминокислот взаимодействуют друг с другом и образовывают полимеры – белки.
Это реакция поликонденсации. Таким образом, реакции поликонденсации – это реакции получения полимеров, которые сопровождаются образованием побочного низкомолекулярного соединения, например воды.
При образовании дипептида между остатками аминокислот возникает связь, которую называют пептидной. Она образуется между остатком карбоксильной группы одной аминокислоты (-СО-) и остатком аминогруппы (-NH-) другой аминокислоты (– СО – NH –).
Эта связь повторяется в полимере много раз, поэтому полимер и называется полипептидом.
Из остатков аминокислот строятся полипептиды – белки. Поэтому при расщеплении белков образуются аминокислоты.
Например, немецкий химик-органик и биохимик Э.Г. Фишер, который является лауреатом Нобелевской премии, занимался химией углеводов и белков. Он синтезировал ряд физиологически активных веществ, внедрял в синтез химических соединений ферменты.
Существует более двадцати аминокислот, а белков множество. Каждый организм имеет свой собственный неповторимый набор белков, который лишь иногда бывает схожим у близких родственников. Как тридцать три буквы алфавита образуют множество слов, так и двадцать аминокислот образуют множество белков благодаря чередованию аминокислот.
Так, определённая последовательность чередования аминокислот определяет первичную структуру белка.
Большая заслуга в изучении в открытии строения белковой молекулы принадлежит русскому биохимику А.Я. Данилевскому. Это русский биохимик, один из основоположников отечественной биохимии. Он работал в области химии ферментов и белков.
Вторичная структура белка – это упорядоченное свёртывание полипептидной цепи в спираль. В расшифровке вторичной структуры белка принимали участие многие выдающиеся учёные разных стран. В середине двадцатого века было доказано существование в белке вторичной структуры. За исследование природы химической связи во вторичной структуре белка Л. Полинг получил Нобелевскую премию.
Третичная структура белка – более сложная конфигурация, чем спираль. Она напоминает по форме клубок.
Четвертичная структура – это несколько полипептидных цепей, расположенных в пространстве. Пример четвертичной структуры белка – гемоглобин.
Белки выполняют ряд функций в организме. Прежде всего, это строительная функция, ведь белки являются составной частью оболочки, ядра, цитоплазмы, клеточного сока, семян.
Все наиболее значимые процессы в организме идут с помощью биологических катализаторов – ферментов. Поэтому белки выполняют ещё и каталитическую функцию.
Немаловажной функцией белков является защитная функция. Особые белки – антитела и антитоксины участвуют в формировании защитного свойства организма – иммунитета.
Такой белок крови, как гемоглобин является переносчиком кислорода, поэтому он выполняет транспортную функцию.
Кроме этого, белки выполняют ещё и энергетическую функцию, так как при распаде белков до конечных продуктов выделяется энергия. При полном расщеплении один грамм белка выделяется 17,6 кДж энергии. Главными поставщиками белков служит мясо, рыба, яйца, творог.
Белки способны гидролизоваться до аминокислот, то есть разлагаться водой в присутствии кислот или щелочей. В результате гидролиза разрушается первичная структура белка.
Для белков характерно такое свойство, как денатурация. Это разрушение белка при нагревании или изменении кислотности среды, при действии радиации, щелочей, солей тяжёлых металлов. Этот процесс можно наблюдать при варке яиц (повышение температуры) или при скисании молока (изменение кислотности среды). При денатурации сохраняется первичная структура белка.
Белки горят и при этом появляется запах горящего рога и жжённого пера.
Для белков характерны цветные реакции, которые являются качественными реакциями на белки.
Если налить в пробирку раствора белка и прибавить несколько капель концентрированной азотной кислоты, то образуется белый осадок. Если нагреть содержимое пробирок, то белый осадок окрашивается в жёлтый цвет. Если этот раствор охладить и добавить концентрированный раствор аммиака, то окраска становится оранжевой. Это так называемая ксантопротеиновая реакция. Эта реакция доказывает наличие бензольных колец в остатках аминокислот.
Если в пробирку налить раствора белка и добавить столько же раствора щёлочи, а затем несколько капель раствора медного купороса, то белок окрашивается в красно-фиолетовый цвет. Эта качественная реакция на белок называется биуретовой. Эта реакция указывает на наличие в белках пептидных связей.
Белки различны по растворимости в воде. Например, белки шерсти, шёлка, ногтей, рога, перьев – нерастворимы в воде, а белки крови, лимфы, пищеварительных соков – растворимы.
Белки – не только питательные вещества для человека и животных, но и сырьё для промышленности. Из шерсти изготавливают ткани, а из рога – пуговицы и гребни. Белки кожи и хрящей идут на изготовление клея. Желатин употребляется в пищевой промышленности, а также при изготовлении фотоплёнки и фотобумаги. Кожи животных используют в кожевенной промышленности.
Таким образом, аминокислоты – это органические амфотерные соединения, содержащие в составе молекулы две различные фуекциональные группы – карбоксильную и аминогруппу. Аминокислоты могут взаимодействовать друг с другом с образованием пептидов. Белки – это полипептиды, построенные из остатков аминокислот. Различают первичную, вторичную, третичную и четвертичную структуру белка. Белки подвергаются гидролизу, денатурации, им свойственны цветные реакции.
Белки (син. протеины) - высокомолекулярные органические вещества, построенные из остатков аминокислот. По своему биологическому значению принадлежат к числу важнейших составных частей организма.
Несомненно, белки абсолютно необходимы для жизни растений, животных и грибов. Именно вследствие такого большого значения белки получили названия протеинов (греч. protos — первый, главный).

Качественной реакцией на белки служит ксантопротеиновая реакция. Ее проводят путем добавления к раствору белка HNO3(конц.) до тех пор, пока не прекратится выпадение осадка. Осадок окрашивается в характерный желтый цвет.

Аминокислота
Аминокислота - органическая кислота, содержащая, по меньшей мере, одну карбоксильную группу (COOH) и одну аминогруппу (NH2). Аминокислоты являются основной составляющей всех белков.
В построении белков участвуют 20 наиболее распространенных аминокислот. На данном этапе учить их наизусть не обязательно, эта задача настигнет вас на кафедре биохимии ;)
И все же для успешного изучения данной темы мы возьмем за основу две аминокислоты: глицин и аланин.
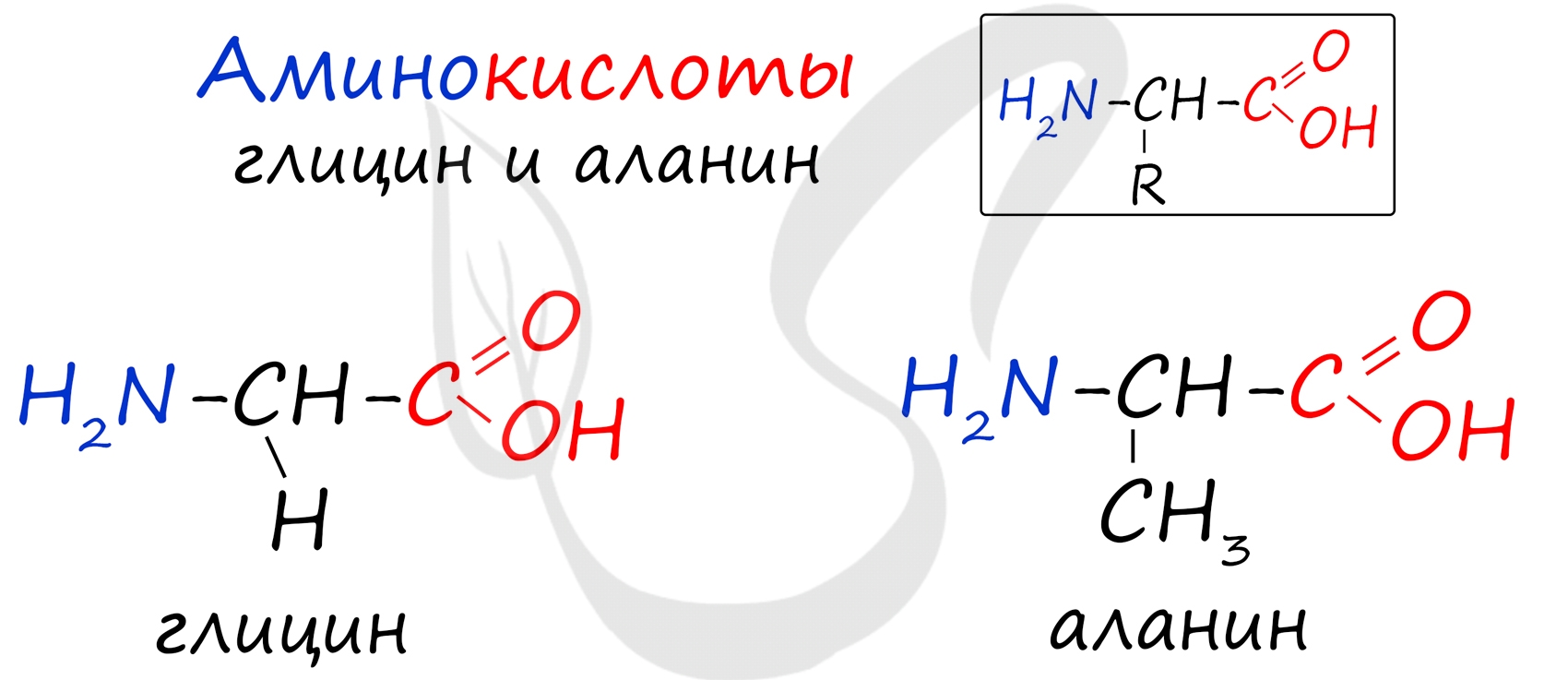
Я хочу вас обрадовать (надеюсь, что обрадую)). Если вы успешно изучили темы: карбоновые кислоты, амины - то вы уже знаете химические свойства аминокислот!
Они напоминают амфотерные соединения: по аминогруппе вступают в реакции с кислотами, по карбоксильной - с основаниями. Мы разберем их подробнее чуть ниже.
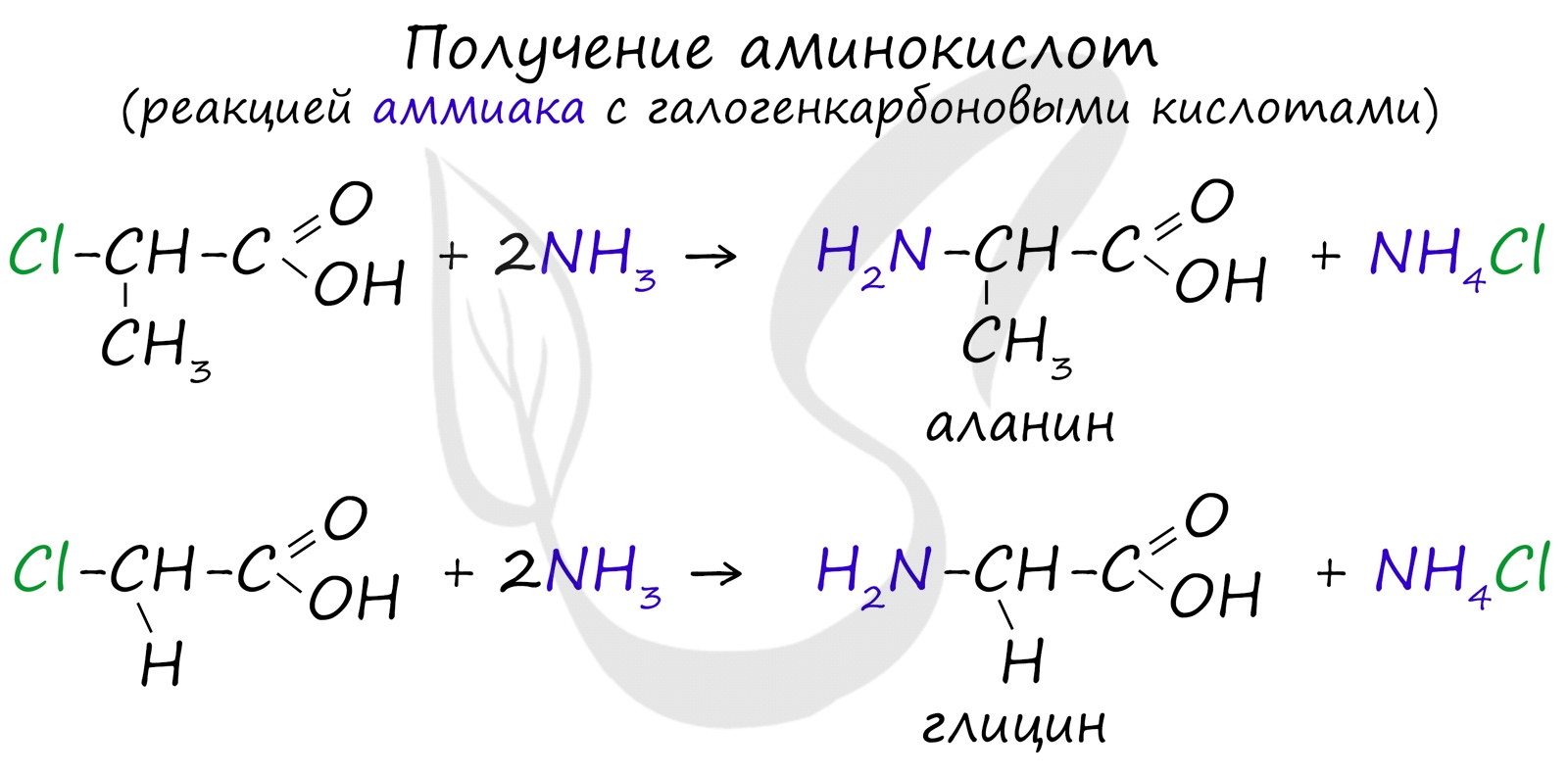
Получение аминокислот
Аминокислоты можно получить в реакции аммиака с галогенкарбоновыми кислотами.
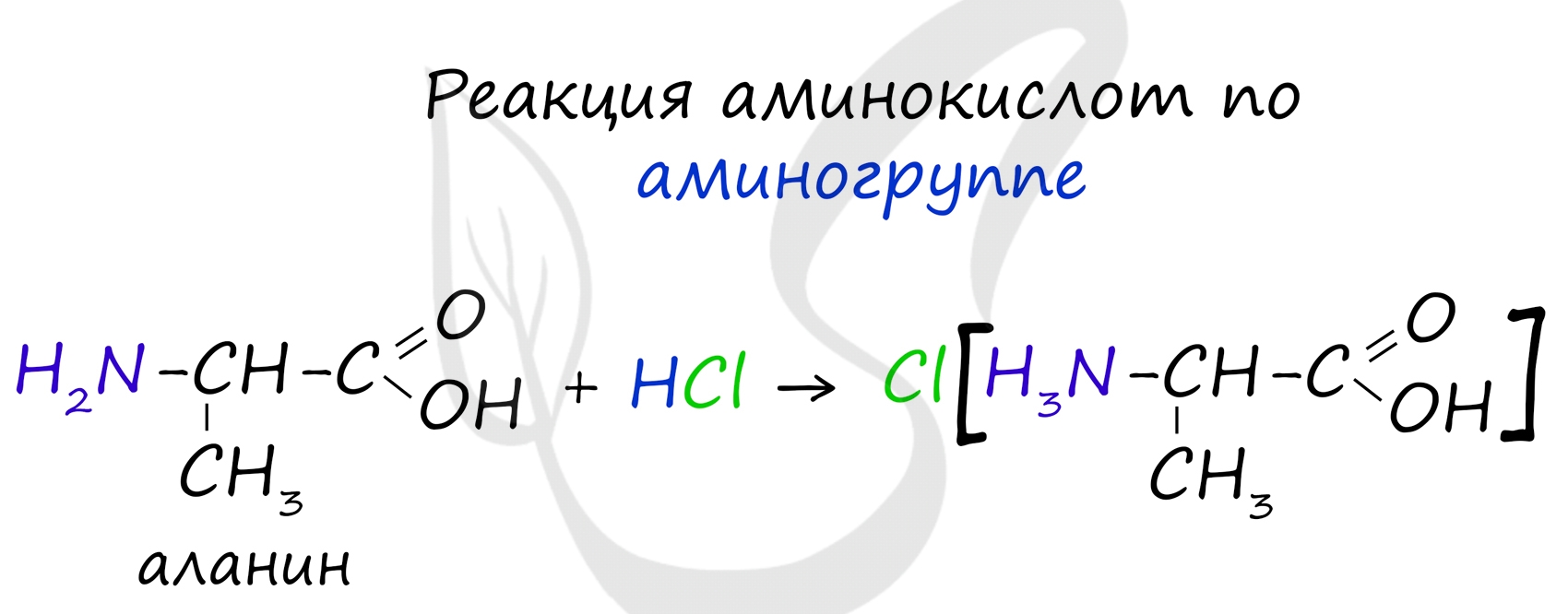
Химические свойства аминокислот
За счет наличия аминогруппы, аминокислоты проявляют основные свойства. Реагируют с кислотами.
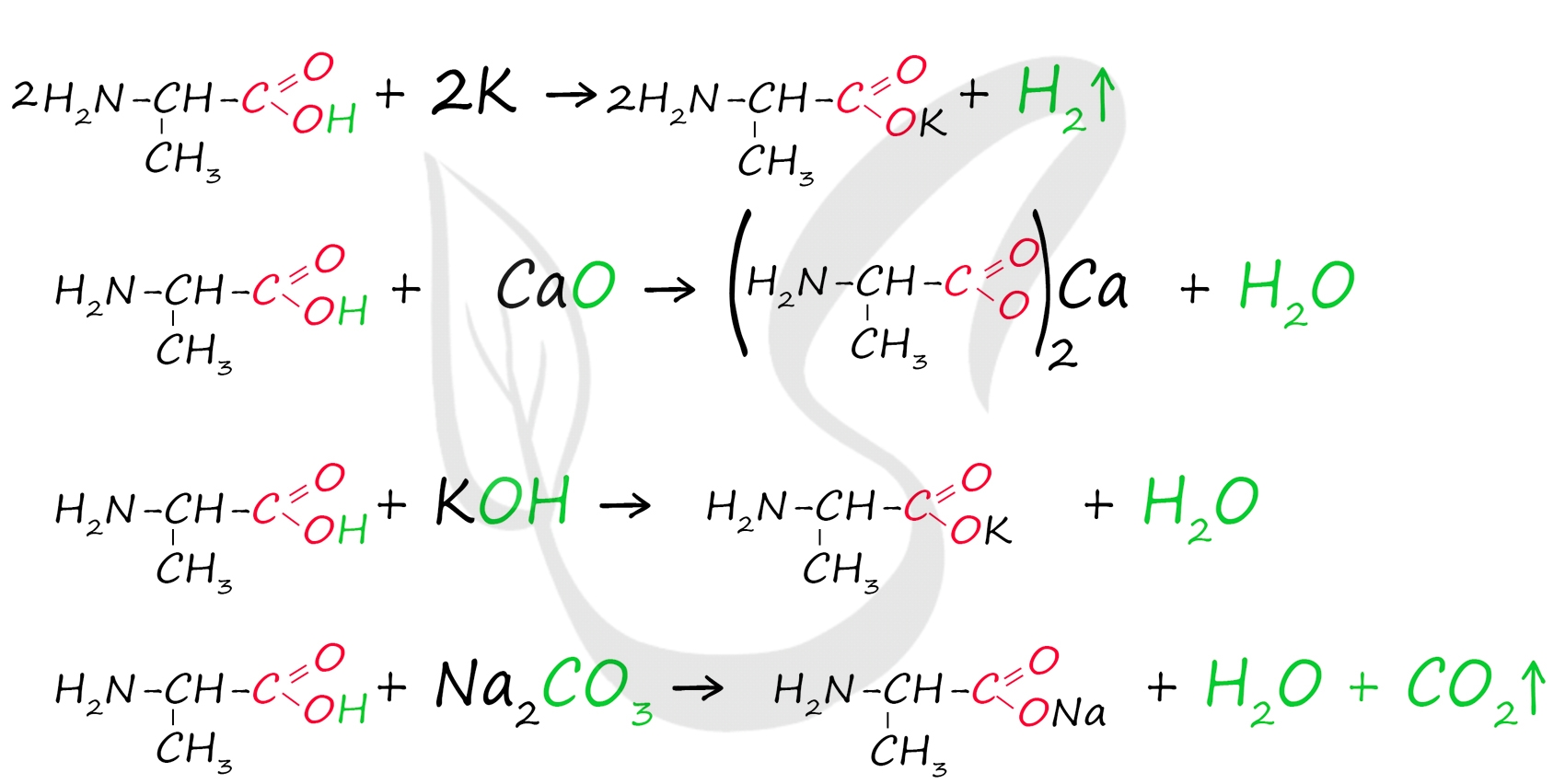
По карбоксильной группе аминокислоты способны вступать в реакции с металлами, основными оксидами, основаниями и солями более слабых кислот.
Аминокислоты способны вступать в реакцию этерификации, образуя сложные эфиры.
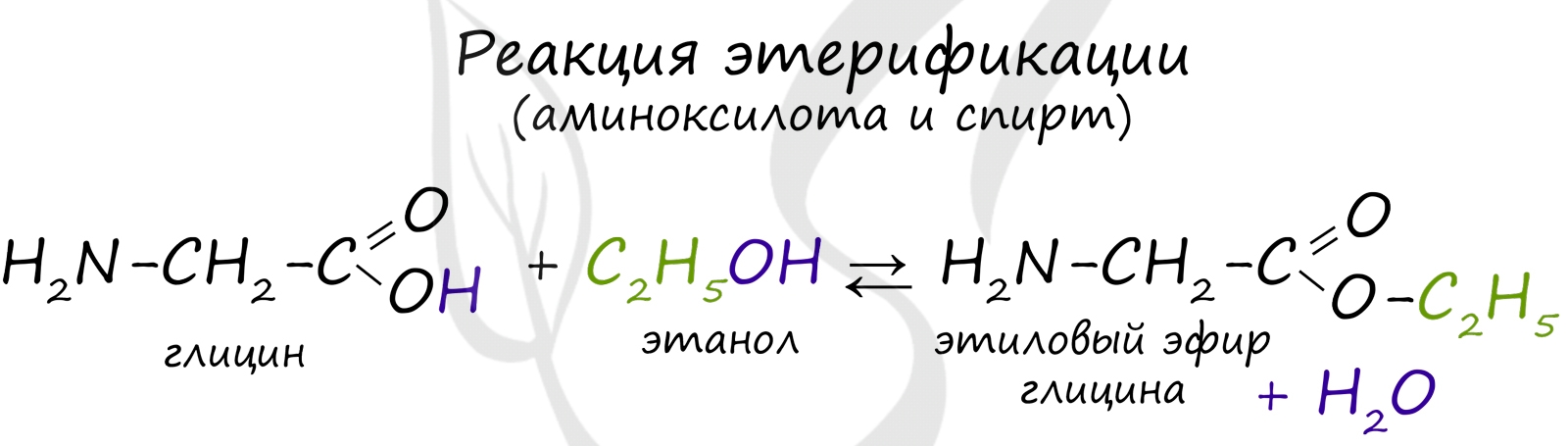
В молекуле белка аминокислоты связаны друг с другом пептидной связью. Она образуется между карбоксильной группой одной аминокислоты и аминогруппой другой аминокислоты.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:

