Амфотерные органические и неорганические соединения 11 класс конспект урока
Обновлено: 06.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Тема урока: Амфотерные органические и неорганические соединения
Девиз урока : Ребенок – не кувшин , который надо наполнить , а лампада , которую надо зажечь .
Средневековые гуманисты
развитие у учащихся представления об амфотерных соединениях;
создание условий для выявления амфотерности соединений посредством решения экспериментальных задач;
отработка умений в написании уравнений реакций с участием амфотерных соединений.
Задачи урока:
развивать учебно – познавательные компетенции учащихся - способность к самостоятельной познавательной деятельности, планирование, анализ, рефлексия, самооценка;
совершенствовать ценностно – смысловую компетенцию учащихся - п родолжить формирование ценностного отношения к исследовательской деятельности как основному способу получения знаний в химии;
продолжить формирование коммуникативных компетенций учащихся – умение общаться в группе, высказывать своё мнение, докладывать аудитории;
способствовать развитию общеучебных компетенций учащихся - совершенствование интеллектуальных умений: умения устанавливать причинно- следственные связи, делать выводы.
Тип урока: урок - исследование
Методы обучения: частично-поисковый, исследовательский.
Формы организации познавательной деятельности: групповая, индивидуальная
Оборудование: хлорид алюминия AlCl 3 , гидроксид натрия NaOH, гидроксид калия, соляная кислота HCl, серная кислота, глицин, фарфоровая ступка, пестик, пипетки, стеклянная палочка, штатив с пробирками.
Предполагаемый результат : сформированное представление об амфотерности органических и неорганических соединений через установление взаимосвязи между строением и свойствами этих веществ.
Предварительная подготовка: профильная группа поделена на 2 малые группы по 3 человека, примерно равные по знаниям, умениям и навыкам.
Организация исследования (правила ТБ)
Оформление результатов эксперимента (заполнение таблицы)
Формулирование вывода по теме урока.
Подведение итогов урока.
Внутрипредметные связи
Межпредметные связи
Биология 10-11 кл.
1. Организационный этап.
- Здравствуйте ребята!
Очень рада всех вас сегодня видеть.
2. Подготовительный этап.
В начале урока учитель ставит проблемный вопрос: можно ли варить щи в алюминиевой кастрюле, хранить в ней квашенную капусту и мыть алюминиевую посуду щелочными средствами, например, содой?
Примерный ответ учащихся: нет нельзя, так как алюминий образует на поверхности М плёнку из оксида алюминия, который является амфотерным соединением и поэтому способен взаимодействовать как с кислотами, так и с основаниями.
Учитель: При изучении амфотерных свойств соединений мы рассматриваем следующие вопросы: (Учитель знакомит с планом урока.)
План урока:
Амфотерные свойства оксидов и гидроксидов
Амфотерные свойства органических соединений
Учитель обращает внимание учащихся на оборудование на их столах, и поясняет, что они будут проводить исследовательскую работу и наблюдать за экспериментом.
Предлагает учащимся сформулировать цели данного урока (записываем на доске).
( Варианты целей: выяснение, что такое амфотерность; развитие умение писать уравнения с участием амфотерных соединений, применять полученные знания для решения задач.)
Вопросы для актуализации знаний:
С чем реагируют кислоты и щелочи?
С чем реагируют кислотные и основные оксиды?
Как доказать основный характер оксида, гидроксида?
Как доказать кислотный характер оксида, гидроксида?
3. Основной этап
Приступайте к выполнению своих исследований.
-Не забывайте о том, что по окончании работы вы ответите на поставленный вашей лаборатории вопрос и зададите его другой лаборатории. И это поможет нам сделать окончательное заключение. Пользуйтесь картой исследования, она Вам поможет определиться с тем, что вы будете делать.
- Ребята помните, что перед вами нет четкой инструкции по выполнению эксперимента, вы сами предлагаете решение этой проблемы и самостоятельно её решаете.
-Если будет нужна помощь, можете обращаться ко мне.
-Прошу лаборатории приступить к работе, хранители времени не забывайте о своих обязанностях, работаем в течении 20 минут.
- При выполнении вашего исследования соблюдайте правила ТБ.
- Инструкции по ТБ у Вас на столах, по мере надобности обращайтесь к ним.
Работу оформляем на картах исследования. Далее каждая лаборатория в, лице научного руководителя докладывает результаты исследования.
И мы вместе делаем окончательный вывод.
ПРОВЕДЕНИЕ ИССЛЕДОВАНИЯ
Выполнение самостоятельного исследования : работа учащихся двумя лабораториями по 3 человека (в каждой лаборатории распределены роли: 1 лаборант, 1 зав лабораторией, 1 научный руководитель)
Учитель – консультант
Выдвижение гипотезы учащимися: Предполагаемая гипотеза:
Гидроксид алюминия и гидроксид цинка будут реагировать с кислотами как типичные основания, а также будут реагировать со щелочью как типичная кислота (с образованием комплексной соли).
Аминокислота глицин, как и все аминокислоты будет проявлять амфотерные свойства реагируя с кислотой по амино-группе и со щелочью по карбоксильной группе.
Подтверждение или опровержение гипотезы:
Учитель: Будет ли гидроксид алюминия амфотерным соединением? А гидроксид цинка? А как вы подтвердили амфотерный характер аминокислоты – глицин?
Презентация результатов исследования : экспертное заключение лабораторий;
Формулирование вывода по работе:
Подведение итогов урока: Всем большое спасибо за работу, было приятно с вами работать. Работы сдайте, я их оценю и выставлю оценки за урок
Рефлексия. Составление синквейна
Домашнее задание: Параграф 22, упр №3 и №5 стр302

В видеоуроке рассматривается понятие амфотерности на примере неорганических и органических веществ, а также зависимость оксидов и гидроксидов переходных элементов от степени окисления.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Амфотерные органические и неорганические соединения"
Амфотэрность с греческого означает и тот, и другой. Их двойственность выражается в том, что они могут проявлять и основные, и кислотные свойства.
Амфотэрными называются соединения, которые в зависимости от условий могут проявлять и кислотные, и основные свойства.
Среди неорганических веществ амфотэрными являются оксиды и гидроксиды пэ-элементов. Например: оксиды и гидроксиды цинка, алюминия, бериллия и других элементов, а также оксиды и гидроксиды некоторых дэ-элементов.

Амфотэрные соединения в реакции с кислотой ведут себя как основания, в реакции с основания выступают в роли кислот.


С точки зрения теории электролитической диссоциации кислоты – это электролиты, при диссоциации которых в качестве катионов образуются катионы водорода. Основания – это электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
Рассмотрим изменение кислотно-основных свойств гидроксидов.
Для примера возьмём строение гидроксида натрия, гидроксида алюминия и серной кислоты.
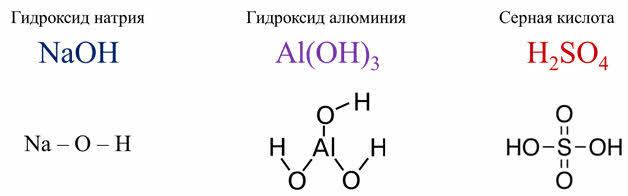
У этих гидроксидов будет по-разному разрываться связь. В гидроксиде натрия связь натрий-кислород полярнее, чем между кислородом и водородом.
Поэтому гидроксид натрия будет диссоциировать на ионы натрия и гидроксид-ионы. В серной кислоте атомы водорода и кислорода значительно отличаются по электроотрицательности, чем между серой и кислородом. Поэтому серная кислота диссоциирует с образованием катионов водорода и сульфат-ионов.
Таким образом, в периодах с увеличением порядкового номера происходит ослабление основных свойств и усиление кислотных свойств гидроксидов.

Рассмотрим свойства бескислородных соединений.
Вспомним, согласно протолитической теории, кислоты – это вещества, группы атомов или ионы, которые являются в данной реакции донорами катионов, то есть отдают катионы водорода.
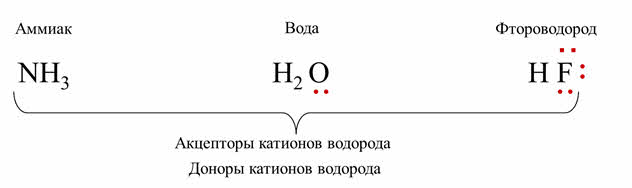
Основания – это вещества, группы атомов или ионы, которые являются акцэпторами катионов, то есть принимают протоны водорода.
Например, рассмотрим водородные соединения неметаллов: аммиака, воды и фтороводорода.
У атома азота в аммиаке одна неподелённая пара электронов, у кислорода в молекуле воды – две неподелённые пары, а у фтора во фтороводороде – три.

В этих молекулах есть неподелённые пары электронов, что позволяет им быть акцэпторами катионов водорода и проявлять основные свойства. Но в молекулах веществ есть и неметаллы – атомы водорода. При отрыве атомов водорода, соединение может быть донором катионов водорода, то есть проявлять кислотные свойства.
Например, в реакции аммиака с водой, катион водорода отделяется от воды, потому что связь между кислородом и водородом более полярная, чем между азотом и водородом, так как разница в электроорицательности кислорода и водорода больше, чем между азотом и водородом.
Этот катион водорода присоединяется к аммиаку. То есть вода здесь проявляет кислотные свойства, а аммиак – основные.
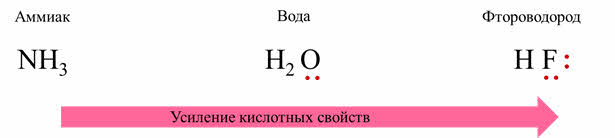
В реакции фтороводорода с водой от фтороводорода отделяется катион водорода, а вода тем самым является акцэптором катионов водорода, потому что связь между водородом и фтором более полярная, чем между кислородом и водородом, фтороводород является кислотой, а вода – основанием.

Поэтому в ряду от аммиака до фтороводорода идёт увеличение порядкового номера неметалла, основные свойства ослабевают, а идёт усиление кислотных свойств.
Таким образом, вода является амфотэрным соединением: с аммиаком вода выступает донором катионов водорода, то есть является кислотой, а в реакции с фтороводородом она будет акцэптором катионов водорода, то есть является основанием.
Амфотэрные соединения реагируют с кислотами и щелочами.
Так, в реакции с кислотами амфотэрные оксиды и гидроксиды ведут себя, как основания.
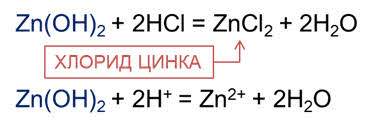
В реакции гидроксида цинка с соляной кислотой образуется соль – хлорид цинка и вода.
В реакции оксида цинка с соляной кислотой образуется соль – хлорид цинка и вода.
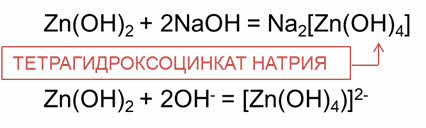
В реакциях с основаниями амфотэрные соединения ведут себя, как кислоты. Так, в реакции гидроксида цинка с гидроксидом натрия образуется тэтра-гидроксо-цинкат натрия, в реакции оксида цинка с гидроксидом натрия образуется соль – тэтра-гидроксо-цинкат натрия.

Аминокислоты являются амфотэрными органическими соединениями. В аминокислотах есть две функциональные группы: аминогруппа и карбоксильная группа.

Эти группы отличаются по свойствам. Так, аминогруппа является акцэптором катионов водорода, так как содержит азот, имеющий неподелённую пару электронов. Аминогруппа обуславливает основные свойства. Карбоксильная группа имеет сильно полярную кислород-водородную связь, поэтому является донором катионов водорода. Карбоксильная группа обуславливает кислотные свойства аминокислот.
Амфотэрные свойства аминокислот связаны с тем, что они являются бифункциональными соединениями. Аминокислота присоединяет протон водорода, который образуется при диссоциации кислоты.

При взаимодействии аминокислоты с гидроксидом натрия она проявляет кислотные свойства, так как взаимодействие происходит в карбоксильной группе.

Аминокислоты реагируют со спиртами по реакции этэрификации с образованием сложных эфиров. При чём, от кислоты отщепляется о-аш группа, а от спирта – атом водорода.

В аминокислотах возможно внутримолекулярное взаимодействие из-за наличия двух функциональных групп. Ион водорода, который образуется при диссоциации в карбоксильной группе, присоединяется к аминогруппе и образуется диполярный ион, как бы внутренняя соль, поэтому аминокислоты проявляют амфотэрные свойства.

Аминокислоты также реагируют друг с другом по реакции кондэнсации.

Благодаря этой реакции в рибосомах происходит биосинтез белка. В промышленности таким образом получают синтетические волокна, например, капрон.
Таким образом, к амфотэрным соединениям относятся соединения, которые могут реагировать и с кислотами, и с основаниями. Неорганическими амфотэрными соединениями являются оксиды и гидроксиды некоторых пэ- и дэ-элементов. Органическими амфотэрными соединениями являются аминокислоты.
Оборудование: набор реактивов, пробирки, NH, Н2O, AlCl3 — на столе учителя и для лабораторного опыта на столик учащихся.
I. Организационный момент
Постановка целей и задач урока.
II. Проверка правильности выполнения домашнего задания
Ответы на задания домашней работы

этиламин С2Н5 → NH2; δN - возрастает за счет радикала —С2Н5, его электронной плотности и электронной плотности двух атомов Н, обеспечивая сильное протонирование, основной характер.
NH3 — аммиак; δN - — усиление только электронной плотностью трех атомов Н, основной характер, т. е. протонирование слабее.

— фениламин, ароматический амин, δN - уменьшается. т. к. неподеленная пара электронов азота вступает в сопряжение с 6е - π-облаком ароматического кольца, протонирование ослабевает. основной характер уменьшается.

— дифениламин, ароматический амин: δN - уменьшается еще сильнее по сравнению с предыдущим, т. к. неподеленная пара электронов атома азота вступает в сопряжение с 6е - π-облаками двух ароматических колеи, протонирование очень слабое, основные свойства очень малы.
Основные свойства в пределах одного периода у водородных соединений уменьшаются к концу периода, т. к. заряд ядра атома элемента возрастает постепенно, радиус иона элемента уменьшается, а С.О. элемента возрастает, протонирование ослабевает, усиливается кислотный характер — отдача протона.
Пример: водородные соединения элементов II периода:

Основные свойства летучих водородных соединений одной группы к концу группы, главной подгруппы ослабевают. С.О. элемента не изменяется, быстро растет заряд ядра атома иона элемента и возрастает радиус атома иона, ослабевает протонирование. усиливается отдача протона, т. е. кислотный характер.
VI группа, главная подгруппа




III. Изучение нового материала
1. Амфотерность, амфотерные неорганические соединения.
2. Лабораторный опыт. Получить амфотерный гидроксил алюминия и доказать его амфотерные свойства.
3. Составление обобщающих схем амфотерных соединений: оксидов и гидроксидов.
4. Амфотерные органические соединения.
Амфотерность (переменность) — проявление соединением кислотных или основных свойств в зависимости от условий.
Амфотерные соединения — оксиды и гидроксиды, как правило, образованы переходными элементами.
Учащимся следует хорошо запомнить переходные элементы, которые чаще всего присутствуют в соединениях.
Амфотерны оксиды и гидроксиды многих элементов (схема 12).
Схема 12
Амфотерные оксиды и гидроксиды

1. Взаимодействуя с сильными кислотами, они обнаруживают основные свойства:

2. Взаимодействуя с щелочами — сильными основаниями, амфотерные гидроксиды и оксиды проявляют кислотные свойства:

Взаимодействуя с щелочами, гидроксид алюминия также образует комплексные соли, состав которых может быть отражен формулой:

Теперь, когда мы познакомились со строением продуктов взаимодействия амфотерных гидроксидов с щелочами в растворе, вернемся к дальнейшему рассмотрению амфотерности. Типичное амфотерное соединение — вода, которая незначительно диссоциирует:

и в присутствии кислоты ведет себя как основание (принимает Н + ), а в присутствии основания — как кислота (отдает Н + ).
В органической химии типичные амфотерные соединения — аминокислоты, общая формула которых для а-аминокислот такова:

Именно амфотерность аминокислот обусловливает их наиболее характерные свойства.
Кислотные свойства аминокислот проявляются в их способности взаимодействовать, например, с основаниями или вступать в реакцию этерификации с образованием сложных эфиров:

Основные свойства аминокислот проявляются в их способности взаимодействовать с кислотами, образуя комплексные ионы по донорно-акцепторному механизму:

Амфотерность аминокислот проявляется в их способности в растворе образовывать в результате диссоциации диполярный ион — как бы внутреннюю соль:

Аминокислоты могут вступать друг с другом в реакции поликонденсации, образуя полипептиды и белки:

Эти процессы непрерывно протекают в клетках, обеспечивая в рибосомах биосинтез белков. Как вы уже знаете, именно порядок чередования в полученной полипептидной цепи исходных аминокислот обусловливает первичную структуру белковой молекулы.
В результате подобной реакции из аминокислот с концевым (почему?) расположением групп —NH2 и —СООН получают полиамиды, например:
Читайте также:

