Альфа и бета распад правило смещения конспект
Обновлено: 05.07.2024
Ответь на вопросы: 1) Расскажите о составе атома; 2)Что такое изотопы? Чем они отличаются друг от друга? 3)Что такое нуклоны? 4) Как определяется число нейтронов в ядре?
Определите состав ядра:
Как называются данные химические элементы, чем они отличаются друг от друга?
- характерен для радиоактивных элементов с порядковым номером больше 83 .- обязательно выполняется закон сохранения массового и зарядового числа. - часто сопровождается гамма-излучением. альфа-частица (ядро атома гелия)
При альфа – распаде химического элемента образуется другой элемент, который расположен в таблице Д.И.Менделеева на две клетки ближе к ее началу, чем исходный. Правило смещения :
Записать реакцию альфа- распада
- часто сопровождается гамма-излучением. - может сопровождаться образованием антинейтрино ( легких электрически нейтральных частиц, обладающих большой проникающей способностью). - обязательно должен выполняться закон сохранения массового и зарядового числа. бета-частица (электрон).
Правило смещения При бета – распаде одного химического элемента образуется другой элемент, который расположен в таблице Д.И.Менделеева в следующей клетке за исходным (т.е. на одну клетку ближе к концу таблицы).
Записать реакцию при бета-распаде:
Решение задач 1. Определите ядро какого химического элемента образуется из углерода—14 в результате бета-распада. 2. Ядро изотопа висмут-211 получилось из другого ядра после альфа- и бета- распадов. Что это за ядро? 3. Сколько альфа- и бета-распадов происходит в результате превращения радия-226 в свинец-206?
Ядро изотопа висмута получилось из другого ядра после одного α - распада и одного β - распада. Что это за ядро? 2. В какой элемент превращается после двух β - распадов и одного α – распада?
Самостоятельная работа Вариант -1 Ядро полония-216 образовалось после двух последовательных альфа-распадов . Из какого ядра оно образовалось? Вариант –2 Во что превращается уран—238 после альфа- и двух бета-распадов?
Дополнительные задачи 1. Сколько альфа- и бета-частиц теряет ядро тория-234 при превращении в ядро радона-222? 2. Определите число протонов и нейтронов в ядрах берклия-243 и америция-243. В чем отличия этих ядер и в чем сходство? 3. Кобальт -60 используется в медицине для лечения и терапии злокачественных образований и воспалительных процессов. Этот изотоп кобальта бета- и радиоактивен. Напишите реакции. 4. Углерод -14 используется для исследования процессов обмена веществ, а также при изучении фотосинтеза растений. Этот изотоп бета-радиоактивен. Запишите реакцию.
По теме: методические разработки, презентации и конспекты
Урок по теме: Радиоактивность. Альфа-, бета-, гамма-распад атомного ядра.
Презентация поможет провести урок по теме "Радиоактивность", познакомит с видами радиоактивного излучения, типами радиоактивного распада.

Опорный конспект к уроку химии в 11 классе "Химическое равновесие. Условие его смещения"
Опорный конспект к уроку химии в 11 классе "Химическое равновесие. Условие его смещения". Его так же можно применять и при изучении этой же темы в 9 классе.

"Химическое равновесие и способы его смещения" - разработка урока + презентация

Факторы, влияющие на смещение химического равновесия (концентрация реагентов, температура, давление и катализатор). Принцип Ле Шателье. Роль смещения химического равновесия в увеличении выхода продукта в химической промышленности
Презентация к уроку по теме: "Факторы, влияющие на смещение химического равновесия (концентрация реагентов, температура, давление и катализатор). Принцип Ле Шателье. Роль смещения химического равновес.

Тренинг профильных способностей "Альфа, бета, гамма" для учащихся 8 класса

11 класс Самостоятельная работа по физике: Правило смещения.
11 класс Самостоятельная работа по физике: Правило смещения.
С Ц Е Н А Р И Й КЛАССНОГО ЧАСА на 1 сентября "ДЕНЬ РОЖДЕНИЯ 10-го бета КЛАССА"
КЛАССНОГО ЧАСА на 1 сентября "ДЕНЬ РОЖДЕНИЯ 10-го бета КЛАССА"Дата 2 сентября 2019 года.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Тема: "Альфа-бета –распад. Правило смещения. Ядерные силы ".
- продолжить изучение явления радиоактивности;
- изучить радиоактивные превращения (правила смещения и закон сохранения зарядового
и массового чисел);
- изучить ядерные силы
- научиться решать задачи на правило смещения.
Задачи :
образовательная - ознакомление учащихся с правилом смещения;
- расширение представлений учащихся о физической картине мира;
развивающая - отработать сущность физической природы радиоактивности,
радиоактивных превращений, правил смещения по периодической
системе химических элементов;
- продолжить развитие навыков работы с таблицами и схемами;
- продолжить развитие навыков работы: выделении главного,
изложение материала, развитие внимательности, умений сравнивать,
анализировать и обобщать факты, способствовать развитию
критического мышления.
воспитательная - способствовать развитию любознательности, формировать умение
излагать свою точку зрения и отстаивать свою правоту.
Средства обучения: компьютер, мультимедиапроектор, сборник задач по физике
А.П.Рымкевич и П.А.Рымкевич с периодической системой химических
1.Организационный момент урока
Знакомство с эпиграфом к уроку:
О, сколько нам открытий чудных
Готовит просвещенья дух
И опыт, сын ошибок трудных
И гений, парадоксов друг
И случай, бог изобретатель.
А.С. Пушкин
Постановка цели урока и задач для её реализации.
2. Проверка усвоения изученного материала
Проверка домашнего задания (Пишет на доске и остальные проверяют правильность выполнения)
Устный фронтальный опрос.
1. Что представляет собой альфа-частица ?
2. Какой заряд имеет ядро, согласно планетарной модели атома Резерфорда?
3. Определите, сколько электронов имеет атом бериллия 9 4 Ве ?
4. Кто открыл явление радиоактивности ?
5. Кто предложил ядерную модель строения атома ?
6. Чему равно массовое число ядра атома марганца 55 25 Мn ?
7. Что представляет собой бета-частица ?
8. Что такое изотопы? Чем они отличаются друг от друга?
9. Почему атомное ядро не распадается на отдельные нуклоны?
3. Изучение нового материала
Формулирование темы и целей урока
а) Сравнительная характеристика радия и радона
Атом имеет сложное строение. Ядро атома состоит из протонов и нейтронов. Между нуклонами в ядре действуют ядерные силы. В результате атомного превращения образуется вещество совершенно нового вида, полностью отличное по своим свойствам от первоначального вещества. В 1903 году появилась совместная работа Резерфорда и Содди об изучении радиоактивности радия.(слайд 2)
б) Правила смещения Ф.Содди
Ф.Содди заметил, что радий в процессе α-распада превращается в другой химический элемент – радон. В 1919 году Э.Резерфорд провел первую искусственную ядерную реакцию.
Таблица “Сравнение свойств радия и радона”
![]()
Далее учащиеся работают с учебником сформулировав правила смещения для альфа- и бета-распадов
Формулировку правил читают по учебнику. Устно, используя таблицу Д.И. Менделеева, определяют, какие вещества могут образоваться при α- распаде из урана, плутония, полония, а также какие вещества образуются из тех же элементов при β-распаде.

Вывод: ядра атомов имеют сложный состав, состоят из протонов и нейтронов.
4. Закрепление изученного
А) Решение задач.
1.Упражнение 47(1)
2. Пользуясьзаконом сохранения массового числа и заряда определить массовое число и зарядовое число химического элемента , образующего после радио a ктивного распада (слайд 11 )
3.В результате какого ради о активного распада натрий-22 превращается в магний – 22? ( слайд 12 )
4. Кобальт-60 используется в медицине для лечения и терапии злокачественных образований и воспалительных процессов. Кобальт-60 бета-радиоактивен. Напишите реакцию.
5. Углерод -14 используется для исследования процессов обмена веществ, а также при изучении фотосинтеза растений. Углерод-14 бета-радиоактивен. Запишите реакцию.
Б ) Тестирование
5. Домашнее задание § 63-64, упражнение 47.
6. Итоги урока
Итак, мы узнали интересные факты. Вы активно выполняли задания, работали устно и письменно, получили оценки. Молодцы! Спасибо! Каково значение эпиграфа для нашего урока?

На данном уроке мы поговорим о таком явлении, как радиоактивность и истории ее открытия. Рассмотрим схему опыта Э. Резерфорда. Разберем схему альфа-, бета- и гамма-распада. Поговорим о правиле смещения.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Радиоактивность. Альфа-, бета- и гамма- излучения. Правило смещения"
В данной теме разговор пойдёт о таком явлении, как радиоактивность. Разберем схему a-, b- и g-распада. А также поговорим о правиле смещения.
Предположение о том, что все тела состоят из мельчайших частиц, было высказано древнегреческими философами Левкиппом и Демокритом примерно 2500 лет назад. Демокрит выдвинул гипотезу о том, что вещество можно было бы делить на все более мелкие и мелкие части, то в конце концов осталась бы частица, которая сохраняла свойства этого вещества, но поделить ее на части было бы уже нельзя. Самую маленькую частицу вещества, которую нельзя разделить на части, Демокрит назвал атомом. Слово атом в переводе с греческого означает неделимый.
Таким названием хотели подчеркнуть, что атом — это мельчайшая, простейшая, не имеющая составных частей частица.
Но примерно с середины XIX в. стали появляться экспериментальные факты, которые ставили под сомнение представления о неделимости атомов. Результаты этих экспериментов наводили на мысль о том, что атомы имеют сложную структуру и что в их состав входят электрически заряженные частицы.
Наиболее ярким свидетельством сложного строения атома явилось открытие явления радиоактивности, сделанное французским физиком Антуаном Анри Беккерелем в 1896 г. Он изучал явление фосфоресценции – свечение, появляющееся после облучения солнечными лучами. Беккерель считал, что открытое излучение может проявляться как раз в результате фосфоресценции. Чтобы доказать это, он заворачивалфотопластинку в черную бумагу и помещал на нее соли калия и урана. Затем пластинку проявляли. Если на ней обнаруживались следы проникающего излучения, то это означало, что соль испускала рентгеновское излучение. Но однажды, когда на улице был пасмурный и дождливый день, Беккерелю не удалось провести данный опыт, и он убрал препараты в шуфлядку стола. Через несколько дней, когда погода успокоилась, и выглянуло ясное Солнце, он решил продолжить свои эксперименты. Достав препараты, Беккерель решил проверить фотопластинку, в которую был завернут исследуемый элемент. Каково же было его удивление, когда он обнаружил, что химический элемент уран самопроизвольно (т. е. без каких-либо внешних воздействий) излучает ранее неизвестные невидимые лучи.


Поскольку новое излучение обладало необычными свойствами, многие ученые занялись его исследованием.
Среди них особая роль принадлежит польскому физику Марии Склодовской-Кюри и ее мужу французскому ученому Пьеру Кюри. Они попытались проверить, нет ли среди веществ, не исследованных Беккерелем, таких, которые обладают таинственными свойствами урана. В первых экспериментах поиски велись с помощью электроскопа. Известно, что воздух – это изолятор, поэтому положение листочков заряженного электроскопа не должно меняться. Но если воздух подвергнуть действию излучения, тогда он становится проводником. Этим свойством излучения и воспользовались ученые для поиска новых элементов. Мария Кюри подносила к заряженному электроскопу различные минералы, и смотрела как ведут себя его листочки. В 1898 году было обнаружено, что подобные лучи испускает еще один элемент – торий.

В том же году супруги Кюри выделили из урановой смоляной руды два новых химических элемента – радий и полоний. От радия и произошел термин радиоактивность (от латинских слов radio — излучаю и activus — действенный).
В настоящее время под радиоактивностью понимают явление самопроизвольного превращения неустойчивого изотопа одного химического элемента в изотоп другого элемента, сопровождающееся испусканием частиц, обладающих большой проникающей способностью.
Такую радиоактивность еще называют естественной радиоактивностью.
В 1899 г. в результате опыта, проведенного под руководством английского физика Эрнеста Резерфорда, было обнаружено, что радиоактивное излучение радия неоднородно, т. е. оно имеет сложный состав.
Рассмотрим, как проводился этот опыт. Резерфорд взял толстостенный свинцовый сосуд с крупицей радия на дне. Пучок радиоактивного излучения радия выходит сквозь узкое отверстие и попадает на фотопластинку. После проявления фотопластинки на ней обнаруживалось одно темное пятно — как раз в том месте, куда попадал пучок.
Потом опыт изменяли: создавали сильное магнитное поле, действовавшее на пучок. В этом случае на проявленной пластинке возникало три пятна: одно, центральное, было на том же месте, что и раньше, а два других — по разные стороны от центрального.
Если два потока отклонились в магнитном поле от прежнего направления, значит, они представляют собой потоки заряженных частиц. Отклонение в разные стороны свидетельствовало о разных знаках электрических зарядов частиц. В одном потоке присутствовали только положительно заряженные частицы, в другом — отрицательно заряженные. А центральный поток представлял собой излучение, не имеющее электрического заряда.
Положительно заряженные частицы назвали a-частицами, отрицательно заряженные — b-частицами, а нейтральные — g-частицами или g -квантами.
Также Резерфорд выяснил, что излучение первого вида едва проходило сквозь лист бумаги, второго — проникало сквозь алюминиевую пластинку толщиной до 1 мм.
Ему удалось доказать, что a-лучи являются потоком ядер атомов гелия.
В том же году Беккерель доказал, что b-лучи являются потоком электронов.
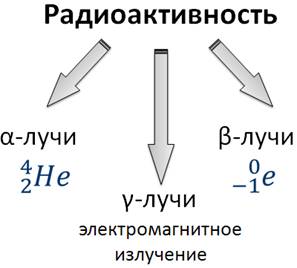
В 1900 году французский физик Вилард установил, что в состав радиоактивного излучения входит еще и третья составляющая, которая проходила сквозь слой свинца толщиной в несколько сантиметров. Он то и назвал это излучение g-лучами.
Явление радиоактивности, т. е. самопроизвольное излучение веществом a-, b- и g-частиц, наряду с другими экспериментальными фактами, послужило основанием для предположения о том, что атомы вещества имеют сложный состав.
Явление радиоактивности давало основания предположить, что в состав атома входят отрицательно и положительно заряженные частицы. Кроме того, было известно, что атом в целом нейтрален.
Опираясь на эти и некоторые другие факты, английский физик Джозеф Джон Томсон предложил в 1903 г. одну из первых моделей строения атома — пудинговую модель. По предположению Томсона, атом представляет собой шар (подобно пудингу), по всему объему которого равномерно распределен положительный заряд. Внутри этого шара находятся электроны (как изюминки в пудинге). Каждый электрон может совершать колебательные движения около своего положения равновесия. Положительный заряд шара равен по модулю суммарному отрицательному заряду электронов, поэтому электрический заряд атома в целом равен нулю.
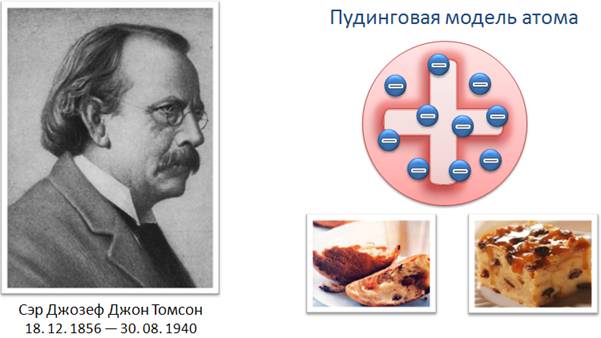
Модель строения атома, предложенная Томсоном, нуждалась в экспериментальной проверке. В частности, важно было проверить, действительно ли положительный заряд распределен по всему объему атома с постоянной плотностью.
Поэтому в 1911 г. Резерфорд совместно со своими сотрудниками провел ряд опытов по исследованию состава и строения атомов.
Суть опыта можно понять из такого сравнения. Пусть нужно проверить, не дотрагиваясь до предмета, однороден он или нет. Например, не спрятан ли в стоге сена металлический предмет. Это можно сделать, находясь вдали от стога используя малокалиберную винтовку и большой фанерный щит. Будем стрелять в стог по различным направлениям и по пробоинам в щите судить о траектории всех пуль. При однородности стога не будет ни одного рикошета. Они появятся при наличии в стоге металлического предмета, причем число рикошетов будет зависеть от его размеров (например, килограммовой гири или гимнастической 32-килограммовой).

В опытах Резерфорда тончайшая пленка из золота обстреливалась положительно заряженными частицами, и оценивались траектории их движения после прохождения пленки. Опыты Резерфорда убедительно показали, что атом неоднороден. Иначе как объяснить, что некоторые положительно заряженные частицы изменяли свое направление движения, хотя их число было чрезвычайно малым. Опыт позволил утверждать, что более 99,96% массы атома и весь положительный заряд сосредоточены в весьма малой области в центре атома, которую назвали ядром атома. Его диаметр примерно в от10 4 до 10 5 раз меньше диаметра самого атома. Соотношение этих размеров примерно такое же, как у размеров макового зернышка, лежащего в центре футбольного поля и самого поля.
Исходя из этих соображений, Резерфорд предложил ядерную (или планетарную) модель атома. Напомним, что согласно этой модели в центре атома находится положительно заряженное ядро, занимающее очень малый объем атома. Вокруг ядра движутся электроны, масса которых значительно меньше массы ядра. Атом электрически нейтрален, поскольку заряд ядра равен модулю суммарного заряда электронов.
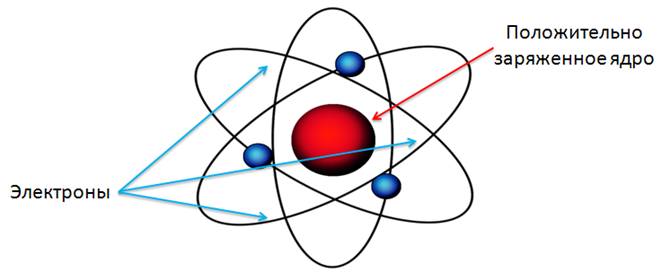
Таким образом, в результате опытов по рассеянию альфа-частиц была доказана несостоятельность модели атома Томсона, и выдвинута ядерная модель строения атома и определен порядок диаметров атомных ядер.
В 1903 г. (т. е. еще до открытия атомного ядра) Эрнест Резерфорд и его сотрудник, английский химик Фредерик Содди, обнаружили, что радиоактивный элемент радий в процессе a-распада (т. е. самопроизвольного излучения альфа-частиц) превращается в другой химический элемент — радон.
Радий и радон — это совершенно разные вещества, они отличаются по своим физическим и химическим свойствам. Радий — это металл и при обычных условиях он находится в твердом состоянии, а радон — инертный газ. Эти химические элементы занимают разные клетки в таблице Менделеева.
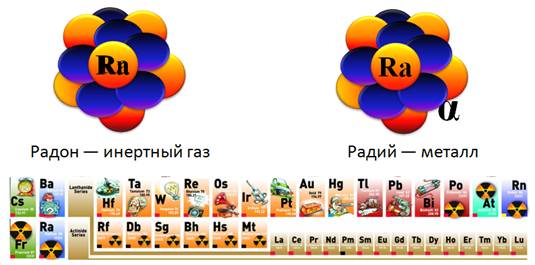
Их атомы отличаются массой, зарядом ядра, числом электронов в электронной оболочке. Они по-разному вступают в химические реакции. Дальнейшие опыты с различными радиоактивными препаратами показали, что не только при альфа-распаде, но и при бета-распаде происходит превращение одного химического элемента в другой.
После того как в 1911 г. Резерфордом была предложена ядерная модель атома, стало очевидным, что именно ядро претерпевает изменения при радиоактивных превращениях. Действительно, если бы изменения затрагивали только электронную оболочку атома (например, потеря одного или нескольких электронов), то при этом атом превращался бы в ион того же самого химического элемента, а вовсе не в атом другого элемента, с другими физическими и химическими свойствами.
Рассмотрим, как записывается реакция a-распада ядра атома радия с превращением его в ядро атома радона.
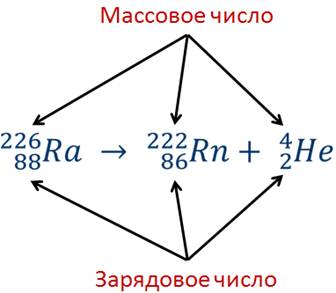
Число, стоящее перед буквенным обозначением ядра сверху, называется массовым числом, а снизу — зарядовым числом (или атомным номером).
Массовое число ядра атома данного химического элемента с точностью до целых чисел равно числу атомных единиц массы, содержащихся в массе этого ядра.
Зарядовое число ядра атома данного химического элемента равно числу элементарных электрических зарядов, содержащихся в заряде этого ядра.
Оба эти числа — массовое и зарядовое — всегда целые и положительные. Они не имеют никакого наименования, поскольку указывают, во сколько раз масса и заряд ядра больше единичных.
Из этой записи видно, что в процессе радиоактивного распада выполняются законы сохранения массового числа и заряда: массовое число и заряд распадающегося ядра атома радия равны соответственно сумме массовых чисел и сумме зарядовядер атомов радона и гелия, образовавшихся в результате этого распада.
Таким образом, из открытия, сделанного Резерфордом и Содди, следовало, что ядра атомов имеют сложный состав, т. е. состоят из каких-то частиц.
Вернемся к излучениям, которые обнаружил Резерфорд и рассмотрим каждое из них более подробно.
a-распад характеризуется вылетом ядра атома гелия. При a-распаде начального ядра продуктом распада оказывается элемент с числом протонов, равным(Z–2) и массовым числом (A–4).
Рассмотрим основные особенности a-распада. Он наблюдается для тяжелых ядер с массовым числом больше двухсот; энергия частиц для различных ядер лежит в пределах от 2 до 9 МэВ; энергии и скорости испускаемых a-частиц в пучке очень близки друг к другу.
b-распад состоит в том, что ядра самопроизвольно испускают электрон.
Изучение b-распада показало, что в нем как будто нарушаются законы сохранения энергии и импульса. Но швейцарский физик Паули высказал предположение, что в процессе распада рождается еще какая-то частица, которая и уносит часть энергии и импульса. На основе этой гипотезы итальянский физик Энрико Ферми показал, что эта частица должна быть нейтральной и иметь ничтожную массу. Эту частицу он назвал нейтрино.
Таким образом, в результате бета-распада образуется новое ядро с тем же самым массовым числом, но с атомным номером на единицу больше.
Рассмотрим особенности бета-распада: он наблюдается для тяжелых и средних ядер; скорости электронов сильно различаются по величине.
В 1913 году английскими учеными Фаянсом и Содди закономерности a- и b-излучений были сведены в общее правило — правило смещения: при a-распаде ядро теряет положительный заряд 2е и масса его убывает приблизительно на четыре атомных единицы массы. В результате элемент смещается на две клетки к началу периодической системы. После b-распада элемент смещается на одну клетку ближе к концу периодической системы.
g-излучение —это поток g-квантов. Испускание g-излучения не приводит к превращениям элементов, оно излучается не атомом, а ядром.
Рассмотрим особенности g-излучения: Это очень коротковолновое электромагнитное излучение с длиной волны от 10 –10 до 10 –13 степени метра; энергия g-кванта находится в пределах от десятков кэВ до нескольких МэВ.
В 1932 году Фредерик и Ирен Жолио-Кюри, облучая нерадиоактивные вещества a-частицами, обнаружили, что некоторые из них после облучения становятся радиоактивными. Это явление получило название искусственной радиоактивности.
Таким образом, оказалось возможным получать радиоактивные изотопы веществ, которые обычно не радиоактивны. Так, например, при бомбардировке a-частицами ядер алюминия образуется радиоактивный изотоп фосфора, который через две с половиной минуты превращается в стабильный изотоп кремния с испусканием позитрона и нейтрино.
Основные выводы:
– Радиоактивность — это явление самопроизвольного превращения неустойчивого изотопа одного химического элемента в изотоп другого элемента, сопровождающееся испусканием частиц, обладающих большой проникающей способностью.
– В 1911 году в результате проведения серии опытов Резерфорд предложил ядерную модель атома согласно которой, в центре атома находится положительно заряженное ядро, занимающее очень малый объем атома. А вокруг ядра движутся электроны, масса которых значительно меньше массы ядра. Атом электрически нейтрален, поскольку заряд ядра равен модулю суммарного заряда электронов.
– Также, в результате опытов, Резерфорд обнаружил три вида ранее не известных излучения — a-, b- и g излучения.
– a-распад характеризуется вылетом ядра атома гелия.
– b-распад состоит в том, что ядра самопроизвольно испускают электрон.
– g-излучение – это поток g -квантов. Испускание γ-излучения не приводит к превращениям элементов, оно излучается не атомом, а ядром.
– Правило смещения для a-, b- распада гласит, что при a-распаде ядро теряет положительный заряд 2е и масса его убывает приблизительно на четыре атомных единицы массы. В результате элемент смещается на две клетки к началу периодической системы. После b-распада элемент смещается на однуклетку ближе к концу периодической системы.
Э. Резенфорд вместе с с английским радиохимиком Ф. Содди доказал, что радиоактивность сопровождается самопроизвольным превращением одного химического элемента в другой.
Причем в результате радиоактивного излучения изменения претерпевают ядра атомов химических элементов.
ОБОЗНАЧЕНИЕ ЯДРА АТОМА
Среди радиоактивных элементов были обнаружены элементы, неразличимые химически, но разные по массе. Эти группы элементов были названы "изотопами" ("занимающими одно место в табл. Менделеева") . Ядра атомов изотопов одного и того же химического элемента различаются числом нейтронов.
В настоящее время установлено, что все химические элементы имеют изотопы.
В природе все без исключения химические элементы состоят из смеси нескольких изотопов, поэтому в таблице Менделеева атомные массы выражены дробными числами.
Изотопы даже нерадиоактивных элементов могут быть радиоактивны.

-альфа-частица (ядро атома гелия)
- характерен для радиоактивных элементов порядковым номером больше 83
.- обязательно выполняется закон сохранения массового и зарядового числа.
- часто сопровождается гамма-излучением.

При альфа-распаде одного химического элемента образуется другой химический элемент, который в таблице Менделеева расположен на 2 клетки ближе к её началу, чем исходный.
Физический смысл реакции:
в результате вылета альфа-частицы заряд ядра уменьшается на 2 элементарных заряда и образуется новый химический элемент.

При бета-распаде одного химического элемента образуется другой элемент, который расположен в таблице Менделеева в следующей клетке за исходным (на одну клетку ближе к концу таблицы).

- бета-частица (электрон).
- часто сопровождается гамма-излучением.
- может сопровождаться образованием антинейтрино ( легких электрически нейтральных частиц, обладающих большой проникающей способностью).
- обяэательно должен выполняться закон сохранения массового и зарядового числа.

Физический смысл реакции:
нейтрон в ядре атома может превращаться в протон, электрон и антинейтрино, в результате ядро излучает электрон.

ДЛЯ ТЕХ, КТО ЕЩЁ НЕ УСТАЛ
Предлагаю написать реакции распада и сдать работу.
( составьте цепочку превращений)
1. Ядро какого химического элемента является продуктом одного альфа-распада
и двух бета-распадов ядра данного элемента ?

2.Ядро изотопа висмута получилось из другого ядра после одного альфа-распада и одного бета-распада.
Читайте также:
- Опасные и вредные факторы пожара действующие на личный состав гпс конспект
- Конспект урока снятие мерок для построения чертежа юбки 6 класс
- Конспект занятия по развитию речи в подготовительной группе на тему игрушки
- Начертательная геометрия тени конспект
- Ремонт автомобильных двигателей техника безопасности организация ремонта двигателей конспект

