Закон рауля химия кратко
Обновлено: 02.07.2024
Рауля законы
Ра у ля зак о ны, количественные зависимости, связывающие концентрацию раствора или с давлением насыщенного пара растворителя над раствором, или с изменением температуры кипения (замерзания) раствора. Один из законов Ф. Рауля гласит: относительное понижение парциального давления пара растворителя равно мольной доле растворённого вещества, т. е.
где — давление насыщенного пара чистого растворителя при данной температуре, p1 — давление насыщенного пара растворителя над раствором, х2 — мольная доля растворённого вещества. В такой форме закон применим лишь к растворам, насыщенный пар которых ведёт себя как идеальный газ. Растворы, для которых соотношение (1) выполняется при всех концентрациях и при всех температурах в области существования раствора, часто называются идеальными (совершенными). В более общем случае в соотношении (1) должны использоваться не давления и концентрации, а летучести и активности. Для другого закона Рауля, по которому повышение температуры кипения (tкип) или понижение температуры замерзания (tк) раствора прямо пропорционально моляльной концентрации растворённого вещества, имеют место соотношения:
где D tкип — величина повышения tкип и D tк — величина понижения tк, m — моляльная концентрация раствора, а Еэ и Ек — т. н. эбулиоскопическая (см. Эбулиоскопия) и криоскопическая (см. Криоскопия) постоянные растворителя (они приводятся во многих физико-химических таблицах). Соотношения (2) используют для определения молекулярной массы растворённого вещества по экспериментально определяемым величинам D tкип и D tк.
Любому раствору характерны те или иные физические свойства, к которым относятся и коллигативные свойства растворов. Это такие свойства, на которые не оказывает влияние природа растворенного вещества, а зависят они исключительно от количества частиц этого растворенного вещества.
К коллигативным свойствам растворов относятся:
- Понижение давление паров
- Повышение температуры кипения
- Понижение температуры затвердевания (кристаллизации)
- Осмотическое давление раствора.
Рассмотрим подробнее каждое из перечисленных свойств.
Понижение давления паров
Давление насыщенного пара (т.е. пара, который пребывает в состоянии равновесия с жидкостью) над чистым растворителем называется давлением или упругостью насыщенного пара чистого растворителя.
Если в некотором растворителе растворить нелетучее вещество, то равновесное давление паров растворителя при этом понижается, т.к. присутствие какого – либо вещества, растворенного в этом растворителе, затрудняет переход частиц растворителя в паровую фазу.
Экспериментально доказано, что такое понижение давления паров напрямую зависит от количества растворенного вещества. В 1887 г. Ф.М. Рауль описал количественные закономерности коллигативных свойств растворов.
Первый закон Рауля
Первый закон Рауля заключается в следующем:
Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
p — давление пара над раствором, Па;
p0 — давление пара над чистым растворителем, Па;
χр-ль — мольная доля растворителя.
nв-ва и nр-ля – соответственно количество растворенного вещества и растворителя, моль.
Иногда Первому закону Рауля дают другую формулировку:
относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества:
При этом принимаем, что χв-ва + χр-ль= 1
Изотонический коэффициент Вант-Гоффа
Для растворов электролитов данное уравнение приобретает несколько иной вид, в его состав входит изотонический коэффициент i:
Δp — изменение давления паров раствора по сравнению с чистым растворителем;
i – изотонический коэффициент.
Изотонический коэффициент (или фактор Вант-Гоффа) — это параметр, не имеющий размерности, который характеризует поведение какого – либо вещества в растворе.
То есть, изотонический коэффициент показывает, разницу содержания частиц в растворе электролита по сравнению с раствором неэлектролита такой же концентрации. Он тесно связан связан с процессом диссоциации, точнее, со степенью диссоциации и выражается следующим выражением:
n – количество ионов, на которые диссоциирует вещество.
α – степень диссоциации.
Повышение температуры кипения или понижение температуры затвердевания (кристаллизации). Второй закон Рауля
Равновесное давление паров жидкости имеет тенденцию к увеличению с ростом температуры, жидкость начинает кипеть, при уравнивании давления ее паров и внешнего давления.
При наличии нелетучего вещества, давление паров раствора снижается, и раствор будет закипать при более высокой температуре, по сравнению с температурой кипения чистого растворителя.
Температура замерзания жидкости также определяется той температурой, при которой давления паров жидкой и твердой фаз уравниваются.
Ф.М. Рауль доказал, что повышение температуры кипения, так же как и понижение температуры замерзания разбавленных растворов нелетучих веществ, прямо пропорционально моляльной концентрации раствора и не зависит от природы растворённого вещества. Это правило известно как Второй закон Рауля:
K — криоскопическая константа,
mв-ва — моляльность вещества в растворе.
Растворы электролитов не подчиняются Законам Рауля. Но для учёта всех несоответствий Вант-Гофф предложил ввести в приведённые уравнения поправку в виде изотонического коэффициента i, учитывающего процесс распада на ионы молекул растворённого вещества:
Осмотическое давление раствора
Некоторые материалы имеют способность к полупроницаемости, т.е. им свойственно пропускать частицы определенного вида и не пропускать частицы другого вида.
Перемещение молекул растворителя (но не растворенного, в нем вещества), через полупроницаемую мембрану в раствор с большей концентрацией из более разбавленного представляет собой такое явление как осмос.
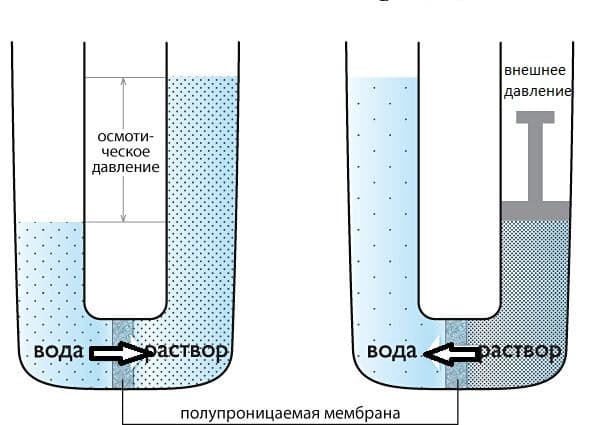
ОСМОС
Представим два таких раствора, которые разделены полупроницаемой мембраной, как показано на рисунке выше. Растворы стремятся к выравниванию концентраций, поэтому вода будет проникать в раствор, тем самым уменьшая его концентрацию.
Для того, чтобы осмос приостановить, необходимо приложить внешнее давление к раствору. Такое давление, которое требуется приложить, называется осмотическим давлением.
Осмотическое давление и концентрацию раствора неэлектролита позволяет связать уравнение Вант — Гоффа, которое напоминает уравнение идеального газа Клапейрона – Менделеева:
где C — молярная концентрация раствора, моль/м 3 ,
R — универсальная газовая постоянная (8,314 Дж/моль·К);
T — абсолютная температура раствора.
Преобразуем уравнение следующим образом:
C = n/V = m/(M·V)
π = т·R·T / M·V или
Для растворов электролитов осмотическое давление определяется уравнением, в которое входит изотонический коэффициент:
где i — изотонический коэффициент раствора.
Для растворов электролитов i > 1, а для растворов неэлектролитов i = 1.
Если полупроницаемой перегородкой разделены два раствора, имеющие одинаковое осмотическое давление, то перемещение растворителя через перегородку отсутствует. Такие растворы называются изотоническими.
Раствор, с меньшим осмотическим давлением, по сравнению с более концентрированным раствором, называют гипотоническим, а раствор с большей концентрацией – гипертоническим.
ЛЕКЦИЯ № 3. Растворы
1. Общая характеристика растворов
Растворы – термодинамически устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это дисперсные системы, состоящие из дисперсной фазы и дисперсионной среды. Различают девять систем (табл. 1):
Дисперсные системы

где Г – газ;
Т – твердое тело;
Ж – жидкость.
Существуют жидкие, газовые и твердые растворы. Растворы отличаются от химических соединений тем, что их состав может изменяться непрерывно. Как и любая химически равновесная в данных условиях система, растворы должны обладать минимумом свободной энергии Гиббса. По своему агрегатному состоянию дисперсные системы могут быть: газообразными, жидкими, твердыми; по степени дисперсности – взвесями, коллоидными и истинными растворами. Взвеси – гетерогенные системы, нестабильные во времени. Частицы их очень малы и сохраняют все свойства фазы. Взвеси расслаиваются, причем диспергированная фаза или выпадает в виде осадка, или всплывает в зависимости от соотношения плотностей. Примеры: туман (жидкость распределена в газе), суспензия (твердое тело – жидкость), эмульсия (жидкость – жидкость, C2H5OH + H2O – этиловый спирт и вода).
В истинном растворе распределенное в среде вещество диспергировано до атомного или молекулярного уровня. Примеры многочисленны: газообразный раствор – воздух, состоящий из главного компонента азота – 78% N2; сплавы, представляющие собой твердые растворы, например, медные Cu – Zn, Cu – Cd, Cu – Ni и др.
Коллоидные растворы – микрогетерогенные системы, занимают промежуточное положение между истинными растворами и взвесями. Растворы состоят из растворенного вещества и растворителя. Растворителем считают тот компонент, который преобладает в растворе. Свойства растворов зависят от концентрации. Рассмотрим способы выражения концентрации растворов.
2. Концентрация и способы ее выражения
Концентрация – количество растворенного вещества, содержащееся в определенном количестве раствора или растворителя. При определении концентрации растворов используются различные методы аналитической химии: весовые, объемные, а также методы, основанные на измерении плотности, показателя преломления и других физико-химических свойств.
Виды концентрации
Массовая доля растворенного вещества в растворе ?, % – отношение массы вещества к массе раствора:

Пример: пусть m(CaCl2) = 10 г, тогда ?(CaCl2) = (10/100) ґ 100% = 10%.
Молярность раствора – число молей растворенного вещества в одном литре раствора.
Пример: 1 моль H2SO4 – 98 г, до одного литра надо добавить воду.
Моляльность – число молей растворенного вещества на 1000 г растворителя. Пример:
Мольная доля растворенного вещества в растворе, N

где n1 – растворенное вещество (моль);
n2 – растворитель (моль).
Пример: имеем 20% NaOH (едкий натр).

Титр – число растворенного вещества в одном миллилитре раствора. Существует титриметрический анализ – метод количественного анализа, при котором содержание определяемого вещества Х рассчитывают на основании измерения количества реактива, затраченного на взаимодействие с Х, выполнение реакции в титриметрическом анализе является конечной стадией анализа. Пример: объем кислоты оттитруем щелочью каплями до исчезновения окрас-ки – полная нейтрализация. При титровании

где Н – нормальность – число моль-эквивалентов растворенного вещества в одном литре раствора.
Основной характеристикой растворов является их растворимость – масса вещества, способная раствориться в ста граммах растворителя при данной температуре; этот процесс сопровождается тепловым эффектом. Количественно растворимость твердого тела, газа, жидкости в жидком растворителе определяется концентрацией насыщенного раствора при данной температуре, т. е. сколько вещества по массе (объему) в данном растворителе. Пример: m(NaCl) – 58,5 г на 100 г H2O при данной температуре. Насыщенный раствор – раствор, находящийся в равновесии, с избытком растворяемого вещества. Пересыщенный – неустойчивый раствор, содержащий больше вещества, чем это определяется его растворимостью.
Качественная характеристика состоит в способности растворяться или не растворяться, например, сера в воде не растворяется, йод в воде практически нерастворим. Процесс растворения состоит из двух стадий:
1. Растворимость в воде твердых веществ (разрушение кристаллов – эндотермическая реакция, т. е. тепло поглощается –q1).
2. Отдельные частицы взаимодействуют с водой, этот процесс носит название – гидратация, при ней тепло выделяется +q2
Если –q1 > q2, то суммарный эффект отрицателен (–Q), если наоборот, то положителен (+Q).
?H = 0 – одинаковые эффекты, ?H 0 – тепло поглощается.
Тепловой эффект растворения – количество тепла одного моля вещества.
вещество + растворитель - насыщенный раствор + Q.
То вещество, которое растворяется с понижением температуры, увеличивает свою растворимость. Рассмотрим растворимость некоторых веществ. Пример, NH4NO3 – нитрат аммония, растворимость падает до нуля, эндотермический эффект реакции. Рассмотрим стадии подробно: на первой стадии – эффект разрушения кристаллической решетки, эндотермический. На второй – равномерное распределение по объему с водой, гидратация – экзотермический.
q1 > q2 > – Q – тепло поглощается,
Другой пример, NaOH – едкий натр, экзотермический эффект реакции,
q1 +Q – тепло выделяется.
Значит, растворимость определяется природой соли вещества и растворителя.
Другой характеристикой растворов является диэлектрическая проницаемость – во сколько раз сила взаимодействия между двумя зарядами меньше, чем в вакууме.
Если растворить в ста миллилитрах водопроводной воды 10 г едкого натра NaOH, то температура резко повышается до 60 o С (температура воды из водопроводного крана +20 o С).
Если растворить 40 г нитрата аммония NH4NO3 в 100 мл этой же воды, то температура резко понижается от +20 o С до –7 o С.
Если растворить хлорид натрия NaCl в 100 мл водопроводной воды, то температура не изменяется.
3. Растворимость газов в жидкостях
Она зависит от давления и температуры. Растворимость газов неодинакова из-за различной химической природы.
N2, H2 – мало растворимы в воде, растворимость NH3, HCl очень велика, в одном объеме H2O растворяется 700 объемов аммиака NH3.
Газ + H2O > 3,5 объема О2 в одном объеме Н2О экзотермический процесс. С повышением температуры растворимость некоторых газов уменьшается. При постоянной температуре и невысоком давлении растворимость газов, не вступающих в химическое взаимодействие с растворителем, подчиняется закону Генри – Дальтона, который состоит из нескольких частей.
1 часть: масса газа, растворяющаяся в данном объеме жидкости, пропорциональна давлению, которое газ производит на жидкость.
Например, CO2 под давлением загоняем в бутылку.
2 часть: объем газа не зависит от давления.
3 часть: если смесь газов растворять, то растворимость каждой составной части пропорциональна своему парциальному давлению.
Газы, реагирующие с водой, не подчиняются закону Генри – Дальтона.
4. Растворы неэлектролитов. Закон Рауля и его следствия
Рассмотрим модель идеального раствора. Раствор называется идеальным, если в нем отсутствует взаимодействие между частицами (молекулами, атомами, ионами). Растворы неэлектролитов – частицы, плохо растворимые в воде, так как нет носителя электрического заряда. Закон Рауля справедлив только для разбавленных растворов неэлектролитов.
Пусть PBO – давление пара над чистым растворителем, при постоянной температуре T1; PB – давление пара растворителя при этой же температуре, но над раствором, состоящим из нелетучего компонента А (сахар), и чистым жидким растворителем В:
Разность PBO – PB равна понижению давления пара.
Величина (PBO – PB) /PBO – относительное понижение упругости пара = XA = ?P/PBO, где XA – мольная доля, PBO > PB, ?P = PBO – PB – абсолютное понижение упругости пара.
Закон Рауля. Относительное понижение упругости пара растворителя над раствором равно мольной доле растворенного нелетучего компонента.

барометрическая формула Больцмана.
Следствия из закона Рауля:
1. Растворение нелетучего компонента в растворителе приводит к расширению температурной области существования жидкой фазы.
2. Понижение температуры замерзания и повышение температуры кипения прямо пропорциональны моляльной концентрации растворенного вещества.
3. Растворы, содержащие одинаковое число молей растворенных веществ в одинаковых молях растворителя, обнаруживают одно и то же понижение температуры замерзания и одно и то же повышение температуры кипения.
где Э – эбуллиоскопическая константа, +0,52.
где К – криоскопическая константа, равная –1,86.
Эбуллиоскопическая константа – разница между температурой кипения раствора и температурой чистого растворителя.
Криоскопическая константа – разница между температурой замерзания раствора и температурой чистого растворителя.
Для решения задач об этих константах необходимо знать массу растворенного вещества и массу раствора. Например, масса хлороформа (трихлорметан CHCl3) рассчитывается по формуле:

где m1 – масса растворенного вещества;
m2 – масса растворителя;
?t – величина, показывающая на сколько градусов понизилась температура;
К – криоскопическая константа.
Осмос – явление селективной диффузии определенного сорта частиц через полупроницаемую перегородку. Это явление впервые описал аббат Нолле в 1748 г. Перегородки, проницаемые только для воды или другого растворителя и непроницаемые для растворенных веществ, как низкомолекулярных, так и высокомолекулярных, могут быть изготовлены из полимерных пленок (коллодия) или гелеобразных осадков, например, ферроцианида меди Cu2[Fe(CN)6]; этот осадок образуется в порах перегородки стеклянного фильтра при погружении пористого материала сначала в раствор медного купороса (CuSO4 x 5H2O), а затем желтой кровяной соли K2[Fе(CN)6] . Вещества диффундируют через такую перегородку, что является важным случаем осмоса, позволяющим измерять осмотическое дав-ление, т. е. осмотическое давление – мера стремления растворенного вещества перейти вследствие теплового движения в процессе диффузии из раствора в чистый растворитель; распределяется равномерно по всему объему растворителя, понизив первоначальную концентрацию раствора.
За счет осмотического давления сила заставляет жидкость подниматься вверх, это осмотическое давление уравновешивается гидростатическим давлением. Когда скорости диффундирующих веществ станут равны, тогда осмос прекратится.
Закономерности:
1. При постоянной температуре осмотическое давление раствора прямо пропорционально концентрации растворенного вещества.
2. Осмотическое давление пропорционально абсолютной температуре.
В 1886 г. Я. Г. Вант-Гофф показал, что величина осмотического давления может быть выражена через состояние газа
Закон Авогадро применим к разбавленным растворам: в равных объемах различных газов при одинаковой температуре и одинаковом осмотическом давлении содержится одинаковое число растворенных частиц. Растворы различных веществ, имеющие одинаковые молярные концентрации при одинаковой температуре, имеют одинаковое осмотическое давление. Такие растворы называются изотоническими.
Осмотическое давление не зависит от природы растворяемых веществ, а зависит от концентрации. Если объем заменить на концентрацию, получим:

Рассмотрим закон Вант-Гоффа: осмотическое давление раствора численно равно тому давлению, которое производило бы данное количество растворенного вещества, если бы оно в виде идеального газа занимало при данной температуре объем, равный объему раствора.
Все описанные законы относятся к бесконечно разбавленным растворам.
Парциальное давление
Парциальное давление – то давление, которое оказывал бы газ, входящий в газовую смесь, если бы из нее были удалены все остальные газы при условии сохранения постоянными температуры и объема.
Общее давление газовой смеси определяется законом Дальтона: общее давление смеси газов, занимающих определенных объем, равно сумме парциальных давлений, которыми обладал бы каждый отдельно взятый газ, если бы он занимал объем, равный объему смеси газов.
где Р – общее давление;
Рк – парциальное давление компонентов.
Фугитивность – функция, характеризующая состояние данного вещества в чистом виде или в смеси с другими веществами при заданных температуре и давлении. По-другому она называется термодинамическая летучесть; является величиной, количественно характеризующей способность вещества к выходу из данной фазы, но выражающей эту характеристику в единицах давления. Для жидкостей и твердых тел она связана с давлением насыщенного пара и становится равной ему, когда к пару применимы законы идеальных газов. Для идеального газа, чтобы найти, например, изменение энергий Гиббса при изотермическом процессе, надо просто решить задачу в соответствии с уравнением Менделеева – Клапейрона:

Для упрощения расчета Г. Льюисом в 1901 г. была введена функция f от Р – фугитивность. Заменяя давление фугитивностью, мы сохраняем простую математическую форму, которую имеют термодинамические зависимости для идеального газа.
Итак, новая функция определяется уравнением:


Значения фугитивности при больших давлениях (и низких температурах) сильно отличаются от Р. Так, при t = 0 и Р = 1200, fco = 2663, при t = 0, P = 100, fNH3 = 204, а для N2 при t = –75, P = 6000, f – 2 x 10 6 , то есть фугитивность становится несоизмеримой с давлением.
Фугитивность можно определить как давление, которое должна производить данная реальная система, чтобы оказывать такое же действие, как и идеальная. Она характеризует отклонение от идеального состояния и, подобно давлению для идеального газа, может рассматриваться как мера рассеиваемости вещества. С приближением реального газа к идеальному состоянию/по величине приближается к Р, так что для идеального газа при всех давлениях обе величины становятся равными, то есть:

Видно, что размерность/совпадает с размерностью Р. Следует подчеркнуть, что замена Р на/в уравнениях идеального газа при переходе к реальному справедлива только для изотермического процесса, так как в соответствии с (2) фугитивность является специфической изотермической функцией. Для характеристики степени отклонения газа от идеального состояния вводят также величину

где ? – коэффициент фугитивности.
Фугитивность растворителя в разбавленном растворе не зависит от природы растворенного вещества и вычисляется по закону Рауля, то есть:

Так как фугитивность жидкости или твердого раствора равна фугитивности насыщенного пара, когда растворитель в парообразном состоянии ведет себя как идеальный газ, уравнение (4) переходит в

Зная зависимостьf1 от состава, можно найти зависимость f2 от N2 по уравнению:

ln f2 = ln N2 + const.
Переписывая это уравнение в виде
ln f2 = ln N2+ ln K(P, T),
получим при P,T= const

Если в последнем уравнении рассматривать f2 как фугитивность растворенного вещества в газовой фазе, сосуществующей жидкой (твердой), то она является точной термодинамической формой закона Генри.
Его формулировка: зависимость растворимости газа в жидкости от давления, заключается в том, что при постоянной температуре газа, растворенного в данной жидкости, растворимость газа пропорциональна его давлению над раствором.
Краткая формулировка: растворимость газа пропорциональна давлению. Этот закон установлен в 1803 г. Ему отвечает уравнение:

где Р2 – парциальное давление растворенного газа.
Газовый закон Генри точно соблюдается только для идеальных растворов и применим лишь в области невысоких давлений к газам, достаточно хорошо подчиняющимся законам Бойля – Мариотта и Гей-Люссака.
Таким образом, для разбавленного раствора фугитивность растворителя вычисляется по закону Рауля, а фугитивность растворенного вещества – по закону Генри. Константа Генри приобретает смысл фугитивности (давления) чистого растворенного вещества при давлении, равном общему давлению над раствором.
Рассмотрим модель идеального раствора. Раствор называется идеальным, если в нем отсутствует взаимодействие между частицами (молекулами, атомами, ионами). Растворы неэлектролитов – частицы, плохо растворимые в воде, так как нет носителя электрического заряда. Закон Рауля справедлив только для разбавленных растворов неэлектролитов.
Пусть PBO – давление пара над чистым растворителем, при постоянной температуре T1; PB – давление пара растворителя при этой же температуре, но над раствором, состоящим из нелетучего компонента А (сахар), и чистым жидким растворителем В:
Разность PBO – PB равна понижению давления пара.
Закон Рауля. Относительное понижение упругости пара растворителя над раствором равно мольной доле растворенного нелетучего компонента.

барометрическая формула Больцмана.
Следствия из закона Рауля:
1. Растворение нелетучего компонента в растворителе приводит к расширению температурной области существования жидкой фазы.
2. Понижение температуры замерзания и повышение температуры кипения прямо пропорциональны моляльной концентрации растворенного вещества.
3. Растворы, содержащие одинаковое число молей растворенных веществ в одинаковых молях растворителя, обнаруживают одно и то же понижение температуры замерзания и одно и то же повышение температуры кипения.
где Э – эбуллиоскопическая константа, +0,52.
где К – криоскопическая константа, равная –1,86.
Эбуллиоскопическая константа – разница между температурой кипения раствора и температурой чистого растворителя.
Криоскопическая константа – разница между температурой замерзания раствора и температурой чистого растворителя.
Для решения задач об этих константах необходимо знать массу растворенного вещества и массу раствора. Например, масса хлороформа (трихлорметан CHCl3) рассчитывается по формуле:

где m1 – масса растворенного вещества;
?t – величина, показывающая на сколько градусов понизилась температура;
К – криоскопическая константа.
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРес
Закон инерции
Закон инерции Из принципа относительности движения вытекает, что тело, на которое не действует никакая внешняя сила, может находиться не только в состоянии покоя, но и в состоянии прямолинейного равномерного движения. Это положение в физике называется законом
ЛЕКЦИЯ № 3. Растворы
ЛЕКЦИЯ № 3. Растворы 1. Общая характеристика растворов Растворы – термодинамически устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это дисперсные системы, состоящие из дисперсной фазы и дисперсионной
7. Закон Генри
7. Закон Генри Фугитивность растворителя в разбавленном растворе не зависит от природы растворенного вещества и вычисляется по закону Рауля, то есть: Так как фугитивность жидкости или твердого раствора равна фугитивности насыщенного пара, когда растворитель в
2. Закон Гесса
6. Следствия теории относительности
6. Следствия теории относительности 6.1. Время жизни Рассмотрим изменение времени жизни элементарных частиц, например, космических ?-мезонов, возникающих в результате взаимодействия космических лучей с атмосферой Земли.<…>Искусственные мезоны движутся сравнительно
Закон Мэрфи
Закон Мэрфи Дональд МИЧИ Я думаю, что самое глубокое и прочное впечатление в своей жизни каждый научный работник получает от того, как неожиданно, как несправедливо, как удручающе трудно хоть что-нибудь открыть или доказать. Многих осложнений и разочарований можно было
Закон Архимеда
Закон Авогадро
Закон Авогадро Пусть вещество представляет собой смесь различных молекул. Нет ли такой физической величины, характеризующей движение, которая была бы одинакова для всех этих молекул, например для водорода и кислорода, находящихся при одинаковой температуре?Механика
XIII. Растворы
XIII. Растворы Что такое раствор Если посолить бульон и размешать ложкой, то не останется и следов соли. Не следует думать, что крупинок соли просто не видно невооруженным глазом. Кристаллики соли никаким способом не удастся обнаружить по той причине, что они растворились.
Твердые растворы
Как замерзают растворы
Как замерзают растворы Если охладить раствор какой-либо соли в воде, то обнаружится, что температура замерзания понизилась. Нуль градусов пройден, а затвердевание не происходит. Только при температуре на несколько градусов ниже нуля в жидкости появятся кристаллики. Это
Закон преломления
Закон преломления В работе Dioptrique Декарт излагает свою теорию света, основанную на вихрях, и обсуждает законы отражения и преломления, впервые выразив принцип, что отношение углов падения и преломления зависит от среды, через которую проходит свет.Уже греки знали, что
Закон Рэлея
Закон Рэлея К концу 1899 г. были проведены более точные измерения в области более длинных волн, которые показали, что в этой области закон Вина уже несправедлив. В июне того же года лорд Рэлей (который был при рождении Джоном Вильямом Стрэтгом (1842-1919)) опубликовал вывод закона
СЛЕДСТВИЯ ДИАМАГНЕТИЗМА: РОЖДЕНИЕ КВАНТОВОЙ МЕХАНИКИ
СЛЕДСТВИЯ ДИАМАГНЕТИЗМА: РОЖДЕНИЕ КВАНТОВОЙ МЕХАНИКИ «Теперь мы уже готовы к рассмотрению теории индуцированного магнетизма с той точки зрения, которой, как я полагаю, придерживался Фарадей. Когда магнитная сила действует на произвольную среду, магнитную, диамагнитную
Читайте также:
- Социальный менеджмент это кратко
- Раскройте сущность гуманистической функции педагога кратко
- Внешняя политика россии в правление елизаветы петровны семилетняя война кратко 8 класс
- Посредничество в разрешении конфликтов внутри школы на принципах добровольности
- Дуализм декарта и идея научного метода роль картезианского сомнения в познании кратко

