Закон ломоносова лавуазье кратко
Обновлено: 05.07.2024
ЛАВУАЗЬЕ — Антуан Лоран (Antoine Laurent Lavoisier, 1743 94), знамен, франц. химик; получил воспитание в коллеже Маза рини и окончил факультет прав в Париже,. Научная деятельность Л. очень разнообразна и плодотворна. Первые работы Л. сделаны под влиянием… … Большая медицинская энциклопедия
МАССЫ СОХРАНЕНИЯ ЗАКОН — 1) М. с. з. в химии (закон Ломоносова Лавуазье) общая масса в в, вступивших в реакцию, равна общей массе продуктов реакции. М. с. з. лежит в осн. количеств. расчётов хим. реакций и имеет большое значение для хим. практики. 2) М. с. з. в физике см … Большой энциклопедический политехнический словарь
Корпускулярно-кинетическая теория М. В. Ломоносова — Корпускулярно кинетическая теория тепла выдвинутая в середине XVIII века М. В. Ломоносовым система принципов и взглядов, основанная на ряде теоретических положений, вытекающих из логических рассуждений и математических расчётов, и … Википедия
ФИЗИКА — ФИЗИКА, наука, изучающая совместно с химией общие законы превращения энергии и материи. В основе обеих наук лежат два основных закона естествознания закон сохранения массы (закон Ломоносова, Лавуазье) и закон сохранения энергии (Р. Майер, Джауль… … Большая медицинская энциклопедия
Ломоносов, Михаил Васильевич — — ученый и писатель, действительный член Российской Академии Наук, профессор химии С. Петербургского университета; родился в дер. Денисовке, Архангельской губ., 8 ноября 1711 г., скончался в С. Петербурге 4 апреля 1765 года. В настоящее… … Большая биографическая энциклопедия
Бойль Роберт — Бойль (Boyle) Роберт (25.1.1627, Лисмор, Ирландия, 31.12.1691, Лондон), английский химик и физик. Учился в Итоне. Сначала занимался религиозными и философскими вопросами, затем (с 1654), переселившись в Оксфорд, принял участие в работах научного… … Большая советская энциклопедия
Бойль — (Boyle) Роберт (25.1.1627, Лисмор, Ирландия, 31.12.1691, Лондон), английский химик и физик. Учился в Итоне. Сначала занимался религиозными и философскими вопросами, затем (с 1654), переселившись в Оксфорд, принял участие в работах… … Большая советская энциклопедия
Медицина — I Медицина Медицина система научных знаний и практической деятельности, целями которой являются укрепление и сохранение здоровья, продление жизни людей, предупреждение и лечение болезней человека. Для выполнения этих задач М. изучает строение и… … Медицинская энциклопедия
Техника и естествознание в Европе во второй половине XVII и в XVIII в. — В науке второй половины XVII в. окончательно победили гелиоцентрическая система, динамика Галилея и картезианская физика (т. е. физика Декарта и его последователей). По сравнению с первой половиной XVII в. научное представление о мире во многом… … Всемирная история. Энциклопедия
Первоначально мысль о сохранении вещества и энергии была высказана великими философами XVII-го и XVIII-го века, как аксиома, т.е. как явление, не нуждающееся в доказательствах. Ломоносов был первым, высказавшим “всеобщий закон природы” совершенно ясно и, главное, подтвердившим его количественными опытами, среди которых наиболее доказательными являлись, конечно, опыты превращения металлов в окалины в запаянных сосудах.

Р.Бойль показал, что при обжигании металлов увеличивается вес их, и объяснял это увеличение веса соединением с металлами весомой части пламени, материи огня.
Опыты Бойля заключались в том, что Бойль брал стеклянные реторты, клал в них свинец или олово, запаивал герметически на огне горлышко реторты и взвешивал их. При нагревании такой реторты свинец переходил в окалину; когда, после двухчасового нагревания, он открывал запаянный кончик реторты, воздух с шумом врывался в неё – признак того, как указывает Бойль, что реторта была действительно герметически запаяна – и при вторичном взвешивании оказывалась прибыль веса. Отсюда Бойль заключил, что материя огня проходит через стекло и соединяется с металлом.
Эти-то опыты Ломоносов повторил в 1756-м году и, как он сам пишет в ежегодных отчётах о своих занятиях, со следующим результатом: “Между разными химическими опытами, которых журнал на 13-ти листах, деланы опыты в заплавленных накрепко стеклянных сосудах, чтобы исследовать, прибывает ли вес металлов от чистого жара. Оными опытами нашлось, что славного Роберта Бойля мнение ложно, ибо без пропускания внешнего воздуха вес сожжённого металла остается в одной мере”.
Последнее обстоятельство – пропускание внешнего воздуха – и было причиною того, что у Бойля, вскрывавшего всегда свои реторты перед взвешиванием, наблюдалось увеличение веса.
Таким образом, опыты Ломоносова с полною определённостью показали, что образование окалины происходит именно от соединения металла с воздухом при прокаливании. Результат этот чрезвычайно важен: истинное объяснение явлений горения, как соединения горящего или обжигаемого тела с кислородом воздуха, судя по известной нам истории науки, принадлежит Лавуазье, который начал свои классические исследования именно с повторения опытов Бойля и в 1773-м году, через 17 лет после Ломоносова, получил совершенно такой же результат, как и Ломоносов. Лавуазье затем изучил те изменения, которые происходят с воздухом при обжигании металлов, и получил отсюда верное объяснение явлений горения.
Опыты Лавуазье повторяются в каждом учебнике химии, об опытах же Ломоносова никто не знает, и даже русские химики не находят нужным упоминать о них; а между тем, Ломоносов был несомненно предшественником Лавуазье.

Лавуазье в 1789-м году в своём “Элементарном руководстве химии” даёт описания явлений брожения виноградного сахара, распадающегося при этом на углекислоту и винный спирт, вес которых равен весу взятого сахара, Лавуазье пишет: “Так как ничто не творится, ни в искусственных процессах, ни в природных, и можно выставить положение, что во всякой операции имеется одинаковое количество материи до и после операции, что качество и количество начал остались теми же самыми, произошли лишь изменения. На этом положении основано всё искусство делать опыты в химии: необходимо предполагать во всех действительное равенство между началами исследуемого тела и получаемого из него анализом”.
Закон сохранения массы вещества при химических реакциях подвергался проверке много раз в XIX-м и начале XX-го столетия и теперь может считаться правильным в пределах тысячных долей миллиграмма. Что же касается закона сохранения энергии, открытого Ломоносовым, то этот закон стал общепризнанным не ранее второй половины XIX-го века.
Подтвердить правильность закона сохранения массы веществ можно и на простом опыте. В колбу помещают немного красного фосфора, закрывают пробкой и взвешивают на весах. Затем колбу с фосфором осторожно нагревают. О том, что произошла химическая реакция, судят по появлению в колбе белого дыма, состоящего из частиц оксида фосфора. При вторичном взвешивании убеждаются, что в результате реакции масса веществ не изменилась.
С точки зрения атомно-молекулярного учения закон сохранения массы объясняется так: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка.
Так как число атомов до реакции и после остается неизменным, то их общая масса также не изменяется.
Значение закона:
1. Открытие закона сохранения массы веществ способствовало дальнейшему развитию химии как науки.
2. На основании закона сохранения массы веществ производят практические важные расчеты.
3. Вещества не исчезают бесследно и не образуются из ничего.
4. Сущность химических явлений заключается в перераспределении атомов исходных веществ с образованием новых веществ.
Закон сохранения массы веществ один из важнейших законов химии. Его открыл М. В. Ломоносов, а позже экспериментально подтвердил А. Лавуазье. Так в чем же состоит суть этого закона?
История
Закон сохранения массы веществ впервые сформулировал М. В. Ломоносов в 1748 году, а экспериментально подтвердил его на примере обжига металлов в запаянных сосудах в 1756 году. Закон сохранения массы веществ Ломоносов связывал с законом сохранения энергии (количества движения). Он рассматривал эти законы в единстве как всеобщий закон природы.

Рис. 1. М. В. Ломоносов.
Но еще до Ломоносова более 20 веков назад древнегреческий ученый Демокрит предполагал, что все живое и неживое состоит из незримых частиц. позже в XVII веке эти догадки подтвердил Р. Бойль. Он проводил эксперименты с металлом и древесиной и выяснил, что вес металла после нагревания увеличился, а вес золы по сравнению с деревом, наоборот, уменьшился.
Независимо от М. В. Ломоносова закон сохранения массы вещества был установлен в 1789 году французским химиком А. Лавуазье, который показал, что при химических реакциях сохраняется не только общая масса веществ, но и масса каждого из элементов, входящих в состав взаимодействующих веществ.
Взгляды Ломоносова и Лавуазье были подтверждены современной наукой. В 1905 году А. Эйнштейн показал, что между массой тела (m) и его энергией (E) существует связь, выражаемая уравнением:
где c – скорость света в вакууме.

Рис. 2. Альберт Эйнштейн.
Таким образом, закон сохранения массы дает материальную основу для составления уравнений химических реакций.
Суть закона сохранения массы вещества
Закон сохранения массы вещества заключается в следующем: масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.

Рис. 3. Закон сохранения массы вещества.
При написании уравнений химических реакций надо следить за соблюдением этого закона. Число атомов элемента в левой и правой частях реакций должно быть одинаковым, так как атомные частицы в химических превращениях неделимы и никуда не исчезают, а лишь переходят из одного вещества в другое. Сущность химической реакции – разрыв одних связей и образование других связей. Поскольку эти процессы связаны с затратой и получением энергии, то знак равенства в реакциях можно ставить, если учтены энергетические факторы, условия реакции, агрегатные состояния веществ.
Очень часто знак равенства, особенно в неорганических реакциях, ставят и без учета необходимых факторов,производя упрощенную запись. При уравнивании коэффициентов вначале уравнивают число атомов металла, потом неметалла, затем водорода и в конце производят проверку по кислороду.
Что мы узнали?
Закон сохранения массы вещества изучают в школе по химии 8 класса, так как понимание его сути необходимо для правильного составления уравнений реакций. О том, что любая материя на земле состоит из невидимых частиц предположил еще древнегреческий ученый Демокрит, а его более современные последователи Ломоносов, Лавуазье, Эйнштейн доказали это экспериментально.
Закон сохранения массы в химии изучают в 8 классе. Его сформулировали на основании опытов по прокаливанию металлов. Этот закон имеет основополагающее значение в химии. После его открытия химия стала считаться точной наукой. Закон послужил основой для проведения количественного химического анализа, для составления химических уравнений. Сохранения массы вещества открыто и обоснованно двумя учеными Ломоносовым и Лавуазье.

История открытия

Впервые о принципе сохранения материи люди задумывались еще в древности. Об этом рассуждали древние философы:
- Эмпедокл;
- Аристотель;
- Демокрит;
- Эпикур.
В средневековье тоже считали, что этот закон действует. Фрэнсис Бэкон еще в 1620 году утверждал, что сумма материй постоянна, уничтожить ее не может ничто.
В 1673 году Роберт Бойль выразил сомнения в законе. У него при нагревании металлов вес окалины увеличился. Причиной этого было проведение опытов в открытых сосудах.

Закон сохранения веществ Ломоносов сформулировал на основании философских соображений. Великий ученый не считал, что открыл новую закономерность. Но ученый опирался на это правило в экспериментах.
Параллельно с Михаилом Васильевичем французский ученый Лавуазье занимался этим вопросом. И в 1789 году он провел опыты, доказывающие, что масса металлов в закрытых сосудах остается неизменной. Лавуазье и Ломоносов являются авторами этой закономерности.
Формулировка закона
Определение закона звучит так: масса веществ, вступивших в реакцию, равна массе образовавшихся веществ. Вещества, которые вступили в реакцию, называются реагентами, а получившиеся — продуктами.
Согласно атомно-молекулярному учению, количество молей в закрытой системе не изменяется, потому что атомы не пропадают и не появляются. Атомы реагентов образуют продукты реакции, меняя структуру связи.
Когда энергия из окружающей среды поглощается, масса увеличивается, а если теряется — уменьшается. При ядерных реакциях изменения ощутимы. При тепловом обмене изменение этой весовой характеристики несущественны.
Химические уравнения
На основании этой закономерности в химических уравнениях считается, что можно поставить знак равенства между массой реагентов и продуктов реакции. Образование одних связей за счет разрыва других называется химической реакцией. При этом образуется или затрачивается какая-то доля энергии. Для упрощения записи в уравнениях не всегда учитываются все необходимые факторы.

Считается, что соответствующие атомы реагентов переходят в атомы продуктов. Уравнение состоит из двух частей:
- левой (в ней записываются формулы реагентов через плюс);
- правой (формулы продуктов).
После определения коэффициентов между частями уравнения ставится знак равенства. Расстановка коэффициентов выполняется по очереди:
- Металлы.
- Неметаллы.
- Водород.
- Кислород (по нему определяют правильность вычислений).
Чтобы уравнять количество атомов, приходится подумать. Например, реакции разложения:
- гидроксида железа (2 Fe (OH)3 = Fe2O3 + 3 H2O);
- оксида серебра (2 Ag2O = 4 Ag + O2);
- карбоната кальция (СаCO3 = СаO + CO2);
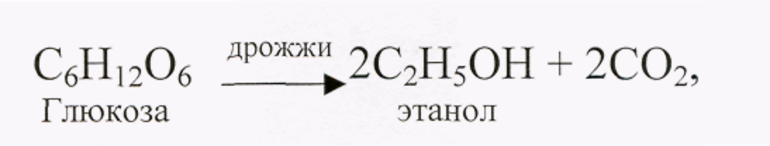
- спиртовое брожение глюкозы (С6Н12О6 = 2 С2Н5ОH + 2 CO2);
- серной кислоты (H2SO4 = SO3 + H2O).
Закон сохранения массы веществ в химии применим с большей точностью, чем в физике, потому что можно пренебречь релятивистскими поправками. Эти поправки наблюдаются, когда скорость тела можно сопоставить со скоростью света.
На основании данного правила составляют уравнения, могут производить количественный химический анализ.
Читайте также:

