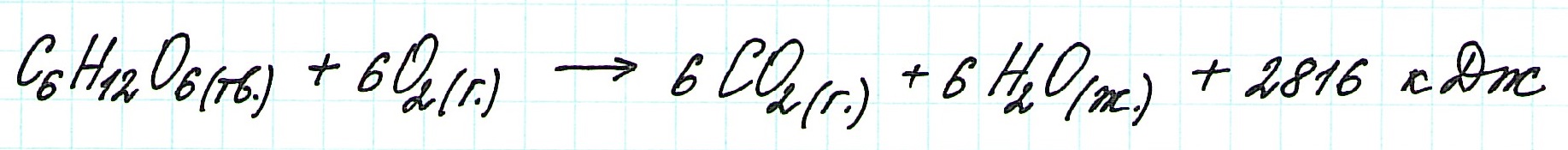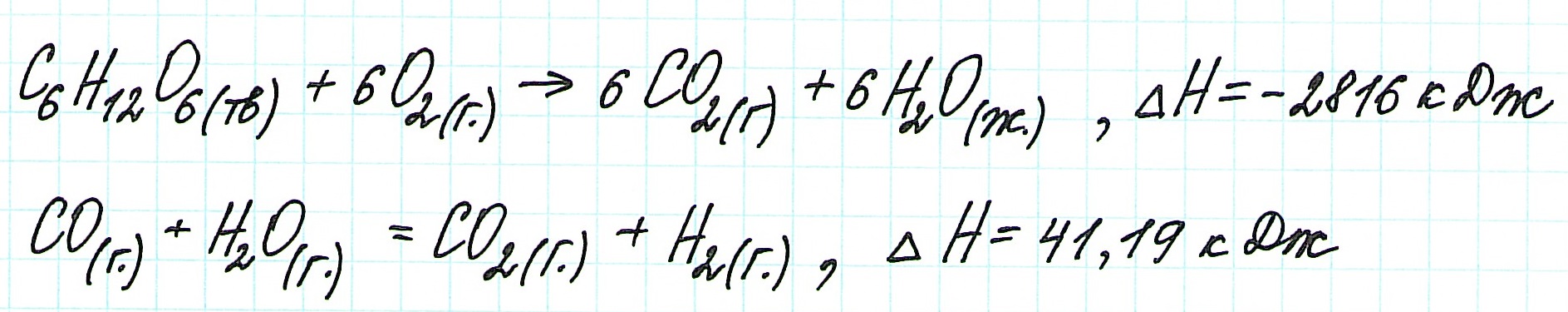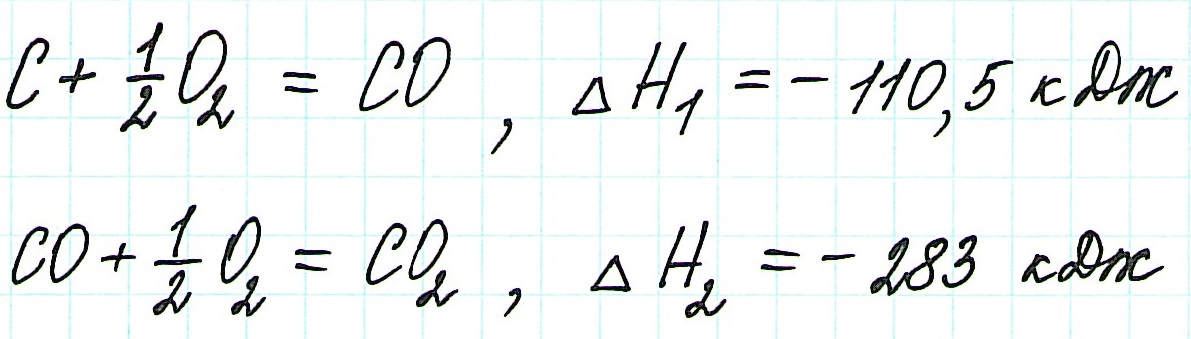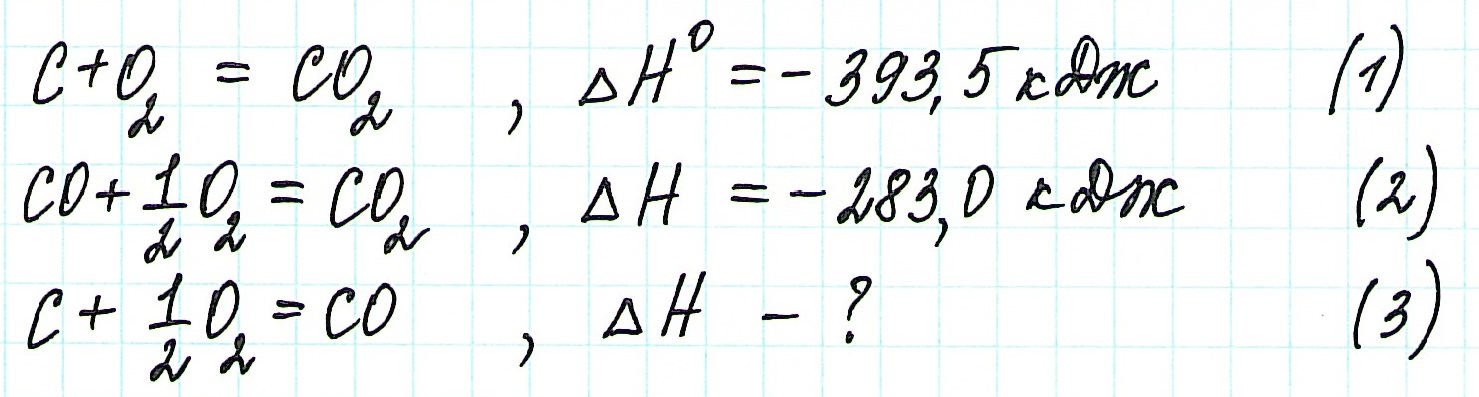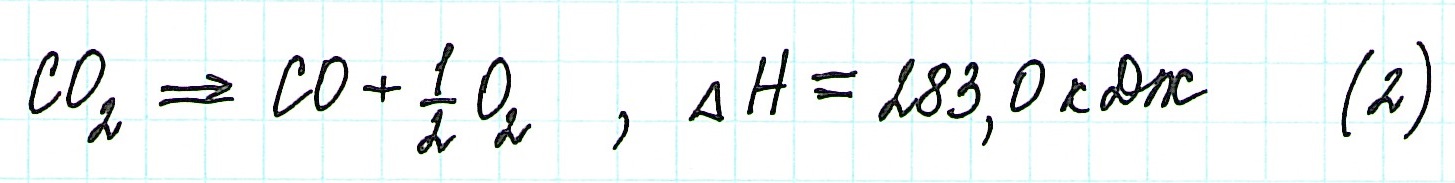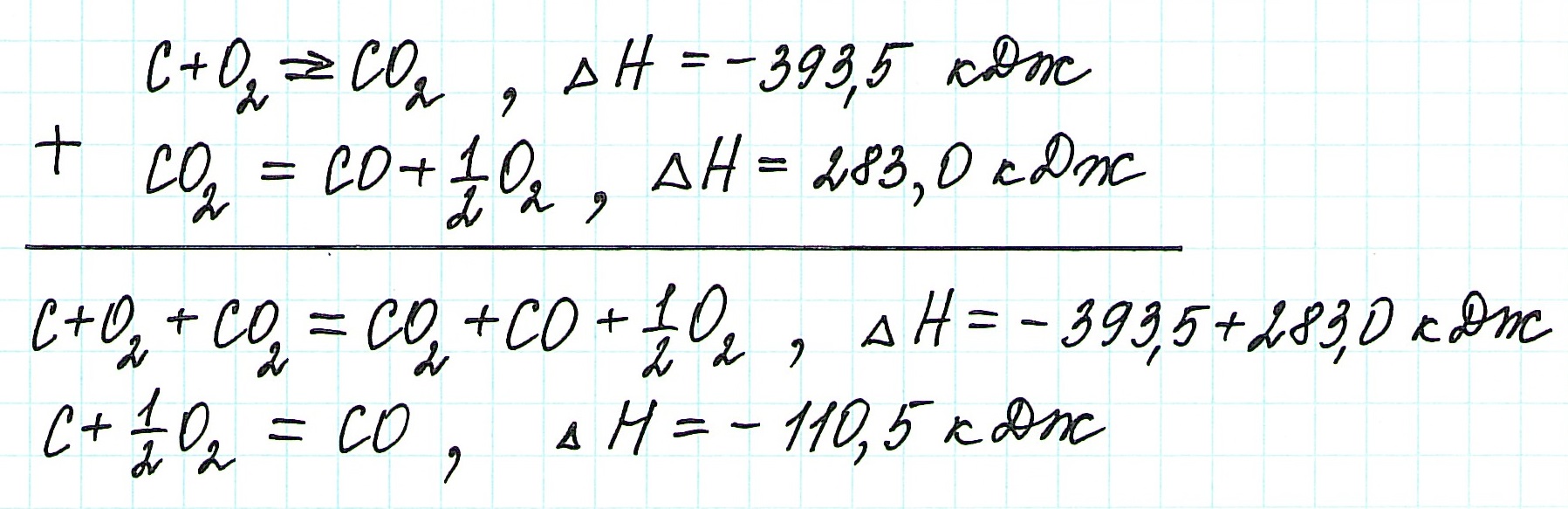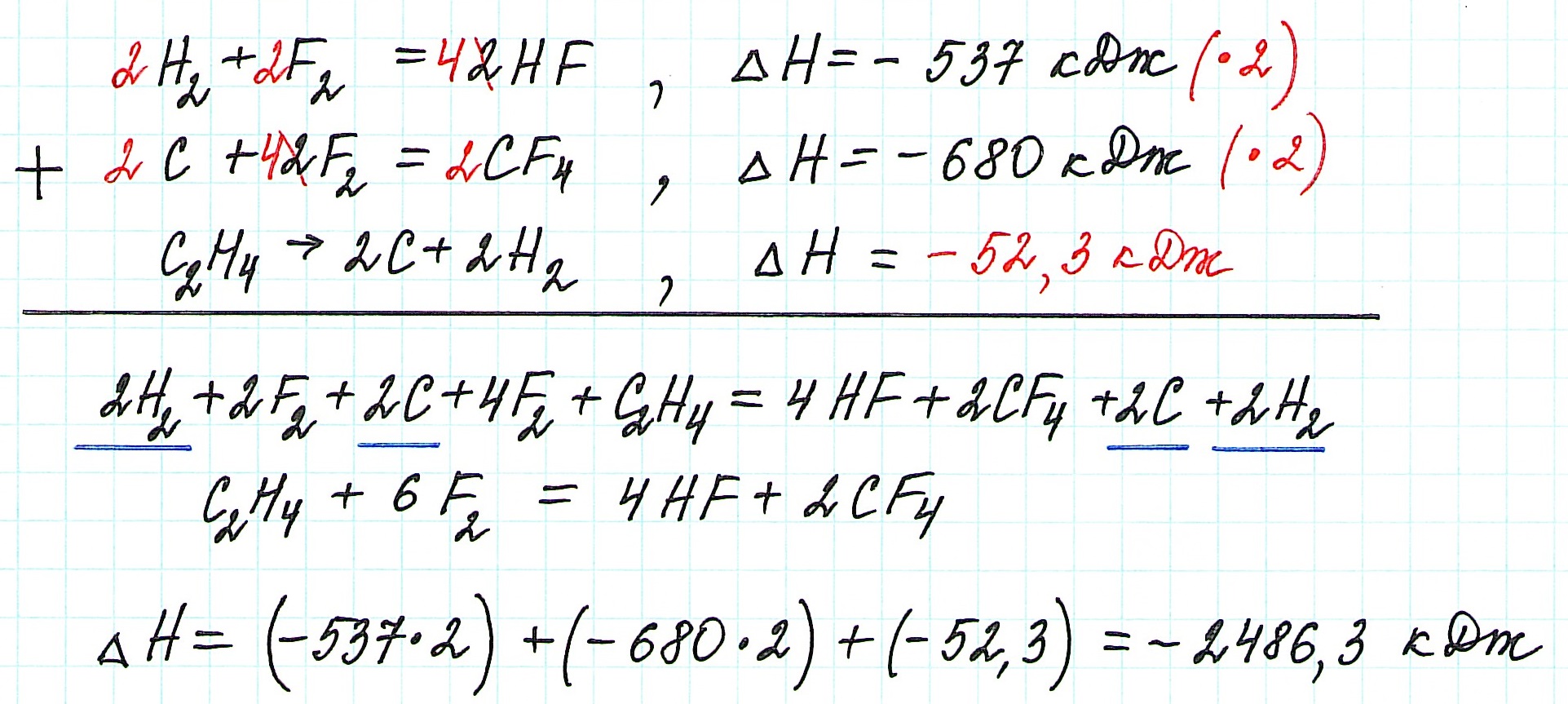Закон гесса и следствия из него кратко
Обновлено: 04.07.2024
Закон Гесса — основной закон термохимии, который формулируется следующим образом:
- Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе (при p,T = const или V,T = const), всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окисление глюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы. Иными словами, закон Гесса есть утверждение о том, что тепловой эффект реакции (Qp = ΔHp,T или QV=ΔUV,T) является функцией состояния. Тепловой эффект реакции (который определён только для изобарно-изотермического или для изохорно-изотермического процессов) нельзя путать с теплотой (Q), выделяемой или поглощаемой в ходе процесса или реакции. В общем случае теплота не является функцией состояния и не описывается законом Гесса.
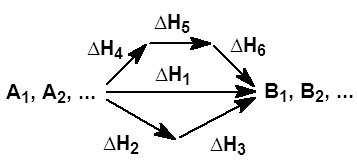
На рисунке приведено схематическое изображение некоторого обобщенного химического процесса превращения исходных веществ А1, А2… в продукты реакции В1, В2…, который может быть осуществлен различными путями в одну, две или три стадии, каждая из которых сопровождается тепловым эффектом ΔHi. Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
Закон открыт русским химиком Г. И. Гессом в 1841 году; он является частным случаем первого начала термодинамики применительно к химическим реакциям. Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты самых разнообразных химических процессов; для этого обычно используют ряд следствий из него.
Этот закон был открыт Гессом в 1840 г. на основании обобщения множества экспериментальных данных.
Формулировка закона Гесса:
Тепловой эффект реакции, протекающей при постоянном давлении (Qp = DН) или при постоянном объеме (QV = DU) и постоянной температуре, определяется только природой и состоянием исходных веществ и продуктов реакции и не зависит от пути перехода от исходных веществ к продуктам реакции (т.е. реакцию можно проводить в одну, две, три и т.д. стадии).
Закон Гесса основан на том, что Qp и QV – функции состояния (в отличие от Q).
QP = H, p = const (20)
Рассмотрим процесс перехода от исходных веществ к продуктам реакции при р = const, Т = const. Тогда Qp = DН. Составим так называемый термохимический цикл. Пусть от исходных веществ к продуктам реакции можно перейти тремя различными путями - в одну, две или три стадии:
Следствия из закона Гесса.
Первое следствие из закона Гесса .
Тепловой эффект реакции равен разности между суммой теплот образования из простых веществ (DfH) продуктов реакции и суммой теплот образования из простых веществ исходных веществ (с учетом стехиометрических коэффициентов).
Математическое выражение для первого следствия из закона Гесса можно записать в следующем виде:
Теплота образования ?fН - это тепловой эффект реакции образования 1 моль соединения из простых веществ.
Стандартное состояние характеризуется и давлением р = 1 атм = 1·10 5 Па.
Тепловые эффекты, отнесённые к этим условиям, называются стандартными тепловыми эффектами.
Стандартная энтальпия (теплота) образования соединения из простых веществ (DfH 0 298) –это есть тепловой эффект реакции образования 1 моль данного соединения из соответствующих количеств простых веществ при стандартных условиях .
Простые вещества - это химические элементы или вещества , взятые в тех агрегатных состояниях или кристаллических модификациях, в которых они устойчивы при стандартном состоянии.
Принято, что для простых веществ DfH 0 298 = 0.
Второе следствие из закона Гесса .
Тепловой эффект реакции равен разности между суммой теплот сгорания (DcH) исходных веществ и суммой теплот сгорания продуктов реакции (с учетом стехиометрических коэффициентов).
Математическое выражение для вторго следствия из закона Гесса можно записать в следующем виде:
Стандартная энтальпия (теплота) сгорания соединения (обозначаемая как DcH 0 298) – это есть тепловой эффект реакции окисления 1 моль данного сединения газообразным молекулярным кислородом при стандартном условиях с образованием соответствующих количеств следующих веществ (если не указано иначе): СО2, газ, Н2Ожидк., N2, газ,. Hhal,(Cl,Br), SO2 газ. и др.
Единицы измерения [DfН] и [DсН] равны кДж/моль, [n] = моль, [DНреакции] = кДж!
Пример 1.1 Рассчитать тепловые эффекты двух следующих реакций:
если известны стандартные теплоты образования всех компонентов данных реакций.
Решение. Выполним расчеты для 25 0 С и давления 1 атм, приняв условие постоянства давления в ходе реакций. В этом случае тепловой эффект должен быть равен изменению энтальпии системы:
Пример 1.2 Рассчитать тепловой эффект полиморфного превращения 1 моль графита в алмаз при стандартных условиях, если известны стандартные теплоты сгорания графита и алмаза при Т = 298,15 К и Р = 1атм.
Решение. Запишем реакцию полиморфного превращения графита в алмаз:
Расчет показывает, что
Следовательно, процесс превращения графита в алмаз при стандартных условиях (если бы он имел место) должен был бы происходить с поглощением небольшого количества тепла.
Связь между Qp и QV для химических реакций.
Рассмотрим реакцию, протекающую при постоянном давлении p. По определению:
Н º U + pV; тогда
Если в реакции участвуют газообразные вещества, то, считая их идеальными газами, с учетом уравнения Менделеева-Клапейрона:
можно получить выражения:
DH = DU + DnгазRT или
где Dnгаз – изменение числа молей газообразных веществ в результате одного пробега реакции,
Иногда пишут вместо Dnгаз символы Dnгаз.
Один пробег реакции означает, что в реакцию вступило такое количество молей каждого из веществ, которое соответствует их стехиометрическим коэффициентам в уравнении реакции.

Этот закон был открыт Гессом в 1840 г. на основании обобщения множества экспериментальных данных.
Формулировка закона Гесса:
Тепловой эффект реакции, протекающей при постоянном давлении (Qp = DН) или при постоянном объеме (QV = DU) и постоянной температуре, определяется только природой и состоянием исходных веществ и продуктов реакции и не зависит от пути перехода от исходных веществ к продуктам реакции (т.е. реакцию можно проводить в одну, две, три и т.д. стадии).
Закон Гесса основан на том, что Qp и QV – функции состояния (в отличие от Q).
QP = H, p = const (20)
Рассмотрим процесс перехода от исходных веществ к продуктам реакции при р = const, Т = const. Тогда Qp = DН. Составим так называемый термохимический цикл. Пусть от исходных веществ к продуктам реакции можно перейти тремя различными путями - в одну, две или три стадии:
Следствия из закона Гесса.
Первое следствие из закона Гесса .
Тепловой эффект реакции равен разности между суммой теплот образования из простых веществ (DfH) продуктов реакции и суммой теплот образования из простых веществ исходных веществ (с учетом стехиометрических коэффициентов).
Математическое выражение для первого следствия из закона Гесса можно записать в следующем виде:
Теплота образования ?fН - это тепловой эффект реакции образования 1 моль соединения из простых веществ.
Стандартное состояние характеризуется и давлением р = 1 атм = 1·10 5 Па.
Тепловые эффекты, отнесённые к этим условиям, называются стандартными тепловыми эффектами.
Стандартная энтальпия (теплота) образования соединения из простых веществ (DfH 0 298) –это есть тепловой эффект реакции образования 1 моль данного соединения из соответствующих количеств простых веществ при стандартных условиях .
Простые вещества - это химические элементы или вещества , взятые в тех агрегатных состояниях или кристаллических модификациях, в которых они устойчивы при стандартном состоянии.
Принято, что для простых веществ DfH 0 298 = 0.
Второе следствие из закона Гесса .
Тепловой эффект реакции равен разности между суммой теплот сгорания (DcH) исходных веществ и суммой теплот сгорания продуктов реакции (с учетом стехиометрических коэффициентов).
Математическое выражение для вторго следствия из закона Гесса можно записать в следующем виде:
Стандартная энтальпия (теплота) сгорания соединения (обозначаемая как DcH 0 298) – это есть тепловой эффект реакции окисления 1 моль данного сединения газообразным молекулярным кислородом при стандартном условиях с образованием соответствующих количеств следующих веществ (если не указано иначе): СО2, газ, Н2Ожидк., N2, газ,. Hhal,(Cl,Br), SO2 газ. и др.
Единицы измерения [DfН] и [DсН] равны кДж/моль, [n] = моль, [DНреакции] = кДж!
Пример 1.1 Рассчитать тепловые эффекты двух следующих реакций:
если известны стандартные теплоты образования всех компонентов данных реакций.
Решение. Выполним расчеты для 25 0 С и давления 1 атм, приняв условие постоянства давления в ходе реакций. В этом случае тепловой эффект должен быть равен изменению энтальпии системы:
Пример 1.2 Рассчитать тепловой эффект полиморфного превращения 1 моль графита в алмаз при стандартных условиях, если известны стандартные теплоты сгорания графита и алмаза при Т = 298,15 К и Р = 1атм.
Решение. Запишем реакцию полиморфного превращения графита в алмаз:
Расчет показывает, что
Следовательно, процесс превращения графита в алмаз при стандартных условиях (если бы он имел место) должен был бы происходить с поглощением небольшого количества тепла.
Связь между Qp и QV для химических реакций.
Рассмотрим реакцию, протекающую при постоянном давлении p. По определению:
Н º U + pV; тогда
Если в реакции участвуют газообразные вещества, то, считая их идеальными газами, с учетом уравнения Менделеева-Клапейрона:
можно получить выражения:
DH = DU + DnгазRT или
где Dnгаз – изменение числа молей газообразных веществ в результате одного пробега реакции,
Иногда пишут вместо Dnгаз символы Dnгаз.
Один пробег реакции означает, что в реакцию вступило такое количество молей каждого из веществ, которое соответствует их стехиометрическим коэффициентам в уравнении реакции.
Количество выделенной (или поглощенной) теплоты Q в данном процессе называют тепловым эффектом процесса. Экзотермической является реакция, протекающая с выделением теплоты, а эндотермической – с поглощением теплоты из окружающей среды.
Для лабораторных и промышленных процессов наиболее типичен изобарный режим (Р=const). Поэтому обычно рассматривают тепловой эффект при Р,Т = const, т.е. изменение энтальпии процесса ΔН.
Следует отметить, что абсолютные значения энтальпии Н определить не представляется возможным, так как не известна абсолютная величина внутренней энергии.
Для экзотермической реакции (Q > 0) ΔН 0.
Химические уравнения, в которых дополнительно указывается величина изменения энтальпии реакции, а также агрегатное состояние веществ и температура, называются термохимическими уравнениями.
В термохимических уравнениях отмечают фазовое состояние и аллотропные модификации реагентов и образующихся веществ: г – газообразное, ж – жидкое, к – кристаллическое; S(ромб), S(монокл), С(графит), С(алмаз) и т.д.
Важно подчеркнуть, что с термохимическими уравнениями можно проводить алгебраические операции сложения, вычитания, деления, умножения.
Изменение энтальпии (внутренней энергии) химической реакции зависит от вида, состояния и количества исходных веществ и продуктов реакции, но не зависит от пути процесса.
- Изменение энтальпии реакции равно сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ (суммирование проводится с учетом стехиометрических коэффициентов).
- Изменение энтальпии реакции равно сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции (суммирование проводится с учетом стехиометрических коэффициентов).
Стандартные термодинамические величины – это такие величины, которые относятся к процессам, все ингредиенты которых находятся в стандартных состояниях.
Стандартным состоянием вещества, находящегося в конденсированной фазе (кристаллической или жидкой), является реальное состояние вещества, находящегося при данной температуре и давлении 1 атм.
Следует подчеркнуть, что стандартное состояние может иметь место при любой температуре.
Обычно тепловой эффект (изменение энтальпии) реакции приводится для температуры 25 о С (298,15 К) и давления 101,325 кПа (1 атм), т.е. указывается стандартная энтальпия ΔН о 298.
Стандартная энтальпия образования ΔН о f,298 (или ΔН о обр,298) – это изменение энтальпии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества присутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Например , ΔН o f,298(Н2О(ж)) = — 285,83 кДж/моль соответствует изменению энтальпии в процессе
при Т = 298,15 К и Р = 1 атм.
Стандартная энтальпия образования простых веществ равна нулю по определению (для наиболее устойчивых их модификаций при данной температуре).
Стандартной энтальпией сгорания ΔН o сгор,298 называют энтальпию сгорания вещества (обычно 1 моль), находящегося в стандартном состоянии с образованием СО2(г), Н2О(ж) и других веществ, состав которых должен быть специально указан. Все продукты сгорания также должны находиться в стандартном состоянии.
Задача 1. Используя справочные термодинамические данные вычислить ΔН o 298 реакции:
Решение. Решим задачу, используя оба следствия из закона Гесса. Ниже для исходных веществ и продуктов реакции приведены значения энтальпий образования и сгорания в кДж/моль (энтальпия сгорания сероводорода до SO2(г) и H2O(ж)):
| Вещество | H2S(г) | O2(г) | SO2(г) | H2O(ж) |
| ΔН o f,298 | -20,60 | 0 | -296,90 | -285,83 |
| ΔН o сгор,298 | -562,10 | 0 | 0 | 0 |
Cогласно первому следствию закона Гесса энтальпия этой реакции ΔН о х.р. равна:
В соответствии со вторым следствием закона Гесса получаем:
ΔН о х.р.,298 = 2ΔН о сгор,298(H2S(г)) = 2(-562,10) = — 1124,20 кДж.
Задача 2. Вычислите ΔН о 298 реакции N2(г) + 3H2(г) = 2NH3(г), используя следующие данные:
Определите стандартную энтальпию образования NH3(г).
Решение. Поскольку с термохимическими уравнениями можно производить все алгебраические действия, то искомое уравнение получится, если:
- разделить на два тепловой эффект первого уравнения и изменить его знак на противоположный, т.е:
- умножить на 3/2 второе уравнение и соответствующую ему величину δН o , изменив ее знак на противоположный:
- сложить полученные первое и второе уравнения.
Таким образом, тепловой эффект реакции N2(г) + 3H2(г) = 2NH3(г) равен:
Δ Н о 298 = (- ΔН о 1/2) + (- 3/2·ΔН о 2) = 765,61 + (- 857,49) = — 91,88 кДж.
Поскольку в рассматриваемой реакции образуется 2 моль NH3(г), то
ΔН о f,298(NH3(г)) = — 91,88/2 = — 45,94 кДж/моль.
Задача 3. Определите энтальпию процесса
если при 298,15 К энтальпия растворения CuSO4(к) в n моль Н2О с образованием раствора CuSO4(р-р, nH2O) равна –40, а энтальпия растворения CuSO4·5H2O(к) с образованием раствора той же концентрации равна +10,5 кДж/моль.
Решение. Составляем цикл Гесса:
![]()
ΔН о 1 = ΔН о 2 + ΔН о х (по закону Гесса). Отсюда получаем:
ΔН о х = ΔН о 1 – ΔН о 2 = – 40,0 – 10,5 = -50,5 кДж.
Другой вариант решения.
По закону Гесса: ΔН о 1 = ΔН о х+ ΔН о 3, т.е. при сложении уравнений (2) и (3) получим уравнение (1).
Задача 4. Вычислите энтальпию образования химической связи С= С в молекуле этилена, если его стандартная энтальпия образования равна 52,3 кДж/моль, энтальпия возгонки графита составляет 716,7 кДж/моль, энтальпия атомизации водорода равна +436,0 кДж/моль, энтальпия образования связи С–Н равна –414,0 кДж/моль.
Решение. Составляем цикл Гесса:
ΔН о (С = С) = 52,3 — 2·716,7 — 2·436,0 + 4·414,0 = — 597,1 кДж/моль.
1. Составьте уравнение реакции, для которой ΔН о соответствует стандартной энтальпии образования ВaCl2·2H2O(к).
При изобарных и изохорных условиях теплота является функцией состояния.
Современная формулировка закона Гесса – общие приращения энтальпии при переходе начальных веществ в продукты реакции не зависят от того, через какие промежуточные стадии прошла реакция.
Закон Гесса позволяет рассчитать тепловые эффекты или приращение энтальпии только при стандартных условиях (р = 1 атм = 10 5 Па, Т = 273 К + 25 = 298 К).
Теплоты при стандартных условиях сведены в таблицу (справочник под редакцией Нищенко). Для индивидуальных веществ: С, Н2, Fe и др. – ?Н = 0.
Следствия из закона Гесса:
1) энтальпия образования 1 моля соединения из простых веществ не зависит от способа получения;
![]()
![]()
где f – формация.
Пример 1. Рассчитать тепловой эффект реакции этерификации спирта.
![]()
Пример 2. Рассчитать тепловой эффект реакции, протекающей по уравнению:
![]()
![]()
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРес
Красота — физический закон?
Красота — физический закон? Теория суперструн дает нам убедительную формулировку теории Вселенной, но не решает фундаментальную проблему: экспериментальная проверка теории при нынешнем уровне развития техники и технологии невозможна. Теория предполагает возможность
Закон всемирного тяготения
Закон инерции
Закон инерции Из принципа относительности движения вытекает, что тело, на которое не действует никакая внешняя сила, может находиться не только в состоянии покоя, но и в состоянии прямолинейного равномерного движения. Это положение в физике называется законом
7. Закон Генри
7. Закон Генри Фугитивность растворителя в разбавленном растворе не зависит от природы растворенного вещества и вычисляется по закону Рауля, то есть: Так как фугитивность жидкости или твердого раствора равна фугитивности насыщенного пара, когда растворитель в
Закон красного смещения
Закон красного смещения Эта история началась с замечательного открытия, сделанного в 1908 году Генриеттой Ливитт, которая тогда не была еще астрономом. Она смотрела не вверх, в звездное небо, а вниз — на фотопластинки, сделанные в Гарвардской обсерватории за много лет. В те
Закон Ньютона
Закон Ньютона Закон всемирного тяготения после обсуждения в третьем чтении был отправлен на доработку… Фольклор Проверка закона Ньютона. Осмысление закона Ньютона до сих пор играет очень важную роль для осмысления представлений о гравитации вообще. Как можно
Закон Мэрфи
Закон Мэрфи Дональд МИЧИ Я думаю, что самое глубокое и прочное впечатление в своей жизни каждый научный работник получает от того, как неожиданно, как несправедливо, как удручающе трудно хоть что-нибудь открыть или доказать. Многих осложнений и разочарований можно было
Закон сохранения массы
Закон сохранения массы Если растворить сахар в воде, то масса раствора будет строго равна сумме масс сахара и воды.Этот и бесчисленное количество подобных опытов показывают, что масса тела есть неизменное свойство. При любом дроблении и при растворении масса остается
Закон инерции
Закон инерции Не приходится спорить – инерциальная система отсчета удобна и обладает неоценимыми преимуществами.Но единственная ли это система или, может быть, существует много инерциальных систем? Древние греки, например, стояли на первой точке зрения. В их сочинениях
Закон Архимеда
Закон Авогадро
Закон Авогадро Пусть вещество представляет собой смесь различных молекул. Нет ли такой физической величины, характеризующей движение, которая была бы одинакова для всех этих молекул, например для водорода и кислорода, находящихся при одинаковой температуре?Механика
Закон преломления
Закон преломления В работе Dioptrique Декарт излагает свою теорию света, основанную на вихрях, и обсуждает законы отражения и преломления, впервые выразив принцип, что отношение углов падения и преломления зависит от среды, через которую проходит свет.Уже греки знали, что
Закон Рэлея
Закон Рэлея К концу 1899 г. были проведены более точные измерения в области более длинных волн, которые показали, что в этой области закон Вина уже несправедлив. В июне того же года лорд Рэлей (который был при рождении Джоном Вильямом Стрэтгом (1842-1919)) опубликовал вывод закона
Закон Планка
Закон Планка Теоретическая ситуация, как описывают, была следующей. Когда в воскресенье 7 октября 1900 г. X. Рубенс со своей женой посетил Планков, он рассказал Планку об измерениях на длинах волн до 50 мкм, которые он произвел вместе с Ф. Курлбаумом в Берлинском институте. Эти
![zakon-gessa-reshenie-zadach]()
Закон Гесса (1840 г.) представляет собой частный случай закона сохранения энергии. Он позволяет определить тепловой эффект химического взаимодействия, используя данные о состояниях веществ только в начале и в конце процесса. Для этого применяется так называемая формула закона Гесса, оформленная в виде формулировки следствия из него.
Итак, что же из себя представляет закон, о котором идет речь? Как, пользуясь им, можно проводить вычисления?
Экзотермические и эндотермические реакции
Основной категорией химического процесса, с которой закон Гесса имеет дело, является тепловой эффект – главный объект термохимии.
Тепловым эффектом Q считают теплоту, либо подающуюся в систему, либо выделяющуюся из нее в ходе химического взаимодействия.
Так, если теплота подается в систему (то есть поглощается из внешней среды), то процесс является эндотермическим. Если теплота, наоборот, уходит из системы в окружающую среду, то процесс является экзотермическим.
Каждая реакция отображается с помощью уравнения. Если в уравнении указан тепловой эффект химического процесса, то такое уравнение называется термохимическим. В нем обязательно записываются либо агрегатные состояния веществ, определяющие общее состояние системы, либо их аллотропные модификации (в случае простых веществ).
Обозначения агрегатных состояний записываются нижним индексом в скобках рядом с химической формулой вещества.
Например, для экзотермического процесса:
![zakon-gessa-formula-reshenie-zadach]()
И для эндотермического процесса:
![]()
Состояния:
— (тв.) – твердое, или (к.) – кристаллическое;
Тепловой эффект Q реакции и изменение энтальпии ΔН имеют одинаковые численные значения, а по знаку противоположны:
![zakon-gessa-formula-reshenie-zadach]()
В связи с этим приведенные выше уравнения можно записать так:
![zakon-gessa-formula-reshenie-zadach]()
Закон Гесса как основной закон термохимии и примеры расчетов с его использованием
![]()
Закон Гесса констатирует:Рассмотрим классический пример.
При экзотермическом взаимодействии углерода (графита) и кислорода образуется углекислый газ. У этого процесса есть два возможных пути: напрямую или через промежуточную стадию, идущую с образованием угарного газа (оксида углерода (II)):
![zakon-gessa-formula-reshenie-zadach]()
При прямом процессе, идущем непосредственно с образованием углекислого газа, выделяется 393,5 кДж энергии:
![zakon-gessa-formula-reshenie-zadach]()
Если процесс взаимодействия графита с кислородом идет в две стадии, то каждая из них также сопровождается выделением энергии:
![zakon-gessa-formula-reshenie-zadach]()
Просуммируем эти два уравнения:
Получаем то же, что и в первом случае (то есть при прямом взаимодействии графита с кислородом): выделяется 393,5 кДж энергии.
Таким образом, результат реакции совершенно не зависит как от пройденного пути, так и от количества промежуточных стадий. Важными оказываются состояния веществ: начальное и конечное.
Прежде, чем рассмотреть примеры расчетов, в которых используется формула закона Гесса, необходимо сделать некоторые уточнения:
1) результаты термохимических расчетов (и измерений) всегда относят к одному молю вещества, которое образуется в ходе реакции;
2) теплота образования – это количество теплоты, выделяющееся при реакции простых веществ с образованием 1 моля продукта;
3) теплоты образования простых веществ принимают за ноль;
4) если прямой процесс является экзотермическим, то обратный будет эндотермическим, и наоборот.
Пример 1.
![zakon-gessa-formula-reshenie-zadach]()
Запишем термохимические уравнения реакций, о которых идет речь:
![zakon-gessa-formula-reshenie-zadach]()
Представим уравнение (2) так, чтобы СО стал конечным продуктом реакции, а не исходным веществом. Для этого запишем уравнение в обратном виде. Теплота сгорания по знаку в таком случае станет противоположной:
![zakon-gessa-formula-reshenie-zadach]()
Для получения ответа на вопрос задачи (по закону Гесса) просуммируем уравнения (1) и (2):
![zakon-gessa-formula-reshenie-zadach]()
Таким образом, при сгорании углерода с образованием угарного газа выделяется 110,5 кДж энергии.
![zakon-gessa-formula-reshenie-zadach]()
Пример 2.
В реакции, для которой требуется вычислить теплоту:
- участвуют 1 молекула этилена и 6 молекул фтора;
- образуются 2 молекулы тетрафторуглерода и 4 молекулы фтороводорода.
— в первой из данных по условию реакций все коэффициенты и теплоту реакции умножим на 2, чтобы получить 4 молекулы фтороводорода;
— во второй реакции также все коэффициенты и теплоту реакции умножим на 2, чтобы получить 2 молекулы тетрафторуглерода;
— уравнение третьей реакции запишем в обратном виде, чтобы этилен стал исходным веществом, а не продуктом реакции;
— изменим знак теплоты третьей реакции на противоположный, так как ее уравнение записываем в обратном виде.
Просуммируем все уравнения:
![zakon-gessa-formula-reshenie-zadach]()
Таким образом, теплота реакции этилена с фтором ΔН= -2486,3 кДж.
Следствие из закона Гесса: вычисление энтальпии реакции
Чаще всего в вычислениях применяется не сам закон Гесса, а следствие из него. Оно позволяет вычислить как изменение энтальпии реакции, так и энтальпию образования любого из участников химического взаимодействия.
Следствие утверждает, что
![zakon-gessa-formula-reshenie-zadach]()
В самом общем виде расчетная формула выглядит так:
![zakon-gessa-formula-reshenie-zadach]()
А если учесть коэффициенты, то так:
![zakon-gessa-formula-reshenie-zadach]()
Для вычислений обычно применяют стандартные энтальпии образования, так как именно в стандартных состояниях вещества наиболее устойчивы:
![]()
Стандартные теплоты (энтальпии) образования являются табличными величинами.
![zakon-gessa-formula-reshenie-zadach]()
Задача 1. Используя данные таблицы стандартных термодинамических величин , вычислите изменение энтальпии для реакции:
![zakon-gessa-reshenie-zadach]()
Решение:
![]()
Задача 2.
![zakon-gessa-reshenie-zadach]()
Решение:
![]()
Задача 3. Решение:
Тепловой эффект в термодинамическом уравнении относят к 1 молю образующегося вещества. С учетом этого запишем уравнение реакции следующим образом:
![]()
![zakon-gessa-reshenie-zadach]()
Следовательно, для данной реакции термохимическое уравнение будет выглядеть так:
![]()
В дополнение ко всему сказанному отметим, что некоторые тепловые эффекты реакций, идущих при стандартном давлении, меняются с температурой. Однако эти изменения незначительны. Поэтому при выполнении термодинамических вычислений для нестандартных условий можно использовать стандартные величины теплот образования. Появится в итоге небольшая ошибка, что вполне допускается.
Таким образом, закон Гесса, а также следствие из него позволяют проводить расчеты, в основе которых лежат тепловые явления химических процессов.
Далее будут рассмотрены случаи, в которых используется формула закона Гесса для расчета таких термодинамических величин, как энтропия и энергия Гиббса.
![]()
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Читайте также: