Закон джоуля томсона кратко
Обновлено: 04.07.2024
Расширение газа при прохождении через так называемый дроссель – местное гидравлическое сопротивление (вентиль, кран, сужение трубопровода и т.п.), сопровождающееся изменением температуры носит название – дросселирование. Этот термодинамический процесс характеризуется постоянством энтальпии (Н = const).
Если во время расширения газа не совершается работа и не подводится и не отводится тепло, то этот процесс происходит при постоянной энтальпии. Однако изменение потенциальной энергии взаимодействия молекул реального газа с изменением расстояний между ними приводит к изменению кинетической энергии хаотического теплового движения молекул, т. е. к изменению температуры газа. Расширение газа без изменения количества теплоты происходит при постоянной энтальпии Н.
В частности, при движении флюидов через пористую среду из-за их адиабатического расширения и влияния дроссельного процесса возникают различного рода термические эффекты. Например, адиабатическое расширение флюидов ( жидкость, газ) сопровождающееся понижением температуры в меньшей степени оказывает влияние на температурные изменения в пласте и на забое работающей скважины ввиду большой теплоёмкости Ср горных пород, а дроссельный процесс вызывает значительные температурные изменения на забое работающей скважины.
Эффектом Джоуля - Томсона называется изменение температуры реального газа в процессе его расширения. При охлаждении газа эффект считается положительным, при нагревании его - отрицательным.
Изменение температуры при снижении давления на 0,1 МПа (1 кгс/см 2 ) называется коэффициентом Джоуля - Томсона. Этот коэффициент изменяется в широких пределах и может иметь положительный или отрицательный знак.
Различают дифференциальный и интегральный коэффициент Джоуля Томсона.
Дифференциальный эффект коэффициента Джоуля - Томсона, выражающийся через абсолютные параметры состояния газа
т. е. коэффициент Джоуля - Томсона равен частной производной от температуры по объёму при постоянной внутренней энергии.
Из уравнения (15) видно, что коэффициент Джоуля-Томсона состоит из двух слагаемых:
- охлаждение за счёт адиабатического расширения;
- нагревание вещества при движении за счёт сил трения.
Изменение температуры газа в процессе изоэнтальпийного расширения при значительном перепаде давления на дросселе называется интегральным дроссель эффектом.Это изменение определяется из соотношения следующего вида:
или из энтальпийных диаграмм.
Приближённо конечную температуру природного газа в процессе дросселирования можно рассчитать по выражению следующего вида
Для реальных газов коэффициент Джоуля Томсона получается из уравнения (14) и уравнения состояния
где - показатель адиабаты.
Как видно из уравнения (18) что если:
- положительно то 0 и газ при дросселировании нагревается;
=0 то = 0 и газ имеет инверсии и кривая точек инверсии соответствует линии поворота сетки графиков коэффициента сверхсжимаемости углеводородных газов (см. нижнюю часть линий на рис.2 , лекция 5).
Фрагмент графической зависимости приведен на рисунке 6.
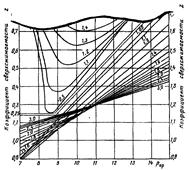
Рисунок 6 Фрагмент графической зависимости коэффициента сверхсжимаемости Z природных газов от приведенных давления и температуры.
Как видно из рисунка 6, значения температуры и давления инверсии высокие, что в большинстве случаев вызывает эффект охлаждения газа при его движении из пласта в скважину.
Следует заметить, что зависимость изменения температур от перепада давления для конкретного дроссельного процесса можно определить графическим способом из энтальпийной диаграммы (см. рис. 5).
Дифференциальные коэффициента Джоуля Томсона определяются при различных значениях давления Р как производные функции Т = f (Р) для данного значения давления и они обычно возрастают по мере падения давления.
Интегральный коэффициент Джоуля-Томсона для природного газа изменяется в пределах от 2 до 4 К/МПа в зависимости от состава газа, падения давления и начальной температуры газа. Для приближенных расчётов среднее значение коэффициента Джоуля - Томсона принимают равным 3 К/МПа. Для жидкостей справедливо следующее соотношение

и поэтому при дросселировании они нагреваются. Для наибольшего снижения температуры газа в штуцере необходимо производить удаление жидкости из газового потока до его поступления в штуцер. Интегральный коэффициент Джоуля – Томсона для нефти изменяется в пределах от 0,4 до 0,6 К/МПа а для воды он составляет 0,235 К/МПа.
Расширение газа при прохождении через так называемый дроссель – местное гидравлическое сопротивление (вентиль, кран, сужение трубопровода и т.п.), сопровождающееся изменением температуры носит название – дросселирование. Этот термодинамический процесс характеризуется постоянством энтальпии (Н = const).
Если во время расширения газа не совершается работа и не подводится и не отводится тепло, то этот процесс происходит при постоянной энтальпии. Однако изменение потенциальной энергии взаимодействия молекул реального газа с изменением расстояний между ними приводит к изменению кинетической энергии хаотического теплового движения молекул, т. е. к изменению температуры газа. Расширение газа без изменения количества теплоты происходит при постоянной энтальпии Н.
В частности, при движении флюидов через пористую среду из-за их адиабатического расширения и влияния дроссельного процесса возникают различного рода термические эффекты. Например, адиабатическое расширение флюидов ( жидкость, газ) сопровождающееся понижением температуры в меньшей степени оказывает влияние на температурные изменения в пласте и на забое работающей скважины ввиду большой теплоёмкости Ср горных пород, а дроссельный процесс вызывает значительные температурные изменения на забое работающей скважины.
Эффектом Джоуля - Томсона называется изменение температуры реального газа в процессе его расширения. При охлаждении газа эффект считается положительным, при нагревании его - отрицательным.
Изменение температуры при снижении давления на 0,1 МПа (1 кгс/см 2 ) называется коэффициентом Джоуля - Томсона. Этот коэффициент изменяется в широких пределах и может иметь положительный или отрицательный знак.
Различают дифференциальный и интегральный коэффициент Джоуля Томсона.
Дифференциальный эффект коэффициента Джоуля - Томсона, выражающийся через абсолютные параметры состояния газа
т. е. коэффициент Джоуля - Томсона равен частной производной от температуры по объёму при постоянной внутренней энергии.
Из уравнения (15) видно, что коэффициент Джоуля-Томсона состоит из двух слагаемых:
- охлаждение за счёт адиабатического расширения;
- нагревание вещества при движении за счёт сил трения.
Изменение температуры газа в процессе изоэнтальпийного расширения при значительном перепаде давления на дросселе называется интегральным дроссель эффектом.Это изменение определяется из соотношения следующего вида:
или из энтальпийных диаграмм.
Приближённо конечную температуру природного газа в процессе дросселирования можно рассчитать по выражению следующего вида
Для реальных газов коэффициент Джоуля Томсона получается из уравнения (14) и уравнения состояния
где - показатель адиабаты.
Как видно из уравнения (18) что если:
- положительно то 0 и газ при дросселировании нагревается;
=0 то = 0 и газ имеет инверсии и кривая точек инверсии соответствует линии поворота сетки графиков коэффициента сверхсжимаемости углеводородных газов (см. нижнюю часть линий на рис.2 , лекция 5).
Фрагмент графической зависимости приведен на рисунке 6.

Рисунок 6 Фрагмент графической зависимости коэффициента сверхсжимаемости Z природных газов от приведенных давления и температуры.
Как видно из рисунка 6, значения температуры и давления инверсии высокие, что в большинстве случаев вызывает эффект охлаждения газа при его движении из пласта в скважину.
Следует заметить, что зависимость изменения температур от перепада давления для конкретного дроссельного процесса можно определить графическим способом из энтальпийной диаграммы (см. рис. 5).
Дифференциальные коэффициента Джоуля Томсона определяются при различных значениях давления Р как производные функции Т = f (Р) для данного значения давления и они обычно возрастают по мере падения давления.
Интегральный коэффициент Джоуля-Томсона для природного газа изменяется в пределах от 2 до 4 К/МПа в зависимости от состава газа, падения давления и начальной температуры газа. Для приближенных расчётов среднее значение коэффициента Джоуля - Томсона принимают равным 3 К/МПа. Для жидкостей справедливо следующее соотношение
и поэтому при дросселировании они нагреваются. Для наибольшего снижения температуры газа в штуцере необходимо производить удаление жидкости из газового потока до его поступления в штуцер. Интегральный коэффициент Джоуля – Томсона для нефти изменяется в пределах от 0,4 до 0,6 К/МПа а для воды он составляет 0,235 К/МПа.
Молекулярная физика - это раздел физики, который рассматривает свойства макроскопических тел и их агрегатные состояния с точки зрения их молекулярного строения, взаимодействия и движения молекул. Она изучает явления, происходящие внутри макроскопических тел.
Основы молекулярной физики были заложены трудами Ломоносова, Джоуля, Больцмана, Клаузиуса, Максвелла и других ученых. Благодаря их трудам молекулярная физика прочно утвердилась в науке. Непосредственным опытным подтверждением молекулярно-кинетической теории являются процесс диффузии, броуновского движения, распространения запаха и многие другие явления.
Движение каждой молекулы в веществе может быть описано законами классической механики. Однако число молекул в веществе чрезвычайно велико, направления и величины скоростей молекул совершенно случайны и непрерывно изменяются так, что становится невозможным охватить уравнениями движения всю совокупность молекул и сделать какие-либо выводы об их поведении.
Тем не менее, состояние вещества и его изменение определяется заданием небольшого числа определенных параметров, как температура, давление, объем, плотность и т.д., значения которых невозможно указать на основе решений уравнений классической механики. Дело в том, что свойства огромного числа молекул подчиняется особым, статистическим закономерностям. Статистическая физика изучает статистические закономерности, описывающие поведение большой совокупности объектов. Она основывается на теории вероятностей и позволяет вычислять средние значения величин, характеризующих движение всей совокупности молекул (средние скорости молекул, средние кинетические энергии, средние значения импульса и т. д.) и на этой основе истолковывает свойства вещества, непосредственно наблюдаемые на опыте (давление, температура и т.д.). В этом состоит суть молекулярно-кинетического изучения вещества.
Наряду со статистическим, существует термодинамический метод изучения вещества. В отличие от статистического метода термодинамический метод не интересуется строением вещества. Термодинамика изучают условия превращения энергии и характеризует их с количественной стороны.
В основе термодинамики лежит небольшое число закономерностей, установленных на основе большого числа опытных фактов и получивших название начала термодинамики.
У статистической физики и термодинамики общий предмет изучения – свойства вещества и происходящие в нем процессы. Подходя к изучению этих свойств с разных точек зрения, эти методы взаимно дополняют друг друга.
Совокупность тел, могущих обмениваться энергией между собой и с внешними телами, не входящими в эту систему, называется термодинамической системой. Одним из основных понятий термодинамики является понятие состояния системы. Состояние системы определяется совокупностью значений всех величин, характеризующих физические свойства системы и называемых термодинамическими параметрами (температура, давление плотность, теплоемкость, электропроводность и т. д.). Состояние системы называется стационарным, если значения всех термодинамических параметров не изменяются во времени. Стационарное состояние называется равновесным, если его неизменность не обусловлена протеканием каких-либо процессов во внешних по отношению к данной системе телах.

Исследования показывают, что параметры состояния тел взаимно связаны и могут быть выражены друг через друга. Поэтому термодинамическое состояние задается только ограниченным числом параметров состояния. Такие параметры называются основными параметрами состояния. Важнейшими параметрами состояния химически однородных систем являются плотность, объем, давление, температура. И между этими параметрами существует связь, выражаемая в виде математического уравнения . Уравнение, связывающее основные параметры состояния, называется уравнением состояния системы.
Эффе́ктом Джо́уля — То́мсона называют изменение температуры газа или жидкости при стационарном адиабатическом дросселировании [1] — медленном протекании газа под действием постоянного перепада давлений сквозь дроссель (пористую перегородку). Назван в честь открывших его [⇨] Джеймса Джоуля и Уильяма Томсона [K 1] . Данный эффект является одним из методов получения низких температур.
С именами Джоуля и Гей-Люссака связан несколько отличающийся по постановке эксперимента эффект: расширение газа через открытый клапан из сосуда высокого давления в сосуд с низким давлением (адиабатическое расширение в вакуум). Теория этого процесса к тому же имеет много сходных черт с анализом собственно эффекта Джоуля — Томсона, поэтому часто (в том числе и в настоящей статье) оба явления обсуждаются одновременно.
Изменение температуры газа в результате медленного протекания его под действием постоянного перепада давления сквозь дроссель — местное препятствие потоку газа (капилляр, вентиль или пористую перегородку, расположенную в трубе на пути потока). Течение газа сквозь дроссель (Дросселирование) должно происходить без теплообмена газа с окружающей средой (адиабатически).
Д. — Т. э. был обнаружен и исследован английским учёными Дж. Джоулем (См. Джоуль) и У. Томсоном в 1852—62. В опытах Джоуля и Томсона измерялась температура в двух последовательных сечениях непрерывного и стационарного потока газа (до дросселя и за ним, рис. 1). Значительное трение газа в дросселе (мелкопористой пробке из ваты) делало скорость газового потока ничтожно малой, так что при дросселировании кинетическая энергия потока была очень мала и практически не менялась. Благодаря низкой теплопроводности стенок трубы и дросселя теплообмен между газом и внешней средой отсутствовал. При перепаде давления на дросселе Δp = p1 — р2, равном 1 атмосфере (1,01․10 5 н/м 2 ), измеренная разность температур ΔT = T2 — T1 для воздуха составила — 0,25°С (опыт проводился при комнатной температуре). Для углекислого газа и водорода в тех же условиях ΔТ оказалась, соответственно, равной -1,25 и +0,02°С.
Д. — Т. э. принято называть положительным, если газ в процессе дросселирования охлаждается (ΔТ 0).
Согласно молекулярно-кинетической теории строения вещества, Д. — Т. э. свидетельствует о наличии в газе сил межмолекулярного взаимодействия (обнаружение этих сил было целью опытов Джоуля и Томсона). Действительно, при взаимном притяжении молекул внутренняя энергия (U) газа включает как кинетическую энергию молекул, так и потенциальную энергию их взаимодействия. Расширение газа в условиях энергетической изоляции не меняет его внутренней энергии, но приводит к росту потенциальной энергии взаимодействия молекул (поскольку расстояния между ними увеличиваются) за счёт кинетической. В результате тепловое движение молекул замедлится, температура расширяющегося газа будет понижаться. В действительности процессы, приводящие к Д. — Т. э., сложнее, т.к. газ не изолирован энергетически от внешней среды. Он совершает внешнюю работу (последующие порции газа, справа от дросселя, теснят предыдущие), а слева от дросселя над самим газом совершают работу силы внешнего давления (поддерживающие стационарность потока). Это учитывается при составлении энергетического баланса в опытах Джоуля — Томсона. Работа продавливания через дроссель порции газа, занимающей до дросселя объём V1, равна p1V1. Эта же порция газа, занимая за дросселем объём V2, совершает работу p2V2. Проделанная над газом результирующая внешняя работа A = p1V1 — p2V2 может быть как положительная, так и отрицательная. В адиабатических условиях она может пойти только на изменение внутренней энергии газа: A = U2 — U1. Отсюда, зная уравнение состояния газа и выражение для U, можно найти ΔT.
Величина и знак Д. — Т. э. определяются соотношением между работой газа и работой сил внешнего давления, а также свойствами самого газа, в частности размером его молекул.
Для идеального газа, молекулы которого рассматриваются как материальные точки, не взаимодействующие между собой, Д. — Т. э. равен нулю.
В зависимости от условий дросселирования один и тот же газ может как нагреваться, так и охлаждаться. Температура, при которой (для данного давления) разность ΔT, проходя через нулевое значение, меняет свой знак, называется температурой инверсии Д. — Т. э. Типичная кривая зависимости температуры инверсии от давления показана на рис. 2. Кривая инверсии отделяет совокупность состояний газа, при переходе между которыми он охлаждается, от состояний, между которыми он нагревается. Значения верхних температур инверсии (Ti, max, рис. 2) для ряда газов приведены в таблице.
Д. — Т. э., характеризуемый малыми значениями ΔT при малых перепадах давления Δр, называют дифференциальным. При больших перепадах давления на дросселе температура газа может изменяться значительно. Например, при дросселировании от 200 до 1 атмосферы и начальной температуре 17°С воздух охлаждается на 35°С. Этот интегральный эффект положен в основу большинства технических процессов сжижения газов (См. Сжижение газов).
Лит.: Ландау Л. Д., Ахиезер А. И., Лифшиц Е. М., Курс общей физики. Механика и молекулярная физика, М., 1965; Ландау Л. Д., Лифшиц, Е. М., Статистическая физика, М., 1964 (Теоретическая физика, т. 5); Зоммерфельд А., Термодинамика и статистическая физика, пер. с нем., М., 1955; Леонтович М. А., Введение в термодинамику, 2 изд., М. — Л., 1952.
| Газ | СО2 | Ar | N2 | H2 | He | Воздух |
|---|---|---|---|---|---|---|
| Ti, max, K | 1500 | 723 | 621 | 202 | 50 | 603 |

Рис. 1. Схема опыта Джоуля — Томсона. В теплоизолированной трубке создаётся стационарный проток газа. После прохождения газа через дроссель его давление p, уд. объём V и температура Т изменяются.

Рис. 2. Кривая инверсии азота. В пределах кривой эффект Джоуля — Томсона положителен (ΔT 0). Для точек на самой кривой эффект равен нулю.
Читайте также:

