Закон бойля мариотта кратко
Обновлено: 02.07.2024
Первый газовый закон был открыт английским ученым Р. Бойлем в 1662 г. при исследовании упругости воздуха.
Между давлением и объемом данной массы газа при постоянной температуре существует обратная зависимость: p ~ 1 / V .
Немного позже, в 1676 году французский ученый Э. Мариотт независимо от Р. Бойля обобщенно сформулировал газовый закон, который теперь называют законом Бойля-Мариотта. По его утверждению, если при определенной температуре данная масса газа занимает объем V1 при давлении p1 , а в другом состоянии при этой же температуре его давление и объем равняются p2 и V2 , то справедливо соотношение:
Закон Бойля-Мариотта: если при постоянной температуре происходит термодинамический процесс, вследствие которого газ переходит из одного состояния ( p1 и V1 ) в другое ( p2 и V2 ), то произведение давления на объем данной массы газа при постоянной температуре является постоянным: pV = const .
\[ pV = const (при T = const) \]
где p — давление, V — объем, T — термодинамическая температура (изотермический процесс).
Закон Бойля-Мариотта устанавливает соотношение между давлением и объемом газа для изотермических процессов: при постоянной температуре объем V данной массы газа обратно пропорциональный его давлению P .
Термодинамический процесс, который происходит при постоянной температуре, называется изотермическим (от гр. isos — равный, therme — теплота). Графически на координатной плоскости pV он изображается гиперболой, которая называется изотермой . Разным температурам отвечают разные изотермы — чем выше температура, тем выше на координатной плоскости pV находится гипербола ( T2>T1 ). Очевидно, что на координатной плоскости рТ и VT изотермы изображаются прямыми, перпендикулярными оси температур.
Учеными, изучающими термодинамические системы, было установлено, что изменение одного макропараметра системы ведет к изменению остальных. Например, повышение давления внутри резинового шарика при его нагревании вызывает увеличение его объема; повышение температуры твердого тела ведет к увеличению его размеров и т. п.
Эти зависимости могут быть довольно сложными. Поэтому сначала рассмотрим существующие связи между макропараметрами на примере простейших термодинамических систем, например для разреженных газов. Экспериментально установленные для них функциональные зависимости между физическими величинами называют газовыми законами.
| Рис. 1.5. Опыт Р. Бойля |
Первый газовый закон был открыт английским ученым Р. Бойлем в 1662 г. при исследовании упругости воздуха. Он взял длинную согнутую стеклянную трубку, запаянную с одного конца, и начал наливать в нее ртуть до тех пор, пока в коротком колене не образовался небольшой закрытый объем воздуха (рис. 1.5). Затем доливал ртуть в длинное колено, изучая зависимость между объемом воздуха в запаянном конце трубки и давлением, созданным ртутью в левом колене. Предположение ученого о том, что между ними существует определенная зависимость, подтвердилось. Сравнивая полученные результаты, Бойль сформулировал следующее положение:
между давлением и объемом данной массы газа при постоянной температуре существует обратная зависимость: p ~ 1 / V.
Эдм Мариотт (1620—1684). Французский физик, изучавший свойства жидкостей и газов, столкновения упругих тел, колебания маятника, естественные оптические явления. Установил зависимость между давлением и объемом газов при постоянной температуре и объяснил на ее основании разные применения, в частности, как найти высоту местности по показаниям барометра. Доказал увеличение объема воды при ее замерзании.


Бойль запирал ртутью немного воздуха в закрытом конце изогнутой трубки (рис. 3-2, а) а затем сжимал этот воздух, понемногу добавляя ртуть в открытый конец трубки (рис. 3-2, б). Давление, испытываемое воздухом в закрытой части трубки, равно сумме атмосферного давления и давления столбика ртути высотой h (h — высота, на которую уровень ртути в открытом конце трубки превышает уровень ртути в закрытом конце). Полученные Бойлем данные измерения давления и объема приведены в табл. 3-1. Хотя Бойль не предпринимал специальных мер для поддержания постоянной температуры газа, по-видимому, в его опытах она менялась лишь незначительно. Тем не менее Бойль заметил, что тепло от пламени свечи вызывало значительные изменения свойств воздуха.
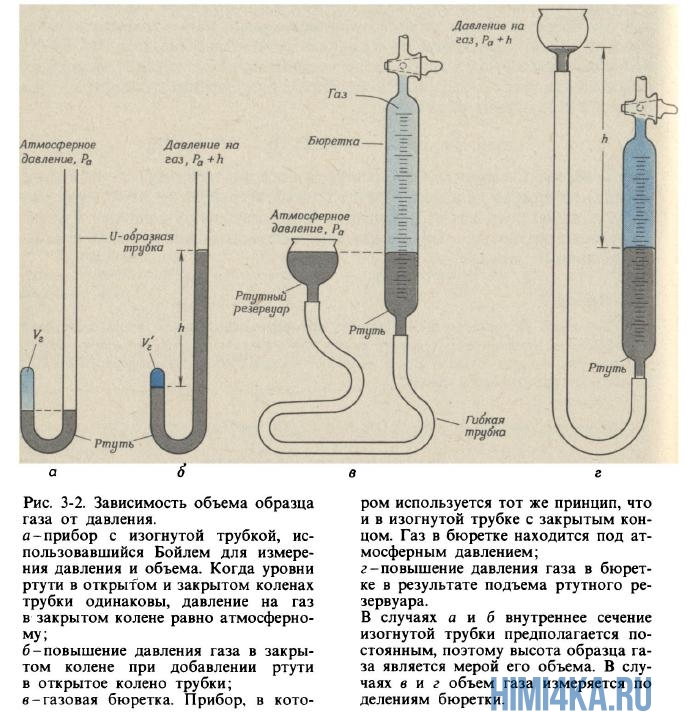
Анализ данных о давлении и объеме воздуха при его сжатии
Таблица 3-1, которая содержит экспериментальные данные Бойля о взаимосвязи давления и объема для атмосферного воздуха, расположена под спойлером.


После того как исследователь получает данные, подобные приведенным в табл. 3-1, он пытается найти математическое уравнение , связывающее между собой две зависящие друг от друга величины, которые он измерял. Один из способов получения такого уравнения заключается в графическом построении зависимости различных степеней одной величины от другой в надежде получить прямолинейный график. Общее уравнение прямой линии имеет вид:
где х и у — связанные между собой переменные, а a и b — постоянные числа. Если b равно нулю, прямая линия проходит через начало координат.
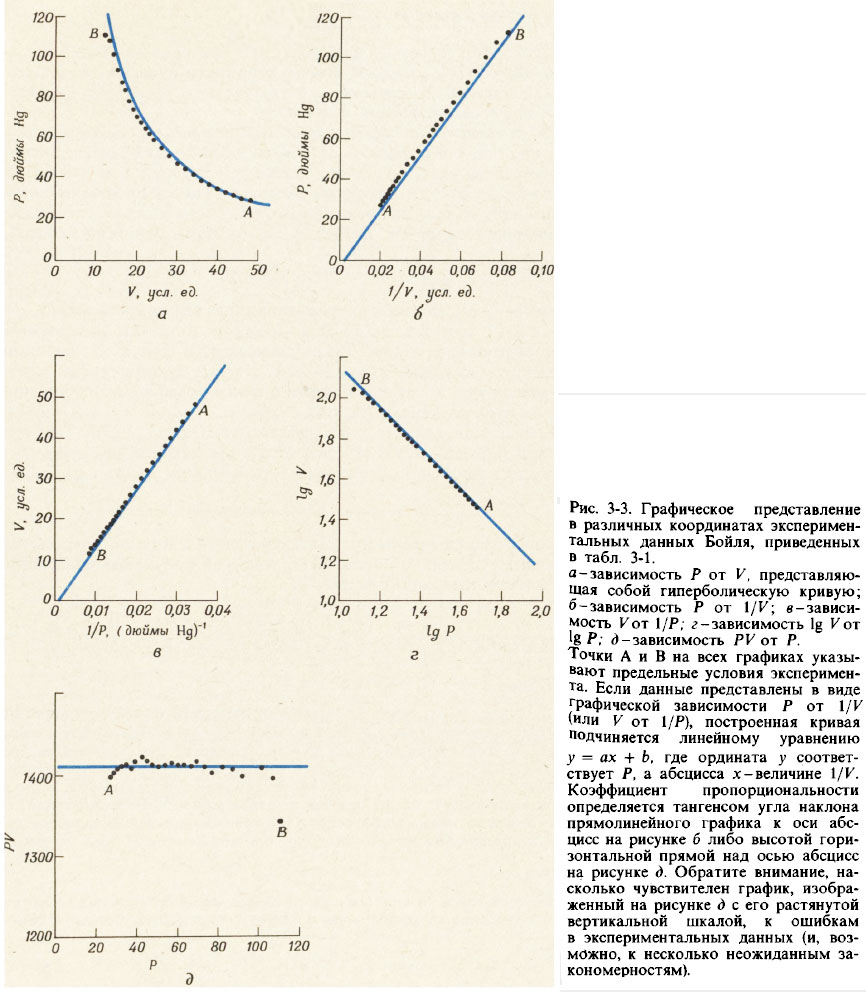
На рис. 3-3 показаны различные способы графического представления данных для давления Р и объема V, приведенных в табл. 3-1. Графики зависимости Р от 1/К и зависимости V от 1/Р представляют собой прямые линии, проходящие через начало координат. График зависимости логарифма Р от логарифма V также является прямой линией с отрицательным наклоном, тангенс угла которого равен — 1. Все эти три графика приводят к эквивалентным уравнениям:
Каждое из этих уравнений представляет собой один из вариантов закона Бойля-Мариотта, который обычно формулируется так: для заданного числа молей газа его давление пропорционально объему, при условии что температура газа остается постоянной.
Кстати, наверняка вам стало интересно, почему закон Бойля-Мариотта назван двойным именем. Это произошло так, потому что этот закон независимо от Роберта Бойля, который открыл его в 1662 году, был переоткрыт Эдмом Мариоттом в 1676 году. Вот так вот.
Когда взаимосвязь между двумя измеряемыми величинами проста до такой степени, как в данном случае, ее можно установить и численным способом. Если каждое значение давления Р умножить на соответствующее значение объема V, нетрудно убедиться, что все произведения для заданного образца газа при постоянной температуре оказываются приблизительно одинаковыми (см. табл. 3-1). Таким образом, можно записать, что
Уравнение (З-Зг) описывает гиперболическую зависимость между величинами Р и V (см. рис. 3-3,а). Для проверки того, что построенный по экспериментальным данным график зависимости Р от V действительно соответствует гиперболе, построим еще дополнительный график зависимости произведения P·V от Р и убедимся, что он представляет собой горизонтальную прямую линию (см. рис. 3-3,д).
Бойль установил, что для заданного количества любого газа при постоянной температуре взаимосвязь между давлением Р и объемом V вполне удовлетворительно описывается соотношением
Формула из закона Бойля-Мариотта
Для сопоставления объемов и давлений одного и того же образца газа при различных условиях (но постоянной температуре) удобно представить закон Бойля-Мариотта в следующей формуле:
где индексы 1 и 2 соответствуют двум различным условиям.
Пример 4. Доставляемые на плато Колорадо пластмассовые мешочки с пищевыми продуктами (см. пример 3) часто лопаются, потому что воздух, находящийся в них, при подъеме от уровня моря на высоту 2500 м, в условиях пониженного атмосферного давления, расширяется. Если предположить, что внутри мешочка при атмосферном давлении, соответствующем уровню моря, заключено 100 см 3 воздуха, какой объем должен занимать этот воздух при той же температуре на плато Колорадо? (Допустим, что для доставки продуктов используются сморщенные мешочки, не ограничивающие расширение воздуха; недостающие данные следует взять из примера 3.)
Решение
Воспользуемся законом Бойля в форме уравнения (3-5), где индекс 1 будем относить к условиям на уровне моря, а индекс 2 — к условиям на высоте 2500 м над уровнем моря. Тогда Р1 = 1,000 атм, V1 = 100 см 3 , Р2 = 0,750 атм, а V2 следует вычислить. Итак,
Закон Бойл это то, что выражает связь между давлением, оказываемым газом или на него, и объемом, занимаемым им; поддерживая постоянную температуру газа, а также его количество (количество молей).
Этот закон вместе с законом Шарля, Гей-Люссака, Шарля и Авогадро описывает поведение идеального газа; в частности, в закрытом контейнере, подверженном изменениям объема под действием механической силы.
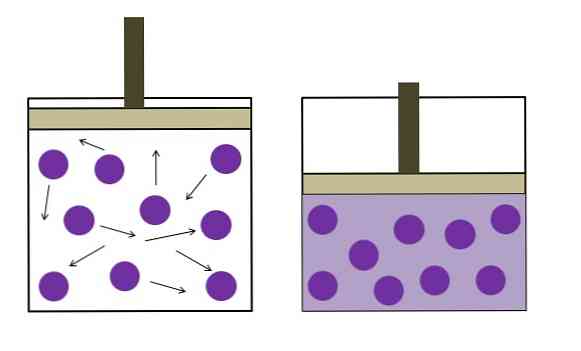
Изображение выше кратко суммирует закон Бойля-Мариотта.
Фиолетовые точки представляют молекулы или атомы газа, которые сталкиваются с внутренними стенками контейнера (слева). При уменьшении доступного пространства или объема контейнера, занимаемого этим газом, увеличивается количество столкновений, что приводит к увеличению давления (справа).
Это показывает, что давление P и объем V газа обратно пропорциональны, если контейнер герметично закрыт; в противном случае более высокое давление будет равно большему расширению контейнера..
Если построить график V относительно P, с данными V и P по осям Y и X, соответственно, будет наблюдаться асимптотическая кривая. Чем меньше V, тем больше увеличение P; то есть кривая будет расширяться до высоких значений P на оси X.
Конечно, температура остается постоянной; но если бы один и тот же эксперимент был проведен при разных температурах, относительные положения этих кривых V против P изменились бы на декартовой оси. Изменение было бы еще более очевидным, если бы оно было нанесено на трехмерную ось с постоянной Т на оси Z.
- 1 История закона Бойля
- 1.1 История вопроса
- 1.2 Эксперимент с ртутью
- 1.3 Эдм Мариотт
- 1.4 Усиление закона
- 4.1 Паровые машины
- 4.2 Sip напитки
- 4.3 Дыхательная система
- 5.1 Эксперимент 1
- 5.2 Эксперимент 2
История закона Бойля
фон
Поскольку ученый Галилео Галилей выразил уверенность в существовании пустоты (1638), ученые начали изучать свойства воздуха и частичных пустот.
Англо-ирландский химик Роберт Бойль начал свое исследование свойств воздуха в 1638 году, узнав, что немецкий инженер и физик Отто фон Герике построил воздушный насос.
Эксперимент с ртутью
С самого начала Бойль хотел изучить эластичность воздуха, качественно и количественно. Залив ртуть через открытый конец J-образной трубки, Бойл пришел к выводу, что воздух в коротком плече трубки сжался под давлением ртути..
результаты
Чем больше количество ртути, добавленной в трубку, тем больше давление на воздух и тем меньше его объем. Бойл получил отрицательный график экспоненциального типа объема воздуха в зависимости от давления.
Хотя, если вы нанесете объем воздуха против обратной величины давления, у вас будет прямая линия с положительным наклоном.
В 1662 году Бойль опубликовал первый физический закон, который был дан в форме уравнения, которое указывало на функциональную зависимость двух переменных. В этом случае давление и объем.
Бойл отметил, что существует обратная зависимость между давлением, оказываемым на газ, и объемом, занимаемым этим газом, причем это соотношение относительно справедливо для реальных газов. Большинство газов ведут себя как идеальные газы при умеренном давлении и температуре.
С более высокими давлениями и более низкими температурами отклонения от поведения реальных газов идеалов стали более заметными.
Эдм Мариотт
Французский физик Эдме Мариотт (1620-1684) независимо открыл тот же закон в 1679 году. Но он был достоин показать, что объем меняется в зависимости от температуры. Вот почему это называется Закон Мариотта или Закон Бойля и Мариотта.
Усиление закона
Даниэль Бернулли (1737) усилил закон Бойля, указав, что давление газа создается воздействием частиц газа на стенки контейнера, в котором он находится..
В 1845 году Джон Уотерстон опубликовал научную статью, в которой он сосредоточил внимание на основных принципах кинетической теории газов..
Позднее Рудольф Клаузиус, Джеймс Максвелл и Людвиг Больцман консолидировали кинетическую теорию газов, которая связывает давление, оказываемое газом, со скоростью частиц газа в движении.
Чем меньше объем контейнера, содержащего газ, тем больше частота ударов частиц, которые его образуют, к стенкам контейнера; и, следовательно, чем больше давление, оказываемое газом.
Из чего состоит этот закон??
Эксперименты, проведенные Бойлем, указывают на наличие обратной зависимости между объемом, занимаемым газом, и давлением, оказываемым на него. Тем не менее, вышеупомянутое соотношение не является полностью линейным, как показано графиком изменения объема в соответствии с давлением, приписанным Бойля.
В законе Бойля указывается, что объем, занимаемый газом, обратно пропорционален давлению. Также указано, что произведение давления газа на его объем является постоянным.
Математическое выражение
Чтобы добраться до математического выражения закона Бойля-Мариотта, начнем с:
Где это указывает, что объем, занимаемый газом, обратно пропорционален его давлению. Тем не менее, существует константа, которая определяет, насколько обратно пропорциональны эти отношения.
Где k - постоянная пропорциональности. Очистка у вас есть:
Произведение давления газа на его объем является постоянным. то:
И из этого можно сделать вывод, что:
Последнее является окончательным выражением или уравнением для закона Бойля.
Для чего это? Какие проблемы решает закон Бойля??
Паровые машины
![]()
Закон Бойля-Мариотта распространяется на эксплуатацию паровых двигателей. Это двигатель внешнего сгорания, который использует преобразование тепловой энергии из количества воды в механическую энергию..
Вода нагревается в герметически закрытом котле, и произведенный пар оказывает давление в соответствии с законом Бойля-Мариотта, который вызывает увеличение объема цилиндра при нажатии поршня..
Линейное движение поршня преобразуется во вращательное движение за счет использования системы кривошипов и кривошипов, которые могут приводить в движение колеса локомотива или ротор электрического генератора..
В настоящее время альтернативный паровой двигатель является малоиспользуемым двигателем, поскольку он был заменен электродвигателем и двигателем внутреннего сгорания в транспортных средствах..
Потягивая напитки
Всасывание безалкогольного напитка или сока из бутылки через пластиковую трубку связано с законом Бойля-Мариотта. Когда воздух всасывается из трубки с помощью рта, происходит снижение давления внутри трубки.
Этот перепад давления облегчает движение жидкости вверх в трубке, что позволяет ей проглатываться. Этот же принцип работает при извлечении крови с помощью шприца.
Дыхательная система
![]()
Закон Бойля-Мариотта тесно связан с функционированием дыхательной системы. Во время фазы вдоха происходит сокращение диафрагмы и других мышц; например, внешние межреберные, которые производят расширение грудной клетки.
Это вызывает снижение внутриплеврального давления, которое вызывает расширение легких, что приводит к увеличению объема легких. Поэтому внутрилегочное давление снижается в соответствии с тем, что указано в законе Бойля-Мариотта..
Когда внутрилегочное давление ниже атмосферного, атмосферный воздух поступает в легкие, что приводит к повышению давления в легких; выравнивание его давления с атмосферным давлением и завершение фазы вдоха.
Впоследствии мышцы вдоха расслабляются, а мышцы выдоха сокращаются. Кроме того, происходит легкая эластическая ретракция, явление, которое вызывает уменьшение объема легких с последующим повышением внутрилегочного давления, что может быть объяснено законом Бойля-Мариотта..
Увеличивая внутрилегочное давление и становясь больше атмосферного давления, воздух поступает из легких внутрь атмосферы. Это происходит до тех пор, пока давление не выровняется, что завершает фазу истечения.
Примеры (эксперименты)
Эксперимент 1
Небольшой баллончик плотно закрывается, образуя узел во рту, внутри шприца, в который был извлечен поршень, приблизительно 20 мл. Плунжер шприца расположен по направлению к средней части шприца, игла извлечена, а вход воздуха закрыт..
наблюдение
Медленно потянув за поршень инжектора, можно увидеть, что баллон надут.
объяснение
На стенку баллона оказывают два давления: давление на ее внутреннюю поверхность, продукт воздуха, содержащегося внутри баллона, и другое давление на внешнюю поверхность баллона, создаваемое воздухом, содержащимся в шприце..
При вытягивании поршня инжектора внутри него создается полувакуум. Следовательно, давление воздуха на внешней поверхности стенки насоса уменьшается, что делает давление внутри насоса относительно большим..
Это чистое давление, согласно закону Бойля-Мариотта, приведет к растяжению стенки баллона и увеличению объема баллона..
Эксперимент 2
Разрежьте пластиковую бутылку примерно пополам, следя за тем, чтобы разрез был как можно более горизонтальным. В устье бутылки помещен хорошо приспособленный баллон, в то же время в глубокую посуду помещается определенное количество воды..
наблюдение
Поместив дно бутылки с баллоном на воду посуды, баллон умеренно надувается.
объяснение
Вода вытесняет определенное количество воздуха, увеличивая давление воздуха на стенку бутылки и внутреннюю часть баллона. Это вызывает, согласно закону Бойля-Мариотта, увеличение объема земного шара, что визуализируется инфляцией земного шара..
Читайте также: