Термодинамическая характеристика поверхности кратко
Обновлено: 30.06.2024
Наиболее характерные свойства дисперсных систем связаны с особым состоянием веществ в поверхностных слоях. Поэтому в основе курса коллоидной химии лежит изучение свойств и структуры поверхностных слоев. Рассматривая свойства поверхностей раздела фаз мы на некоторое время отвлечемся от свойства дисперсности коллоидных систем и рассмотрим общие закономерности для поверхностей независимо от их протяженности, не забывая при этом, что рассматриваемые общие закономерности играют наибольшую роль именно для дисперсных систем.
5.1. Общая характеристика поверхностного слоя и его энергия. Два метода описания поверхностного слоя
Рассмотрим двухфазную систему жидкость – газ. Молекулы в объеме жидкости по энергетическому состоянию отличаются от молекул на поверхности, т.к. взаимодействия молекул жидкости с молекулами газа меньше, чем молекул жидкости между собой.
Равнодействующая сил межмолекулярного взаимодействия в случае молекулы в объеме жидкости равна нулю, а в случае молекулы на поверхности – направлена перпендикулярно к поверхности в сторону жидкой фазы. Она называется внутренним давлением. Внутреннее давление тем больше, чем больше полярность жидкости. РН2О=14000 атм., а РС6Н6=3800 атм. Это большие величины, поэтому жидкости мало сжимаются под действием внешних давлений. Под действием внутреннего давления молекулы стремятся уйти с поверхности вглубь жидкости, уменьшив тем самым поверхность до минимальной при данных условиях. Поэтому поверхность жидкости находится как бы в состоянии натяжения. Для увеличения поверхности жидкости необходимо произвести работу против межмолекулярных сил, обусловливающих внутреннее давление:
dW = σ ´ ds ,
где W –работа, затрачиваемая на увеличение поверхности;
s –поверхность;
σ -коэф-т пропорциональности.
σ = dW / dS, (5.1)
Если поверхность однородна, что характерно для индивидуальных веществ, то уравнение (5.1) в интегральной форме запишется
σ = DW / Ds, Дж/м 2 или Эрг/см 2 (5.2)
В этом случае σ -это работа образования единицы поверхности.
Коэффициент σможет быть выражен и в единицах измерения силы, отнесенной к единице длины:
Дж/м 2 = Н ´ м/м 2 = Н / мили
Эрг/см 2 = дин ´ см / см 2 = дин / см
В силовом выражении параметр σ называют поверхностным натяжением.
Поверхностное натяжение –этосила, действующая на единицу длины границы раздела и обусловливающая сокращение поверхности. Оно направлено тангенциально к поверхности жидкости и измеряется в н/м.
Другими словами, это стягивающая сила, отнесенная к единице длины контура и направленная тангенциально к поверхности. Наличие поверхностного натяжения легко доказывается таким опытом. Берут рамку из проволоки с подвижной планкой, опускают в мыльный раствор. Образовавшаяся пленка, стягиваясь, передвигает планку. Чтобы растянуть пленку, необходимо некоторое усилие.
Т.к. увеличение поверхности требует определенных энергетических затрат (работы против межмолекулярных сил), то это несамопроизвольный процесс, он характеризуется увеличением свободной поверхностной энергии DG.
При обратимом изотермическом процессе работа, необходимая для увеличения площади поверхности, равна увеличению свободной поверхностной энергии
DG = σ ´ Ds
То же самое происходит при дроблении твердых материалов. Увеличивается поверхность и свободная поверхностная энергия. Это характерно для систем любых типов.
С ростом t о , σ снижается в результате ослабления межмолекулярных сил. Поскольку σ есть результат нескомпенсированности межмолекулярных сил, то σ полярных жидкостей больше чем неполярных.
Т.к. состояние молекул в объеме фаз и на поверхности раздела различно, то и многие свойства в поверхностном слое отличны от свойств объема фазы. То есть на поверхности раздела имеется поверхностный слой толщиной в несколько молекул, внутри которого происходит резкое изменение многих свойств фазы.
A a A¢
S d S¢
B B¢
b
Рис. 5.1. Межфазный слой
Допустим, соприкасаются 2 фазы a и b.
АА¢ и ВВ¢ - границы, за которыми сохраняются все свойства фазы.
d - толщина слоя.
Метод описания термодинамики поверхностного слоя, основанный на представлении о слое толщиной d, называется методом слоя конечной толщины. На практике толщину поверхностного слоя определить очень трудно. Поэтому трудно определить значения параметров системы в поверхностном слое. Кроме того, оказывается, что для одного параметра (h) это одно d, для другого параметра (r) это другое d. Поэтому определение термодинамических параметров слоя невозможно с большой точностью.
Рассмотрим для примера как в методе Гиббса состав поверхностного слоя ni s определяется избыточным числом молей компонентов ni S .
Обозначим концентрации i-го компонента в фазах a и b соответственно Ci a и Ci b . Изменение концентрации i-го компонента вдоль нормали, направленной из фазы a в фазу b изобразится кривой Ci (х), где х меняется от xa до xb.
Учитывая, что dn = CdV, a dV = sdx, выразим состав поверхностного слоя.
x a
ni s = s ò Ci´dx – s [ Ci b (x S - x b ) + Ci a (х a -x S )] , (5.3)
В дисперсных системах большая часть всех молекул или атомов, составляющих вещество, находится на поверхности раздела фаз. Эти поверхностные молекулы отличаются от молекул, находящихся внутри фазы по своему энергетическому состоянию, что приводит к возникновению избыточной поверхностной энергии. Избыточная поверхностная энергия равна произведению поверхностного натяжения на площадь межфазной поверхности.
Любая термодинамическая система стремиться уменьшить свою поверхностную энергию. Избыточная поверхностная энергия может уменьшиться за счет:
· уменьшения поверхностного натяжения: адсорбция, адгезия, смачивание, образование двойного электрического слоя;
· уменьшения площади поверхности: сферическая форма капель (сглаживание поверхности), объединение частиц (коагуляция, агрегация, коалесценция).
Поверхностное натяжение
Физический смысл поверхностного натяжения
Изобразим границу раздела жидкости с ее собственным паром (рис.9.1). На молекулу, находящуюся внутри жидкости, действуют силы взаимного притяжения (силы молекулярного сцепления) со стороны всех окружающих ее соседних молекул. Равнодействующая этих сил
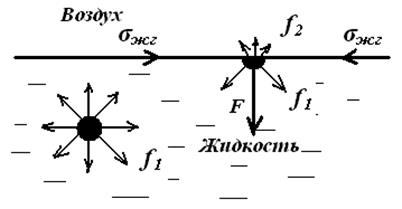
Рис.9.1. Межмолекулярное взаимодействие внутри жидкости и
на поверхности раздела фаз.
равна нулю вследствие симметрии силового поля, и для перемещения молекулы внутри жидкости не требуется затрачивать работу. Это вызвано тем, что в газообразной фазе молекулы удалены друг от друга на большие расстояния, и действующие между ними силы Молекулы, находящиеся на границе раздела фаз, испытывают действие межмолекулярных сил в большей степени со стороны жидкой фазы f1, чем со стороны газообразной f2 (f1 >> f2). Результирующая сила Р, пропорциональной разности сил (f1 - f2), направлена внутрь жидкости. Эта сила, отнесенная к единице поверхности (1 м 2 или 1 см 2 ), называется внутренним (молекулярным) давлениемpM.
Молекулярное давление определяется силой сцепления молекул, оно тем выше, чем полярнее вещество. Таким образом, на поверхности любой жидкости существует огромное давление, стремящееся затянуть все молекулы с поверхности внутрь жидкой фазы. Этим объясняется шарообразная форма капель жидкости.
Мы уже сказали, что молекулярные силы стремятся втянуть молекулы поверхностного слоя внутрь фазы. Поэтому, для образования новой поверхности необходимо затратить некоторую работу против сил молекулярного притяжения.
Поверхностное натяжение ( ) – работа обратимого изотермического процесса, затраченная на образование единицы площади поверхности раздела фаз (энергетическое определение поверхностного натяжения):
Знак минус говорит о том, что положительная работа совершается при уменьшении или сокращении поверхности.
Силовое определение: поверхностное натяжение– сила, направленная тангенциально (параллельно) к поверхности и приходящаяся на единицу длины периметра, ограничивающего эту поверхность.
Физическая сущность – поверхностные молекулы стремятся уйти вглубь конденсированной фазы, тем самым, сжимая поверхность.
Оба эти определения необходимо рассматривать в единстве. Такое единство энергетического и силового подходов сложилось исторически. Величина поверхностного натяжения была введена в физику задолго до появления понятия энергии и рассматривалась как сила, стягивающая гипотетическую пленку на поверхности жидкости и противодействующая ее растяжению. Силовое определение более справедливо для жидкостей, так как у них одновременно с образованием поверхности молекулы и атомы на ней ориентируются, уплотняются, переходя в равновесное состояние и вызывая тем самым тангенциальное натяжение поверхности.
Термодинамическое определение поверхностного
Натяжения
При p и Т=const запишем объединенное уравнение первого и второго начал термодинамики для гетерогенной системы относительно изменения энергии Гиббса:
где Т – температура; S / – энтропия, р – давление, V – объем, S – площадь поверхности, – поверхностное натяжение, – химический потенциал i-того компонента, ni – число моль i-того компонента, – электрический потенциал, q – количество электричества.
При постоянных Т, р, ni и q имеем:
Поверхностное натяжение есть частная производная от энергии Гиббса по площади поверхности раздела фаз при постоянных: давлении, температуре, числе моль компонентов и заряде.
Так как объединенное уравнение первого и второго начал термодинамики может быть записано и относительно других термодинамических потенциалов, а именно внутренней энергии U, энергии Гельмгольца (А), и энтальпии (H), то при соответствующих постоянных параметрах получим:

Поверхностное натяжение– частная производная от любого термодинамического потенциала по площади межфазной поверхности при постоянных соответствующих параметрах.

Данное издание создано в помощь студентам вузов, которые хотят быстро подготовиться к экзаменам и сдать сессию без проблем. Пособие составлено с учетом Государственного образовательного стандарта.
Оглавление
- 1. Возникновение и основные этапы развития коллоидной химии. Предмет и объекты исследований коллоидной химии
- 2. Основные особенности дисперсных систем. Особенности ультрамикрогетерогенного состояния (наносостояния)
- 3. Различные типы классификации дисперсных систем. Лиофильные и лиофобные дисперсные системы
- 4. Дисперсность. Удельная поверхность дисперсных систем, методы ее измерения
- 5. Коллоиды. Примеры коллоидных систем, их распространенность в природе и значение для современной технологии
- 6. Оптические методы исследования дисперсных систем (нефелометрия, турбидиметрия)
- 7. Оптические свойства коллоидов. Статическое рассеяние света. Оптическая анизотропия
- 8. Поглощение света дисперсными системами, уравнение Бугера-Ламберта-Бера. Определение размеров коллоидных частиц
- 9. Поверхностные явления. Роль поверхностных явлений в процессах, протекающих в дисперсных системах
- 10. Поверхность раздела фаз. Свободная поверхностная энергия. Поверхностное натяжение. Адсорбция
- 11. Термодинамическое описание разделяющей поверхности
- 12. Адсорбция. Площадь, приходящаяся на одну молекулу в адсорбционном слое
- 13. Хроматографический адсорбционный анализ
Приведённый ознакомительный фрагмент книги Коллоидная химия. Шпаргалка предоставлен нашим книжным партнёром — компанией ЛитРес.
11. Термодинамическое описание разделяющей поверхности
Разделяющая поверхность — это геометрическая поверхность, которая воспроизводит форму поверхности разрыва и располагается параллельно последней. Если представить идеализированную систему в которой каждая из интенсивных величин имеет характерные для данной объемной фазы значения, и сравнить ее с реальной системой, то получим, что разности соответствующих экстенсивных параметров в данных системах представляют собой поверхностные избытки. Например, состав поверхностного слоя определяется избыточным числом молей компонентов ni s .
Для нахождения последнего необходимо рассмотреть изменение концентрации компонента системы вдоль нормали, направленной из одной фазы в другую. В реальных системах данное изменение выражается функцией С (x), которая представляет собой кривую и имеет постоянные величины в глубине фаз. В идеализированной системе данная функция представлена двумя прямыми, доходящими до разделяющей поверхности. Состав поверхностного слоя будет выражен формулой:

где ni s — избыток количества вещества в поверхностном слое; xb и xa — объемы разделяемых фаз;
C b и C a — концентрация вещества в реальной и идеализированной системах; s — площадь поверхности раздела.
U s = U — (U α + U β )
U = U s + U α + U β .
Члены правой части этих выражений различаются тем, что U α и U β являются полными количествами энергии в двух объемных фазах, а U s представляет собой поверхностный избыток.
Аналогичные выражения записывают для других термодинамических функций: энтальпии, энтропии свободных энергий Гельмгольца и Гиббса.
Достоинством данного метода описания поверхностного слоя является отсутствие необходимости уточнения его границ. Функции, выражающие избытки, являются инвариантными в отношении толщины поверхностного слоя, однако они зависят от положения разделяющей поверхности.
Поверхностный слой может подвергаться воздействию изменений температуры и состава. Поэтому необходимо принять во внимание в качестве переменных поверхностные энтропию S s и состав n s , в результате будет получено фундаментальное уравнение для энергии разделяющей поверхности:
dU s = T s dS s + σds + Σμ s dn s ,
где dU s — внутренняя энергия поверхностного слоя T s — температура разделяющей поверхности;
S s — энтропия поверхностного слоя; s — коэффициент пропорциональности, численно равный поверхностному натяжению; s — площадь поверхностного слоя; m s — химический потенциал поверхностного слоя; n s — состав поверхностного слоя.
Данное уравнение находят путем вычитания уравнений для двух объемных фаз из выражения для внутренней энергии U всей системы. Согласно теории Гиббса для плоского поверхностного слоя последнее уравнение справедливо при любом положении разделяющей поверхности; для искривленной поверхности к нему добавляются члены, связанные с кривизной.
Атомы на поверхности раздела твердого тела или жидкости обладают окружением, отличным от окружения в объеме. Читатель, наверно, уже обратил внимание, что в главе 3 приводилось это утверждение, однако здесь речь пойдет о характеристике и свойствах поверхности и межфазных границ на языке термодинамических параметров. Появление поверхности или поверхностей раздела ведет к увеличению энергии системы. Ранее был введен важнейший параметр — химический потенциал, который характеризует химические превращения вещества, в том числе на поверхности. В этом пункте вводится другой параметр, специфичный для поверхности, — поверхностное натяжение. Здесь опять целесообразно начать рассмотрение с аналогии силы в механике.
Можно рассмотреть схему на рис. 11.1, на которой изображена петля из материала, включающего жидкость.

Для увеличения поверхности вдоль координаты xна расстояние dx необходимо приложить силу f, предполагая, что жидкость ведет себя как упругая пленка. Совершенная работа fdx равна приращению поверхностной энергии γdA =γ l dx, где l — размер поверхности раздела, перпендикулярный направлению действия силы. Тогда величина f / l = γ представляет собой силу, приходящуюся на единицу длины и называется поверхностным натяжением.
Таким образом, поверхностное натяжение определяется как обратимая работа, необходимая для увеличения поверхности жидкости на единичную площадь
Для термодинамической трактовки рассматривается двухкомпонентная система, в соответствии с первым и вторым началом термодинамики, изменение внутренней энергий и свободной энергии Гиббса записывается в виде
dE = TdS – pdV + γ dA + ∑ μi dni (11.25)
dG = -S dT +Vdp + γ dA + ∑ μi dni (11.26)
Тогда поверхностное натяжение определяется как
где индексы относятся к параметрам, которые должны оставаться постоянными при увеличении поверхности на единичную величину.
Это уравнение может применятся и для системы, включающей твердую фазу.
Поверхностное натяжение γ для твердых тел определяется как обратимая работа по созданию новой поверхности путем добавления других атомов на поверхности. Это работа необходима, чтобы деформировать поверхность твердого тела и представляет собой меру искажений поверхности, которая может быть как за счет сжатия, так и растяжения твердого тела. Для жидкости поверхностное растяжение и сжатие равны, а для твердого тела — могут отличатся.
Читателю, вероятно, известно, что наиболее наглядно действие поверхностного натяжения проявляется в образовании сферических капель воды, мыльных пузырей и т.д., что связано с минимизацией площади поверхности и поверхностной энергии.
Образование поверхности сопровождается увеличением свободной энергии. Для постоянных р, Т и ni,
Для кристаллов γ = f(θ) зависит от кристаллических направлений. Аналогичное рассмотрение применимо для поверхностей, включающих интерфейсный слой, изображенный, например, на рис. 11.2, где вместо общей системы рассматриваются параметры поверхности интерфейсного слоя (избыточные параметры).

dE = TdS + γ dA – pdV + ∑ μi dni
где dV — объем интерфейсного слоя (t x dA), dS — избыточная энтропия интерфейса, избыточное количество ni--компонента атомов на границе. После интегрирования

Таким образом, поверхностное натяжение плоской поверхности представляет собой избыточную энергию Гиббса на единицу поверхности. После дифференцирования (11.30) и сравнения с (11.29) получается
Adγ = - SdT +Vdp - ∑ ni dμi(11.32)
И на единичную площадь
dγ = - sdT +vdp - ∑ Гi dμi(11.33)
где Гi, — избыточное количество молей i-го компонента на единицу поверхности межфазного слоя, a s и v — избыточная энтропия и объем на единицу поверхности. При постоянных температуре и давлении
Для двух компонент
однако dμ1и dμ2не являются независимыми величинами, а связаны между собой уравнением Гиббса — Дюгема
где x1и x2 — мольные фракции двух компонент. Следовательно
Теперь можно воспользоваться (11.21), (11.23) и записать следующее важное уравнение, которое может иметь отношение также и к адсорбции,
а с2 — концентрация компоненты 2. Предполагается также, что коэффициент активности а2 не меняется при низкой концентрации. При этом возникает избыточная компонента 2 на межфазной границе и

Таким образом, распределение нескольких сортов атомов на границе определяется суммарным понижением свободной энергии и характеризуется сильным влиянием малых количеств веществ с низким поверхностным натяжением. Эти вещества имеют тенденцию концентрироваться в поверхностном слое, уменьшая поверхностное натяжение. Для компонент с высоким поверхностным натяжением добавление в поверхностный слой с более низкой поверхностной энергией ведет к уменьшению их концентрации на поверхности и оказывает весьма слабое влияние на поверхностное натяжение. Следовательно поверхностная энергия не меняется линейно при перераспределении содержания того или иного компонента. Этот факт демонстрируется на рис. 11.3
При низкой концентрации Г2 может быть измерена в координатах γ — ln с2 по наклону зависимости. Наклон может оставаться постоянным в некотором интервале с высокой поверхностной активностью, соответствующем, например, образованию монослоя на поверхности. Для веществ с высокой поверхностной энергией, таких как металлы, влияние поверхностных примесных атомов очень велико. Например, кислород и сера могут понизить поверхностное натяжение жидкого железа от 1,84 н/м до 1,2 н/м при добавлении всего 0,05%. То же самое справедливо и для поверхностей твердых металлов, карбидов и нитридов.

Значения рассмотренной поверхностной энергии изменяются в очень широких пределах от 0,072 Дж/м 2 для воды до нескольких единиц для алмаза и карбида кремния. В качестве примеров приведем данные [4]: медь (твердая) — 1,43, серебро (твердое) — 1,14, платина (жидкая) — 1,86, поваренная соль (кристалл (100)) — 0,30, оксид железа (жидкий) — 0,59, оксид алюминия (твердый) — 0,91, карбид титана (твердый) 1,19 Дж/м 2 . В целом поверхностная энергия для твердых веществ может превышать аналогичные значения для жидкости на 15 ÷ 25 %. Избыточная поверхностная энергия для материалов с развитой поверхностью достаточна для обеспечения многих процессов на поверхности, например спекания нанокластеров, как это будет показано далее.
Читайте также:

