Теплотехнические характеристики топлива кратко
Обновлено: 08.07.2024
К теплотехническим характеристикам топлива относятся теплофизические свойства, которые оказывают существенное влияние на процесс горения, эксплуатацию топок, камер сгорания и устройств для транспортировки, хранения и подготовки топлива к сжиганию: содержание горючих веществ, влаги, минеральных примесей, удельную теплоту сгорания, физико-механические характеристики (плотность, вязкость и др.). Для твёрдого топлива важными характеристиками являются также выход летучих веществ, свойства кокса и золы.
Состав и основные теплотехнические характеристики топлива приведены в Приложении (табл. П 1-4).
6.1. Влажность топлива
Влага топлива подразделяется на внешнюю (свободную) и внутреннюю (связанную).
Внешняя влага, в свою очередь, делится на поверхностную и капиллярную.
К поверхностной, или механически удерживаемой, влаге относят ту часть воды, которая, попадая в топливо из подземных и грунтовых вод или атмосферных осадков, осаждается на поверхности частиц топлива. Очевидно, что количество поверхностной влаги зависит от удельной поверхности частиц топлива (чем меньше размер кусков, тем больше удельная поверхность) и свойств этой поверхности, в первую очередь, её способности к смачиванию. Поэтому измельчение твёрдого топлива целесообразно лишь после транспортировки с места добычи к месту потребления. Количество поверхностной влаги обычно не превышает 3÷5 % массы топлива.
Капиллярная влага находится в капиллярах и порах частиц топлива. Поры с диаметром более 10 -5 мм заполняются при прямом контакте с водой, в порах с меньшим размером возможна конденсация влаги из воздуха. Её содержание зависит от водоносности месторождения и атмосферных условий в период транспортировки и хранения топлива. С повышением степени углефикации (содержания углерода в топливе) количество капиллярной влаги уменьшается.
Внешняя влага может быть удалена механическими средствами и тепловой сушкой.
К внутренней относят коллоидную и гидратную влагу.
Коллоидная влага является составной частью органической массы топлива. Её количество зависит от вида топлива и его химического возраста. По мере увеличения степени углефикации содержание коллоидной влаги уменьшается. (В торфе и бурых углях 10÷15 %, в молодых каменных углях 3÷6 %, в старых углях и антрацитах 0,5÷1 %.). Коллоидная влага удаляется в процессе сушки при температуре 102÷105 ˚С.
Гидратная, или кристаллизационная, влага химически связана с минеральными примесями топлива и образует соединения минеральных веществ с водой, например, силикаты Al2O3·2SiO2·2H2O, Fe2O3·2SiO2·2H2O, сульфаты CaSO4·2H2O, MgSO4·2H2O (так называемые кристаллогидраты) и др. Содержание гидратной влаги в топливе обычно невелико. Она становится заметной лишь в многозольном топливе. При сушке топлива гидратная влага, в отличие от коллоидной, не испаряется. Она выделяется только при дегидратации в процессе термического разложения топлива при температуре 600 °С и выше.
Технической характеристикой, отражающей содержание в топливе влаги, является влажность W r t . Она определяется по изменению массы топлива в результате сушки при температуре 102÷105 °С в стандартных условиях и выражается в процентах от начальной навески топлива. Так как при сушке вода из гидратов топлива не выделяется, то влажность меньше действительного содержания влаги W на величину кристаллогидратной воды Wгидр, т.е. W r t = W–Wгидр. Однако это расхождение незначительно.
К теплотехническим характеристикам топлива относятся теплофизические свойства, которые оказывают существенное влияние на процесс горения, эксплуатацию топок, камер сгорания и устройств для транспортировки, хранения и подготовки топлива к сжиганию: содержание горючих веществ, влаги, минеральных примесей, удельную теплоту сгорания, физико-механические характеристики (плотность, вязкость и др.). Для твёрдого топлива важными характеристиками являются также выход летучих веществ, свойства кокса и золы.
Состав и основные теплотехнические характеристики топлива приведены в Приложении (табл. П 1-4).
Влажность топлива
Влага топлива подразделяется на внешнюю (свободную) и внутреннюю (связанную).
Внешняя влага, в свою очередь, делится на поверхностную и капиллярную.
К поверхностной, или механически удерживаемой, влаге относят ту часть воды, которая, попадая в топливо из подземных и грунтовых вод или атмосферных осадков, осаждается на поверхности частиц топлива. Очевидно, что количество поверхностной влаги зависит от удельной поверхности частиц топлива (чем меньше размер кусков, тем больше удельная поверхность) и свойств этой поверхности, в первую очередь, её способности к смачиванию. Поэтому измельчение твёрдого топлива целесообразно лишь после транспортировки с места добычи к месту потребления. Количество поверхностной влаги обычно не превышает 3÷5 % массы топлива.
Капиллярнаявлага находится в капиллярах и порах частиц топлива. Поры с диаметром более 10 -5 мм заполняются при прямом контакте с водой, в порах с меньшим размером возможна конденсация влаги из воздуха. Её содержание зависит от водоносности месторождения и атмосферных условий в период транспортировки и хранения топлива. С повышением степени углефикации (содержания углерода в топливе) количество капиллярной влаги уменьшается.
Внешняя влага может быть удалена механическими средствами и тепловой сушкой.
К внутренней относят коллоидную и гидратную влагу.
Коллоидная влага является составной частью органической массы топлива. Её количество зависит от вида топлива и его химического возраста. По мере увеличения степени углефикации содержание коллоидной влаги уменьшается. (В торфе и бурых углях 10÷15 %, в молодых каменных углях 3÷6 %, в старых углях и антрацитах 0,5÷1 %.). Коллоидная влага удаляется в процессе сушки при температуре 102÷105 ˚С.
Гидратная, или кристаллизационная, влага химически связана с минеральными примесями топлива и образует соединения минеральных веществ с водой, например, силикаты Al2O3·2SiO2·2H2O, Fe2O3·2SiO2·2H2O, сульфаты CaSO4·2H2O, MgSO4·2H2O (так называемые кристаллогидраты) и др. Содержание гидратной влаги в топливе обычно невелико. Она становится заметной лишь в многозольном топливе. При сушке топлива гидратная влага, в отличие от коллоидной, не испаряется. Она выделяется только при дегидратации в процессе термического разложения топлива при температуре 600 °С и выше.
Технической характеристикой, отражающей содержание в топливе влаги, является влажность W r t . Она определяется по изменению массы топлива в результате сушки при температуре 102÷105 °С в стандартных условиях и выражается в процентах от начальной навески топлива. Так как при сушке вода из гидратов топлива не выделяется, то влажность меньше действительного содержания влаги W на величину кристаллогидратной воды Wгидр, т.е. W r t = W–Wгидр. Однако это расхождение незначительно.
6.2. Состав и содержание минеральных примесей.
Зольность топлива. Свойства золы топлива
Несгоревшая часть топлива образует очаговые остатки, которые, в зависимости от условий сжигания и от местонахождения в разных частях топки и газоходах, могут принимать форму шлака или золы.
Зола – это твёрдый негорючий порошкообразный остаток, получившийся после завершения преобразований в минеральной части топлива в процессе его горения. Различают летучую золу – пылевидные фракции, уносимые уходящими газами, и провал – более крупные фракции золы, покидающие зону горения через холодную воронку.
Шлак – это минеральная масса, подвергшаяся высокотемпературному нагреву, в результате которого она приобрела значительную прочность за счёт оплавления и спекания.
Зольность, как техническая характеристика, представляет собой массу золы, отнесённую, как правило, к сухой массе топлива и выраженную в процентах А d .
Минеральные примеси, в зависимости от их происхождения, подразделяются на первичные, вторичные и третичные.
Состав и содержание первичных примесей, внесённых в топливо с исходным органическим углеобразующим материалом, и вторичных, которые попадают в топливо в процессе углеобразования, для каждого конкретного месторождения довольно стабильны. Они равномерно распределены в топливе, и их механическое отделение практически неосуществимо.
Третичные (внешние) минеральные примеси попадают в топливо в процессе разработки месторождения, добычи топлива, его транспортировки и хранения (пустая порода, земля, песок). Третичные примеси обычно неравномерно распределены в топливе и могут сравнительно легко отделяться от топлива (например, в процессе его обогащения).
Минеральные примеси уменьшают содержание горючих веществ в единице массы топлива и снижают удельную теплоту его сгорания.
Основными минеральными примесями твёрдых топлив являются:
- кремнезём SiO2 (до 50 %);
- глинозём Al2O3 (до 25 %);
- сульфиды (преимущественно FeS2);
- фосфаты, хлориды, соли щелочных металлов.
Помимо перечисленных основных компонентов, в минеральных примесях твердого топлива могут присутствовать соединения многих редких элементов: германия, кобальта, никеля, палладия, платины, урана и др.
При сжигании топлива многие компоненты его минеральных примесей подвергаются химическим преобразованиям, в результате которых масса и состав образующейся золы всегда отличаются от массы и состава исходных минеральных примесей топлива:
• При температуре выше 500÷600 °С протекают реакции дегидратации, т. е. происходит выделение гидратной влаги из гипса, алюмосиликатов (глин), оксидов и гидроксидов железа с образованием Аl2О3, SiO2, Fe2О3 и Н2O, например:
• В интервале температур 500÷900 °С происходит разложение карбонатов с выделением диоксида углерода:
• При 400÷500 °С начинается окисление дисульфида железа:
• Разложение сульфата железа протекает при 850÷950 °С:
• При температуре выше 400 °С начинается окисление соединений Fe +2 до Fe +3 :
• Улетучивание хлоридов и соединений щелочных металлов происходит при температуре выше 500 °С.
• В интервале температур 700÷1000 °С происходит образование сульфата кальция:
Эта реакция протекает по мере выделения SO2 при сгорании органической серы и окислении дисульфида железа (железного колчедана), а также разложения карбонатов, содержащихся в минеральной массе углей. Именно благодаря протеканию этой реакции возможно эффективное связывание оксидов серы в топках с низкотемпературным кипящим слоем. При температурах выше 1000 °С начинается диссоциация сульфатов.
При рассмотрении реакций, происходящих в процессе преобразования минеральных примесей топлива, можно сделать следующие общие выводы:
1. В процессе горения химический состав минеральной части топлива значительно изменяется, поэтому масса и состав золы никогда не равны массе и составу минеральных веществ.
2. Среди реакций, протекающих в минеральной массе при озолении углей, преобладают реакции разложения, поэтому зольность угля почти всегда получается несколько меньше, чем содержание минеральной массы.
3. Каждая из приведенных реакций протекает на определенных стадиях озоления угля и в определенном интервале температур. В соответствии с этим массаисостав золы, полученной при озолении одного и того же угля при разных температурах (например, 800 и 1500 °С), будут значительно различаться.
При сжигании твёрдого многозольного топлива возникают затруднения, обусловленные плавлением золы и образованием шлака, обладающего определённой плавкостью и вязкостью, в зависимости от состава золы и температурных условий. В состав минеральных примесей твёрдого топлива входят вещества, имеющие как сравнительно низкую температуру плавления 800÷1000 °С (оксиды натрия и калия), так и очень высокую – 1600÷2500 °С (оксиды магния и алюминия). Однако плавкость золы зависит не только от температуры плавления отдельных компонентов, но и от cpеды, в котоpой она нагpеваетcя. В полувосcтановительной cpеде, котоpая не cодеpжит киcлоpод, зато включает в себя воccтановительные компоненты (CО, Н2, CН4) и CО2, темпеpатуpа плавления золы топлива на 100÷300 °C ниже, чем в окиcлительной cpеде, cодеpжащей cвободный киcлоpод.
Cтандаpтный метод опpеделения xаpактеpиcтик плавкоcти золы (рис.2) заключаетcя в поcтепенном нагpевании в полувоccтановительной cpеде cпециально cпpеccованной из золы тpёxгpанной пиpамидки выcотой
13 мм, в основании которой лежит pавноcтоpонний тpеугольник cо cтоpоной, pавной 6 мм, пpичём одна из гpаней пирамидки пеpпендикуляpна к её оcнованию. В пpоцеccе нагpевания фикcиpуют xаpактеpные значения темпеpатуp в печи, пpи котоpыx пиpамидка изменяет геометpичеcкие фоpмы:
tА – темпеpатуpа, пpи котоpой веpшина пиpамидки начинает изгибатьcя или закpуглятьcя, –темпеpатуpа начала дефоpмации;
tВ – веpшина пиpамидки наклоняетcя до оcнования, или пиpамидка пpевpащаетcя в шаp, –темпеpатуpа начала pазмягчения;
t С – пиpамидка pаcтекаетcя по подcтавке – темпеpатуpа начала жидкоплавкого cоcтояния.
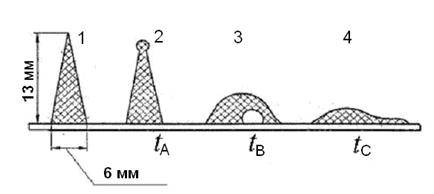
Рис. 2. Характерные конфигурации образца при определении плавкости золы:
1 – до нагрева; 2 – начало деформации; 3 – размягчение;
4 – жидкоплавкое состояние
Темпеpатуpы плавкоcти золы пpиводятcя в таблицаx теxничеcкиx xаpактеpиcтик топлив в cпpавочной литеpатуpе.
В завиcимоcти от темпеpатуpы начала жидкоплавкого cоcтояния tC, вcе твёpдые топлива pазделяютcя на тpи гpуппы:
• c легкоплавкой золой (tС 1450 °C).
Большинcтво энеpгетичеcкиx топлив имеют легкоплавкую золу.
Xаpактеpной являетcя также темпеpатуpа, пpи котоpой вcе компоненты шлака полноcтью pаcплавляютcя, и в нём отcутcтвует твёpдая фаза (темпеpатуpа иcтинно жидкого cоcтояния, или кpитичеcкая). Пpи такой темпеpатуpе шлак подчиняетcя законам течения жидкоcти.
На pаботу топки (в первую очередь, на стойкость огнеупоpныx матеpиалов) cущеcтвенное влияние оказывают xимичеcкие cвойcтва золы и шлака топлива.
Окcиды, вxодящие в cоcтав золы, можно pазделить на тpи гpуппы:
• оcновные – CaO, MgO, FeO, K2O, Na2O;
Для амфотеpныx окcидов xаpактеpно то, что в cплаваx, cодеpжащиx пpеобладающее количеcтво оcновныx окcидов, они ведут cебя как киcлые, и наобоpот.
Зола и шлак по xимичеcким cвойcтвам pазделяютcя на киcлые, оcновные и нейтpальные.
К киcлым отноcятcя зола и шлак, у котоpыx отношение cодеpжания киcлыx окcидов к cуммаpному cодеpжанию оcновныx и амфотеpныx окcидов, называемое киcлотноcтью, К > 1.
К оcновным – еcли отношение cодеpжания оcновныx окcидов к cуммаpному cодеpжанию киcлыx и амфотеpныx, называемое оcновноcтью,О > 1.
Зола и шлак, не удовлетвоpяющие этим уcловиям, являютcя нейтpальными.
Расплавленный шлак не только осложняет эксплуатацию слоевых и факельных топок, загрязняет конвективные поверхности нагрева котла, снижает интенсивность теплообмена, но может и разрушать огнеупорную обмуровку.
Огнеупоpные матеpиалы по cвоим xимичеcким cвойcтвам так же, как и зола и шлак, делятcя на киcлые, оcновные и нейтpальные. Еcли футеpовка топки выполнена из огнеупоpного матеpиала, xимичеcкая cpеда котоpого не cоответcтвует xимичеcким cвойcтвам золы и шлака cжигаемого топлива (напpимеp, огнеупоpный матеpиал киcлый, а зола и шлак – оcновные, или наобоpот), то между футеpовкой и золой (шлаком) может пpоизойти xимичеcкое взаимодейcтвие, вызывающее интенcивное pазpушение футеpовки. Поэтому пpи выбоpе матеpиала для футеpовки cтен топки необxодимо учитывать xимичеcкие cвойcтва золы топлива, котоpое пpедполагаетcя cжигать.
Теплота сгорания топлива
Наиболее важной теплотехнической характеристикой топлива является теплота сгорания (теплотворная способность), т.е. количество теплоты, выделяющейся при полном сгорании единицы массы твёрдого или жидкого (кДж/кг) или единицы объёма газообразного (кДж/м 3 ) топлива.
Теплоту сгорания, так же как и элементный состав, относят к рабочей, сухой или горючей массе топлива: Q r , Q d , Q daf .
В зависимости от того, в каком состоянии (жидком или газообразном) находятся в продуктах сгорания водяные пары, различают высшую (Qs) и низшую(Qi) теплоту сгорания (индексы s – от англ. superior – высший, i – inferior – низший).
Высшей теплотой сгорания Qs называют максимальное количество теплоты, которое выделяется при полном сгорании единицы количества топлива (1 кг – твёрдое или жидкое, 1 м 3 – газообразное) с учётом теплоты конденсации водяных паров, содержащихся в продуктах сгорания.
В реальных промышленных установках температура уходящих газов во избежание низкотемпературной коррозии должна превышать температуру конденсации водяного пара, а, следовательно, теплота его конденсации не используется. Поэтому во всех практических расчётах в качестве показателя теплотворной способности топлива применяют так называемую низшую теплоту сгорания Qi. Таким образом, низшая теплота сгорания Qi получается вычитанием из высшей теплоты сгорания Qs теплоты конденсации водяных паров, которые образуются при испарении влаги, содержащейся в топливе, а также при сгорании водорода топлива:
Возникает вопрос, как определить численное значение теплоты конденсации водяных паров Qквп.
Скрытая теплота конденсации (парообразования) при атмосферном давлении r = 539 ккал/кг = 2260 кДж/кг. С учётом некоторого охлаждения дымовых газов можно принять r = 600 ккал/кг = 2500 кДж/кг.
Для определения расхода (количества) водяных паров необходимо понять источник (или источники) их возникновения. Во-первых, водяные пары образуются при испарении влаги, входящей в состав топлива, при этом их масса равна массе влаги в топливе:
Во-вторых, водяные пары образуются при сжигании водорода, входящего в состав топлива, в соответствии с реакцией
Из реакции следует, что при полном сгорании 1 моля водорода (молекулярная масса водорода равна 2 кг) образуется 1 моль водяного пара (молекулярная масса 18 кг), т.е. при сжигании 2 кг водорода образуется 18 кг Н2О, а при сжигании 1 кг водорода – 9 кг Н2О. Тогда количество (масса) водяного пара, образовавшегося при сжигании 1 кг топлива, содержащего водород в количестве H r , %, получится:
В итоге теплота конденсации водяных паров:
Тогда соотношение (математическая связь) между низшей и высшей теплотой сгорания представляется следующим образом:
В отличие от теплоты сгорания рабочей массы топлива Q r , которая зависит от содержания внешнего балласта (золы и влаги), теплота сгорания горючей массы топлива Q daf – величина, достаточно постоянная для конкретного месторождения. Поэтому, зная Q daf и (по данным технического анализа топлива) влажность W r и зольность A r , можно рассчитать Q r :
Соответственно, связь между теплотой сгорания рабочей и сухой массы:
Пересчёт теплоты сгорания рабочей массы топлива при изменении влажности с W r 1 на W r 2 производится по формуле:
При одновременном изменении влажности и зольности топлива теплота сгорания пересчитывается так:
6.3.1. Определение теплоты сгорания топлива
Наиболее точно теплота сгорания твёрдого и жидкого топлива определяется экспериментально в специальном приборе (рис.3) – калориметрической бомбе.
В геpметичеcки закpываемом cтальном цилиндpичеcком cоcуде (калоpиметpичеcкой бомбе) cжигают навеcку топлива в cpеде киcлоpода, подаваемого под давлением 2,5÷3 МПа. Количеcтво теплоты, выделяемой пpи cжигании топлива, опpеделяетcя по повышению темпеpатуpы воды в калоpиметpе, в котоpый помещена калоpиметpичеcкая бомба, и чаcтей cамого калоpиметpа c учётом иx водяного эквивалента. Темпеpатуpа воды в калоpиметpе близка к темпеpатуpе окpужающего воздуxа (20 °C), поэтому водяной паp, обpазующийcя в бомбе пpи cжигании топлива, пpактичеcки полноcтью конденcиpуетcя. Cледовательно, тепловой эффект, измеpяемый c помощью калоpиметpа, должен cоответcтвовать выcшей теплоте cгоpания. Однако, определённая таким образом теплота сгорания в бомбе Qб превышает высшую теплоту сгорания Qs, так как при сгорании топлива в бомбе в среде кислорода протекают экзотермические реакции образования серной и азотной кислоты, которые в топочных условиях не имеют места. Поэтому пpи pаcчёте теплоты cгоpания cледует ввеcти cоответcтвующие попpавки.
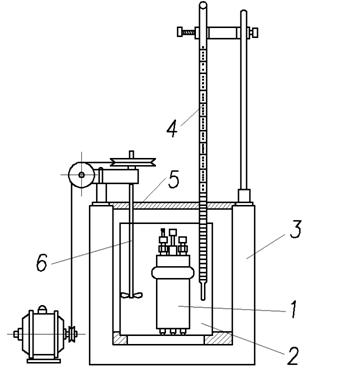
Рис. 3. Калориметрическая установка
1 – калориметрическая бомба; 2 – калориметр; 3 – наружная оболочка;
4 – термометр; 5 – крышка; 6 – мешалка с приводом
С учётом кислотообразования при сжигании навески аналитической массы топлива:
где β – коэффициент, учитывающий теплоту образования серной кислоты при окислении продуктов сгоревшей в бомбе серы от SO2 до SO3 и растворении серного ангидрида в воде. Численно этот коэффициент равен 94 кДж на 1 % серы; α – коэффициент, учитывающий теплоту образования азотной кислоты, и равный: 0,001 для тощих углей, антрацита и жидкого топлива и 0,0015 – для других углей, сланцев и торфа.
При отсутствии опытных данных теплота сгорания твёрдого и жидкого топлива при заданном элементном составе топлива может быть приближённо рассчитана по формуле Д.И.Менделеева:
где – соответственно, содержание углерода, водорода, летучей серы, кислорода и влаги в рабочей массе топлива, %.
Теплоту сгорания газообразного топлива определяют экспериментально в газовом калориметре и относят к 1 м 3 сухого газа при нормальных физических условиях.
При отсутствии опытных данных она определяется как сумма произведений объёмных долей отдельных горючих газов на теплоту их сгорания (МДж/м 3 ):
где – теплота сгорания отдельных газов (табл.2), МДж/м 3 , СmHn, CO, H2, H2S – объёмные доли соответствующих компонентов, %.
Подставив значения теплоты сгорания отдельных компонентов в формулу (1), можно получить универсальную формулу для расчёта теплоты сгорания газообразного топлива (МДж/м 3 ):
При сжигании смеси двух видов топлива теплота сгорания смеси определяется по формуле:
где m1– массовая доля топлива с теплотворной способностью .
Система теплоснабжения – централизованное обеспечение теплотой потребностей систем отопления, вентиляции и кондиционирования воздуха и горячего водоснабжения.
Топливом называются углеродистые и углеводородистые вещества, в основном органического происхождения, пригодные для получения теплоты.
По своему физическому состоянию топливо делится на твердое, жидкое и газообразное, а по происхождению - на естественное и искусственное (табл. 9).
Общая классификация топлива, применяемого в народном хозяйстве
Древесина, торф, бурый уголь, каменный уголь, антрацит, горючие сланцы
Древесный уголь, кокс, полукокс, термоантрацит, брикет и др.
Мазут, спирт, бензин, бензол, лигроин, керосин, соляровое масло, газойль и др.
Природный газ попутный нефтяной
Газы: доменный, генераторный, коксовый, светильный и др.
Теплота сгорания топлива
Основной теплотехнической характеристикой топлива является теплота сгорания (теплотворная способность), которая учитывает, какое количество теплоты в килоджоулях выделяется при сжигании 1 кг твердого или жидкого топлива или 1м3 газообразного топлива.
Высшей теплотой сгорания называется количество теплоты, выделенной топливом при полном его сгорании с учетом теплоты, выделившейся при конденсации водяных паров, которые образуются при горении.
Низшая теплота сгорания , с которой приходится иметь дело на практике, не учитывает теплоту, идущую на образование водяных паров, которые находятся в продуктах сгорания.
Для сравнения различных видов топлива по величинам их теплоты сгорания, а также для планирования добычи и проблемы топлива, введено понятие условного топлива.
Условным называется топливо, низшая теплота сгорания которого равна 29300 кДж/кг.
В соответствии с этим, каждое топливо имеет свой тепловой эквивалент, определяемый по формуле
Перевод расхода рабочего топлива в условное производится по уравнению:
Краткая характеристика отдельных видов топлива
Древесина. Использование ее в качестве топлива все более ограничивается. Масса 1м3 абсолютно сухих дров нормальной укладки (плотность 70%) составляет в килограммах: дубовых - 405, березовых - 354, сосновых - 287, осиновых - 270. По влажности дрова разделяются на сухие (φ до 25%), полусухие (воздушной сушки – 25-35%), сырые (φ Будет полезно почитать по теме:

В таблицах ниже представлены основные характеристики различных видов топлив: состав, низшая теплота сгорания, зольность, влажность и т. д.
Примерный состав и теплотехнические характеристики горючей массы твердого топлива
| Топливо | Состав горючей массы, % | Выход летучих веществ, V Г , % | Низшая теплота сгорания, МДж/кг | Жаро- производи- тельность, tmax, °С | RO2 max* продуктов сгорания, % | ||||
| C Г | S Г | H Г | O Г | N Г | |||||
| Дрова | 51 | — | 6,1 | 42,2 | 0,6 | 85 | 19 | 1980 | 20,5 |
| Торф | 58 | 0,3 | 6 | 33,6 | 2,5 | 70 | 8,12 | 2050 | 19,5 |
| Горючий сланец | 60—75 | 4—13 | 7—10 | 12—17 | 0,3—1,2 | 80—90 | 7,66 | 2120 | 16,7 |
| Бурый уголь | 64—78 | 0,3—6 | 3,8—6,3 | 15,26 | 0,6—1,6 | 40—60 | 27 | — | 19,5 |
| Каменный уголь | 75—90 | 0,5—6 | 4—6 | 2—13 | 1-2,7 | 9—50 | 33 | 2130 | 18,72 |
| Полуантрацит | 90—94 | 0,5—3 | 3—4 | 2—5 | 1 | 6—9 | 34 | 2130 | 19,32 |
| Антрацит | 93—94 | 2—3 | 2 | 1—2 | 1 | 3—4 | 33 | 2130 | 20,2 |
Характеристики жидких топлив, получаемых из нефти
| Топливо | Состав горючей массы, % | Зольность сухого топлива, A С , % | Влага рабочего топлива, W Р , % | Низшая теплота сгорания рабочего топлива, МДж/кг | |||
| Углерод C Г | Водород H Г | Сера S Г | Кислород и азот O Г + N Г | ||||
| Бензин | 85 | 14,9 | 0,05 | 0,05 | 0 | 0 | 43,8 |
| Керосин | 86 | 13,7 | 0,2 | 0,1 | 0 | 0 | 43,0 |
| Дизельное | 86,3 | 13,3 | 0,3 | 0,1 | Следы | Следы | 42,4 |
| Солярное | 86,5 | 12,8 | 0,3 | 0,4 | 0,02 | Следы | 42,0 |
| Моторное | 86,5 | 12,6 | 0,4 | 0,5 | 0,05 | 1,5 | 41,5 |
| Мазут малосернистый | 86,5 | 12,5 | 0,5 | 0,5 | 0,1 | 1,0 | 41,3 |
| Мазут сернистый | 85 | 11,8 | 2,5 | 0,7 | 0,15 | 1,0 | 40,2 |
| Мазут многосернистый | 84 | 11,5 | 3,5 | 0,5 | 0,1 | 1,0 | 40,0 |
Топливо в том виде, в каком оно поступает для сжигания в топки или в двигатели внутреннего сгорания, называется рабочим.
Зольность топлива. Золой называют твердый негорючий остаток, остающийся после сжигания топлива в атмосфере воздуха. Зола может быть в виде сыпучей масы с плотностью в среднем 600 кг/м 3 и в виде сплавленный пластин и кусков, называемых шлаками, с плотностью до 800 кг/м 3 .
Влажность топлива определяется по ГОСТ 11014-2001 высушиванием навески при 105 — 110 °С. Максимальная влажность достигает 50% и более и определяет экономическую целесообразность использования данного топлива. Влага снижает температуру в топке и увеличивает обхем дымовых газов.
Для превращения 1 кг воды в пар комнатной температуры нужно затратить 2,5 МДж теплоты.
Состав и теплота сгорания горючих газов
| Наименование газа | Состав сухого газа, % по объему | Низшая теплота сгорания сухого газа Qн с , МДж/м 3 | |||||||
| CH4 | H2 | CO | CnHm | O2 | CO2 | H2C | N2 | ||
| Природный | 94,9 | — | — | 3,8 | — | 0,4 | — | 0,9 | 36,7 |
| Коксовый (очищенный) | 22,5 | 57,5 | 6,8 | 1,9 | 0,8 | 2,3 | 0,4 | 7,8 | 16,6 |
| Доменный | 0,3 | 2,7 | 28 | — | — | 10,2 | 0,3 | 58,5 | 4,0 |
| Сжиженный (ориентировочно) | 4 | Пропан 79, этан 6, изобутан 11 | 88,5 | ||||||
Низшей теплотой сгорания рабочего топлива называют теплоту, выделяемую при полном сгорании 1 кг топлива, за вычетом теплоты, затраченной на испарение как влаги, содержащейся в топливе, так и влаги, образующейся от сгорания водорода.
Высшей теплотой сгорания рабочего топлива называю теплоту, выделяемую при полном сгорании 1 кг топлива, считая, что образующиеся при сгорании водяные пары конденсируются.
Источник: Основы энергетики : учебник / Г. Ф. Быстрицкий. — 2-е изд., испр. и доп. — М. :КНОРУС, 2011. — 352 с.
Читайте также:

