Современные представления о структуре жидкости кратко
Обновлено: 03.07.2024
ЖИДКОСТЕЙ ТЕОРИЯ. Каждый из нас без труда припомнит немало веществ, которые он считает жидкостями. Однако дать точное определение этого состояния вещества не так-то просто, поскольку жидкости обладают такими физическими свойствами, что в одних отношениях они напоминают твердые тела, а в других – газы. Наиболее ярко сходство между жидкостями и твердыми телами проявляется у стеклообразных материалов. Их переход от твердого состояния к жидкому при повышении температуры происходит постепенно, они просто становятся все более мягкими, так что нельзя указать, в каком температурном интервале их следует назвать твердыми телами, а в каком – жидкостями. Можно лишь сказать, что вязкость стеклообразного вещества в жидком состоянии меньше, чем в твердом. Твердое стекло поэтому часто называют переохлажденной жидкостью.
По-видимому, наиболее характерным свойством жидкостей, отличающим их от твердых тел, является низкая вязкость (высокая текучесть). Благодаря ей они принимают форму сосуда, в который налиты. На молекулярном уровне высокая текучесть означает относительно большую свободу частиц жидкости. В этом жидкости напоминают газы, хотя силы межмолекулярного взаимодействия жидкостей больше, молекулы расположены теснее и более ограничены в своем движении.
К сказанному можно подойти и иначе – с точки зрения представления о дальнем и ближнем порядке. Дальний порядок существует в кристаллических твердых телах, атомы которых расположены строго упорядоченно, образуя трехмерные структуры, которые можно получить многократным повторением элементарной ячейки. Пример двумерного дальнего порядка представлен на рис. 1,а. В жидкости и стекле дальний порядок отсутствует. Это, однако, не означает, что они вообще не упорядочены. Для жидкости характерна картина, подобная изображенной на рис. 1,б. Число ближайших соседей у всех атомов практически одинаково, но расположение атомов по мере их удаления от какой-либо выделенной позиции становится все более и более хаотичным. Таким образом, упорядоченность существует лишь на малых расстояниях, отсюда и название: ближний порядок. Адекватное математическое описание структуры жидкости может быть дано лишь с помощью статистической физики. Например, если жидкость состоит из одинаковых сферических молекул, то ее структуру можно описать радиальной функцией распределения g(r), которая дает вероятность обнаружения какой-либо молекулы на расстоянии r от данной, выбранной в качестве точки отсчета. Экспериментально эту функцию можно найти, исследуя дифракцию рентгеновских лучей или нейтронов, а с появлением быстродействующих компьютеров ее стали вычислять методом компьютерного моделирования, основываясь на имеющихся данных о природе сил, действующих между молекулами, или на предположениях об этих силах, а также на законах механики Ньютона. Сравнивая радиальные функции распределения, полученные теоретически и экспериментально, можно проверить правильность предположений о природе межмолекулярных сил.
В органических веществах, молекулы которых имеют удлиненную форму, в том или ином интервале температур иногда обнаруживаются области жидкой фазы с дальним ориентационным порядком, который проявляется в тенденции к параллельному выстраиванию длинных осей молекул. При этом ориентационная упорядоченность может сопровождаться координационной упорядоченностью центров молекул. Жидкие фазы такого типа обычно называют жидкими кристаллами; для понимания их структурных свойств тоже весьма полезно компьютерное моделирование. См. также ЖИДКИЙ КРИСТАЛЛ.
В газах никакой упорядоченности в расположении молекул нет. Таким образом, жидкости занимают промежуточное положение между кристаллическими твердыми телами и газами, т.е. между полностью упорядоченными и полностью неупорядоченными молекулярными системами. Именно поэтому теория жидкостей оказывается столь сложной. Ниже мы рассмотрим связь между твердыми телами, жидкостями и газами, а также между различными свойствами жидкостей, пользуясь простыми молекулярными моделями.
Жидкость, газ и межмолекулярные силы.
В 1 см 3 газа при температуре 0° С и нормальном давлении содержится примерно 2,7Ч10 19 молекул, так что среднее расстояние между ними составляет около 30Ч10 –8 см, или 30 Å. Поскольку диаметр самих молекул всего лишь несколько ангстрем, логично предположить, что взаимодействие между молекулами газа пренебрежимо мало всегда, кроме моментов их столкновений. Таким образом, мы приходим к модели газа, в которой молекулы представляются движущимися независимо друг от друга шариками, сталкивающимися друг с другом и со стенками сосуда, в который газ заключен. При температуре 0° С скорость молекул составляет несколько сотен метров в секунду, и их столкновения со стенками сосуда создают ощутимое давление. Более детальное рассмотрение указанной модели дает соотношение между давлением P, объемом V и термодинамической температурой T (T = °С + 273)
(1)PV/T = const (для данного количества газа).
Это соотношение – так называемое уравнение состояния идеального газа – представляет собой обобщенную запись законов Бойля – Мариотта, Гей-Люссака и Шарля, и поведение большинства газов описывается им с хорошей точностью. Уравнение (1) выполнялось бы всегда, если бы газ оставался газом независимо от понижения температуры или повышения давления. Однако хорошо известно, что все газы можно перевести в жидкое состояние, если достаточно сильно сжать их или охладить. Для каждого газа есть так называемая критическая температура Tc, ниже которой он всегда может быть ожижен путем повышения давления; выше Tc газ не может быть ожижен ни при каких условиях. Это означает, что модель независимо движущихся молекул в условиях, когда температура выше Tc, является лишь приближенной, а ниже Tc при высоких давлениях и плотностях она вообще неверна. Существование жидкого состояния ниже Tc наводит на мысль, что между молекулами действуют силы притяжения, поскольку иначе вообще нельзя понять, почему они остаются вблизи друг от друга. Однако помимо притяжения молекулы испытывают и взаимное отталкивание – мы убеждаемся в этом, когда пытаемся уменьшить объем жидкости (или твердого тела). Силы притяжения действуют на больших расстояниях, чем силы отталкивания, но и те и другие имеют электростатическую природу.
Если ввести в модель идеального газа поправки на сцепление молекул и их объем, то получается уравнение, вообще говоря, отличное от (1). Одно из таких уравнений, выведенное Я.Ван-дер-Ваальсом, имеет вид
Здесь a и b – константы, характерные для данного газа. Это уравнение также предсказывает существование критической температуры Tc и качественно описывает наблюдаемый переход между газообразной и жидкой фазами.
Рассмотрим некоторые практические следствия из уравнения (2). На рис. 2 представлен график зависимости давления газа от объема. Пусть некоторое количество газа занимает объем V1 при температуре T1 и давлении P1. При уменьшении объема давление возрастает и состояние газа изменяется: из точки A он переходит в точку B. Здесь газ начинает конденсироваться, причем дальнейшее уменьшение объема уже не приводит к изменению давления. При движении вдоль прямой BC количество жидкости возрастает до тех пор, пока в точке C газ не будет ожижен полностью. Постоянное давление, соответствующее этому процессу, называется давлением насыщенного пара при данной температуре T1. Во всех точках отрезка BC между жидкостью и газом существует равновесие (термодинамическое). Это означает, что число молекул, испаряющихся с поверхности жидкости в 1 с, в точности равно числу молекул, конденсирующихся из пара в жидкость. Для дальнейшего уменьшения объема необходимо создать очень высокое давление, чтобы преодолеть силы взаимного отталкивания молекул жидкости. Этой ситуации отвечает вертикальная прямая CD. Кривая ABCD называется изотермой, поскольку всем ее точкам соответствует одна и та же температура. Если такой же опыт проводить при более высокой температуре, то в соответствии с уравнением Ван-дер-Ваальса мы получим изотерму с таким же ходом, лишь отрезок BC станет короче. И наконец, при критической температуре Tc этот отрезок вообще стянется в точку с координатами Tc и Pc. В этой точке жидкость и газ неразличимы. При температурах, превышающих Tc, уравнение Ван-дер-Ваальса (2) переходит в уравнение (1) (кривая, соответствующая температуре T2 на рис. 2). Значения критических температур и соответствующих им давлений приведены в следующей таблице:
Поверхностное натяжение.
Как мы видели, учет межмолекулярных сил позволяет правильно объяснить процесс конденсации газа. Попытаемся теперь с учетом этих сил описать некоторые физические свойства жидкостей.
Представим себе каплю ртути. Мы можем слегка расплющить ее пальцем, но стоит убрать палец, и капля снова соберется в шарик. Она ведет себя так, как будто ее обтягивает эластичная пленка. Это и есть проявление эффекта поверхностного натяжения. Его природа станет ясна, если мы обратимся к рис. 3. Здесь A и B – две молекулы жидкости, первая в объеме, вторая на поверхности. В обоих случаях на них действуют силы притяжения со стороны других молекул, но лишь тех, которые находятся внутри сферы диаметром в несколько ангстрем, поскольку эти силы быстро убывают с расстоянием. Для молекулы A такая сфера лежит полностью внутри жидкости, поэтому равнодействующая всех сил равна нулю. Молекула B, находящаяся на поверхности, будет втягиваться внутрь жидкости, поскольку на нее действуют только силы притяжения со стороны молекул, находящихся в нижней полусфере. Такие же силы, перпендикулярные поверхности и направленные внутрь жидкости, действуют на все молекулы вблизи поверхности; они и создают поверхностное натяжение.
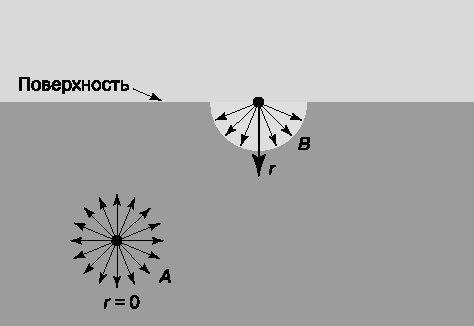
Поверхностное натяжение S количественно определяется как сила, действующая на единицу длины линии на поверхности жидкости. Рассмотрим мыльную пленку, натянутую на вертикальную рамку из двух тонких проволочек TUV и PQ (рис. 4). Проволочка PQ не закреплена и может свободно передвигаться. Она будет смещаться вниз под действием силы тяжести, пока последняя не уравновесится силой, обусловленной поверхностным натяжением. Поскольку пленка имеет две поверхности, на проволочку будет действовать сила 2SL, где L – длина участка проволочки PQ, контактирующего с пленкой.
Из-за наличия поверхностного натяжения любое увеличение площади поверхности жидкости сопряжено с затратами энергии. Именно поэтому небольшие капли жидкости принимают сферическую форму: отношение площади их поверхности к объему становится минимальным, а вслед за этим минимизируется и потенциальная энергия. Большие капли деформируются под действием силы тяжести.
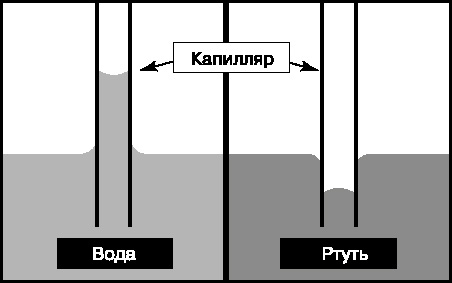
Капиллярные явления.
Кипение жидкостей.
При кипении жидкости в открытом сосуде давление внутри пузырьков пара, образующихся в жидкости, должно быть по меньшей мере равно атмосферному давлению – иначе пузырьки просто будут схлопываться. Следовательно, в точке кипения давление паров жидкости равно атмосферному. На достаточно большой высоте температура кипения жидкости ниже, чем на уровне моря, поскольку барометрическое давление понижается с высотой. Так, температура кипения воды на высоте 4000 м составляет лишь около 85° С, тогда как на уровне моря она равна 100° С.
Кипение – это интенсивное испарение жидкости, происходящее не только с поверхности, но и во всем ее объеме, внутрь образующихся пузырьков пара. Чтобы перейти из жидкости в пар, молекулы должны приобрести энергию, необходимую для преодоления сил притяжения, удерживающих их в жидкости. Например, для испарения 1 г воды при температуре 100° С и давлении, соответствующем атмосферному давлению на уровне моря, требуется затратить 2258 Дж, из которых 1880 идут на отделение молекул от жидкости, а остальные – на работу по увеличению объема, занимаемого системой, против сил атмосферного давления (1 г водяных паров при 100° С и нормальном давлении занимает объем 1,673 см 3 , тогда как 1 г воды при тех же условиях – лишь 1,04 см 3 ).
Температура кипения раствора нелетучего вещества, как правило, выше, чем чистого растворителя. Поскольку жидкость закипает, когда давление ее паров становится равным атмосферному, указанная закономерность означает, что давление паров раствора нелетучего вещества при данной температуре ниже, чем у чистого растворителя.
Затвердевание жидкостей.
Растворение жидкостей.
Наряду с полярными жидкостями, молекулы которых в значительной степени связаны между собой, существуют и неполярные с более слабыми межмолекулярными связями. Примером таких жидкостей могут служить углеводороды – бензол, нафталин и др. Молекулы этих жидкостей построены из атомов углерода и водорода, которые обобществляют свои валентные электроны вместо того, чтобы отдавать или присоединять их. Об относительной слабости связей между молекулами углеводородов свидетельствует низкая температура их кипения. Между жидкостями с четко выраженными полярными свойствами (вода) и абсолютно неполярными (углеводороды) находится целый спектр классов жидкостей, так что не всегда можно заранее сказать, будут две данные жидкости смешиваться или нет. Но в большинстве случаев выполняется правило, сформулированное в начале раздела.
Кроме электронной структуры, смешиваемость жидкостей может существенным образом зависеть от размера молекул, а также от температуры. Например, никотин смешивается с водой в любой пропорции ниже 60° С и выше 208° С; при промежуточных же температурах взаимная растворимость никотина и воды весьма ограничена.
Осмос.
В 1748 Ж.Нолле обнаружил, что некоторые растительные клетки в концентрированном солевом растворе сжимаются – вода уходит из них через клеточную мембрану. Если те же клетки перенести затем в воду, то они разбухают и восстанавливают свой размер. Такое перемещение вещества (диффузия) через полупроницаемую перегородку, разделяющую раствор и чистый растворитель или два раствора разной концентрации, называется осмосом. Это явление можно объяснить тем, что молекулы растворителя, как правило, меньше молекул растворенного вещества, а потому легче проходят сквозь поры в перегородке. Поскольку в разбавленном растворе (или чистом растворителе) число молекул растворителя больше, чем в концентрированном, происходит диффузионный перенос этих молекул в сторону последнего. См. также ОСМОС.
Жидкости и твердые тела.
Ранее мы говорили о взаимоотношениях жидкостей и их паров вблизи критической температуры Tc. Аналогичные взаимоотношения существуют между жидкостями и твердыми телами – по крайней мере вблизи температуры плавления Tm.
Обычно при расплавлении твердого тела его объем увеличивается примерно на 10%, т.е. среднее расстояние между соседними молекулами в твердом и жидком состояниях почти одинаково. Сцепление между атомами или молекулами в твердом и жидком состояниях различается не очень сильно, и пластичность твердых тел можно считать аналогом текучести жидкостей. Таким образом, по своим физическим свойствам твердые тела и жидкости различаются не столь радикально, как это кажется. Соответственно существуют два типа теорий жидкого состояния: одни опираются на представления современной теории твердого тела, а другие – на представления, заимствованные из теории газов. Теории первого типа более адекватны вблизи точки плавления Tm, а второго – вблизи критической точки Tc.
Жидкие металлы.
Многие физические свойства твердых металлов мало меняются при плавлении. В связи с этим разрабатываются более общие теории, в которых свойства жидких и твердых металлов рассматриваются с единых позиций. В этих теориях важную роль играет структурный фактор, определяемый взаимным расположением атомов. Оказывается, что вследствие довольно сильных колебаний атомов твердого тела при повышенных температурах структурный фактор твердого тела вблизи точки плавления не очень сильно отличается от такового для жидкости. Металлы с низкой температурой плавления, например натрий, применяются в качестве охлаждающих теплоносителей в ядерных реакторах АЭС.
Френкель Я.И. Кинетическая теория жидкостей. Л., 1975
Крокстон К. Физика жидкого состояния. М., 1987
Жидкость представляет собой вещество, пребывающее в промежуточном между твердым и газообразным состоянии. Это такое агрегатное состояние вещества, в котором прослеживается взаимосвязь молекул и атомов между собой таким образом, что это дает ему возможность сохранения своего объема, но при это, не настолько сильно, чтобы добиться сохранения еще и формы.
Рисунок 1. Взаимодействие молекул жидкостей. Автор24 — интернет-биржа студенческих работ
Молекулярно-кинетическая теория направлена на исследование строения и свойств вещества на основе представлений о существовании атомов и молекул в качестве наименьших частиц химических веществ. В основу данной теории положены три основные положения:
- Все вещества (как жидкие, так и газообразные, и твердые) появились из мельчайших частиц (молекул, состоящих из атомов). Молекулы химического вещества существуют в виде простых и сложных (состоящих из одного либо нескольких атомов).
- Молекулы и атомы являются электрически нейтральными частицами. При определенных условиях они способны к приобретению дополнительного электрического заряда и превращаются в положительные (отрицательные) ионы.
- Атомы и молекулы пребывают в непрерывном хаотическом движении. Частицы между собой осуществляют взаимодействие за счет сил, обладающих электрической природой. При этом гравитационное взаимодействие между частицами оказывается пренебрежимо малым.
Свойства и строение жидкостей
Жидкости склонны к легкому изменению своей формы с сохранением объема. В стандартных условиях они привычно принимают форму емкости, в которой находятся. Поверхность жидкости, что не соприкасается со стенками сосуда, называется свободной. Ее образование происходит вследствие воздействия силы тяжести на молекулы жидкости.
Готовые работы на аналогичную тему
Свойства жидкостей можно объяснить малыми промежутками между их молекулами малы. Так, молекулы упакованы настолько плотным образом, что расстояние между каждыми двумя из них оказывается меньше их размеров.
Молекулярная теория воды
Существует ряд определенных гипотез, объясняющих строение льда, пара, воды. Все они в какой-то степени опираются на молекулярно-кинетическую теорию строения вещества, чьи основы заложил М. Ломоносов.
Рисунок 2. Масса и размеры молекул. Автор24 — интернет-биржа студенческих работ
Данная теория исходит из принципов классической механики, что рассматривает молекулы (атомы) в формате шариков правильной формы, электрически нейтральных, идеально упругих. Такие молекулы склонны подвергаться исключительно механическим соударениям и не испытывать каких-либо электрических сил взаимодействия.
Водяной пар, согласно положениям молекулярно-кинетической теории, представляет собрание молекул, расстояние между ними многократно превышает размеры самих молекул. Молекулы газа, пребывающие в непрерывно-хаотическом движении, пробегают путь между стенками сосудов, где заключен газ и при этом происходит их столкновение между собой на данном пути.
При приближении температуры газа к температуре кипения (100°C) наступает уменьшение скорости молекул, и при соударении силы притяжения между ними возникает больше сил упругих отталкиваний в момент удара. По этой причине газ способен конденсироваться в жидкость.
Жидкость, в отличие от газа, является совокупностью близкорасположенных между собой молекул. Это расположение настолько близкое, что между ними начинается проявление сил взаимного притяжения. Это не позволяет молекулам жидкости разлетаться в разные стороны, подобно молекулам газа, а только колебаться около собственного равновесного положения.
Наряду с тем, из-за недостаточной плотности строения жидкости, в ней присутствуют свободные места, вследствие чего (исходя из теории Френкеля), обладающие большей энергией молекулы начинают вырываться из своего привычного окружения и скачкообразно перемещаться в соседнее отверстие на расстоянии, равном размерам самих молекул.
В случае охлаждения жидкости можно наблюдать обратный процесс. Начинается уменьшение скоростей колебательного движения молекул, становится более прочной структура жидкости, а сама она переходит в состояние льда (кристаллическое).
Структура воды в трех ее агрегатных состояниях
Проблема оценки структуры воды пока представляет для ученых определенные сложности. Наиболее популярной считается гипотеза, предложенная в 1883 году Уайтингом.
В ней утверждается, что:
- в качестве основной строительной единицы водяного пара выступает молекула гидроль (моногидроль);
- основной строительной единицей воды будет являться двойная молекула дигидроль;
- лед считается состоящим из тройных молекул тригидроль.
На данных представлениях основывается гидрольная теория структуры воды, согласно которой водяной пар считается состоящим из комплекса простейших молекул моногидроля, их ассоциаций и также из незначительного числа молекул дигидроля.
В жидком виде вода считается смесью молекул моногидроля, дигидроля и тригидроля. Соотношение количества таких молекул в воде будет различным и зависимым от температуры. Поскольку молекула воды сама по себе несимметрична, центры тяжести положительных и отрицательных зарядов у нее не будут совпадать.
Рисунок 3. Полярные молекулы. Автор24 — интернет-биржа студенческих работ
Молекулы обладают двумя полюсами – положительным и отрицательным, создающими, подобно магниту, силовые молекулярные поля. Такие молекулы называются полярными (диполями). Количественная характеристика полярности при этом определяется электрическим моментом диполя.
Вещество в зависимости от условий, в которых оно находится, может иметь разные агрегатные состояния: твердое, жидкое, газообразное или состояние плазмы. Главным образом это зависит от температуры Т и давления – р. Значения этих параметров определяет характер взаимодействия между молекулами от чего, в свою очередь, зависит структура и свойства вещества. Жидкости в этом смысле занимают промежуточное положение между газами и твердыми телами. В частности, для жидкости, как и для кристаллических тел, характерно наличие определённого объёма, и вместе с тем жидкость, подобно газу, принимает форму сосуда, в котором находится. Тем не менее жидкость нельзя рассматривать просто как сильно сжатый газ: количественное различие в плотностях настолько велико, что свойства жидкостей во многом значительно отличаются от свойств газов. В первую очередь это относится к различию в характере теплового движения молекул жидкости и газа.
Свойства жидкостей их структура, особенности движения молекул представляют особый интерес для биофизиков и медиков, т.к. биоорганизмы больше, чем на половину состоят из жидкостей. Обмен веществ, снабжение клеток кислородом, выведение из организмов продуктов жизнедеятельности обеспечивается именно перемещением жидкостей.
Молекулы в жидкостях находятся значительно ближе друг к другу, чем в газах. По этой причине силы межмолекулярного взаимодействия в жидкости значительно больше, чем в газе. Соответственно поправка р´= а/V 2 на добавочное давление в уравнении состояния Ван-дер-Ваальса, как показывает расчёт, очень велика: примерно в 10 6 раз больше, чем в газах. Например, для воды ван-дер-ваальсово давление равно примерно 11 000 атмосфер. Именно этой огромной величиной молекулярного давления объясняется ничтожно малая сжимаемость жидкостей даже при значительном изменении внешнего давления.
Исключение в этом плане составляют жидкости с удлиненной или дискообразной формой молекул, для которых, при определенных условиях, упорядоченная ориентация частиц наблюдается в пределах значительных объёмов. Такие жидкости получили название жидких кристаллов, т.к. для них, в силу указанной особенности структуры, наблюдается анизотропия механических, оптических, электрических и др. свойств, подобно тому, как это имеет место в кристаллах.
В случае несферической формы молекулы жидкости могут совершать кроме колебаний также вращательное и вращательно-колебательное движения.

Такая структура жидкостей и характер поведения её молекул обеспечивает сильно выраженную самодиффузию частиц жидкости и её основное свойство – текучесть. Вместе с тем, жидкости практически несжимаемы и сохраняют свой объем подобно твердым телам. Сближает жидкости с твердыми телами и то обстоятельство, что они способны сопротивляться растяжению.
По сравнению с газами жидкости обладают значительным коэффициентом теплового расширения. Значения коэффициентов объёмного расширения при постоянном давлении (p = const):
приведены в таблице (Яковлев сттр. 213).
Молярные теплоёмкости Ср и СV для жидкостей тоже существенно отличаются от соответствующих значений для их паров. (табл Яковлнев стр. 214)
Интересно отметить, что для жидкостей не выполняется уравнение Майера: Ср – СV = R. В тоже время из теории известно, что значения γ = Ср /СV для жидкостей примерно такие же, как и у газов.
ЖИДКОСТИ.
Вещество в зависимости от условий, в которых оно находится, может иметь разные агрегатные состояния: твердое, жидкое, газообразное или состояние плазмы. Главным образом это зависит от температуры Т и давления – р. Значения этих параметров определяет характер взаимодействия между молекулами от чего, в свою очередь, зависит структура и свойства вещества. Жидкости в этом смысле занимают промежуточное положение между газами и твердыми телами. В частности, для жидкости, как и для кристаллических тел, характерно наличие определённого объёма, и вместе с тем жидкость, подобно газу, принимает форму сосуда, в котором находится. Тем не менее жидкость нельзя рассматривать просто как сильно сжатый газ: количественное различие в плотностях настолько велико, что свойства жидкостей во многом значительно отличаются от свойств газов. В первую очередь это относится к различию в характере теплового движения молекул жидкости и газа.
Свойства жидкостей их структура, особенности движения молекул представляют особый интерес для биофизиков и медиков, т.к. биоорганизмы больше, чем на половину состоят из жидкостей. Обмен веществ, снабжение клеток кислородом, выведение из организмов продуктов жизнедеятельности обеспечивается именно перемещением жидкостей.
Молекулы в жидкостях находятся значительно ближе друг к другу, чем в газах. По этой причине силы межмолекулярного взаимодействия в жидкости значительно больше, чем в газе. Соответственно поправка р´= а/V 2 на добавочное давление в уравнении состояния Ван-дер-Ваальса, как показывает расчёт, очень велика: примерно в 10 6 раз больше, чем в газах. Например, для воды ван-дер-ваальсово давление равно примерно 11 000 атмосфер. Именно этой огромной величиной молекулярного давления объясняется ничтожно малая сжимаемость жидкостей даже при значительном изменении внешнего давления.
Исключение в этом плане составляют жидкости с удлиненной или дискообразной формой молекул, для которых, при определенных условиях, упорядоченная ориентация частиц наблюдается в пределах значительных объёмов. Такие жидкости получили название жидких кристаллов, т.к. для них, в силу указанной особенности структуры, наблюдается анизотропия механических, оптических, электрических и др. свойств, подобно тому, как это имеет место в кристаллах.
В случае несферической формы молекулы жидкости могут совершать кроме колебаний также вращательное и вращательно-колебательное движения.
Такая структура жидкостей и характер поведения её молекул обеспечивает сильно выраженную самодиффузию частиц жидкости и её основное свойство – текучесть. Вместе с тем, жидкости практически несжимаемы и сохраняют свой объем подобно твердым телам. Сближает жидкости с твердыми телами и то обстоятельство, что они способны сопротивляться растяжению.
По сравнению с газами жидкости обладают значительным коэффициентом теплового расширения. Значения коэффициентов объёмного расширения при постоянном давлении (p = const):
приведены в таблице (Яковлев сттр. 213).
Молярные теплоёмкости Ср и СV для жидкостей тоже существенно отличаются от соответствующих значений для их паров. (табл Яковлнев стр. 214)
Интересно отметить, что для жидкостей не выполняется уравнение Майера: Ср – СV = R. В тоже время из теории известно, что значения γ = Ср /СV для жидкостей примерно такие же, как и у газов.
ЖИ́ДКОСТЬ, агрегатное состояние вещества, занимающее промежуточное положение между газообразным и твёрдым кристаллич. состояниями. Область существования Ж. ограничена со стороны низких темп-р фазовым переходом в твёрдое состояние (кристаллизацией), а со стороны высоких темп-р – в газообразное (испарением). По химич. составу различают однокомпонентные, или чистые, Ж. и двух- или многокомпонентные жидкие смеси ( растворы ). Химически чистые однокомпонентные Ж. могут быть разделены на нормальные (простые) и ассоциированные. К первым относятся одноатомные Ж., такие как сжиженные благородные газы, жидкие металлы , а также ряд многоатомных Ж. Ко вторым относится значит. число многоатомных органич. Ж., на свойства которых в заметной степени оказывают влияние слабые химические взаимодействия (водородные связи). Особое место занимают жидкие кристаллы с сильно выраженной анизотропией и квантовые жидкости , обладающие специфическими квантовыми свойствами при очень низких температурах.
Удобным методом описания структуры простой жидкости является функция радиального распределения, которая может быть рассчитана на основании данных по расстоянию рентгеновских лучей и нейтронов. Вероятность того, что элемент объема в жидкости объема V содержит заданную молекулу, пропорциональна Вероятность, что данная пара молекул занимает два таких объема (при этом предполагается, что расстояние между частицами достаточно велико и их межмолекулярный потенциал мал).
Если же расстояние между молекулами приближается к диаметру молекулы то объем молекулы и силы межмолекулярного взаимодействия жестко определяют расстояние между молекулами. В этом случае вероятность того, что данная пара занимает два определенных элемента объема, будет равна
где радиальная функция распределения, или поправка к фактору свободного распределения. Вероятность найти какую-либо молекулу в объеме на расстоянии от центра фиксированной молекулы будет равна
Число молекул в сферической области толщины (рис. 38) будет равно
где число молекул в объеме
Метод исследования структуры жидкости посредством функции радиального распределения был предложен в 1920 г. Дебаем и Менке. На рис. 39а представлена функция радиального распределения для ртути (Дебай, 1930). В 1934 г. Морелл и Гильдебранд получили аналогичную функцию распределения на очень красивой модели.
Они изготовили много одинаковых шариков из горячего раствора желатина, капая его в холодное масло.
Рис. 38. Расположение ближайших соседей в простых жидкостях
Рис. 39. Функция радиального распределения для ртути (а), для желатиновых шариков при комнатной температуре (б) и для желатиновых шариков при более высокой температуре (в)
Некоторое их количество покрасили ламповой сажей. Все шарики плотно упаковали в растворе желатина. При этом, так как показатель преломления раствора и некрашенных шариков был одинаковым, в сосуде были видны только крашеные шарики. Сосуд сильно встряхивали, делали фотографии в двух проекциях одновременно с помощью зеркала и измеряли расстояние между крашеными шариками. Затем опять встряхивали сосуд и фотографировали, и так много раз.
На основании полученных результатов авторы построили зависимость от где диаметр шарика. Функция реального распределения желатиновых шариков представлена на рис. 39б и, как видно из сравнения рисунков 39а и
39б, очень похожа на функцию радиального распределения ртути. Рядом авторов (Гильдебрандт, 1939; Томас, 1938; Кампбелл, 1943) было показано, что для всех простых жидкостей в соответственном состоянии функции радиального распределения оказываются одинаковыми (рис. 40).
Из функции радиального распределения было определено число ближайших соседей. В кристалле из простых молекул при плотной упаковке максимальное число соседей — Это число зависит от температуры и давления
где V — объем моля жидкости, число Авогадро.
Рис. 40. Функция радиального распределения для ряда простых жидкостей в одинаковом соответственном состоянии
Рис. 41, Функция радиального распределения аргона и воды
Зависимость числа ближайших соседей в Xе от температуры и давления имеет следующий вид:
Подобные результаты были получены и для других жидкостей. Прохоренко и Фишер (1959) дали детальную теорию
флуктуаций координационного числа простых жидкостей. Они заключили, что полученные ими результаты противоречат квазикристаллическим моделям простых жидкостей и свидетельствуют в пользу статистического распределения молекул в жидкости.
В 1953 г. Гильдебрандт опубликовал рядом два графика, представляющие функцию радиального распределения рассеяния рентгеновских лучей галлием при одной и той же температуре. В одном случае исследовалось рассеяние рентгеновских лучей мелким порошком а в другом случае расплавом галлия при . В расплаве не было обнаружено никаких следов хорошо определенной структуры порошка. Эта работа была направлена на опровержение широко распространенных квазикристаллических теорий жидкости и, в частности, теории сиботаксических состояний Стюарта (1927).
Функция радиального распределения для сложных многоатомных молекул естественно не совпадает с радиальной функцией распределения сферически симметричных простых молекул. Прежде всего это связано с тем, что для несимметричных молекул функция распределения является функцией не только расстояния, но и углов. На рис. 41 представлена функция радиального распределения аргона (сплошная кривая) и воды (Бен-Нейм, 1969).
Большое теоретическое значение функции радиального распределения состоит в следующем. Во-первых, она непосредственно экспериментально связана с функцией рассеяния рентгеновских лучей и нейтронов. Во-вторых, если известна температурная зависимость зависимость ее от числа частиц в объеме и потенциал межмолекулярного взаимодействия то определены все свойства жидкости, так как потенциальная энергия системы, пропорциональна интегралу
Однако до сих пор
1) точный вид функции известен с очень малой точностью,
2) точной связи нет,
3) роль многочастичных взаимодействии остается не выясненной, и проблема жидкого состояния ждет разрешения.
Читайте также:
- Воспитание авторские программы школ россии избранные модули
- Задача для детского сада купили 5 ящиков яблок по 24 кг в каждом
- Общая характеристика права древнего востока кратко
- Закон о праве детей с особыми потребностями на обучение в массовых школах
- Основные части речи изучаются в школе на основе линейного принципа

