Сформулируйте закон фарадея для электролиза кратко
Обновлено: 02.07.2024
Электролизом называют процессы, протекающие на электродах под действием электрического тока, подаваемого от внешнего источника тока через электролиты.
При электролизе на электродах непрерывно протекают окислительно-восстановительные реакции. На катоде (К(-)) происходит процесс восстановления, на аноде (А(+)) – процесс окисления. Продукты этих реакций или откладываются на электродах, или вступают во вторичные реакции (взаимодействуют между собой, с молекулами растворителя или с веществом электрода), или накапливаются в растворе у электродов. Течение первичных анодных и катодных реакций подчиняется законам Фарадея.
Первый закон Фарадея: масса вещества m, выделяемая на электроде электрическим током, пропорциональная количеству электричества Q, прошедшему через электролит:
m = kQ, но Q =It (9.16)
где I – сила тока, А; t – время пропускание тока, с.
k – коэффициент пропорциональности, равный количеству вещества, выделяемого при прохождении одного кулона (Кл) электричества (электрохимический эквивалент).
Второй закон Фарадея: массы различных веществ, выделенных одним и тем же количеством электричества, пропорциональных их химическим эквивалентам (Мэ):
Для выделения 1 грамма эквивалента вещества требуется пропустить через электролит одно и тоже количество электричества, равное приблизительно 96500 Кл (число Фарадея). Следовательно:
Подставив последнее уравнение в (9.17), получим формулу, объединяющую оба закона Фарадея.
Соотношение (9.18) используют в расчетах процессов при электролизе. При практическом проведении электролиза всегда некоторая часть электрической энергии затрачивается на побочные процессы. Важной характеристикой рентабельности установки для проведения электролиза (электролизера) является выход по току (h, %):
где mпр – масса фактически выделенного вещества; mтеор – масса вещества, которая должна была выделиться в соответствии с законом Фарадея.
На процесс электролиза существенно влияет плотность тока, то есть сила тока, приходящаяся на единицу рабочей поверхности электрода.
Рассмотрим процессы, протекающие на катоде и аноде. Если электролиз идет в расплаве соли, то на катоде выделяется металл, а на аноде газ аниона.
Например, электролиз расплава хлорида натрия приводит к восстановлению ионов Na + до металлического натрия на катоде (отрицательном электроде)
и окислению хлорид ионов Cl – до газообразного хлора на аноде (положительном электроде)
Если электролиз идет в растворе соли, то помимо катиона металла и аниона в растворе находятся ионы H + и OH + :
При наличии нескольких видов ионов или недиссоциированных молекул электрохимически активных веществ возможно протекание нескольких электродных реакций. На катоде, прежде всего, протекает реакция с наиболее положительным потенциалом. Поэтому при катодном восстановлении возможно три случая:
Катионы металлов, стоящие в ряду напряжения от Li + до Al 3+ включительно не восстанавливаются на катоде, вместо них выделяется водород:
Катионы металлов, находящиеся в ряду напряжения от Al 3+ до H + (включительно) восстанавливаются одновременно с молекулами воды, что связано с более высокой поляризацией (перенапряжением) при выделении водорода, чем поляризацией (перенапряжением) разряда многих металлов:
Катионы металлов, стоящие в ряду напряжения после водорода полностью восстанавливаются на катоде:
На аноде в первую очередь реагируют наиболее сильные восстановители – вещества, имеющие наиболее отрицательные потенциалы.
На нерастворимом аноде (уголь, графит, платина, иридий) анионы кислородсодержащих кислот не окисляются, а окисляется вода с образованием кислорода:
Анионы бескислородных кислот (Cl - , I - , Br - , S 2- и т.д.) окисляются до простых веществ (Cl2, I2, Br2, S и т. д.) при высокой плотности тока. При малой плотности тока выделяется только кислород, а при выравнивании потенциала и протекают обе реакции.
На растворимом аноде идет процесс растворения самого анода, например, Сu +- 2e ® Cu 2+ .
Электролиз применяют в:
1) металлургии для получения меди, цинка, кобальта, марганца и других металлов;

2) в химической промышленности электролизом получают газообразный хлор, водород, кислород, щелочи, окислители (пероксид водорода, перманганат калия, хлораты и другие);
3) получение гальванопокрытий: никелирование, меднение, цинкование, хромирование;
4) электрохимическая анодная обработка металлов и сплавов для придания изделиям определенной формы.
Электролизом называют процессы, протекающие на электродах под действием электрического тока, подаваемого от внешнего источника тока через электролиты.
При электролизе на электродах непрерывно протекают окислительно-восстановительные реакции. На катоде (К(-)) происходит процесс восстановления, на аноде (А(+)) – процесс окисления. Продукты этих реакций или откладываются на электродах, или вступают во вторичные реакции (взаимодействуют между собой, с молекулами растворителя или с веществом электрода), или накапливаются в растворе у электродов. Течение первичных анодных и катодных реакций подчиняется законам Фарадея.
Первый закон Фарадея: масса вещества m, выделяемая на электроде электрическим током, пропорциональная количеству электричества Q, прошедшему через электролит:
m = kQ, но Q =It (9.16)
где I – сила тока, А; t – время пропускание тока, с.
k – коэффициент пропорциональности, равный количеству вещества, выделяемого при прохождении одного кулона (Кл) электричества (электрохимический эквивалент).
Второй закон Фарадея: массы различных веществ, выделенных одним и тем же количеством электричества, пропорциональных их химическим эквивалентам (Мэ):
Для выделения 1 грамма эквивалента вещества требуется пропустить через электролит одно и тоже количество электричества, равное приблизительно 96500 Кл (число Фарадея). Следовательно:
Подставив последнее уравнение в (9.17), получим формулу, объединяющую оба закона Фарадея.
Соотношение (9.18) используют в расчетах процессов при электролизе. При практическом проведении электролиза всегда некоторая часть электрической энергии затрачивается на побочные процессы. Важной характеристикой рентабельности установки для проведения электролиза (электролизера) является выход по току (h, %):
где mпр – масса фактически выделенного вещества; mтеор – масса вещества, которая должна была выделиться в соответствии с законом Фарадея.
На процесс электролиза существенно влияет плотность тока, то есть сила тока, приходящаяся на единицу рабочей поверхности электрода.
Рассмотрим процессы, протекающие на катоде и аноде. Если электролиз идет в расплаве соли, то на катоде выделяется металл, а на аноде газ аниона.
Например, электролиз расплава хлорида натрия приводит к восстановлению ионов Na + до металлического натрия на катоде (отрицательном электроде)
и окислению хлорид ионов Cl – до газообразного хлора на аноде (положительном электроде)
Если электролиз идет в растворе соли, то помимо катиона металла и аниона в растворе находятся ионы H + и OH + :
При наличии нескольких видов ионов или недиссоциированных молекул электрохимически активных веществ возможно протекание нескольких электродных реакций. На катоде, прежде всего, протекает реакция с наиболее положительным потенциалом. Поэтому при катодном восстановлении возможно три случая:
Катионы металлов, стоящие в ряду напряжения от Li + до Al 3+ включительно не восстанавливаются на катоде, вместо них выделяется водород:
Катионы металлов, находящиеся в ряду напряжения от Al 3+ до H + (включительно) восстанавливаются одновременно с молекулами воды, что связано с более высокой поляризацией (перенапряжением) при выделении водорода, чем поляризацией (перенапряжением) разряда многих металлов:
Катионы металлов, стоящие в ряду напряжения после водорода полностью восстанавливаются на катоде:
На аноде в первую очередь реагируют наиболее сильные восстановители – вещества, имеющие наиболее отрицательные потенциалы.
На нерастворимом аноде (уголь, графит, платина, иридий) анионы кислородсодержащих кислот не окисляются, а окисляется вода с образованием кислорода:
Анионы бескислородных кислот (Cl - , I - , Br - , S 2- и т.д.) окисляются до простых веществ (Cl2, I2, Br2, S и т. д.) при высокой плотности тока. При малой плотности тока выделяется только кислород, а при выравнивании потенциала и протекают обе реакции.
На растворимом аноде идет процесс растворения самого анода, например, Сu +- 2e ® Cu 2+ .
Электролиз применяют в:
1) металлургии для получения меди, цинка, кобальта, марганца и других металлов;
2) в химической промышленности электролизом получают газообразный хлор, водород, кислород, щелочи, окислители (пероксид водорода, перманганат калия, хлораты и другие);
3) получение гальванопокрытий: никелирование, меднение, цинкование, хромирование;
4) электрохимическая анодная обработка металлов и сплавов для придания изделиям определенной формы.

В 1836 году Майкл Фарадей опубликовал выведенные математически количественные характеристики электролиза. Обнаруженные взаимосвязи между количеством прошедшего через электролит электричества и количеством выделившегося при этом вещества впоследствии были названы законами Фарадея для электролиза.
Первый закон
Если пропускать через раствор медного купороса электрический ток в течение определённого количества времени, то на катоде выделяется небольшое количество меди. Однако если пустить ток большей силы, за такое же количество времени на катоде образуется большее количество меди. При увеличении времени и одинаковой силе тока также увеличивается количество меди.

Рис. 1. Майкл Фарадей.
Фарадей установил взаимосвязь массы вещества, силы тока и времени. Математически эта взаимосвязь выражается следующим образом:
- m – масса вещества;
- k – электрохимический эквивалент;
- I – сила тока;
- t – время.
Электрохимический эквивалент – это масса вещества, образованная при прохождении через электролит тока в 1 А за одну секунду. Выражается как соотношение массы вещества к количеству электричества или г/Кл.
Произведение силы тока и времени выражает количество электричества: q = It. Это электрический заряд, измеряемый в кулонах (один ампер к одной секунде). Электрический заряд отражает способность тела быть источником электромагнитного поля и принимать участие в электромагнитном взаимодействии.
Соответственно, уравнение Фарадея приобретает вид:

Рис. 2. Первый закон Фарадея.
Первый закон электролиза Фарадея: масса вещества, выделившегося при электролизе, прямо пропорциональна количеству электрического тока, пропущенного через электролит.
Второй закон
Фарадей, пропуская электрический ток одинаковой силы через различные электролиты, заметил, что массы веществ на электродах неодинаковы. Взвесив выделившиеся вещества, Фарадей сделал вывод, что вес зависит от химической природы вещества. Например, на каждый грамм выделенного водорода приходилось 107,9 г серебра, 31,8 г меди, 29,35 г никеля.
На основе полученных данных Фарадей вывел второй закон электролиза: для определённого количества электричества масса химического элемента, образовавшегося на электроде, прямо пропорциональна эквивалентной массе элемента. Она равна массе одного эквивалента – количеству вещества, реагирующему или замещающему 1 моль атомов водорода в химических реакциях:
- μ – молярная масса вещества;
- z – число электронов на один ион (валентное число ионов).
Для выделения одного моля эквивалента затрачивается одинаковое количество электричества – 96485 Кл/моль. Это число называется числом Фарадея и обозначается буквой F.
Согласно второму закону, электрохимический эквивалент прямо пропорционален эквивалентной массе вещества:

Рис. 3. Второй закон Фарадея.
Два закона Фарадея можно привести к общей формуле: m = (q / F) ∙ (μ/z).
Что мы узнали?
Фарадей, проводя реакцию электролиза разных веществ, вывел два закона. Согласно первому закону, масса вещества, осевшего на электрод, прямо пропорциональная количеству электричества, пропущенного через электролит: m = kq. Второй закон отражает взаимосвязь электрохимического эквивалента и эквивалентной массы вещества: k = (1/F) μeq. Электрохимический эквивалент – количество выделившегося вещества при прохождении единицы электричества. Эквивалентная масса – количество вещества, реагирующее с 1 молем водорода.
В результате исследований Майкла Фарадея были открыты основополагающие законы электролиза. Этот процесс активно используется в современной технике и промышленности. Законы электролиза Фарадея позволяют рассчитать условия протекания процесса и его количественные показатели.

Что такое электролиз
Ток, как известно, представляет собой упорядоченное движение зарядов. Он может протекать не только по проводам, но и через другие вещества. Для этого необходимо, чтобы вещество имело носители зарядов.
В качестве проводника может выступать жидкость, в которой происходят окислительно-восстановительные реакции. В ней имеется большое количество ионов. При пропускании через такой раствор электрического тока происходит оседание вещества на электродах. На практике этим можно воспользоваться, например, для получения металлов с высокой степенью чистоты.

При электролизе на катоде будет проходить процесс восстановления, а на аноде — окисления. Продукты реакций иногда откладываются на электродах, а в некоторых случаях продолжают вступать во вторичные реакции.
Если раствор содержит соли металлов, то последний будет откладываться на катоде, а на аноде образуется газ. Это можно продемонстрировать на электролизе поваренной соли (NaCl). Чистый натрий будет оседать на катоде, а хлор — на аноде.

Растворы веществ, обеспечивающих высокое содержание ионов в жидкости, называются электролитами. Этот термин ввёл в употребление Фарадей. Согласно его определению, речь идёт о тех жидкостях, способных пропускать электроток.
Протекание электролитических реакций возможно при выполнении следующих условий:
- В электролите не должно быть пространственной электрической однородности. В нем должна присутствовать объёмная неравномерность по уровню потенциала. Как пример можно привести ситуацию, когда в аккумуляторах происходит выработка электрического тока. Под его воздействием происходит неравномерное объёмное распределение зарядов в электролитах. Электроток обязательно должен быть постоянным.
- Чтобы можно было говорить о прохождении тока, в растворе должны присутствовать носители электрозарядов. При этом важно, чтобы они могли свободно перемещаться под действием приложенного к ним электрического поля.
На практике к электролитам относят растворимые соли, а также кислоты и щёлочи. При прохождении электротока через металлический проводник в качестве носителей заряда выступают только электроны. В электролитах присутствует ещё одна их разновидность — ионы.

Обычно атомы водорода или металлов теряют электроны и становятся положительными ионами. Отрицательно заряженные ионы —это гидроксильные группы или кислотные молекулярные остатки. При воздействии электрополя на раствор ионы с отрицательным зарядом начинают притягиваться к аноду, а с положительным — к катоду. Электрический ток в жидкостях практически представляет собой одновременное перемещение носителей заряда противоположных знаков.
В результате отрицательные ионы отдают лишние электроны положительному электроду. Соответственно, положительные ионы восполняют недостающие электроны за счёт частиц, которые получают у отрицательного электрода. После восстановления электрической нейтральности эти вещества выделяются из раствора, осаждаясь или выделяясь в виде газа.
Здесь рассмотрена ситуация, когда происходит только одна электролитическая реакция. На практике получившиеся вещества могут участвовать в других реакциях. В результате процесс электролиза становится более сложным. Таких реакций может быть 2, 3 или больше.

Законы Фарадея об электролизе
Процессы электролиза подчиняются законам Фарадея. Он обнародовал свои изыскания в 1833 году, основываясь на собственноручно проделанных опытах.
Первый закон
Первый закон электролиза Фарадея рассматривает массу вещества, которое задержалось на электродах в результате химической реакции при пропускании электротока за определённое время.
Формулировка первого закона Фарадея имеет следующий вид: если взвесить вещество, образовавшееся на электродах в результате пропускания через раствор электротока, то его вес будет пропорционален заряду, прошедшему через этот раствор.

Формула содержит коэффициент пропорциональности k. Он является постоянным для определённого вещества. Его величина равна весу вновь образованного материала при прохождении заряда в 1 Кулон. Коэффициент носит название электрохимического эквивалента.
Уравнение представлено в двух вариантах — с учётом заряда или силы тока. В последнем случае закон Фарадея для электролиза формулируется следующим образом: количество вещества, выделенного на электродах за определённое время, пропорционально силе электротока, протекающего в жидкости.
Закономерность, которую выражает первый закон Фарадея, можно продемонстрировать с помощью опыта. Для этого нужно через раствор медного купороса пропустить электрический ток. Следует сравнить две ситуации, когда пропускается электроток различной силы. При более слабом количество меди, выделившейся на электроде, будет меньше.
Второй закон
Второй закон Фарадея тесно связан с первым. Он гласит следующее: масса, полученного при помощи электролиза вещества, пропорциональна его химическому эквиваленту.
К такому выводу Фарадей пришел, пропуская один и тот же электрический ток в жидкостях различного состава. Взвешивая каждый раз полученный металл, он увидел, что результат получается различным. Ученый понял, что результат зависит от химического состава вещества. Поэтому в законе используется понятие химического эквивалента. Он выражается отношением молярной массы вещества к валентности.

Фарадей провёл дополнительные эксперименты и выяснил, что получить один моль вещества можно, если на электролитическую реакцию затратить 96485 Кулонов. Это число называют постоянной Фарадея и обозначают буквой F.
Исходя из этого, можно записать выражение для определения электрохимического эквивалента:
Следовательно, зная химическую формулу вещества и массу, которую необходимо получить, можно вычислить, какой заряд необходимо в этом случае потратить.
Объединённый закон
Для определения количественных показателей электрохимических реакций на практике используется объединённый закон Фарадея.

Обобщенный закон можно представить в виде такой формулировки: отношение массы полученного вещества к его химическому эквиваленту равно отношению использованного заряда к тому, который надо потратить на извлечение одного моля вещества.
Практическое применение
Электролиз и поясняющие его законы Фарадея, имеют широкое практическое применение. Впервые в истории это явление использовал русский физик Якоби. Он создал оттиски фигур для оформления Исаакиевского собора в Санкт-Петербурге, применив метод, который носит название гальванопластики. Данный метод позволяет получать качественные копии металлических фигур.

Ещё одно направление использования электролиза в химии — получение металлов высокой степени чистоты. В частности, таким образом можно добывать магний, алюминий, натрий и кальций. Обычно электролизу подвергается расплав руды.
Применяя такую технологию, как гальваностегия можно покрывать металлическую деталь тонкой и равномерной оболочкой определённого вещества. Данным способом создают защитные покрытия.
С помощью электролиза можно проводить очищение металлов от примесей, повышая их степень чистоты. Также можно получать концентрированные щёлочи и кислоты.

Электролиз приносит пользу не только за счет того, что на электроде оседает вещество, но и за счет того, что на аноде выделяется газ. Такой технологический процесс позволяет получать, например, водород.
Электрохимия нашла своё применение и при очистке сточных вод. При помощи химического разложения загрязнения выводятся из жидкости, делая её пригодной для повторного использования.
Электрический ток, проходящий через растворы электролитов, способствует разложению веществ и дает возможность получать химически чистые материалы. Данный процесс получил наименование электролиза, нашедшего широкое применение в промышленном производстве. Физические преобразования проводников, находящихся в жидкости, объясняет закон Фарадея для электролиза, на основании которого анод выполняет функцию положительного электрода, а катод – отрицательного. С помощью него осуществляется очистка металлов от примесей и выполняется нанесение тонких покрытий, защищающих металлические поверхности.
Суть процесса электролиза
Электролизом называются процессы окислительно-восстановительных реакций, протекающие под принудительным воздействием электрического тока. Для его выполнения используется специальная емкость с электролитическим раствором, куда погружаются металлические штыри, соединенные с наружным источником питания.
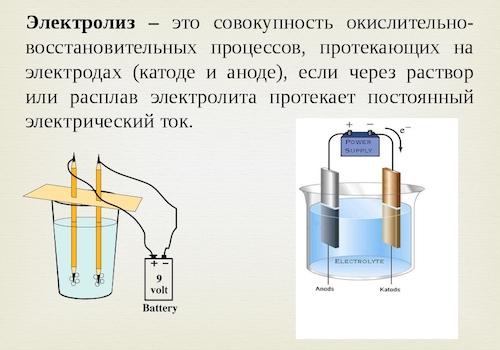
Электрод, соединенный с полюсом отрицательного значения источника тока, считается катодом. Именно в данном месте частицы электролита восстанавливаются. Другой электрод подключается к плюсовому полюсу и носит название анода. На этом участке вещество электрода или частицы электролита окисляются. Химические реакции на этом участке происходят по-разному, в зависимости от материала анода и состава электролитического раствора. Поэтому, как утверждает химия, электроды по отношению к электролиту могут быть инертными или растворимыми.
К категории инертных относятся аноды, изготовленные из материала, не окисляющегося во время электролиза. В качестве примера можно привести графитовые или платиновые электроды. Растворимыми являются практически все остальные виды металлических анодов, подверженных окислению в ходе электролитической реакции.
Электролитами чаще всего служат различные виды растворов или расплавов, внутри которых происходит хаотичное движение заряженных частиц – ионов. Когда на них воздействует электрический ток, они начинают двигаться в определенном направлении: катионы – к катоду, анионы – к аноду. Попадая на электроды, они теряют свои заряды и оседают на них.

Таким образом, на катоде и аноде происходит накопление так называемых суммарных продуктов, состоящих из электрически нейтральных веществ. Весь процесс электролиза выполняется под напряжением, подаваемым на электроды. Данное напряжение Uэл-за является типичным примером разности потенциалов, требующейся для обеспечения нормального течения электролитических реакций. Чисто теоретически это напряжение принимает вид формулы: Uэл-за = Еа – Ек, в которой Еа и Ек являются потенциалами химических реакций, происходящих на аноде и катоде.
Существует определенная связь между количеством электричества, протекавшего через раствор, и количеством вещества, выделенного в период электролитической реакции. Данное явление было описано английским физиком Фарадеем и оформлено в виде двух законов.
Первый закон Фарадея
Данный закон был выведен ученым экспериментальным путем. Он определяет пропорциональную зависимость между массой вещества, образующегося на электроде и зарядом, проходящим через электролитический раствор.
Эту пропорцию наглядно отображает формула m=k х Q=k х I х t, где k является коэффициентом пропорциональности или электрохимическим эквивалентом, Q – заряд, прошедший через электролит, t – время прохождения заряда, m – масса вещества, образовавшегося на электроде в результате реакции.

Первый закон Фарадея служит для определения количества первичных продуктов, образовавшихся в процессе электролиза на электродах. Масса этого вещества составляет суммарную массу всех ионов, попавших на электрод. Это подтверждается формулой m=m0 х N = m0 х Qq0 = m0q0 х I х t, в которой m0 и q0 соответственно являются массой и зарядом единичного иона. N=Qq0 – определяет количество ионов, попавших на электрод за время прохождения заряда Q через раствор электролита.
Следовательно, величина электрохимического эквивалента k представляет собой соотношение массы иона m0 используемого вещества и заряда q0 этого иона. Известно, что величина заряда иона составляет произведение валентности n этого вещества и элементарного заряда е, то есть, q0 = n х e. Исходя из этого, электрохимический эквивалент k будет выглядеть следующим образом: k = m0q0 = m0 х NAn х e х NA = 1F х μn. В этой формуле NA является постоянной Авогадро, μ – молярной массой данного вещества. F = e х NA является постоянной Фарадея и составляет 96485 Кл/моль.
Числовое значение данной величины равняется заряду, который должен быть пропущен через раствор электролита, для того чтобы на электроде выделился 1 моль вещества с одинаковой валентностью. Рассматриваемый закон Фарадея для электролиза примет вид еще одной формулы: m = 1F х μn х I х t.
Читайте также:
- Эволюция службы управления персоналом зарубежный и российский опыт кратко
- Психологические особенности обучения иностранному языку в средней школе
- Австралоидная раса характеристика кратко
- Должностная инструкция администратора в школе 2020
- Принцип диалогичности социального воспитания в школьном классе

