Проблема нижней границы периодической системы кратко
Обновлено: 03.07.2024
Ю. Ц. Оганесян. Здесь и далее фото из фотоархива Объединенного института ядерных исследований
— Юрий Цолакович, почему юбилей открытия периодического закона так важен для всего мира? И что он означает для Вас, для Ваших коллег: это — праздник, подтверждение высокой роли естественно-научного сообщества? Мемориальный год (как его часто называют в печати) поможет решить перспективные научные задачи?
Все это свидетельство того, что темой Международного года стало явление неординарное. Мы и сегодня ищем ответы на вопросы, которые перед нами ставит Периодическая таблица химических элементов.
— Прежде чем дальше вести нашу беседу, позвольте мне ознакомить читателей журнала с общим положением дел в области, которую мы будем обсуждать.
Из планетарной модели атома Э. Резерфорда (1911) мы знаем, что атом состоит из плотного ядра (в котором сосредоточена практически вся его масса и весь его положительный заряд) и электронов, двигающихся вокруг ядра на большом расстоянии. Ядро, в свою очередь, состоит из протонов и нейтронов, близко расположенных друг к другу. Их связь возникает под действием короткодействующих ядерных сил, нам пока неизвестных. Строгой теории сильных взаимодействий нет. Поэтому описание ядерной материи базируется на различных теоретических моделях. Их области применения ограниченны, и предсказания могут сильно отличаться друг от друга.
Наоборот, электромагнитные силы, хотя и в сотни раз слабее ядерных, дальнодействующие, нам хорошо известны. Поэтому описание движения электронов вокруг зарядового центра (ядра атома) базируется на строгой теории — квантовой электродинамике. Свое начало эта наука берет еще от модели атома Н. Бора (1913), уравнения движения электрона в электрическом поле П. Дирака (1925), последующих работ Д. Хартри, В. А. Фока и др. В рамках квантовой электродинамики таблицу Менделеева можно рассчитать в детальных подробностях, что делалось неоднократно в так называемом нерелятивистском приближении, вплоть до элемента с атомным номером 172.
Поэтому ответ на вопросы, сколько может быть элементов в Периодической таблице и как определяются ее границы, мы должны дать с двух позиций — ядерной физики и атомной физики. Попытаемся это сделать.
В первом случае мы скажем: атом (элемент) есть, пока существует ядро с периодом полураспада не менее 10 −14 с (время, необходимое для того, чтобы вокруг ядра образовалась соответствующая электронная структура атома). Во втором формулируем так: атом (элемент) существует до тех пор, пока никакие дополнительные (ранее неучтенные) эффекты не изменят предсказаний квантовой электродинамики.
Карта изотопов с островом стабильности в правом верхнем углу
В атомных (химических) свойствах сверхтяжелых элементов тоже сюрпризы.
С увеличением атомного номера элемента растет электрическое поле ядра, в котором двигаются электроны. По мере приближения их скорости к скорости света, согласно теории относительности, растет релятивистская масса электрона. Это в первую очередь относится к электронам на внутренних орбитах, ближайших к ядру, двигающихся с максимальной скоростью. Релятивистский эффект приводит к сжатию внутренних орбит (релятивистское сжатие). Эффект должен быть учтен в расчете структуры сверхтяжелого атома, что не было сделано в упомянутых выше нерелятивистских расчетах.
Есть основания полагать, что при дальнейшем увеличении атомного номера уже для элементов 121–123 групповые отличия почти исчезнут. По сути, исчезнет периодичность в изменении химических свойств элементов. На смену старой Периодической таблице придет новая, сильно измененная в начале восьмого периода. Выступая на торжественном открытии Международного года Периодической таблицы химических элементов 29 января 2019 г. в штаб-квартире ЮНЕСКО, я говорил о том, что, по-видимому, мы в своих исследованиях уже сегодня близко подошли к границе, за которой исчезают групповые различия химических элементов.
Как увидеть это в эксперименте, когда атомы живут всего доли миллисекунд? Как получить эти атомы в минимально необходимом количестве? Наконец, можно ли отойти назад и в исследованиях химических свойств уже синтезированных сверхтяжелых элементов увидеть границы применимости периодического закона?
Вы видите, что после открытия сверхтяжелых элементов в нашу действительность, как из ящика Пандоры, выплеснулось много проблем. Некоторые из них пока просто не имеют решения.
— Что это означает и к чему следует готовиться специалистам?
— Кажется, что дело сделано.
— Нет, показана лишь выполнимость необходимого первого условия. Теперь надо эти ядра получить в эксперименте. И тут мы быстро пришли к заключению, что наши средства, которые сыграли решающую роль в синтезе сверхтяжелых элементов (многие из них были лучшими в мировой практике) совершенно непригодны, чтобы двигаться вперед. На новом этапе исследований необходимо существенно поднять чувствительность эксперимента, улучшить аппаратуру, иметь значительно более мощные ускорители, более совершенные методики, освоить новые технологии. Нужно как бы уйти из прошлого и перейти в здание будущего. И совершить переход по возможности быстро. Мы пошли этим путем.
С 2012 г. Объединенный институт ядерных исследований в Дубне начал строить новый ускорительный комплекс, по существу новую лабораторию — Фабрику сверхтяжелых элементов. Мы поставили задачу увеличить чувствительность опытов в десятки, а со временем, быть может, в 100 раз. Принять такое решение было нелегко, слишком много нового нужно было делать одновременно, но другого выхода не было.
Прошло семь лет, и 26 декабря 2018 г. в 10 утра новый ускоритель (циклотрон ДЦ-280) в соответствии с графиком сооружения этой установки дал первый пучок ускоренных тяжелых ионов. Для наших конструкторов, инженеров и техников это большой этап проделанной работы, свидетельствующий о том, что все узлы нового изделия работают, как задумано. У руководства института тоже есть чувство завершенности: все вложенные средства правильно и быстро реализованы.
Ускоритель ДЦ-280 — базовая установка Фабрики сверхтяжелых элементов
— Можно задать Вам наивный вопрос: зачем нужно дальше заполнять Периодическую таблицу Менделеева? Какое значение для науки имеет эта работа?
— В конечном счете мы проверяем и тем самым изучаем закон природы, открытый Д. И. Менделеевым 150 лет назад. Заполнять Периодическую таблицу очень важно, потому что мы уже чувствуем, что подошли близко к моменту, когда этот закон начинает меняться, причем меняться быстро. И, несмотря на то что продвижение к все более тяжелым элементам требует огромных усилий, познание любых изменений законов природы — например, периодичности свойств химических элементов — носит фундаментальный характер. Как уже говорилось, с ростом атомного номера элемента релятивистский эффект быстро растет. Еще быстрее меняется электронная структура сверхтяжелого атома и энергия связи его последнего электрона, ответственного за химические свойства элемента. Мы же должны исследовать этот эффект экспериментально. А для того чтобы добраться до этих атомов, надо, как говорится, еще пуд соли съесть. Надо получать в десятки и сотни раз больше атомов, чем мы имели в последние годы. Время существования тяжеловесов в лучшем случае — доли секунды. Как определить химические свойства этих атомов за доли секунды? Да, химические реакции идут значительно быстрее, но нужно придумать, как управляться в эти мгновения. Пока не знаем, но будем, определенно, этим заниматься.
— Ученые, работающие в вашем исследовательском коллективе — выпускники российских вузов?
— Конечно, большинство наших сотрудников пришли в институт после окончания вузов Москвы, Санкт-Петербурга, Воронежа, Саратова, Твери, Томска, Дальнего Востока. Но мы, Объединенный институт ядерных исследований (ОИЯИ), — международный научный центр 18 стран-участниц. Среди них многие бывшие республики Советского Союза, страны Восточной Европы, Азии (Монголия, Вьетнам), Куба. У института широкое научное сотрудничество и с исследователями Швейцарии, Германии, Италии, Франции, Израиля, США и др. С американскими учеными мы взаимодействуем наиболее плотно уже более 25 лет. Они готовят для наших совместных экспериментов мишенный материал на ядерном реакторе в Национальной лаборатории Ок-Риджа.
— Почему так трудно произвести элементы, живущие от микросекунды до нескольких секунд, и идентифицировать их химические свойства? Были ли на протяжении Вашей работы кризисные моменты, когда казалось, что исследования зашли в тупик?
Г. Н. Флёров и Ю. Ц. Оганесян. Конец 1980-х годов
— Как Вам удалось найти оригинальный метод синтеза сверхтяжелых элементов, позволивший обогнать лаборатории ядерных исследований Японии, США?
— Мы действительно использовали новый подход и не делали из этого секрета. Однако и прежний метод синтеза, так называемое холодное слияние ядер, тоже родился в стенах нашей лаборатории в 1974 г. Спустя несколько лет после первых экспериментов нам стало понятно, что к получению долгоживущих сверхтяжелых элементов реакция холодного слияния не приведет, потому что во взаимодействующих ядрах не хватает нейтронов. А для того чтобы получить даже весьма скромный избыток нейтронов, нужно существенно усложнить эксперимент: использовать в качестве мишенного материала не свинец или висмут, как ранее, а нейтронно-избыточные изотопы искусственных элементов, такие как: плутоний-244 ( 244 Pu) или кюрий-248 ( 248 Cm). А в качестве бомбардирующего снаряда надо выбрать уникальное вещество — очень редкий и дорогой кальций-48 ( 48 Ca) ** (содержит 20 протонов и 28 нейтронов): в естественной смеси изотопов кальция его в 500 раз меньше основного изотопа — кальция-40 ( 40 Ca). Затем необходимо ускорить ионы 48 Ca до скорости, равной примерно 0,1 скорости света, в расчете на редкий процесс слияния ядер — 244 Pu + 48 Ca, — ведущего к образованию 114-го элемента.
На Фабрике сверхтяжелых элементов мы не планируем проводить много экспериментов; их будет несколько в год, но более длительных и емких, чем прежние. Наверное, через 15–20 лет наши нововведения вновь устареют, но при трех-четырех экспериментах в год можно будет накопить данные, которые позволят понять структуру и свойства тяжелейших элементов и, конечно, существенно расширят наши знания о границах Таблицы элементов.
Ю. Ц. Оганесян на пресс-конференции, посвященной присвоению названий новым элементам Периодической системы элементов Д. И. Менделеева, в лаборатории ядерных реакций имени Г. Н. Флёрова. 12 декабря 2016 г.
— Таким образом, Вы отводите 20 лет для того, чтобы разобраться с вопросами, которые сегодня поставила Периодическая таблица?
— Можно ли предположить, что где-то в природе (может быть, в космосе) реализуются естественные условия синтеза сверхтяжелых элементов?
— Серьезная проблема, и астрофизики занимаются этим делом основательно. Могут ли сверхтяжелые элементы образоваться в природном синтезе (нуклеосинтезе) подобно всем тяжелым элементам, вплоть до урана? Тот факт, что в космических лучах не обнаружены ядра тяжелее урана, теоретически объясним более коротким временем их жизни по сравнению со временем пролета от источника к детектору. С другой стороны, всегда остается вопрос: способен ли нуклеосинтез во вспышке сверхновой дотянуться до столь тяжелых ядер? А если да, то смогут ли эти элементы выжить в процессе последовательных бета-распадов и лечь на линию бета-стабильности? Я не хочу вводить читателя в частные проблемы, достаточно почувствовать, что процесс определяется многими условиями. Хотел бы только обратить внимание на то, что искусственный синтез элементов далек от того, как он происходит в природе. Мы в лаборатории не в состоянии создать условия вспышки сверхновой, с большими плотностями потока нейтронов, сверхвысокими температурами, с вовлечением огромного количества вещества. Поэтому сталкиваем уже приготовленные природой или наработанные в ядерном реакторе долгоживущие нуклиды, преследуя цель уловить редкий процесс слияния ядер с образованием составного ядра суммарной массы, его быстрое охлаждение не без потерь (выживание) и затем наблюдать его самопроизвольный распад.
Результаты, более-менее близкие к природному синтезу, реализуются в малом объеме подземного ядерного взрыва, когда исходным веществом для последующего синтеза более тяжелых элементов служит уран или плутоний. За очень короткий промежуток времени, менее 1 мкс, в цепной реакции возникает поток нейтронов высокой плотности, в котором исходные ядра могут захватить до 20 нейтронов. В последующих после взрыва бета-распадах образуются трансурановые элементы вплоть до 100-го элемента — фермия. Так были впервые синтезированы элементы с Z = 99 и Z = 100. Но для синтеза более тяжелых элементов этих условий явно недостаточно. Напомним, что при вспышке сверхновой синтез длится секунды и в процесс вовлечены массы вещества, превышающие массу Солнца.
— Некоторые ученые допускают, что при столкновении черных дыр могут извергаться короткоживущие ядра, которые при распаде образовали бы ядра тяжелее железа. Согласны ли Вы с этим предположением?
— Как бы Вы ответили: какую роль Периодическая таблица играет в Вашей научной работе?
— Я пришел к этой задаче из своих занятий ядерной физикой. Теперь столкнулся с проблемой электронной структуры тяжелейших атомов. Красивая наука — атомная физика, демонстрирующая удивительную гармонию. Она очень притягательна и интересна. Жалею, что не занялся этой наукой немного раньше.
* Г. Н. Флёров (1913–1990) — советский физик-ядерщик, один из отцов-основателей Объединенного института ядерных исследований в Дубне, академик АН СССР.
** Кальций-48 ( 48 Ca) — самый тяжелый изотоп кальция, испытывает двойной бета-распад с периодом полураспада (4,39 ± 0,58) 10 19 лет.
На Земле существуют только такие элементы, среднее время жизни которых приблизительно равно или превосходит возраст Земли. Самый легкий из этих элементов — водород (1Н), а самый тяжелый — уран (92U)- Однако этими элементами не ограничивается диапазон возможных химических элементов, природа гораздо богаче и разнообразнее.

В природе существует атом, который легче водорода, — позитроний (Рs) (нарисовать рисунок).
Не принимая во внимание волновой природы частиц, позитроний можно представить в виде электрона и позитрона. Позитрон - частица, по массе близкая к электрону, но имеющая положительный, а не отрицательный заряд. Позитроний — движущиеся вокруг общего центра тяжести электрон и позитрон. Позитроний состоит из электронно-позитронной оболочки и не имеет ядра. Позитроний имеет короткое время жизни: около 10 -7 —10 -10 с и исчезает (аннигилирует) с испусканием фотонов.
Позитроний является сильным восстановителем и может участвовать в химических реакциях как восстановитель. Например, он восстанавливает ионы Fе 3+ до Fе 2+
Открытие позитрония экспериментально поставило вопрос о существовании совершенно иного материального мира, построенного из антиатомов. Действительно, позитроний находится на границе между атомами — системами, состоящими из положительно заряженного ядра и отрицательно заряженных электронов, и антиатомами — системами из отрицательно заряженных ядер и положительно заряженных позитронов.
Антиатомы существуют, некоторые из них (антиатомы водорода, гелия) изучены экспериментально. Поэтому нельзя говорить о начале периодической системы, так как ее таблица может симметрично (по крайней мере, теоретически) относительно позитрония повторять в мире антиатомов структуру периодической системы Д. И. Менделеева
Проблема систематизации химических элементов привлекла к себе пристальное внимание в середине XIX в., когда стало ясно, что многообразие окружающих нас веществ является результатом разных сочетаний сравнительно малого числа химических элементов.
В хаосе элементов и их соединений великий русский химик Д.И.Менделеев первым навел порядок, создав свою периодическую таблицу элементов.
1 марта 1869 г. считается днем открытия периодического закона, когда Менделеев сообщил о нем научному сообществу. Известные в то время 63 элемента ученый разместил в своей таблице таким образом, что главные свойства этих элементов и их соединений менялись периодически по мере увеличения их атомной массы. Наблюдаемые изменения свойств элементов в горизонтальном и вертикальном направлениях таблицы следовали строгим правилам. Например, ярко выраженный у элементов Iа группы металлический (основный) характер с увеличением атомной массы убывал по горизонтали таблицы и возрастал по вертикали.
Однако ни сам Менделеев, ни его современники не могли ответить на вопрос, в чем причины периодичности свойств элементов, существует ли и где проходит граница периодической системы. Менделеев предчувствовал, что причина представленной им взаимосвязи между свойствами и атомной массой элементов кроется в сложности самих атомов.
Лишь спустя много лет после создания периодической системы химических элементов в работах Э.Резерфорда, Н.Бора и других ученых было доказано сложное строение атома. Последующие достижения атомной физики позволили решить многие неясные проблемы периодической системы химических элементов. Прежде всего оказалось, что место элемента в периодической таблице определяется не атомной массой, а зарядом ядра. Стала понятной природа периодичности химических свойств элементов и их соединений.
Атом стали рассматривать как систему, в центре которой находится положительно заряженное ядро, а вокруг него вращаются отрицательно заряженные электроны. При этом электроны группируются в околоядерном пространстве и движутся по определенным орбитам, входящим в электронные оболочки.
Все электроны атома принято обозначать с помощью чисел и букв. Согласно этому обозначению главные квантовые числа 1, 2, 3, 4, 5, 6, 7 относятся к электронным оболочкам, а буквы s, p, d, f, g – к подоболочкам (орбитам) каждой оболочки. Первая оболочка (считая от ядра) имеет только s-электроны, вторая может иметь s- и p- электроны, третья – s-, p- и d-электроны, четвертая – s-,
p-, d- и f- электроны и т.д.
Каждая оболочка может вместить вполне определенное число электронов: первая – 2, вторая – 8, третья – 18, четвертая и пятая – по 32. Этим определяется число элементов в периодах таблицы Менделеева. Химические свойства элементов обусловлены строением внешней и предвнешней электронных оболочек атомов, т.е. тем, сколько электронов они содержат.
Ядро атома состоит из положительно заряженных частиц – протонов и электрически нейтральных частиц – нейтронов, часто называемых одним словом – нуклоны. Порядковый номер элемента (его место в периодической таблице) определяется числом протонов в ядре атома данного элемента. Массовое число А атома элемента равно сумме чисел протонов Z и нейтронов N в ядре: A = Z + N. Атомы одного и того же элемента с разным числом нейтронов в ядре являются его изотопами.
Химические свойства разных изотопов одного и того же элемента не отличаются друг от друга, а ядерные – изменяются в широких пределах. Это проявляется прежде всего в стабильности (или нестабильности) изотопов, которая существенно зависит от соотношения числа протонов и нейтронов в ядре. Легкие стабильные изотопы элементов обычно характеризуются равным числом протонов и нейтронов. С ростом заряда ядра, т. е. порядкового номера элемента в таблице, это соотношение меняется. У стабильных тяжелых ядер нейтронов почти в полтора раза больше, чем протонов.
Как и атомные электроны, нуклоны также образуют оболочки. С увеличением числа частиц в ядре последовательно заполняются протонные и нейтронные оболочки. Ядра с полностью заполненными оболочками являются самыми стабильными. Например, очень устойчивой ядерной структурой характеризуется изотоп свинца Pb-208, который имеет заполненные оболочки протонов (Z = 82) и нейтронов (N = 126).
Природа сил, удерживающих в ядре протоны и нейтроны, пока недостаточно ясна. Полагают, что между нуклонами действуют очень большие гравитационные силы притяжения, которые способствуют увеличению стабильности ядер.
К середине тридцатых годов прошлого столетия периодическая таблица была разработана настолько, что показывала положение уже 92 элементов. Под порядковым номером 92 был уран – последний из найденных на Земле еще в 1789 г. естественных тяжелых элементов. Из 92 элементов таблицы только элементы с порядковыми номерами 43, 61, 85 и 87 в тридцатые годы не были точно установлены. Они были открыты и изучены позже. Редкоземельный элемент с атомным номером 61 – прометий – был обнаружен в малых количествах в рудах как продукт самопроизвольного распада урана. Анализ атомных ядер недостающих элементов показал, что все они радиоактивны, причем из-за коротких периодов их полураспада они не могут существовать на Земле в заметных концентрациях.
В связи с тем, что последним тяжелым элементом, найденным на Земле, был элемент с атомным номером 92, можно было бы предположить, что он и является естественным пределом периодической таблицы Менделеева. Однако достижения атомной физики указали путь, по которому оказалось возможным перешагнуть через поставленную природой границу периодической таблицы.
Элементы с большими атомными номерами, чем у урана, называют трансурановыми. По своему происхождению эти элементы являются искусственными (синтетическими). Их получают путем ядерных реакций трансформации элементов, встречающихся в природе.
Первую попытку, хотя не совсем удачную, открыть трансурановую область периодической системы предпринял итальянский физик Энрико Ферми в Риме вскоре после того, как было доказано существование нейтронов. Но лишь в 1940–1941 гг. успеха в открытии первых двух трансурановых элементов, а именно нептуния (атомный номер 93) и плутония (атомный номер 94), добились американские ученые из Калифорнийского университета в Беркли.
В основе методов получения трансурановых элементов лежит несколько видов ядерных реакций.
Первый вид – нейтронный синтез. В этом методе в ядрах тяжелых атомов, облученных нейтронами, происходит превращение одного из нейтронов в протон. Реакция сопровождается так называемым электронным распадом ( – -распадом) – образованием и выбросом из ядра с огромной кинетической энергией отрицательно заряженной – -частицы (электрона). Реакция возможна при избытке в ядре нейтронов.
Противоположной реакцией является превращение протона в нейтрон с испусканием положительно заряженной + -частицы (позитрона). Подобный позитронный распад ( + -распад) наблюдается при недостатке в ядрах нейтронов и ведет к уменьшению заряда ядра, т.е. к уменьшению атомного номера элемента на единицу. Аналогичный эффект достигается, когда протон превращается в нейтрон за счет захвата ближайшего орбитального электрона.
Новые трансурановые элементы вначале были получены из урана по методу нейтронного синтеза в ядерных реакторах (как продукты взрыва ядерных бомб), а позже синтезированы с помощью ускорителей частиц – циклотронов.
Реакция спонтанного, самопроизвольного деления ядер атомов радиоактивных элементов была открыта нашим соотечественником Г.Н.Флеровым и чехом К.А.Петржаком в Объединенном институте ядерных исследований (ОИЯИ, г. Дубна) в опытах с ураном-238. Увеличение порядкового номера приводит к быстрому уменьшению времени полураспада ядер атомов радиоактивных элементов.
В связи с этим фактом выдающийся американский ученый Г.Т.Сиборг, лауреат Нобелевской премии, участвовавший в открытии девяти трансурановых элементов, полагал, что открытие новых элементов, вероятно, закончится приблизительно на элементе с порядковым номером 110 (по свойствам аналогичном платине). Эта мысль о границе периодической таблицы была высказана в 60-е годы прошлого столетия с оговоркой: если не будут открыты новые методы синтеза элементов и существование пока неизвестных областей устойчивости самых тяжелых элементов. Некоторые из таких возможностей были выявлены.

В развитии теории периодической системы химических элементов большую роль сыграло сопоставление химических свойств и строения электронных оболочек лантаноидов с порядковыми номерами 58–71 и актиноидов с порядковыми номерами 90–103. Было показано, что сходство химических свойств лантаноидов и актиноидов обусловлено подобием их электронных структур. Обе группы элементов являются примером внутреннего переходного ряда с последовательным заполнением 4f- или 5f-электронных оболочек соответственно после заполнения внешних s- и р-электронных орбиталей.
Элементы с порядковыми номерами в периодической таблице 110 и выше были названы сверхтяжелыми. Продвижение к открытию этих элементов становится все более трудным и долгим, т.к. недостаточно провести синтез нового элемента, нужно его идентифицировать и доказать, что новый элемент обладает лишь ему одному присущими свойствами. Трудности вызваны тем, что для изучения свойств новых элементов доступным оказывается небольшое число атомов. Время же, в течение которого можно изучать новый элемент до того, как произойдет радиоактивный распад, обычно очень невелико. В этих случаях, даже когда получен всего один атом нового элемента, для его обнаружения и предварительного изучения некоторых характеристик используют метод радиоактивных индикаторов.
Элемент-109 – мейтнерий – это последний элемент в периодической таблице, представленной в большинстве учебников по химии. Элемент-110, принадлежащий к той же группе периодической таблицы, что и платина, был впервые синтезирован в г. Дармштадт (Германия) в 1994 г. с помощью мощного ускорителя тяжелых ионов по реакции:

Время полураспада полученного изотопа крайне мало. В августе 2003 г. 42-я Генеральная ассамблея ИЮПАК и Совет ИЮПАК (Международный союз по чистой и прикладной химии) официально утвердили название и символ элемента-110: дармштадтий, Ds.
По информации, полученной из ОИЯИ, в Лаборатории ядерных реакций им. Г.Н.Флерова осуществлен синтез элементов с порядковыми номерами 110–118 (за исключением элемента-117).
В результате синтеза по реакции:

в Дармштадте в 1996 г. получено несколько атомов нового элемента-112, распадающегося с выделением -частиц. Период полураспада этого изотопа составлял всего 240 микросекунд. Немного позже в ОИЯИ поиск новых изотопов элемента-112 провели, облучая атомы U-235 ионами Са-48.
В сентябре 2004 г. группа японских ученых из Физико-химического исследовательского института под руководством Косуки Морита (Kosuke Morita) заявила, что ими синтезирован элемент-113 по реакции:

Было также заявлено об открытии элементов с порядковыми номерами 118 и 116 в результате длительных совместных исследований ядерных реакций изотопов калифорния Cf-249 и кюрия Сm-245 c пучком тяжелых ионов Са-48, проведенных российскими и американскими учеными в период 2002–2005 гг. в ОИЯИ. Элемент-118 замыкает 7-й период таблицы Менделеева, по своим свойствам является аналогом благородного газа радона. Элемент-116 должен обладать некоторыми свойствами, общими с полонием.
По сложившейся традиции открытие новых химических элементов и их идентификация должны быть подтверждены решением ИЮПАК, но право предложить названия элементам предоставляется первооткрывателям. Подобно карте Земли, периодическая таблица отразила названия территорий, стран, городов и научных центров, где были открыты и изучены элементы и их соединения, увековечила имена знаменитых ученых, внесших большой вклад в развитие периодической системы химических элементов. И не случайно элемент-101 назван именем Д.И.Менделеева.
Эта гипотеза была опровергнута и показано, что нет ограничений для существования очень тяжелых элементов с точки зрения представлений о строении электронных оболочек. Ограничения возникают в результате неустойчивости самих ядер.
Однако надо сказать, что время жизни элементов уменьшается нерегулярно с ростом атомного номера. Следующая ожидаемая область устойчивости сверхтяжелых элементов, обусловленная появлением замкнутых нейтронных или протонных оболочек ядра, должна лежать в окрестности дважды магического ядра с 164 протонами и 308 нейтронами. Возможности открытия таких элементов пока не ясны.

1.1. Первые биологические классификации основывались на несущественных признаках, например, на способах передвижения: летают - птицы; бегают- звери; ползают - гады; плавают - рыбы; не двигаются - растения.
Такая классификация была искусственной, хотя и давала в целом правильное представление о биологических объектax. Правда, были и исключения: кит - это не рыба, летучая мышь - не птица, губки и кораллы - не растения и т.д.
а) Почему Периодический закон, является основой естественной системы элементов?
б) Какие признаки химического элемента являются существенными?
в) Могут ли быть построены принципиально иные естественные системы элементов?
г) Существуют ли ограничения (если существуют - то какие) на число и тип существенных признаков химического элемента?
д) Какие известны Вам подходы к систематике химических соединений? На основе каких параметров строились эти системы?
Почему таблица Лавуазье, будучи выдающимся обобщением химических знаний эпохи флогистона, тем не менее не является законом природы?
Постройте график Шанкуртуа.
Простые вещества, принадлежащие к трём стихиям, которые можно рассматривать как элементы тел.
Огненная тепловая материя
Основа жизненного воздуха
Основа газа, не поддерживающего жизнь
Основа горючего газа
*Цитируется по кн.: Фигуровский Н.А. Очерк общей истории химии. М.: Наука, 1969. С.365.
Продолжение табл. 1
Простые не металлические вещества, кислотного характера, способные к окислению.
Простые солеобразующие вещества, земли
Магнезия, горькая соль
Барит, тяжелый шпат
а) Проверьте, имеют ли место на построенном Вами графике Шанкуртуа те особенности, о которых пишет Л. А. Чугаев.
б) Приведите другие критические замечания, относящиеся к системе Шанкуртуа.
в) Можно ли усовершенствовать эту систему, устранив указанные недостатки?
г) Попытайтесь придумать свою форму Периодической системы.
Несмотря на это высказывание автора периодического закона, в дальнейшем предпринимались неоднократные попытки спирального изображения Периодической системы. Одной из последних является спиральная периодическая таблица Т. Бенфи (1960 г.) (рис.1). Её отличительная особенность состоит в том, что в ней нашли своё место как d-элементы (переходные металлы), так и f-элементы (лантаноиды и актиноиды), кроме того, оставлены места для еще неоткрытых элементов.
а) Какие достоинства таблицы Бенфи Вы може отметить?
б) Согласны ли вы с утверждением о том, что эта форма более естественно согласуется с идей развития, усложнения состав элементов, чем более распространенная короткопериодная форма Периодической систем?
в) Разрешаются ли проблемы размещения водорода, лантаноидов, актиноидов и других элементов на таком графике?
г) Внесите номера ещё не открытых элементов в пустые клетки спиральной периодической таблицы Бенфи.
1.5. Известны предложения о расширении Периодической системы за счет введения нулевого периода, состоящего из двух элементов - нейтрона и электрона. Один из аргументов в пользу этой идеи состоит в том, что все периоды в системе, кроме первого, парные: второй и третий, четвертый и пятый, шестой и седьмой. Первый период в сочетании с нулевым окажется тоже парным.
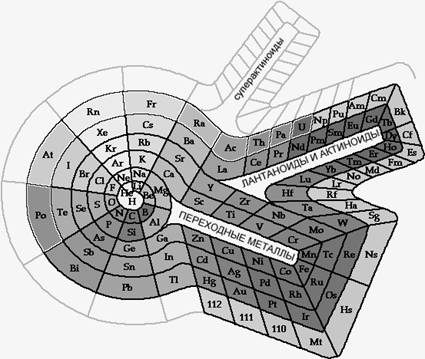
Рис. 1. Спиральная периодическая таблица (разработана проф. T. Бенфи в 1960 г.)
а) Найдите в литературе по истории химии таблицу, предложенную Л.Мейером.
б) Содержится ли в этой таблице идеи периодичности свойств химических элементов?
1.7. Водород в различных вариантах Периодической таблицы расположен в первой или седьмой группах или же, значительно реже, над углеродом в четвертой группе.
Приведите теоретические соображения, расчетные и. экспериментальные данные, как подтверждающие, так и опровергающие эти известные варианты размещения водорода.
1.8. d-элементы восьмой группы обычно классифицируют двояким образом: их либо делят на элементы семейства железа и платиновые металлы, либо делят на триады: железо - рутений - осмий; кобальт - родий - иридий; никель - палладий - платина.
Какие принципы при этом кладутся в основу того или иного варианта деления? Строго ли обосновано электронным строением атомов и высшими степенями окисления элементов размещение их в виде триад?
Автор Периодического закона не допускал даже мысли о возможности исключения из системы и выделения в отдельные подтабличные ряды (как это делается в некоторых современных таблицах) лантаноидов и актиноидов.
Проанализируйте все известные степени окисления этих элементов и попробуйте расположить их в качестве побочной подгруппы (наряду с подгруппами d-элсментов) в группы таблицы. Проанализируйте достоинства и недостатки полученной формы таблицы. А может быть, уВас есть аргументированные альтернативные варианты? Приведите их и обоснуйте как можно полнее.
1.10. Известный американский ученый Г. Сиборг, успешно работавший в области химии трансурановых элементов, предложил так называемую актиноидную гипотезу, согласно которой 5f-элементы являются аналогами трехвалентного элемента актиния.
Согласуется ли эта гипотеза с современными данными о степенях окисления актиноидов? Ответ обоснуйте, приведя как можно более полные данные о степенях окисления актиноидов, известных в настоящее время.
1.11. Одним из наиболее крупных мыслителей, увидевших в системе Менделеева принципиально новое, был англичанин Г. Мозли, вышедший из семьи талантливых натуралистов.
Судьба Мозли была трагична: он погиб молодым человеком в 1916 г. в Дарданеллах. Перед уходом на войну успел сдать в печать незаконченную работу (после его смерти друзья и сотрудники завершили ее).
Г. Мозли предложил простой способ определения порядковых номеров элементов, исходя из изучения рентгеновских спектров.
а) Сформулируйте закон Мозли и объясните, каким образом он связывает рентгеновские спектры элементов с их атомным номером.
б) На каком основании Мозли сделал вывод о существовании неизвестных в его время элементов?
Читайте также:

