Периодическая система элементов менделеева физика кратко
Обновлено: 30.06.2024
В начале XIX в. с развитием идей химической атомистики и методов химического анализа появились первые попытки систематизации элементов по их атомному весу, признанному основной количественной характеристикой элемента.
В 1817 г. И.В. Дёберейнер заметил, что атомный вес стронция приблизительно совпадает со средним значением атомных весов кальция и бария, причем свойства элементов, составляющих триаду Ca–Sr–Ba, сходны. В 1829 г. он указал и на другие триады.
В 1863 г. А. де Шанкуртуа расположил элементы в порядке возрастания их атомных весов по спирали на поверхности цилиндра, разделенного на вертикальные полосы. Элементы со сходными химическими и физическими свойствами оказывались при этом расположенными на одной вертикали.
В 1864 г. Д. Ньюлендс заметил, что если расположить элементы в порядке возрастания атомного веса, то каждый восьмой элемент, начиная от выбранного произвольно, в какой-то мере подобен первому, как восьмая нота в музыкальной октаве. Ньюлендс назвал эту закономерность законом октав. В 1865 г. он построил таблицу, в которой элементы были расположены в порядке возрастания их атомного веса.
В период 1857–1868 гг. У. Одлинг составил несколько таблиц. В таблице 1857 г. 49 элементов были размещены в 9 группах. В 1861 г. эта классификация была несколько усовершенствована: химически сходные элементы Одлинг объединил в триады, тетрады и пентады, вне этих объединений остались водород, бор и олово. Наибольший интерес представляет таблица 1868 г., в которой элементы (таблица включала 45 элементов из 62 известных в то время) расположены в порядке возрастания их атомных весов.
В 1864 г. Л. Мейер опубликовал таблицу элементов, в которой 44 элемента были расставлены в шести столбцах в соответствии с их валентностью (высшей) по водороду. Таблица состояла из двух частей. В основной таблице, объединяющей шесть групп (первая группа – углерода, вторая – азота, третья – кислорода, четвертая – галогенов, пятая – щелочных металлов, шестая – щелочно-земельных металлов), 28 элементов были расставлены в порядке возрастания их атомных весов, в ней фигурировали тетрады и пентады, во вторую (небольшую) таблицу вошли элементы, не укладывающиеся в группы первой таблицы.
В 1869 г. Д.И. Менделеев открыл периодический закон химических и физических свойств элементов в зависимости от атомной массы (рис. 8.2). Выяснилось, что если расположить все химические элементы в порядке возрастания их атомных масс, то обнаруживается сходство физико-химических свойств элементов. Через промежутки, называемые периодами, элементы, расположенные в одном вертикальном ряду – группе элементов, – обнаруживают повторяемость физических и химических свойств. Во времена Менделеева были известны 64 элемента. Расположив их в систему, Менделеев в некоторых случаях должен был отступить от принципа связи периодичности с возрастанием атомной массы (K и Ar).

При этом часть клеток периодической системы оказалась свободной, т.к. соответствующие им элементы тогда еще не были открыты. Менделееву удалось на основании своей системы предсказать существование ряда новых химических элементов (галий, скандий, германий и др.) и описать их химические свойства. В дальнейшем все эти элементы были открыты и предсказания Менделеева полностью подтвердились. Ему удалось также внести уточнения в значения атомных масс и химические свойства некоторых элементов. Так, атомные массы бериллия, титана, цезия и урана, вычисленные на основе закона Менделеева, оказались правильными, а данные о них, известные ранее, – ошибочными. Это явилось триумфом Периодической системы Менделеева. Являясь одним из важнейших законов естествознания, периодический закон Менделеева составляет основу современной химии, атомной и ядерной физики.
Физический смысл порядкового номера Z элемента периодической системы Менделеева был выяснен в ядерной модели атома Резерфорда. Порядковый номер Z элемента совпадает с числом протонов – положительных элементарных зарядов в ядре. Число их закономерно возрастает на единицу при переходе от предыдущего химического элемента к последующему. Это число совпадает с общим количеством электронов в атоме данного элемента.
Химические свойства элементов, их оптические и некоторые другие физические свойства объясняются поведением внешних электронов, называемых валентными или оптическими. Периодичность свойств химических элементов связана с периодичностью в расположении валентных электронов атома различных элементов.
Объяснение строения периодической системы элементов, теоретическое истолкование периодической системы Менделеева было дано в квантовой теории Бором в 1922 г. еще до появления квантовой механики. Последовательная теория периодической системы основывается на следующих положениях:
· общее число электронов в атоме данного химического элемента равно порядковому номеру Z этого элемента;
· состояние электрона в атоме определяется набором его четырех квантовых чисел: n, l, , ;
· распределение электронов в атоме по энергетическим состояниям должно удовлетворять принципу минимума потенциальной энергии: с возрастанием числа электронов каждый следующий электрон должен занять возможные энергетические состояния с наименьшей энергией;
· заполнение электронами энергетических уровней в атоме должно проходить в соответствии с принципом Паули.
Порядок заполнения электронами состояний в различных слоях (оболочках), а в пределах одной оболочки – в подгруппах (подоболочках) должен соответствовать последовательности расположения энергетических уровней с различными значениями квантовых чисел n и l. Сначала заполняются состояния с наименьшей возможной энергией, а затем состояния с более высокой энергией. Для многих атомов этот порядок соответствует тому, что сначала занимаются оболочки с меньшим значением n, а затем должна заниматься электронами следующая оболочка. В пределах одной оболочки сначала заполняются состояния с l = 0, а затем состояния с большим l, вплоть до l = n – 1. Система электронов, построенная на таких основах, должна иметь структуру и число элементов в одном периоде (длину периода), соответствующие табл. 2.

Ключевые слова конспекта: Периодическая система химических элементов Д.И. Менделеева, группы и периоды Периодической системы, физический смысл порядкового номера химического элемента.
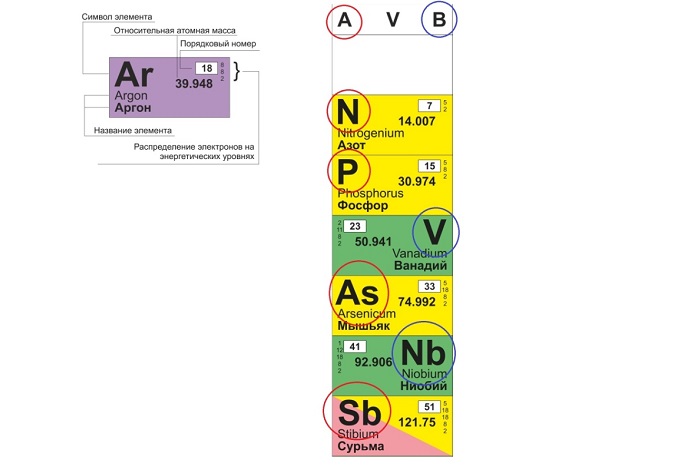
Периодическая система химических элементов — это таблица, в которой все химические элементы расположены в порядке возрастания атомных номеров. Таблица включает в себя периоды и группы, т.е. горизонтальные строчки и вертикальные столбцы.
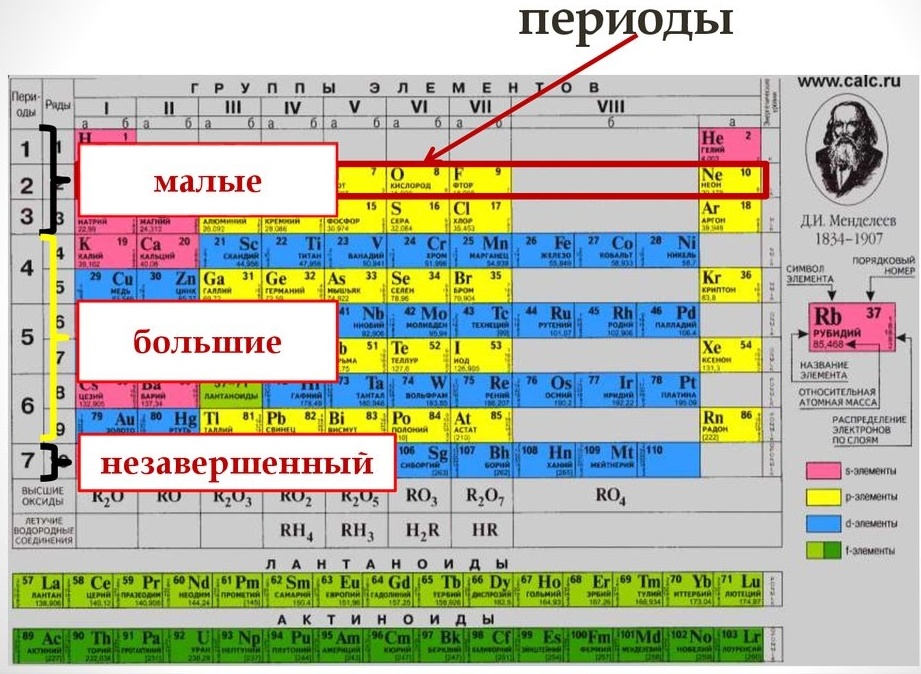
Период — это последовательность (горизонтальный ряд в таблице) элементов с возрастающими атомными номерами, начинающаяся щелочным металлом (или водородом) и заканчивающаяся благородным газом.
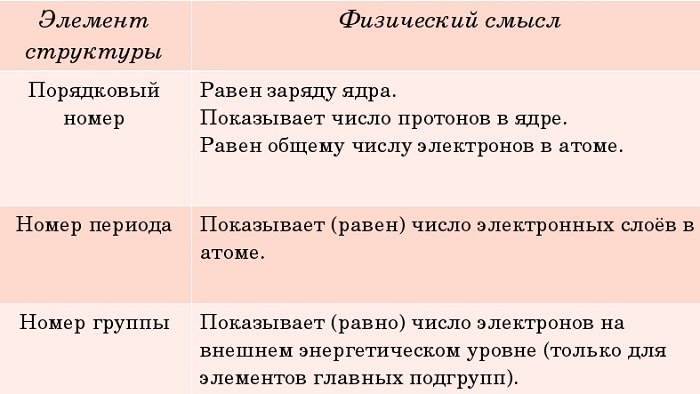
Число электронных слоев в атомах данного периода равно номеру периода.
В периодах с возрастанием атомного номера Z металлические свойства ослабевают, а неметаллические усиливаются.

Группа — это вертикальная колонка элементов в таблице, включающая элементы с одинаковой максимальной степенью окисления, равной номеру группы, и одинаковой отрицательной степенью окисления, для атомов неметаллов равной номеру группы минус 8.
В группах с возрастанием атомного номера Z металлические свойства усиливаются, а неметаллические ослабевают. Число валентных электронов атома обычно равно номеру группы.
В коротком варианте таблицы Менделеева различают малые периоды — 1-й, 2-й и 3-й, содержащие 2, 8 и 8 элементов соответственно, а также большие периоды — 4-й, 5-й, 6-й и незавершенный 7-й. Каждый большой период таблицы включает две строчки (два ряда). Например, в 4-м периоде, начинающемся калием 19K, последний элемент в верхней строчке — никель 28Ni, он в числе элементов триады (Fe, Со, Ni) попадает в VIII группу. Следующий элемент — медь 29Cu записан строчкой ниже и находится в I-й группе.
Каждая группа с номерами от I до VIII включает две группы — А и Б.
A-группы включают элементы малых периодов, а также элементы больших периодов, которые по свойствам наиболее близки к соответствующим элементам малых периодов.
Б-группы включают элементы больших периодов, в атомах которых электроны, появляющиеся в них с увеличением заряда ядра, попадают в слой, предшествующий внешнему.
Физический смысл порядкового номера химического элемента:
Крупная, многогранная и неоднозначная группировка химических элементов порождает немало вопросов на тему того, как пользоваться таблицей Менделеева. Между тем, это самый полный и завершенный вариант сортировки атомов всех веществ этой планеты.
Область применения данной классификации – не только химия или иные точные и естественные науки. Полезна она будет и простому обывателю для тренировки памяти или приспособлению к большим и сложным формулировкам и документам. С должным усердием и прилежанием в изучении таблицы, она станет легко понимаемым справочным материалом.
Периодическая таблица Менделеева
До Дмитрия Ивановича собрать элементы в один список пытались многие умы Европы. С начала XIX века они предприняли множество попыток сопоставления веществ.

В 1869 г. свой первый план представляет и Менделеев, через 2 года – завершает доработку и издает последний вариант таблицы.
Основная идея группировки – периодичность. Расположив элементы в порядке увеличения атомной массы, он заметил, что время от времени их свойства повторяются.
Ко 2-й половине XIX века миру было известно намного меньше веществ, чем сегодня, так что химик оставил пустые места в своей таблице, предполагая открытие новых элементов, и даже сумел заранее определить свойства открытых впоследствии галлия Ga 31 и германия Ge 32.
С каждым последующим номером элемента возрастает его атомная масса, заряд ядра, уровень электронов (количество элементов и их связей), показатели активности повторяются в зависимости от периода.
Формулировка периодического закона химических элементов
Русский ученый составлял наброски таблицы около 20 лет, пытаясь подобрать верную закономерность в их размещении. Отметив концепцию цикличности, он превратил её в периодический закон, изложив свое понимание правила:

Как читать таблицу Дмитрия Ивановича Менделеева
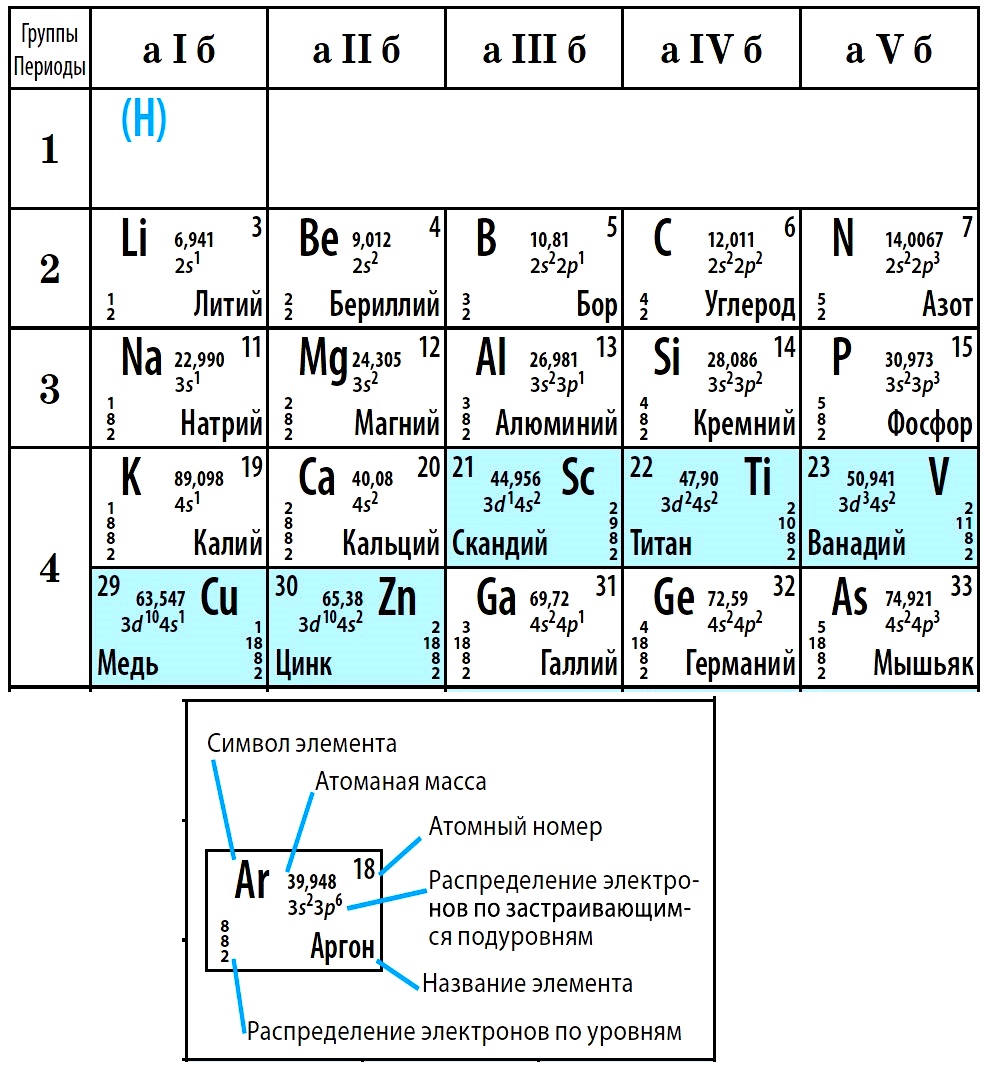
Ячейки химической базы данных разбиты в группы последовательностей по горизонтали и вертикали. Элементы имеют краткое обозначение из 1-3 букв (для формул и вычислений).
Группы
Представлены в виде столбцов таблицы. В системе старого образца их 8.
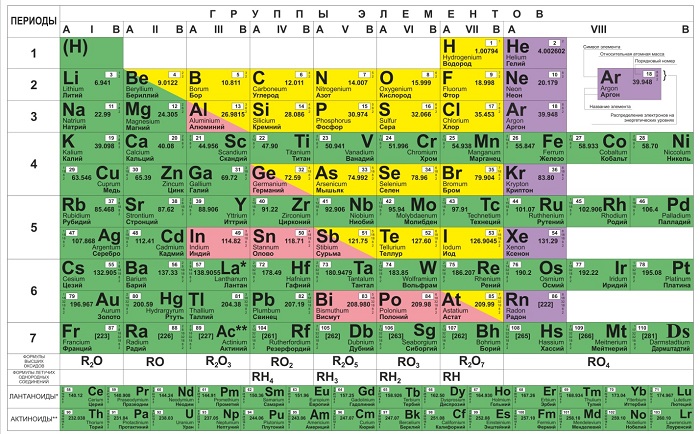
В настоящий же момент выделено 18.
Распределяют элементы в группы по однотипности: по строению атома они подобны друг другу. Также у представителей одного столбца схожая формула высшего оксида.
Традиционные типы столбцов делятся на подкатегории: А (с яркими признаками группы) и В (переходные металлы). Принадлежность зависит от положения символа (слева для A или справа для B):
Периоды
Горизонтальные цепочки в таблице, в которых элементы расположены по росту порядкового номера. В линии слева направо увеличиваются заряды ядра атомов.
Периодов всего 7:
1-й период содержит лишь гелий He 2 и водород H 1 ;
2 и 3 содержат по 8 компонентов;
4-й и 5-й содержат 18 единиц каждый;
6-й период вмещает 32 элемента;
7-й хранит 31 единицу и продолжает дополняться.
Физический смысл порядкового номера
Порядковый номер химического элемента также показывает, сколько в составе ядра атома протонов и сколько электронов вращается вокруг него.
Свойства таблицы Менделеева
Химические элементы оцениваются по множеству параметров. Один из основных – окислительно-восстановительные свойства.
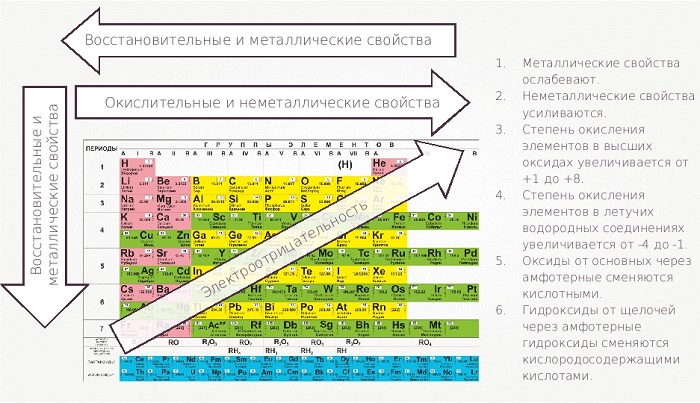
С убыванием в периоде и возрастанием в группе (стремление к левому нижнему углу) проявляются металлические характеристики, обратное направление в правый верхний угол увеличивает окислительные неметаллические качества.
Элементы таблицы Менделеева

Часть элементов с номером более 100 открыта сравнительно недавно, их принадлежность к каким-либо группам только предположительна.
Щелочные и щелочноземельные элементы
Представители 1 (IA) и 2 (IIA) групп таблицы Менделеева - металлы со слабой устойчивостью и высокой степенью растворимости:
Щелочные металлы имеют серебристый отблеск, хорошо разламываются и режутся. Из всех размещенных в таблице металлов активнее других вступают в реакцию с молекулами других веществ, отдавая единственный свободный электрон. При контакте с водой создают гидроксиды – щелочи:
Щелочноземельные металлы более твердые и тугоплавкие, с бледно-серым оттенком. В их список входят:

Большая часть из них способна создавать щелочь, но не так легко расстается с двумя незанятыми электронами. Другие металлы они замещают, но перед щелочными бессильны и вытесняются ими из молекул.
Лантаноиды и актиноиды
Прежде получили название редкоземельных металлов из-за малого количества месторождений и трудностей в выводе чистого металла из соединений. Им соответствует 3 (III B) группа, хотя это иногда оспаривается.

Актиноиды, помимо общих черт, радиоактивны. В природе, кроме, урана U 92, почти не встречаются, создаются искусственно.

Для удобства обе группы элементов выведены в 2 строки под общей таблицей.
Галогены и благородные газы
17 (VII A) группа состоит из галогенов:

Самый реактивный – фтор F 9 (способен разрушать молекулы воды):
С ростом периода свойства элементов слабеют.
Все галогены токсичны, опасны для жизни, поражают дыхательные пути.
В последней, VIII A или 18 группе, находятся инертные газы:

Их внешний уровень электронов равен 8 (полностью заполнен), отчего они не способны вступать в реакцию с другими атомами. Крайне редко создают непрочные молекулы, распадающиеся при нагревании.
Переходные металлы
Представлены всеми подгруппами в традиционной системе или занимают с 3 по 12 столбцы в современных таблицах. Большинство обладает металлическим блеском, по цвету и состоянию различаются (большинство – твердые, но есть исключения, например, жидкая ртуть).
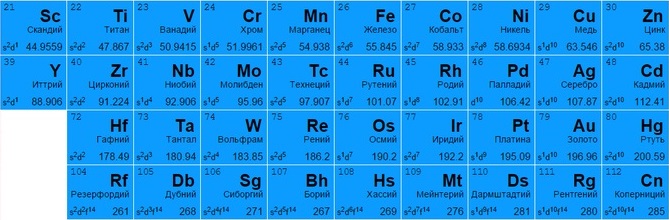
Могут отдавать разное количество электронов с нескольких оболочек для создания вещества (например, титан Ti 22 и железо Fe 26 способны отдавать от 2 до 4, медь Cu 29 – от 1 до 2, цинк Zn 30 – только 2, золото Au 79 и серебро Ag 47 практически не вступают в реакцию).
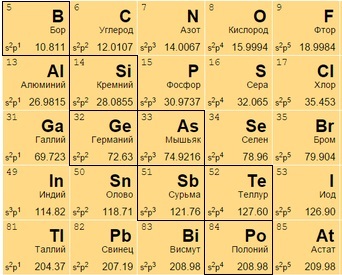
Металлоиды
Располагаются на стыке посреди легких металлов и неметаллов, в диагонали с 13 по 17 группах. В своем большинстве – полупроводники (хуже металлов проводят электрический ток).
Часть из них – металлы внешне, неметаллы по активности, часть – наоборот. Бор B 5, к примеру, является неметаллом с полупроводниковыми качествами.
Постпереходные металлы
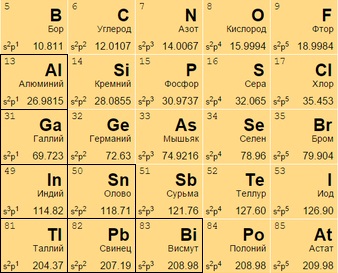
Размещаются после переходных металлов под полупроводниками (в 13-17 столбцах или IIIA – VIIA). Алюминий Al 13 носит неопределенный статус (иногда причисляется к металлоидам).
Неметаллы
Располагаются в правом верхнем углу между полуметаллами и инертными газами (начала 13-17 групп). Имеют больше электронов на внешней оболочке, стремятся присоединить к себе еще больше (в противоположность металлам), чтобы набрать полный уровень электронов.
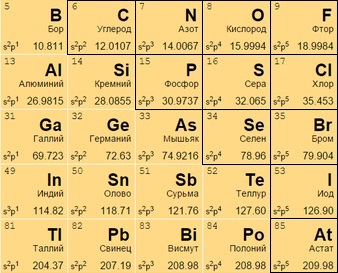
Могут находиться:
в виде газа (кислород O 8, азот N 7);
жидкости (бром Br 35);
в твердом (углерод C 6, кремний Si 14) состоянии.
Интересное положение занимает водород H 1. Его причисляют то к 1, то к 17 группе: он, будучи неметаллом, может проявлять и окислительные, и восстановительные свойства.
Заключение
При детальном рассмотрении таблица Менделеева уже не кажется столь огромной. Главные моменты в пользовании – отследить группу и период элемента, после чего будет несложно определить его свойства и показатели.
Различные картинки в 8 или 18 столбцов не будут поводом для замешательства: семейства и категории выделяются разными цветами (полуметаллы – двухцветные). Ученики найдут решение задач, а любители головоломок получат новый способ тренировки мышления. Ячейка с нужными обозначениями найдется без особых препятствий.
Как пользоваться таблицей Менделеева? Для непосвященного человека читать таблицу Менделеева – всё равно, что для гнома смотреть на древние руны эльфов. А таблица Менделеева может рассказать о мире очень многое.
Помимо того, что сослужит вам службу на экзамене, она еще и просто незаменима при решении огромного количества химических и физических задач. Но как ее читать? К счастью, сегодня этому искусству может научиться каждый. В этой статье расскажем, как понять таблицу Менделеева.
Периодическая система химических элементов (таблица Менделеева) – это классификация химических элементов, которая устанавливает зависимость различных свойств элементов от заряда атомного ядра.
История создания Таблицы
Дмитрий Иванович Менделеев был не простым химиком, если кто-то так думает. Это был химик, физик, геолог, метролог, эколог, экономист, нефтяник, воздухоплаватель, приборостроитель и педагог. За свою жизнь ученый успел провести фундаментально много исследований в самых разных областях знаний. Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов.

Д. И. Менделеев (1834-1907)
В середине девятнадцатого века попытки упорядочить известные химические элементы (известно было 63 элемента) параллельно предпринимались несколькими учеными. Например, в 1862 году Александр Эмиль Шанкуртуа разместил элементы вдоль винтовой линии и отметил циклическое повторение химических свойств.
Химик и музыкант Джон Александр Ньюлендс предложил свой вариант периодической таблицы в 1866 году. Интересен тот факт, что в расположении элементов ученый пытался обнаружить некую мистическую музыкальную гармонию. В числе прочих попыток была и попытка Менделеева, которая увенчалась успехом.

Первоначальный вариант таблицы Менделеева
В 1869 году была опубликована первая схема таблицы, а день 1 марта 1869 года считается днем открытия периодического закона. Суть открытия Менделеева состояла в том, что свойства элементов с ростом атомной массы изменяются не монотонно, а периодически.
Первый вариант таблицы содержал всего 63 элемента, но Менделеев предпринял ряд очень нестандартных решений. Так, он догадался оставлять в таблице место для еще неоткрытых элементов, а также изменил атомные массы некоторых элементов. Принципиальная правильность закона, выведенного Менделеевым, подтвердилась очень скоро, после открытия галлия, скандия и германия, существование которых было предсказано ученым.
Современный вид таблицы Менделеева
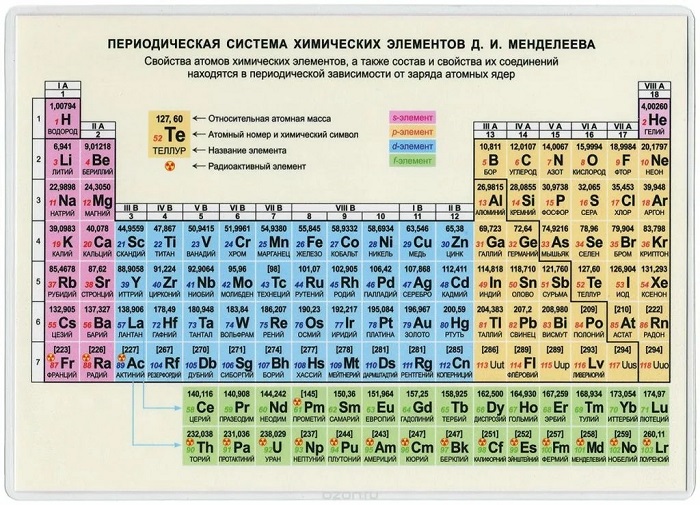
Ниже приведем саму таблицу
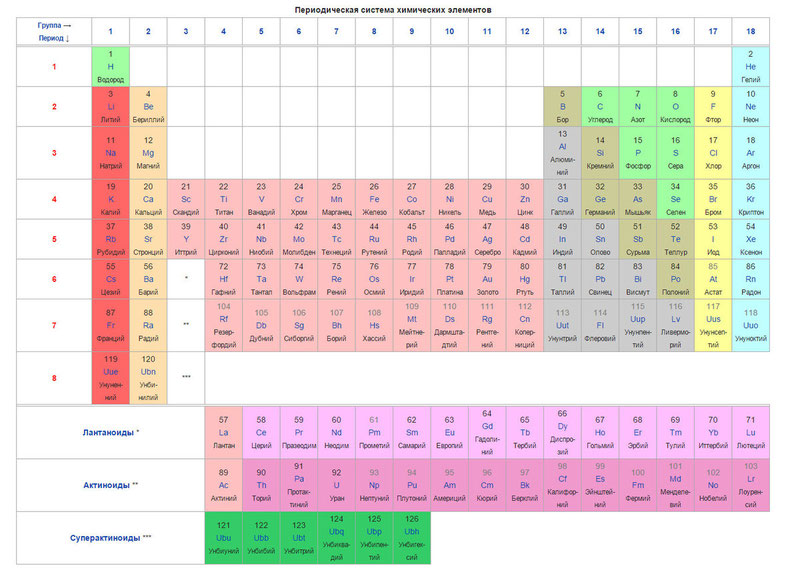
Сегодня для упорядочения элементов вместо атомного веса (атомной массы) используется понятие атомного числа (числа протонов в ядре). В таблице содержится 120 элементов, которые расположены слева направо в порядке возрастания атомного числа (числа протонов)
Столбцы таблицы представляют собой так называемые группы, а строки – периоды. В таблице 18 групп и 8 периодов.
- Металлические свойства элементов при движении вдоль периода слева направо уменьшаются, а в обратном направлении – увеличиваются.
- Размеры атомов при перемещении слева направо вдоль периодов уменьшаются.
- При движении сверху вниз по группе увеличиваются восстановительные металлические свойства.
- Окислительные и неметаллические свойства при движении вдоль периода слева направо увеличиваются.
Что мы узнаем об элементе по таблице? Для примера, возьмем третий элемент в таблице – литий, и рассмотрим его подробно.
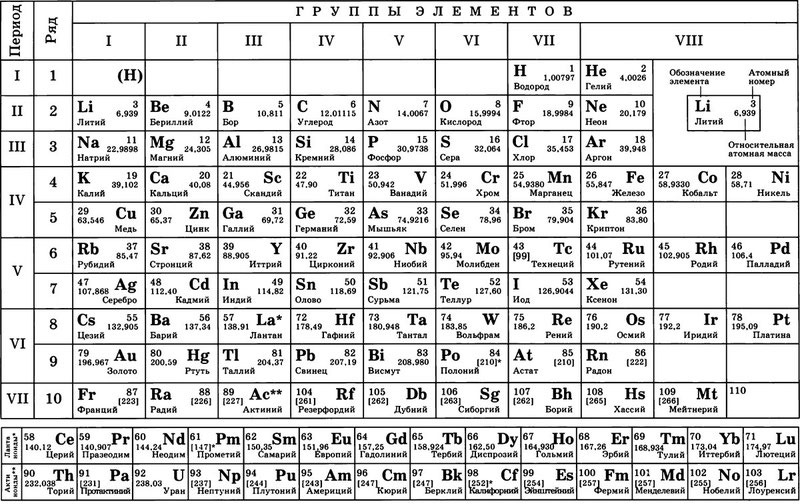
Первым делом мы видим сам символ элемента и его название под ним. В верхнем левом углу находится атомный номер элемента, в порядке которого элемент расположен в таблице. Атомный номер, как уже было сказано, равен числу протонов в ядре. Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
Атомная масса указана под атомным числом (в данном варианте таблицы). Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число. Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
Вот и закончился наш курс "Таблица Менделеева для чайников". В завершение, предлагаем вам посмотреть тематическое видео, и надеемся, что вопрос о том, как пользоваться периодической таблицей Менделеева, стал вам более понятен. Напоминаем, что изучать новый предмет всегда эффективнее не одному, а при помощи опытного наставника. Именно поэтому, никогда не стоит забывать о студенческом сервисе, который с радостью поделится с вами своими знаниями и опытом.
Иван Колобков, известный также как Джони. Маркетолог, аналитик и копирайтер компании Zaochnik. Подающий надежды молодой писатель. Питает любовь к физике, раритетным вещам и творчеству Ч. Буковски.
Читайте также:

